Исследование влияния высокого и низкого стартового титра в модельных средах на изменения активной и титруемой кислотности при культивировании капусты белокочанной сорта Парус молочнокислыми бактериями L. lactis и L. mesenteroides
Автор: Кондратенко В.В., Лялина О.Ю., Посокина Н.Е., Шишлова Е.С., Захарова А.И., Терешонок В.И.
Журнал: Овощи России @vegetables
Рубрика: Физиология и биохимия растений
Статья в выпуске: 5 (38), 2017 года.
Бесплатный доступ
Задачей исследований являлось изучение динамики активной и титруемой кислотности с низким и высоким стартовым титром при культивировании капусты белокочанной сорта Парус молочнокислыми бактериями в базовой модельной среде (БМС) и модифицированной модельной среде (ММС) в процессе ферментирования. Для сравнения использовали стартерные культуры рода Leuconostoc видов Leuconostoc lactis ВКПМ B-12150 и Leuconostoc mesenteroides subsp. mesenteroides ВКПМ B-8818. В данном эксперименте были рассмотрены два важных момента: создание благоприятных условий для роста молочнокислых микроорганизмов и подавление нежелательной патогенной микрофлоры, которая в итоге может привести к порче продукта. Одним из ключевых моментов при масштабировании результатов исследований, связанных с ферментированием растительных объектов микроорганизмами на изначально нестерильное сырье является требование максимально быстрого создания условий, препятствующих размножению С botulinum и предотвращения накопления в продукте ботулинического токсина. Поэтому важным фактором является соблюдение необходимого граничного условия по международным нормам достижение рН≤ 4,6, а по российским достижение рН≤ 4,2. В связи с чем, анализ экспериментальных данных показал, что данные граничные условия были достигнуты по истечении существенно-различающихся временных интервалов при культивировании микроорганизмов с разным стартовым титром. В результате исследований было выявлено, что оптимальные показатели по динамике активной и титруемой кислотности при достижении граничного значения рН 4,2 получаются при культивировании молочно-кислых микроорганизмов L. mesenteroides в ММС при условии,что значения стартового титра находятся в пределах от 3*103 до 3*105 КОЕ/г.
Капуста белокочанная, динамика активной кислотности, динамика титруемой кислотности, базовая и модифицированные модельные среды, низкий и высокий стартовый титр, рн, монокультура, заквасочные (стартерные) культуры, молочнокислые бактерии (микроорганизмы), ферментирование, l.lactis и l.mesenteroides
Короткий адрес: https://sciup.org/140223734
IDR: 140223734 | УДК: 635.342:001.891 | DOI: 10.18619/2072-9146-2017-5-88-91
Текст научной статьи Исследование влияния высокого и низкого стартового титра в модельных средах на изменения активной и титруемой кислотности при культивировании капусты белокочанной сорта Парус молочнокислыми бактериями L. lactis и L. mesenteroides
Ф ерментированные пищевые продукты можно получать благодаря активности сбраживающих микроорганизмов, естественным образом присутствующих в сырье или производственной среде. Процессы ферментации, происходящие естественным путем, в некотором смысле непредсказуемы, что неприемлемо для крупномасштабного производства. В связи с этим, для повышения надежности и обеспечения более стабильного процесса ферментации зачастую применяют бактериальные заквасочные культуры (закваски или консорциумы), которые должны обладать соответствующими свойствами и быть способными доминировать над нативными молочнокислыми бактериями. Выбор той или иной заквасочной культуры (одно- или многоштаммовой) определяется свойствами субстрата, ожиданиями потребителей и техническими требованиями [1].
Ферментация овощей зависит не от одного микроорганизма, а от пула бактерий (заквасочных культур) разных родов и видов. Заквасочные культуры могут быть чистыми или смешанными. При ферментации пищевых продуктов под влиянием динамично меняющихся условий среды происходит сложная смена пулов микроорганизмов. Определенный микроорганизм (или группа микроорганизмов) начинает размножаться и через некоторое время становится доминирующим. В результате накопления соединений-ингибиторов роста он замедляется, и начинают размножаться другие виды, менее чувствительные к ингибирующим факторам [2].
При ферментации овощной продукции применяют лишь несколько стартерных культур (штаммов молочнокислых микроорганизмов) и основной закваской при квашении капусты является культура на основе Leuconostoc mesenteroides.
Стрептококкоподобные бактерии рода Leuconostoc – это грамположительные, неспорообразующие, неподвижные, гетероферментативные факультативно-анаэробные кокки, широко распространенные в окружающей среде, включая почву и растения [3]. Они в процессе своей жизнедеятельности продуцируют молочную и уксусную кислоту, углекислый газ, этиловый спирт, декстран и эфиры [4]. Чаще всего имеют форму овалов, могут образовывать цепочки. Оптимальная температура для роста 20…30°С, но рост может происходить между 5°С и 37°С [5]. Род Leuconostoc включает «типичного представителя» L. mesenteroides и 8 «второстепенных» видов – L.pseudomesenteroides, L.lactis, L.citreum, L.gelidum, L.carnosum, L.fallax, L.argentinum и L.oenos [6].
При производстве квашеной капусты основным видом бактерий, которые размножаются на первой гетерофермента-тивной стадии ферментации, являются молочнокислые микроорганизмы L. mesenteroides (процесс занимает ~6 дней), они продуцируют молочную и уксусную кислоты, а также СО2, после чего происходит рост Lactobacillus brevis и, наконец, размножаются Lactobacillus plantarum , которые опять продуцируют кислоту, снижая значение рН ниже 4,0. Все это позволяет долго хранить квашеную капусту в анаэробных условиях [1]. Конечные продукты производимые бактериями Leuconostoc sp.и другими гетероферментативными молочнокислыми бактериями имеют важное значение для получения продукта с хорошим вкусом и ароматом [7]. Именно на этой стадии в значительной степени определяются продуцирование летучих вкусоароматических соединений и соотношение между молочной и уксусной кислотами [8]. Значение рН продукта быстро снижается, из-за чего ограничивается активность размягчающих капусту нежелательных микроорганизмов и ферментов, а диоксид углерода вытесняет остаточный кислород, обусловливая анаэробные условия для предотвращения развития патогенной микрофлоры. Активное развитие L. mesenteroides обеспечивает условия для роста других молочнокислых бактерий в известной последовательности и является определяющим для получения высококачественного ферментированного продукта [1].
Стартерные культуры рода Leuconostoc используют с целью минимизации влияния условий окружающей среды, естественной изменчивости микрофлоры, влияния температуры, а также уменьшение количества соли [2].
Ферментированные овощи с добавлением молочнокислых микроорганизмов играют важную роль в питании, обеспечивая наличие безопасного для здоровья и питательного про- дукта, с длительным сроком годности, с улучшенными органолептическими свойствами. Целью будущих разработок в этой области является повышение качества и снижение порчи ферментированных овощей и фруктов, что можно обеспечить путем управления процессом ферментации с использованием сочетания физических, химических и биологических факторов [1].
Цели и задачи
С целью минимизации влияния окружающей среды, влияния температуры, уменьшения количества соли и т.д. для исследований нами были выбраны молочнокислые микроорганизмы рода Leuconostoc , для сравнения использовали 2 вида этих бактерий L.lactis и L.mesenteroides.
Целью наших исследований являлось изучение влияния высокого и низкого стартового титра в модельных средах на изменение активной и титруемой кислотности при культивировании капусты белокочанной сорта Парус молочнокислыми бактериями L.lactis и L.mesenteroides .
Важным моментом при обработке полученных экспериментальных данных и выборе оптимальных показателей являлось достижение необходимого более «жесткого» требования – граничного условия рН 4,2, отвечающего за безопасность рассмотренного сырья. В процессе исследований основная задача состояла в том, чтобы рассмотреть влияние данных молочнокислых микроорганизмов на динамику активной и титруемой кислотности в процессе ферментации в зависимости от времени и в выборе наилучшего штамма для создания качественного продукта с полезными свойствами.
Материалы и методы
В качестве объектов исследования использовали микроорганизмы рода Leuconostoc видов Leuconostoc lactis ВКПМ B-12150 и Leuconostoc mesenteroides subsp. mesenteroides ВКПМ B-8818, предоставленные ФГУП ГосНИИгенетика. Монокультуры культивировали на двух модельных питательных средах – базовой (БМС) и модифицированной (ММС), в качестве которых использовали капусту белокочанную сорта Парус, предоставленную ФГБНУ «ВНИИ селекции и семеноводства овощных культур» (ФГБНУ ФНЦО).
Базовую модельную среду готовили последовательными операциями, включающими мойку, шинкование, гомогенизацию капусты белокочанной до получения однородной кашицеобразной массы. Отдельно готовили модифицированную модельную среду внесением в базовую модельную среду NaCl в количестве 1,5% от массы базовой среды. Для сохранения модельных сред их фасовали в стеклянные банки объёмом 0,1 дм3 с винтовым типом укупорки, герметично укупоривали и стерилизовали при противодавлении 1 бар в течение 20 мин с последующим охлаждением до комнатной температуры. В модифицированную модельную среду в стерильных условиях добавляли аскорбиновую кислоту в количестве 35 мг на 100 г среды, перемешивали до полного растворения и вторично укупоривали также в стерильных условиях.
Регенерацию культур L. lactis и L.mesenteroides проводили в боксе в асептических условиях по следующей схеме: посев культуры, находящейся на хранении, в жидкую питательную среду MRS; термостатирование при температуре 30°С в течение 72 ч, определение начального титра культуры.
Инокуляцию двух видов модельных сред (БМС и ММС) проводили путём введения двух различных титров суспензий микроорганизмов в количестве 2% инокулята от объёма среды.
Начальный низкий и высокий титр в БМС и в ММС соответствовал следующим значениям: в 2* на 10 в 3 степени; 3* на 10 в 5 степени; 2* на 10 в 4 степени, 2* на 10 в 6 степени; 2* на 10 в 3 степени, 3* на 10 в 5 степени; 3 умножить на 10 в 3 степени, 3* на 10 в 5 степени.
Активную фазу ферментирования осуществляли в термостате в течение 7 суток (168 ч) при температуре 30°С. Определение скорости культивирования микроорганизмов проводили путём выборочного контроля титра в модельных средах в течение семи суток с ежедневным отбором проб. Количество молочнокислых микроорганизмов определяли по [9].
Отбор проб для определения физико-химических показа- телей (титруемая кислотность и рН проводили ежедневно в течение 7 суток в следующих вариантах: L. lactis БМС низкий титр – 2*103, высокий титр – 3*105); L. lactis ММС низкий титр – 2*104, высокий титр – 2*106; в L.mesenteroides БМС низкий титр – 2*103, высокий титр – 3*105; в L.mesenteroides ММС низкий титр – 3*103, высокий титр – 3*105.
Титруемую кислотность определяли по [10] в пересчете на молочную кислоту. Для проведения анализа отбирали по 35 г каждого образца, затем в колбонагревателе нагревали дистиллированную воду до 800С, перемещали навеску в количестве 35 г в мерную стеклянную колбу с одной меткой на 250 мл и доводили до метки горячей дистиллированной водой. После этого настаивали в течении 30 мин, периодически перемешивая, фильтровали и титровали 0,01% раствором NaOH в трех повторностях, используя по 50 мл пробы на каждую повторность.
Обработку результатов микробиологических исследований проводили с помощью программы Microsoft Excel.
Результаты
Исследована динамика активной и титруемой кислотностей с низким и высоким стартовым титром, при культивировании капусты белокочанной сорта Парус молочнокислыми бактериями L. lactis и L. mesenteroides в базовой модельной среде (БМС) и модифицированной модельной среде (ММС) в процессе ферментирования. В данном эксперименте также рассмотрены два важных момента: создание благоприятных условий для роста молочнокислых микроорганизмов и подавление нежелательной патогенной микрофлоры, которая в итоге может привести к порче продукта. Необходимо отметить, что одним из ключевых моментов при масштабировании результатов исследований, связанных с ферментированием растительных объектов микроорганизмами на изначально нестерильное сырье является требова-
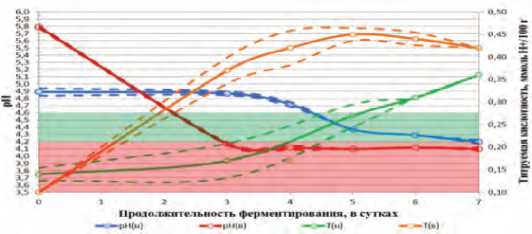
Рис. 1. Динамика активной и титруемой кислотности в БМС с добавлением молочнокислых бактерий L. lactis в процессе ферментирования.
ние максимально быстрого создания условий, препятствующих размножению Сl. botulinum, для предотвращения накопления в продукте ботулинического токсина. На основании существующих литературных данных [11, 12] ключевым граничным условием по международным нормам является достижение рН≤ 4,6, а по российским нормам – достижение рН≤ 4,2. Анализ экспериментальных данных показал, что данные граничные условия были достигнуты по истечении существенно-различающихся временных интервалов при культивировании микроорганизмов с разным стартовым титром.
На рисунке 1 показана динамика активной и титруемой кислотности в базовой модельной среде с добавлением молочнокислых бактерий L. lactis в процессе ферментирования в зависимости от времени.
При культивировании L. lactis в базовой модельной среде с низким стартовым титром, кривая, описывающая динамику рН от продолжительности ферментирования, находится в зоне плато (в пределах ± 0,05) более трех первых суток ферментирования, после чего происходит плавное линейное изменение рН на 0,6 единиц в течение следующих вторых суток, с последующим переходом в зону плато. В то же время при культивировании того же штамма, но с высоким стартовым титром было установлено отсутствие начальной
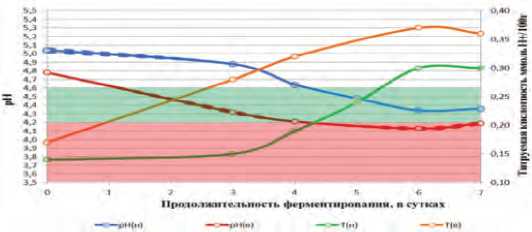
Рис. 2. Динамика активной и титруемой кислотности в ММС с добавлением молочнокислых бактерий L. lactis в процессе ферментирования.
зоны плато в динамике рН. Данный показатель демонстрировал резкое уменьшение на 1,7 единиц в течение трех суток с последующим переходом в зону плато.
При высоком стартовом титре значение рН 4,6 было достигнуто в течение двух суток, а достижение значения рН 4,2 было достигнуто в течение трех суток, в то время как при культивировании с низким стартовым титром в первом случае для этого потребовалось более четырех суток, а во втором достижения необходимого граничного значения не произошло. При этом в последнем случае начало нарастания титруемой кислотности отмечали уже на начальном этапе ферментирования, в результате чего при низком стартовом титре только на третьи сутки, что создает высокий риск развития Cl. botulinum.
На рисунке 2 показана динамика активной и титруемой кислотности в модифицированной модельной среде с добавлением молочнокислых бактерий L. lactis в процессе ферментирования в зависимости от времени.
При культивировании L. lactis в модифицированной модельной среде с низким стартовым титром, кривая, описывающая динамику рН от продолжительности ферментирования, имеет зону плато (в пределах ± 0,1) в интервале первых трех суток ферментирования, с последующим переходом в зону линейного снижения рН на 0,6 единиц в течение следующих трех суток и оканчивается второй зоной плато, в тоже время при культивировании того же штамма, но с высоким стартовым титром, было установлено отсутствие начальной зоны плато в динамике рН. Данный показатель демонстрировал линейное уменьшение на 0,6 единиц в течение четырех суток с последующим переходом в зону плато.
При высоком стартовом титре значение рН 4,6 было достигнуто в течение первых суток обработки, а значение рН 4,2 было достигнуто в течение четвертых суток, в то время как при культивировании с низким стартовым титром в первом случае для этого потребовалось четверо суток, а во втором случае достижение необходимого граничного значения не произошло. При этом в последнем случае начало нарастания титруемой кислотности отмечали только по истечении третьих суток ферментирования, в результате чего при низком стартовом титре в течение первых трех суток начальные характеристики обработанного сырья практически не меняются, что создает высокий риск разви-
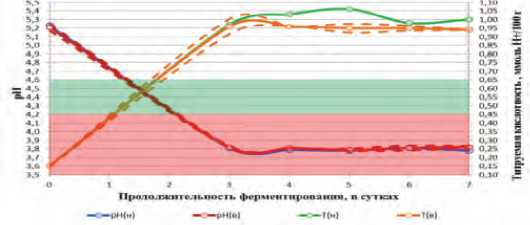
Рис. 3. Динамика активной и титруемой кислотности в БМС с добавлением молочнокислых бактерий L.mesenteroides в процессе ферментирования.
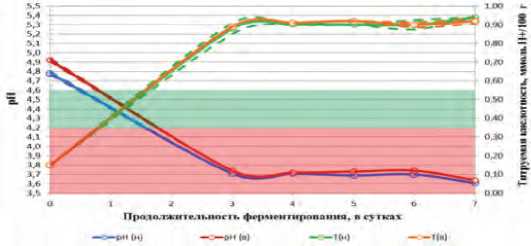
Рис. 4. Динамика активной и титруемой кислотности в ММС с добавлением молочнокислых бактерий L.mesenteroides в процессе ферментирования.
тия Сl. botulinum .
На рисунке 3 показана динамика активной и титруемой кислотности в базовой модельной среде с добавлением молочнокислых бактерий L.mesenteroides в процессе ферментирования в зависимости от времени.
При культивировании L.mesenteroides в базовой модельной среде кривые, описывающие динамику рН от продолжительности ферментирования, как с низким, так и высоким стартовым титром в начале процесса демонстрируют выраженное уменьшение в течение первых трех суток, с последующим плавным переходом в зону плато, в связи с чем, для обоих вариантов характерны одинаковые стартовые характеристики среды. Соответственно, граничное значение рН 4,6 в обоих вариантах было достигнуто в течение чуть более одних суток, а значение рН 4,2 в обоих вариантах было достигнуто в течение чуть более двух суток. При этом в интервале от 0 до 3 суток отмечена высокая интенсивность нарастания титруемой кислотности.
На рисунке 4 показана динамика активной и титруемой кислотности в модифицированной модельной среде с добавлением молочнокислых бактерий L.mesenteroides в процессе ферментирования в зависимости от времени.
При культивировании L. mesenteroides в модифицированной модельной среде кривые, описывающие динамику рН и титруемой кислотности с низким и высоким стартовым титром качественно схожи с кривыми того же штамма при культивировании в базовой модельной среде, с той лишь разницей, что достижение граничного значения рН 4,6 было достигнуто в интервале менее чем за одни сутки, а достижение граничного значения рН 4,2 было достигнуто в интервале менее чем за двое суток.
Выводы
В процессе исследований было отмечено наличие динамики активной и титруемой кислотностей в БМС и ММС при культивировании молочнокислыми микроорганизмами как с низким, так и с высоким стартовым титром.
Оценка временных интервалов достижения граничного условия рН 4,6 в БМС показала, что для L. lactis он значимо коррелирует с величиной стартового титра и составляет при высоком стартовом титре более двух суток, а при низком – более четырех суток. При культивировании L. mesenteroides таковое различие выражено слабо и находится в пределах одних суток с начала ферментации. При этом в ММС прослеживается другая ситуация: для L. lactis временной интервал достижения граничного условия при высоком стартовом титре составляет одни сутки, а при низком – четверо суток, тогда как при культивировании L. mesenteroides различие выражено слабо, а временной интервал составляет менее одних суток.
Оценка временных интервалов достижения граничного условия рН 4,2 в БМС показала, что для L. lactis при высоком стартовом титре он составляет трое суток, а при низком – граничное условие не достигается (в пределах области определения продолжительности ферментирования). При культивировании L. mesenteroides различие выражено слабо, и временной интервал находится в пределах двух суток. В отношении культивирования в ММС прослеживается другая тенденция: если для L. lactis при высоком стартовом титре временной интервал достижения граничного условия составляет четверо суток, а при низком – не достигает его, то при культивировании L. mesenteroides таковое различие также выражено слабо, как и при культивировании в БМС, с той лишь разницей, что временной интервал составляет менее двух суток.
В силу того, что при прочих равных условиях при наличии двух однотипных, но численно отличающихся граничных условий, для однозначного обеспечения соблюдения локальных требований безопасности следует придерживаться того граничного условия, которое определяет более «жесткие» требования. Таковым является рН 4,2. В соответствии с этим оптимальными являются показатели динамики активной и титруемой кислотности при культивировании L. mesenteroides в ММС при условии задания численного значения стартового титра в пределах от 3*103 до 3*105 КОЕ/г.
-
• Литература
-
1. Настольная книга производителя и переработчика плодоовощной продукции. Под редакцией Н.К. Синха, И.Г. Хью. Перевод с англ. яз. – СПб.: Профессия, 2014. – С. 467-485.
-
2. Suzanne Johanningsmeier. 2007. Effect of Leuconostoc mesenteroides starter culture on fermentation of cabbage with reduced salt concentrations. Journal of food science. – Vol. 72, Nr. 5. – 2007, 166.
-
3. Ахметова Л.И., Перевалова Е.Ю., Розанова С.М. Бактерии рода Leuconostoc: клиническое значение, идентификация, чувствительность к антибиотикам. Том 3. – 2001. – С. 49.
-
4. Выщепан А.Г., Мельман М.Е. Физико-химические основы соления и квашения овощей. Госторгиздат – 1952. – С.3-140.
-
5. Орлов Н.П. Производство, хранение и реализация солено-квашеных овощей и плодов. – К.: Урожай, 1989. – С.6-46.
-
6. The gram-positive cocci: part II: Streptococci, Enterococci, and the «streptococcus-like» bacteria. In: Koneman E.W., Alien S.D., Janda W.M., Schreckenberger P.S., Winn W.C., editors. Color atlas and textbook of diagnostic microbiology. Philadelphia: Lippincott – 1997. – P. 577-651.
-
7. Hutkins R.W. Microbiology and technology of fermented foods. IFT Press Blackwell Publishing, 2006. – 473.
-
8. Pederson С.S., Albury M.N. The sauerkraut fermentation / NY Sta. Agric. Exp. Sta. // Geneva Bull., 1969. – 824 с.
-
9. ГОСТ 10444.11-2013 «Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета количества мезофильных молочнокислых микроорганизмов».
-
10. ГОСТ ISO 750-2013 «Продукты переработки фруктов и овощей. Определение титруемой кислотности».
-
11. Дж. М. Джей, М. Дж. Лесснер, Д.А. Гольден. Современная пищевая микробиология. Пер. 7-го англ. изд. – М.: БИНОМ. Лаборатория знаний, 2017. – 886 с.
-
12. ТР ТС 021/2011 «О безопасности пищевой продукции» № 880 от 09.12.2011 г.
-
-
• References
-
1. Nastol'naya kniga proizvoditelya i pererabotchika plodoovoshchnoj produkcii. Pod redakciej N.K. Sinha, I.G. H'yu. Perevod s angl. yaz. – SPb.: Professiya, 2014. – S. 467-485.
-
2. Suzanne Johanningsmeier. 2007. Effect of Leuconostoc mesenteroides starter culture on fermentation of cabbage with reduced salt concentrations. Journal of food science. – Vol. 72, Nr. 5. – 2007, 166.
-
3. Ahmetova L.I., Perevalova E.YU., Rozanova S.M. Bakterii roda Leuconostoc: klinicheskoe znachenie, identifikaciya, chuvstvitel'nost' k antibiotikam. Tom 3. – 2001. – S. 49.
-
4. Vyshchepan A.G., Mel'man M.E. Fiziko-himicheskie osnovy soleniya i kvasheniya ovoshchej. Gostorgizdat – 1952. – S.3-140.
-
5. Orlov N.P. Proizvodstvo, hranenie i realizaciya soleno-kvashenyh ovoshchej i plodov. – K.: Urozhaj, 1989. – S.6-46.
-
6. The gram-positive cocci: part II: Streptococci, Enterococci, and the «streptococ-cus-like» bacteria. In: Koneman E.W., Alien S.D., Janda W.M., Schreckenberger P.S., Winn W.C., editors. Color atlas and textbook of diagnostic microbiology. Philadelphia: Lippincott – 1997. – P. 577-651.
-
7. Hutkins R.W. Microbiology and technology of fermented foods. IFT Press Blackwell Publishing, 2006. – 473.
-
8. Pederson S.S., Albury M.N. The sauerkraut fermentation / NY Sta. Agric. Exp. Sta. // Geneva Bull., 1969. – 824 s.
-
9. GOST 10444.11-2013 «Mikrobiologiya pishchevyh produktov i kormov dlya zhivot-nyh. Metody vyyavleniya i podscheta kolichestva mezofil'nyh molochnokislyh mikroorganizmov».
-
10. GOST ISO 750-2013 «Produkty pererabotki fruktov i ovoshchej. Opredelenie titruemoj kislotnosti».
-
11. Dzh. M. Dzhej, M. Dzh. Lessner, D.A. Gol'den. Sovremennaya pishchevaya mikrobiologiya. Per. 7-go angl. izd. – M.: BINOM. Laboratoriya znanij, 2017. – 886 s. 12. TR TS 021/2011 «O bezopasnosti pishchevoj produkcii» № 880 ot 09.12.2011 g.
-
Список литературы Исследование влияния высокого и низкого стартового титра в модельных средах на изменения активной и титруемой кислотности при культивировании капусты белокочанной сорта Парус молочнокислыми бактериями L. lactis и L. mesenteroides
- Настольная книга производителя и переработчика плодоовощной продукции. Под редакцией Н.К. Синха, И.Г. Хью. Перевод с англ. яз. -СПб.: Профессия, 2014. -С. 467-485.
- Suzanne Johanningsmeier. 2007. Effect of Leuconostoc mesenteroides starter culture on fermentation of cabbage with reduced salt concentrations. Journal of food science. -Vol. 72, Nr. 5. -2007, 166.
- Ахметова Л.И., Перевалова Е.Ю., Розанова С.М. Бактерии рода Leuconostoc: клиническое значение, идентификация, чувствительность к антибиотикам. Том 3. -2001. -С. 49.
- Выщепан А.Г., Мельман М.Е. Физико-химические основы соления и квашения овощей. Госторгиздат -1952. -С.3-140.
- Орлов Н.П. Производство, хранение и реализация солено-квашеных овощей и плодов. -К.: Урожай, 1989. -С.6-46.
- The gram-positive cocci: part II: Streptococci, Enterococci, and the «streptococcuslike» bacteria. In: Koneman E.W., Alien S.D., Janda W.M., Schreckenberger P.S., Winn W.C., editors. Color atlas and textbook of diagnostic microbiology. Philadelphia: Lippincott -1997. -P. 577-651.
- Hutkins R.W. Microbiology and technology of fermented foods. IFT Press Blackwell Publishing, 2006. -473.
- Pederson С.S., Albury M.N. The sauerkraut fermentation/NY Sta. Agric. Exp. Sta.//Geneva Bull., 1969. -824 с.
- ГОСТ 10444.11-2013 «Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета количества мезофильных молочнокислых микроорганизмов».
- ГОСТ ISO 750-2013 «Продукты переработки фруктов и овощей. Определение титруемой кислотности».
- Дж. М. Джей, М. Дж. Лесснер, Д.А. Гольден. Современная пищевая микробиология. Пер. 7-го англ. изд. -М.: БИНОМ. Лаборатория знаний, 2017. -886 с.
- ТР ТС 021/2011 «О безопасности пищевой продукции» № 880 от 09.12.2011 г.


