Исследование возможности получения микро- и нанопорошка нитридной композиции TiN-BN в системе «галогенид титана - азид натрия - галогенид бора» по азидной технологии СВС
Автор: Шиганова Людмила Александровна, Бичуров Георгий Владимирович, Керсон Ирина Александровна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Физика и электроника
Статья в выпуске: 6-1 т.16, 2014 года.
Бесплатный доступ
Синтез порошков нитридов и композиций на их основе в микро- и наноразмерном состоянии и высокого качества на сегодняшний день является актуальной задачей. Азидная технология самораспространяющегося высокотемпературного синтеза (СВС-Аз) позволяет получать композиционные порошки, обладающие нужными свойствами, всего в одну стадию, без операции смешивания отдельно полученных порошков нитридов. Использование комплексной галоидной соли азотируемого элемента позволяет получать конечный продукт в виде ультрадисперсного (100-500 нм) и наноразмерного (менее 100 нм) порошка нитрида этого элемента. В процессе исследований установлено, что нитридные композиции на основе TiN и BN могут образовываться в системах, состоящих из азида натрия, галогенида титана и галогенида бора. Результаты исследований морфологии и размера частиц, гранулометрического состава конечного продукта, синтезированного при различном соотношении компонентов в исследуемых системах говорят о том, что конечный продукт представляет собой нано- и ультрадисперсный порошок, состоящий из отдельных гранул (агломератов) нитрида титана TiN и нитрида бора BN, а также небольшого количества побочных продуктов - борида титана TiB и гексафтортитаната натрия Nа 3TiF 6.
Нитрид титана, нитрид бора, нитридная композиция, азид натрия, галогенид, самораспространяющийся высокотемпературный синтез, микро- и нанопорошок
Короткий адрес: https://sciup.org/148205705
IDR: 148205705 | УДК: 546.17-39:546.171.8:549.451.4-46:661.8-41
Текст научной статьи Исследование возможности получения микро- и нанопорошка нитридной композиции TiN-BN в системе «галогенид титана - азид натрия - галогенид бора» по азидной технологии СВС
материала, нередко сопровождающиеся сменой его агрегатного состояния [1, 2].
Большими возможностями в этом отношении обладает открытый в 1967 году академиком А.Г. Мержановым и профессорами И.П. Боровинской и В.М. Шкиро процесс самораспространяющего-ся высокотемпературного синтеза (СВС) тугоплавких соединений, в том числе и нитридов [3, 4]. Однако, проанализировав различные источники информации [4-8], можно сделать вывод о том, что в работах Института структурной макрокинетики и материаловедения РАН (ИСМАН), являющегося разработчиком способа и технологии СВС, не упоминается о получении композиций «нитрид – нитрид» в одну стадию. В принципе, в режиме классического СВС возможно получение композиций, но в этом случае исходная шихта будет состоять из смеси порошков элементов, частицы которых будут иметь непосредственный контакт. Поэтому здесь возможно химическое взаимодействие в системе, например, «титан-бор» с образованием соответствующих бинарных соединений. Чтобы разделить частицы титана и бора в исходной шихте СВС, необходимо в нее вводить какие-либо инертные тугоплавкие добавки или компоненты целевой композиции. А это будет снижать выход и качество получаемого продукта.
Одним из приоритетных направлений в науке является синтез наноразмерных материалов и создание технологий их получения. Известно, что для получения нитридных композиций нано-и микропорошков по ресурсосберегающей технологии СВС перспективно использовать такую ее разновидность как азидная технология СВС (СВС-Аз). Технология СВС-Аз основана на использовании азида натрия NaN3 в качестве твердого азотирующего реагента и галоидных солей различного состава [1, 9-11].
Достоинствами азидной технологии СВС с точки зрения получения нанопорошков являются [12]: а) низкие температуры и скорости горения. При низких температурах горения затруднительны процессы рекристаллизации и агломерации частиц продукта, поэтому после синтеза целевой продукт представляет собой неспечен-ный порошок с размером частиц, близким к размеру частиц порошка азотируемого элемента; б) наличие побочных продуктов синтеза как в газовом, так и в конденсированном состояниях, которые разделяют частицы целевого продукта, препятствуя увеличению их размера; в) применение газифицирующихся добавок (галоидных солей). В качестве галоидных солей, используемых в исходных шихтах СВС-Аз, применяются неорганические соединения, содержащие в своем составе помимо галогена различные радикалы. Хорошо себя зарекомендовали галоидные соли аммония, например, NH4Cl или NH4F. В результате целевой продукт синтеза будет содержать уже не натрий, а нейтральную соль, например, NaCl и NaF. Но для получения нитридов более высокой степени чистоты и наноразмерной структуры необходимо использовать галоидные соли, содержащие азотируемый элемент и дополнительно щелочной металл (KBF4, Na2TiF6) или аммонийную группу ((NH4)2TiF6, NH4BF4) [13-15].
Целью данной работы являлось исследование возможности получения ультрадисперсного (100500 нм) и наноразмерного (менее 100 нм) композиционного порошка на основе TiN и BN в режиме самораспространяющегося высокотемпературного синтеза с использованием азида натрия и различных галоидных солей титана и бора.
МАТЕРИАЛЫ И МЕТОДИКИ
При выборе азидных систем СВС для синтеза нитридной композиции «нитрид титана-нит-рид бора» используется классификация и номенклатура комплексных галоидных солей, представленная в [1, 9]. Ввиду того, что большинство галоидных солей титана и бора не имеют промышленного производства, а получены в лабораторных условиях, в настоящей работе были использованы галоидные соли, которые выпускаются промышленностью.
В качестве исходного сырья использовались:
порошок тетрафторбората калия классификации «ч», представляющий собой соль в виде кристаллов KBF4 белого цвета (KBF4 не менее 99,0 мас. %); порошок тетрафторбората аммония классификации «ч», представляющий собой соль в виде кристаллов (NH4BF4) белого цвета ((NH4BF4) не менее 99,00 мас. %): порошок гек-сафтортитаната аммония классификации «ч», представляющий собой соль в виде кристаллов (NH4)2TiF6 белого цвета ((NH4)2TiF6 не менее 99,00 мас. %); порошок гексафтортитаната натрия, представляющий собой соль в виде кристаллов Nа2TiF6 белого цвета (Nа2TiF6 не менее 98,00 мас. %); порошок азида натрия классификации «ч», представляющий собой белые гексагональные кристаллы NaN3 (NaN3 не менее 98,71 мас. %) [1].
Стехиометрические уравнения химических реакций получения нитридной композиции TiN-BN в режиме СВС-Аз от изменения соотношения компонентов в исходной шихте выглядят следующим образом:
-
а) KBF4+9NaN3+(NH4)2TiF6=
=TiN-BN+9NaF +KF+4H2+13,5N2;(1)
увеличение в исходной шихте компонента KBF4: 2KBF4+12NaN3+(NH4)2TiF6=
=TiN-2BN+12NaF+2KF+4H2+17,5N2;(2)
3KBF4+15NaN3+(NH4)2TiF6=
=TiN-3BN+15NaF+3KF+4H2+21,5N2;(3)
4KBF4+18NaN3+(NH4)2TiF6=
=TiN-4BN+18NaF+4KF+4H2+25,5N2;(4)
увеличение в исходной шихте компонента (NH4)2TiF6:
KBF4+15NaN3+2(NH4)2TiF6=
=2TiN-BN+15NaF+KF+8H2+23N2;(5)
KBF4+21NaN3+3(NH4)2TiF6=
=3TiN-BN+21NaF+KF+12H2+32,5N2;(6)
KBF4+27NaN3+4(NH4)2TiF6=
=4TiN-BN+27NaF+KF+16H2+42N2;(7)
-
б) KBF4+7NaN3+Na2TiF6=
=TiN-BN+9NaF+KF+9,5N2;(8)
увеличение в исходной шихте компонента KBF4: 2KBF4+10NaN3+Na2TiF6=
=TiN-2BN+12NaF+2KF+13,5N2;(9)
3KBF4+13NaN3+Na2TiF6=
=TiN-3BN+15NaF+3KF+17,5N2;(10)
4KBF4+16NaN3+Na2TiF6=
=TiN-4BN+18NaF+4KF+22,5N2;(11)
увеличение в исходной шихте компонента Na2TiF6: KBF4+11NaN3+2Na2TiF6=
=2TiN-BN+15NaF+KF+15N2;(12)
KBF4+15NaN3+3Na2TiF6=
=3TiN-BN+21NaF+KF+20,5N2;(13)
KBF4+19NaN3+4Na2TiF6=
=4TiN-BN+27NaF+KF+26N2;(14)
-
в) NH4BF4+10NaN3+(NH4)2TiF6=
=TiN-BN+10NaF+6H2+15,5N2;(15)
увеличение в исходной шихте компонента NH4BF4: 2NH4BF4+14NaN3+(NH4)2TiF6=
=TiN-2BN+14NaF+8H2+21,5N2;(16)
3NH4BF4+18NaN3+(NH4)2TiF6=
=TiN-3BN+18NaF+10H2+27,5N2;(17)
4NH4BF4+22NaN3+(NH4)2TiF6=
=TiN-4BN+22NaF+12H2+33,5N2; (18) увеличение в исходной шихте компонента (NH4)2TiF6:
NH4BF4+16NaN3+2(NH4)2TiF6=
=2TiN-BN+16NaF+10H2+25N2;(19)
NH4BF4+22NaN3+3(NH4)2TiF6=
=3TiN-BN+22NaF+14H2+34,5N2;(20)
NH4BF4+28NaN3+4(NH4)2TiF6=
=4TiN-BN+28NaF+18H2+44N2;(21)
-
г) NH4BF4+8NaN3+Na2TiF6=
=TiN-BN+10NaF+2H2+11,5N2;(22)
увеличение в исходной шихте компонента NH4BF4: 2NH4BF4+12NaN3+Na2TiF6=
=TiN-2BN+14NaF+4H2+17,5N2;(23)
3NH4BF4+16NaN3+Na2TiF6=
=TiN-3BN+18NaF+6H2+23,5N2;(24)
4NH4BF4+20NaN3+Na2TiF6=
=TiN-4BN+22NaF+8H2+29,5N2; (25) увеличение в исходной шихте компонента Na2TiF6: NH4BF4+12NaN3+2Na2TiF6=
=2TiN-BN+16NaF+2H2+17N2;(26)
NH4BF4+16NaN3+3Na2TiF6=
=3TiN-BN+22NaF+2H2+22,5N2;(27)
NH4BF4+24NaN3+4Na2TiF6=
=4TiN-BN+28NaF+2H2+28N2.(28)
Расчет массы компонентов исходных шихт в системах СВС-Аз производился с учетом стехиометрического соотношения компонентов в системе. Количество окислителя (азота азида натрия) и связующего (галогена галоидной соли) в стехиометрическом соотношении позволяет полностью увязывать металлического натрий в процессе синтеза в нейтральное соединение – хлорид или фторид натрия.
Термодинамический анализ возможности синтеза нитридной композиции TiN-BN проводился по компьютерной программе «Thermo», разработанной в ИСМАН [16]. Температура горения рассчитывалась в предположении отсутствия теплопотерь и с учетом полного превращения исходных компонентов в конечные продукты синтеза по уравнениям химических реакций (1) - (28). В результате термодинамического анализа строились зависимости адиабатических температур и изменений энтальпии в химической реакции, равновесных составов продуктов синтеза от соотношения компонентов в исходных системах.
Синтез нитридной композиции TiN-BN, измерение линейных скоростей и максимальных температур горения проводились в лабораторном реакторе СВС-Аз постоянного давления с рабочим объемом 4,5 литра. При синтезе создавались следующие условия: давление азота в реакторе Р = 4 МПа, плотность исходной шихты – насыпная ( δ = 0,34), диаметр образца D = 30 мм [1, 9].
Рентгенофазовый анализ конечного продукта проводился с помощью дифрактометра ARL X’trA. Исследование морфологии и размера частиц порошковых нитридных композиций проводилось с помощью растрового электронного микроскопа Jeol JSM -6390A.
РЕЗУЛЬТАТЫ
Результаты расчета теоретического содержания азота в нитридной композиции TiN-BN при различном соотношении фаз TiN и BN представлено в табл. 1. Эти результаты необходимы для нахождения содержания основного вещества в целевом продукте и определения его качества.
Таблица 1. Теоретическое содержание азота в нитридной композиции TiN-ВN при различном соотношении фаз TiN и BN
|
Нитридная композиция |
Содержание азота, мас. % |
|
TiN-ВN |
32,23 |
|
2TiN-ВN |
28,23 |
|
3TiN-ВN |
26,59 |
|
4TiN-ВN |
25,69 |
|
TiN-2ВN |
37,54 |
|
TiN-3ВN |
40,91 |
|
TiN-4ВN |
43,24 |
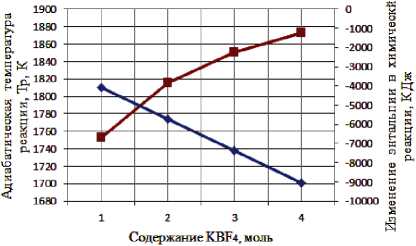
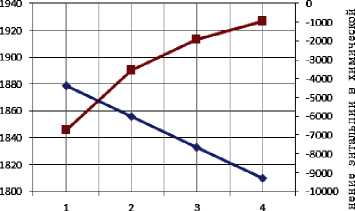
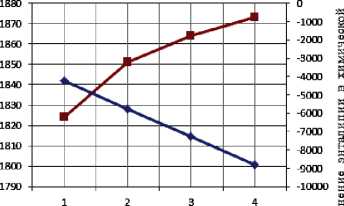
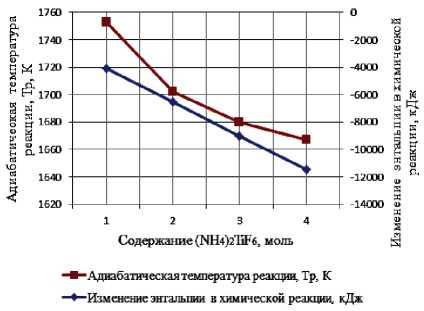
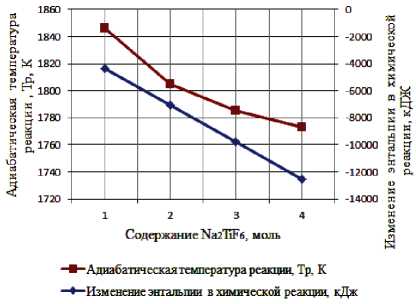
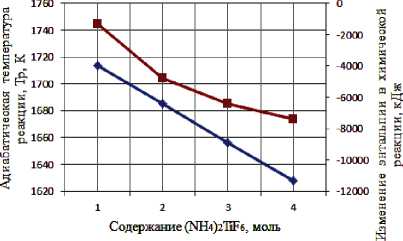
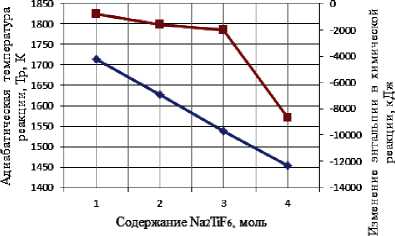
Результаты термодинамического расчета зависимости адиабатической температуры реакции и изменения энтальпии в химической реакции от соотношения компонентов в системах « х KBF4-NaN3- у (NH4)2TiF6», « х KBF4-NaN3- у Na2TiF6», « х NH4BF4-NaN3- у (NH4)2TiF6», « х NH4BF4-NaN3- у Na2TiF6» представлены на рис. 1.
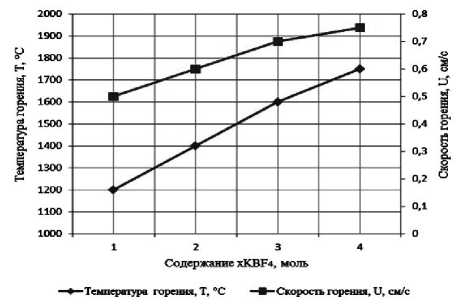
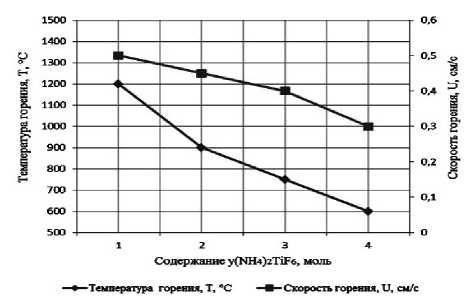
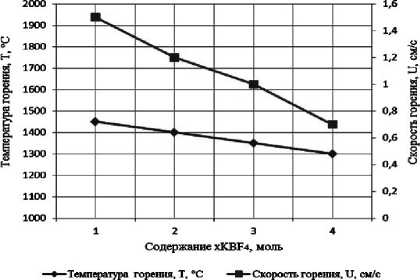
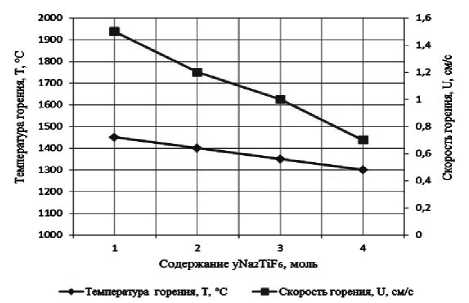
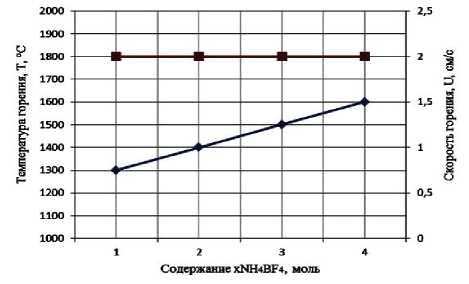
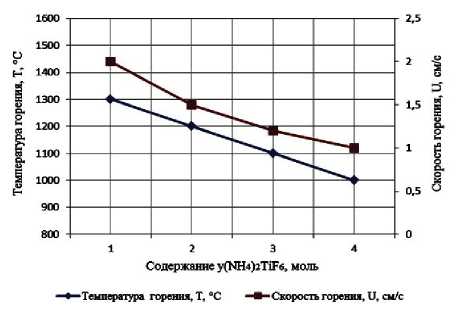
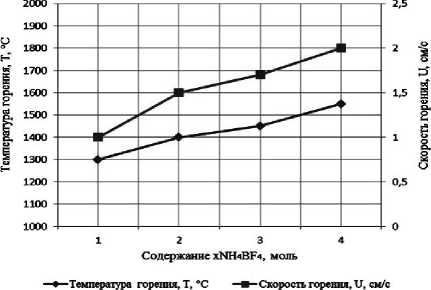
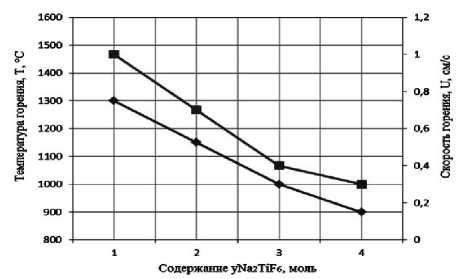
Результаты экспериментального определения зависимости температуры и скорости горения от соотношения компонентов в системах « х KBF4-NaN3- у (NH4)2TiF6», « х KBF4-NaN3- у Na2TiF6», « х NH4BF4-NaN3- у (NH4)2TiF6», « х NH4BF4-NaN3- у Na2TiF6» представлены на рис. 2.
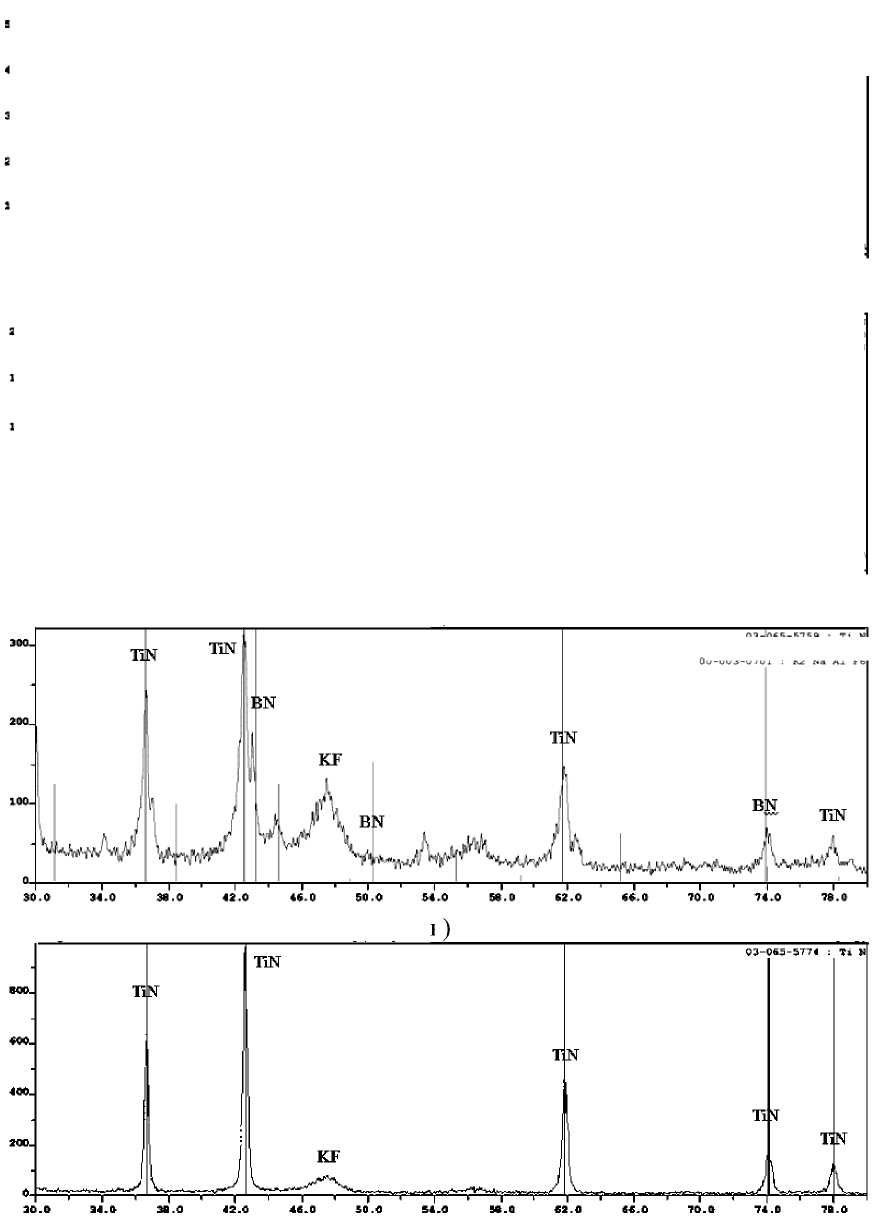
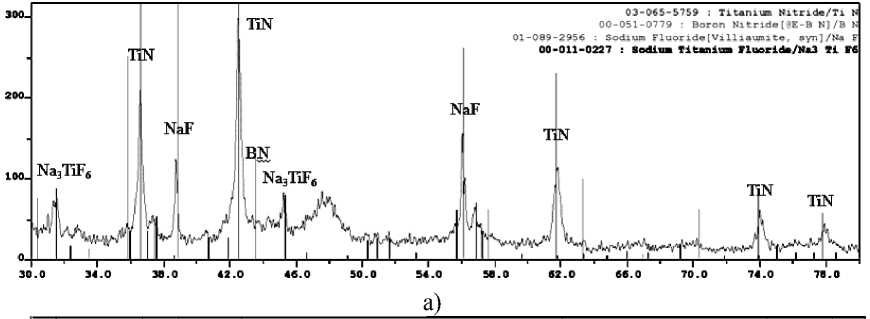
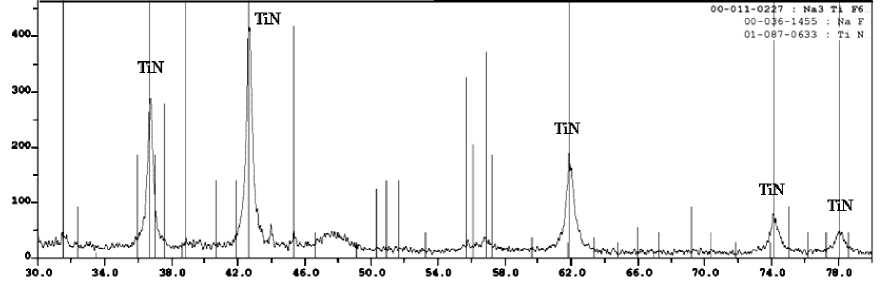
Дифрактограммы конечных продуктов синтеза, полученных из систем 3KBF4-15NaN3-(NH4)2TiF6», «KBF4-21NaN3-3(NH4)2TiF6», «3KBF4-13NaN3-Na2TiF6», «KBF4-15NaN3-3Na2TiF6», « 3NH4BF4-18NaN3-(NH4)2TiF6»,
в)
а)
Содержание KBF4, моль
■ Ад иабатич еская температура реакции, Тр, К
—^Изменение энтальпии в химической реакции, кДж
д)
б)
г)
—^Адиабатическаятемпература реакции, Тр, К
♦ Изменение энтальпии в химической реакции, кДж
е)
-
■ Адиабатическая температура реакции, Тр, К
—^Изменение энтальпии в химической реакции, кДж
-
■ Адиабатическая температура реакции, Тр, К
■^Изменение энтальпии в химической реакции, кДж
ж)
з)
Рис. 1. Зависимость адиабатической температуры реакции и изменения энтальпии в химической реакции от соотношения компонентов в системах:
-
а) « х KBF4-NaN3-(NH4)2TiF6»; б) «KBF4-NaN3- у (NH4)2TiF6»; в) « х KBF4-NaN3-Na2TiF6»;
-
г) «KBF4-NaN3- у Na2TiF6»; д) « х NH4BF4-NaN3-(NH4)2TiF6»; е) «NH4BF4-NaN3- у (NH4)2TiF6»;
ж) « х NH4BF4-NaN3-Na2TiF6»; з) «NH4BF4-NaN3- у Na2TiF6»
-
а)
-
б)
в)
—•—Температура горения, Т, °C И Скорость горения, U, см/с
д)
е)
♦ Температура горения, Т, °C ■ Скорость горения, U, см/с
ж)
з)
Рис. 2. Зависимости экспериментальной температуры и скорости горения от соотношения компонентов в системах:
а) « х KBF4-NaN3-(NH4)2TiF6»; б) «KBF4-NaN3- у (NH4)2TiF6»; в) « х KBF4-NaN3-Na2TiF6»; г) «KBF4-NaN3- у Na2TiF6»; д) « х NH4BF4-NaN3-(NH4)2TiF6»; е) «NH4BF4-NaN3- у (NH4)2TiF6»;
ж) « х NH4BF4-NaN3-Na2TiF6»; з) «NH4BF4-NaN3- у Na2TiF6»
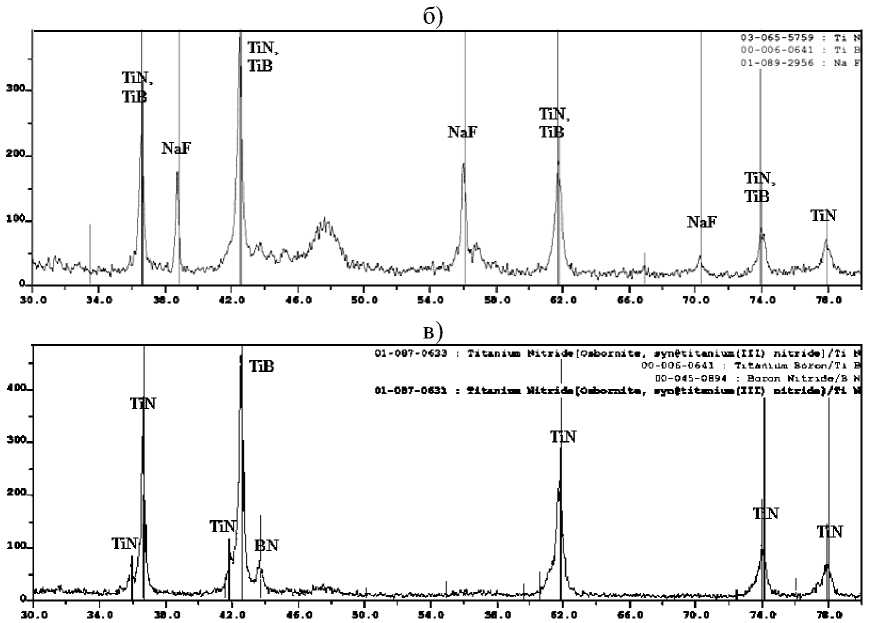
«NH4BF4-22NaN3-3(NH4)2TiF6», « 3NH4BF4-16NaN3 - Na2TiF6», «NH4BF4-16NaN3-3Na2TiF6», после водной промывки представлены на рис. 3 и 4.
На рис. 5 представлена морфология частиц ко-
нечного продукта (композиционного порошка), синтезированного из систем «KBF4-9NaN3-(NH4)2TiF6», «3KBF4-15NaN3-(NH4)2TiF6», «KBF4-21NaN3-3(NH4)2TiF6», «KBF4-7NaN3-Na2TiF6»,
|
500- |
т |
N. |
UN, TiB |
01-071-9845 : 00-006-0641 ; 00-015-0500 |
Ti N Ti В : В N |
|
|
т |
LB |
|||||
|
400- |
||||||
|
I |
N, |
|||||
|
I |
lB |
|||||
|
300- |
||||||
|
■ |
BN |
Ti |
N, T |
N |
||
|
200- |
TiJ |
в T |
lB |
|||
|
100_ |
^^Л^лЛ^гЛ^ |
^Л^*Ч^>лХ^ |
/ |
* '•A^^T'-s^As^'V-***'**’'^^ |
S^ |
|
в)
г)
Рис. 3. Дифрактограммы конечных промытых продуктов синтеза, полученных из систем: а) «3KBF4-15NaN3-(NH4)2TiF6»; б) «KBF4-21NaN3-3(NH4)2TiF6»;
в) «3KBF4-13NaN3-Na2TiF6»; г) «KBF4-15NaN3-3Na2TiF6»
|
30.0 |
1 ■ 34.0 |
1 ■ 1 38.0 *2.0 |
<6,0 50.0 m',0 50.0 |
62.0 66.0 70.0 |
74.0 78.0 |
|||
|
a) |
||||||||
|
200- 160_ 120 80. «_ |
Ti Ti |
sr, 1 8 |
TiN, T1B IN |
T T |
N, В |
01-071-9845 00-006-0641 01-071-6179 T1J^ T1B T T |
N, lB |
|
|
0. |
WW |
ч.;'^* |
^ X^,^v^\kA^^^ |
^Ai^^'iW^^V^^^ |
||||
|
30 |
.0 |
1 1 34.0 |
38.0 42.0 |
4 6.0 30.0 54.0 56*. 0 б) |
65 |
I 1 I 1 I 1 .0 66.0 70.0 |
74.0 78 |
.0 |
03-065-5759 : Tl N 01-071-6113 ; В N
00-003-0701 : К2 N* Al F6
г)
Рис. 4. Дифрактограммы конечных промытых продуктов синтеза, полученных из систем: а) « 3NH4BF4-18NaN3-(NH4)2TiF6»; б) «NH4BF4-22NaN3-3(NH4)2TiF6»;
в) « 3NH4BF4-16NaN3 - Na2TiF6»; г) «NH4BF4-16NaN3-3Na2TiF6»
«3KBF4-13NaN3- у Na2TiF6», «KBF4-15NaN3-3Na2TiF6», « NH4BF4-10NaN3-(NH4)2TiF6», «3NH4BF4-18NaN3-(NH4)2TiF6», «NH4BF4-22NaN3-3(NH4)2TiF6», « NH4BF4-8NaN3 - Na2TiF6», «3NH4BF4-16NaN3-Na2TiF6», «NH4BF4-16NaN3-3Na2TiF6».
ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
Результаты проведенных термодинамических расчетов (рис. 1) показывают, что адиабатические температуры реакций достаточно высокие,

а) б) в)

г) Д) е)

ж) з) и)

к)

л)
Рис. 5. Морфология частиц конечного продукта (композиционного порошка), синтезированного в системах: а) «KBF4-9NaN3-(NH4)2TiF6»; б) «3KBF4-15NaN3-(NH4)2TiF6»; в) «KBF4-21NaN3-3(NH4)2TiF6»; г) «KBF4-7NaN3-Na2TiF6»; д) «3KBF4-13NaN3- у Na2TiF6»; е) «KBF4-15NaN3-3Na2TiF6»;
ж) « NH4BF4-10NaN3-(NH4)2TiF6»; з) «3NH4BF4-18NaN3-(NH4)2TiF6»;
и) «NH4BF4-22NaN3-3(NH4)2TiF6»; к) « NH4BF4-8NaN3 - Na2TiF6»;
л) «3NH4BF4-16NaN3-Na2TiF6»; м) «NH4BF4-16NaN3-3Na2TiF6»

м)
поэтому все представленные системы СВС-Аз способны к самостоятельному горению и образованию нитридной композиции TiN-BN в режиме СВС из систем «KBF4-NaN3-(NH4)2TiF6», «KBF4-NaN3-Na2TiF6», «NH4BF4-NaN3-(NH4)2TiF6», «NH4BF4-NaN3-Na2TiF6» [6, 16]. Экспериментальные исследования, результаты которых представ- лены на рис. 2, подтвердили заключение о способности представленных систем СВС-Аз к самостоятельному горению.
Из рис. 3 и 4 видно, что в системах «хKBF4-NaN3-(NH4)2TiF6» и «KBF4-NaN3-у(NH4)2TiF6» кроме нитридной композиции TiN-ВN образуется еще и борид титана TiВ. Конечный продукт синтеза, полученный при горении систем «хKBF4-NaN3-Na2TiF6» и «KBF4-NaN3-уNa2TiF6», состоит из TiN, ВN и КF. Конечный продукт синтеза, полученный при горении систем «хNH4BF4-NaN3-(NH4)2TiF6», «NH4BF4-NaN3-у(NH4)2TiF6», «хNH4BF4-NaN3-Na2TiF6» и «NH4BF4-NaN3-уNa2TiF6», кроме TiN и ВN содержит в небольшом количестве галоидную соль – гексафторти-танат натрия Nа3TiF6, а при использовании в исходной системе галоидной соли Na2TiF6 в конечном продукте появляется борид титана.
Из рис. 5а видно, что форма частиц нитридной композиции, синтезированной в системе «KBF4-9NaN3-(NH4)2TiF6», имеет округлую и неправильную форму и средний размер частиц составляет 200-350 нм. С увеличением содержания KBF4и (NH4)2TiF6 в шихте до 3 молей (рис. 5б и 5в) форма частиц нитридной композиции имеет округлую и неправильную форму и средний размер частиц составляет 300-400 нм.
Из рис. 5г видно, что форма частиц нитридной композиции, синтезированной в системе «KBF4-7NaN3-Na2TiF6» имеет округлую форму и средний размер частиц составляет 90-130 нм. С увеличением содержания KBF4и Na2TiF6 в шихте до 3 молей форма частиц нитридной композиции «3KBF4-13NaN3-Na2TiF6» (рисунок 5д) имеет округлую и неправильную форму, а форма частиц нитридной композиции «KBF4-15NaN3-3Na2TiF6» (рис. 5е) имеет неправильную приплюснутую форму, средний размер частиц составляет 500-600 нм.
Из рис. 5ж видно, что форма частиц нитридной композиции, синтезированной в системе « NH4BF4-10NaN3-(NH4)2TiF6», имеет неправильную форму и средний размер частиц составляет 150-200 нм. С увеличением содержания NH4BF4 и (NH4)2TiF6 в шихте до 3 молей форма частиц нитридной композиции «3NH4BF4-18NaN3-(NH4)2TiF6» (рис. 5з) имеет вытянутую загнутую в половинку баранки форму, а форма частиц нитридной композиции «NH4BF4-22NaN3-3(NH4)2TiF6» (рис. 5и) имеет неправильную форму, средний размер частиц составляет 170-200 нм.
Из рис. 5к видно, что форма частиц нитридной композиции, синтезированной в системе « NH4BF4-8NaN3 - Na2TiF6» имеет игольчатую форму и средний размер частиц составляет 100150 нм. С увеличением содержания NH4BF4 и Na2TiF6 в шихте до 3 молей форма частиц нитридной композиции «3NH4BF4-16NaN3-Na2TiF6» (рис. 5л) имеет игольчатую форму и средний размер частиц составляет 70-90 нм, а форма частиц нитридной композиции «NH4BF4-16NaN3-3Na2TiF6» (рис. 5м) имеет неправильную форму и средний размер частиц составляет 170-200 нм.
Из рис. 5 видно также, что в большинстве слу- чаев наноразмерные и ультрадисперсные частицы продукта объединены в гранулы (агломераты), т.е. конечный продукт представляет собой нано – и ультраструктурированный микропорошок, состоящий из отдельных гранул (агломератов), размер которых может достигать десятков микрометров.
ЗАКЛЮЧЕНИЕ
Таким образом, полученный по азидной технологии СВС из систем «KBF4-9NaN3-(NH4)2TiF6», «3KBF4-15NaN3-(NH4)2TiF6», «KBF4-21NaN3-3(NH4)2TiF6», «3KBF4-13NaN3- у Na2TiF6», «KBF4-15NaN3-3Na2TiF6», « NH4BF4-10NaN3-(NH4)2TiF6», «3NH4BF4-18NaN3-(NH4)2TiF6», «NH4BF4-22NaN3-3(NH4)2TiF6», « NH4BF4-8NaN3 - Na2TiF6», «NH4BF4-16NaN3-3Na2TiF6» композиционный порошок на основе нитрида титана и нитрида бора можно классифицировать как микропорошок, состоящий из гранул ультрадисперсных частиц, а из систем «KBF4-7NaN3-Na2TiF6» и «3NH4BF4-16NaN3-Na2TiF6» - как микропорошок, состоящий из гранул наноразмерных частиц (наноструктуриро-ванный порошок).
Работа выполнена при финансовой поддержке Министерства образования и науки РФ в рамках базовой части Государственного задания ФГБОУ ВПО “Самарский государственный технический университет” (код 1583) .
Список литературы Исследование возможности получения микро- и нанопорошка нитридной композиции TiN-BN в системе «галогенид титана - азид натрия - галогенид бора» по азидной технологии СВС
- Бичуров Г.В., Шиганова Л.А., Титова Ю.В. Азидная технология самораспространяющегося высокотемпературного синтеза микро-и нанопорошков нитридных композиций: Монография. М.: Машиностроение, 2012. 519 с.
- Чухломина Л.Н., Максимов Ю.М., Верещагин В.И. Самораспространяющийся высокотемпературный синтез композиционных нитридсодержащих керамических материалов. Новосибирск: Наука, 2012. 260 с.
- Амосов А.П., Боровинская И.П., Мержанов А.Г. Порошковая технология самораспространяющегося высокотемпературного синтеза материалов: Учебное пособие. М.: Машиностроение-1, 2007. 568 с.
- Merzhanov A.G. and Borovinskaya I.P. Historical Retrospective of SHS: An Autoreview//International Journal of Self-Propagating High-Temperature Synthesis. 2008. Vol. 17. No. 4. P. 242-265.
- Мержанов А.Г. Процессы горения и синтез материалов: Монография. Черноголовка: ИСМАН, 1999. 512 с.
- Мержанов А.Г. Твердопламенное горение: Монография. Черноголовка: ИСМАН, 2000. 240 с.
- Самораспространяющийся высокотемпературный синтез: теория и практика/Сб. науч. статей под ред. Е.А.Сычева. Черноголовка: Территория, 2001. 432 с.
- Концепция развития самораспространяющегося высокотемпературного синтеза как области научно-технического прогресса/Сб. науч. статей под ред. А.Г. Мержанова. Черноголовка: Территория, 2003. 368 с.
- Амосов А.П., Бичуров Г.В. Азидная технология самораспространяющегося высокотемпературного синтеза микро-и нанопорошков нитридов: Монография. М.: Машиностроение-1, 2007. 526 с.
- Azides as Reagents in SHS Processes/A.P Amosov., G.V. Bichurov, N.F Bolshova., V.M. Erin, A.G. Makarenko, Yu.M. Markov//International Journal of Self-Propagating High-Temperature Synthesis. 1992. Vol.1, No 2. P. 239-245.
- Bichurov George. The Use of Halides in SHS Azide Technology//International Journal of Self-Propagating High-Temperature Synthesis. 2000. Vol.9, No.2. P. 247-268.
- Principles and Methods for Regulation of Dispersed Structure of SHS Powders: from Monocrystallites to Nanoparticles/A.P. Amosov, I.P. Borovinskaya, A.G. Merzhanov and A.E. Sytchev//International Journal of Self-Propagating High-Temperature Synthesis. 2005. Vol. 14. No. 1. P. 165-186.
- Механизм образования наноструктурированного порошка нитрида титана в режиме самораспространяющегося высокотемпературного синтеза в системе «гексафтортитанат аммония-азид натрия»/А.П. Амосов, Г.В. Бичуров, Ю.В. Титова, Л.А. Шиганова//Известия Самарского научного центра РАН. 2009. Tом 11. №3. С.111-116.
- The Self-Propagating High-Temperature Synthesis of a Nanostructured Titanium Nitride Powder with the Use of Sodium Azide and Haloid Titanium Containing Salt/L.A. Shiganova, G.V. Bichurov, A.P. Amosov, Yu.V. Titova, A.A. Ermoshkin, P.G. Bichurova//Russian Journal of Non-Ferrous Metals. 2011. Vol. 52, No. 1. P. 91-95.
- Self-Propagating High-Temperature Synthesis of Nanostructural Aluminium Nitride Powder with The Use of Aluminium Fluoride and Sodium Azide/Yu.V. Titova, L.A. Shiganova, D.A. Maydan, G.V. Bichurov//Russian Journal of Non-Ferrous Metals. 2014. Vol. 55, No. 2http://www.springerlink.com/content/1067-8212/52/1/. P. 177-181.
- Mamyan S.S. Thermodynamic Analysis of SHS Processes//Key Engineering Materials. 2002. Vol. 217. P. 1-8.


