Исследование возможности создания лекарственного покрытия билиарных стентов на основе сополимера «полимолочная кислота - поликапролактон», модифицированного углеродными нанотрубками и доксорубицином
Автор: Запороцкова И.В., Сучков С.Г., Борознин С.В., Звонарева Д.А., Чешева М.Ф., Шинкарев Р.В.
Журнал: НБИ технологии @nbi-technologies
Рубрика: Нанотехнологии и наноматериалы
Статья в выпуске: 2 т.17, 2023 года.
Бесплатный доступ
В данной статье рассмотрена возможность создания ультратонкого лекарственного покрытия для билиарных стентов. Также в статье представлены теоретические расчеты взаимодействия комплексов полимеров-носителей и сополимера «полимолочная кислота - поликапролактон», модифицированных углеродными нанотрубками. Данное покрытие предложено с целью улучшения биосовместимости при проведении эндобилиарного стентирования.
Стентирование, ультратонкое покрытие, полимолочная кислота, поликапролактон, доксорубицин, углеродные нанотрубки
Короткий адрес: https://sciup.org/149143226
IDR: 149143226 | УДК: 544.18:678.7-13 | DOI: 10.15688/NBIT.jvolsu.2023.2.3
Текст научной статьи Исследование возможности создания лекарственного покрытия билиарных стентов на основе сополимера «полимолочная кислота - поликапролактон», модифицированного углеродными нанотрубками и доксорубицином
DOI:
Под механической желтухой обычно подразумевают симптомокомплекс, возникающий при нарушении оттока желчи по желчным протокам печени. Данное заболевание является показанием к выполнению стентирования. К сожалению, со временем врачи отметили ряд недостатков в проведении эндобилиарно-го стентирования, главным из которых стало проявление рестеноза. Также в течение первых нескольких часов после завершения процедуры стентирования может возникнуть риск появления серьезного осложнения, такого как тромбоз и рестеноз.
Для снижения рисков возникновения таких осложнений, а также для улучшения будущих результатов операции стали применять стенты со специальным лекарственным покрытием для обеспечения локальной транспортировки, качественного нанесения лекарственного вещества на поверхность билиарного стента и пролонгированного выхода препарата необходимо создание полимерного комплекса-носителя [2].
В рамках исследования было предложено сверхтонкое лекарственное покрытие, состоящее сразу из двух полимеров (поликапролактон (PCL) и полимолочная кислота
(PMC)), углеродных нанотрубок (CNT), влияющих на его стойкость и сохранение на поверхности стента за счет уникальных сорбционных свойств, и лекарственного препарата доксорубицин (DOX), который обладает выраженной противоопухолевой активностью [3; 4; 5].
Для доказательства возможности создания и эффективности нового сверхтонкого лекарственного покрытия были проведены квантово-химические расчеты взаимодействия его основных компонентов, выполненные методом DFT [1].
Поликапролактон + углеродная нанотрубка
Расчеты проводились пошаговым приближением фрагмента полимера-носителя, а именно поликапролактона, к молекулярному кластеру углеродной нанотрубки типа (6, 6) и расчета энергии адсорбции.
Приближение данной системы производилось с шагом 0,2 Å в диапазоне от 1,8 Å до 5,0 Å, расчет энергии выполнялся методом теории функционала плотности в приближении B3LYP с базисным набором 6-31G.
НАНОТЕХНОЛОГИИ И НАНОМАТЕРИАЛЫ
Оптимизация геометрии комплекса, состоящего из поликапролактона и углеродной нанотрубки, изображена на рисунке 1.
Результаты взаимодействия данного полимера-носителя с углеродной нанотрубкой представлены на графике (рис. 2).
Проанализировав энергетическую кривую, заметим на расстоянии 2,8 Å минимальное значение энергии адсорбции, что характеризует реализацию процесса адсорбции в данной системе. Данный график показал, что комплекс стабилизируется и адсорбируется при энергии, равной E адс = -0,8 эВ.
Полимолочная кислота + углеродная нанотрубка
Далее был смоделирован комплекс взаимодействия полимолочной кислоты и угле- родной нанотрубки (см. рис. 3). Пошаговое приближение осуществлялось аналогично приближению поликапролактона. Активный центр в качестве атома кислорода приближался к центральному атому поверхности кластера углеродной нанотрубки.
Результаты расчета энергии адсорбции системы «полимолочная кислота + УНТ» представлены на графике (см. рис. 4).
Анализ полученной кривой показал, что адсорбция реализуется при минимальном значении энергии E адс = -0,66 эВ, которая соответствует расстоянию 2,6 Å.
Комплекс «сополимер + углеродная нанотрубка»
Универсальность поликапролактона заключается в том, что можно модифицировать
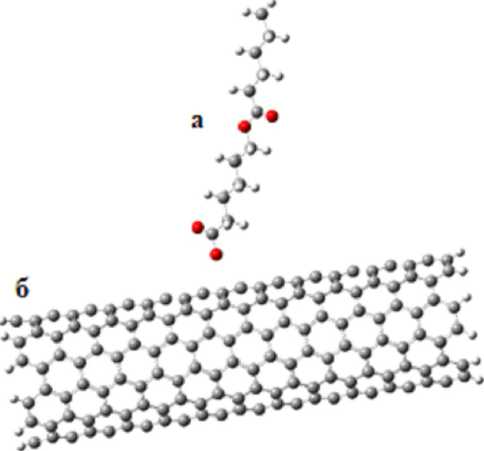
Рис. 1. Модель оптимизированного комплекса «поликапролактон ( а ) + углеродная нанотрубка ( б )»
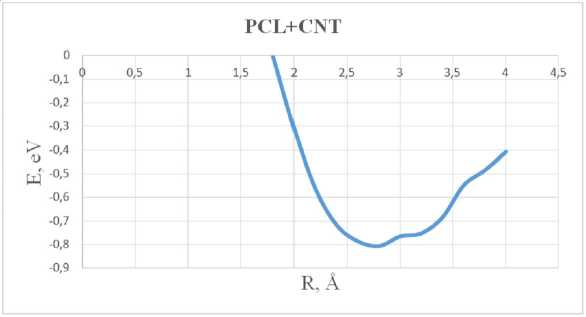
Рис. 2. График зависимости энергии адсорбции (эВ) от расстояния (Å) комплекса «PCL + CNT»
его физические, химические и механические свойства сополимеризацией. В ранних исследованиях было установлено, что полимеризация изменяет химические свойства, что косвенно оказывает влияние на все другие свойства, такие как степень кристалличности, растворимость и картина деградации, в результате чего модифицированный полимер может быть предназначен для доставки лекарственных средств. Поликапролактон совместим с природными полимерами, такими как крахмал, гидроксиапатит, хитозан и синтетическими полимерами, а именно с полиэтиленгликолем, поливиниловым спиртом и полимолочной кислотой. Поэтому в нашей работе мы использовали сополимер, состоящий одновременно из полимолочной кислоты и поликапролактона.
В работе предложены два варианта строения сополимеров в качестве полимера-носителя:
-
1. Сополимер типа A-B-A-B-A-B
-
2. Сополимер типа AAA-BBB
Оптимизированная геометрия сополимеров типа A-B-A-B-A-B и типа AAA-BBB, состоящих из мономеров поликапролактона и полимолочной кислоты, представлена на рисунке 5.
Процесс взаимодействия сополимера (PCL и PMC) с углеродной нанотрубкой рассматривался путем приближения атома кислорода примерно к середине фрагмента кластера УНТ. Приближение осуществлялось с шагом 0,2 Å в диапазоне расстояний от 1,8 Å до 5,0 Å.
На рисунке 6 представлен комплекс сополимера (PCL+PMC) с углеродной нанотрубкой.
Результаты взаимодействия характеризуются энергетической кривой, указанной на рисунке 7.
Для сравнения сополимер типа AAA-BBB аналогичным образом приближался к повер-
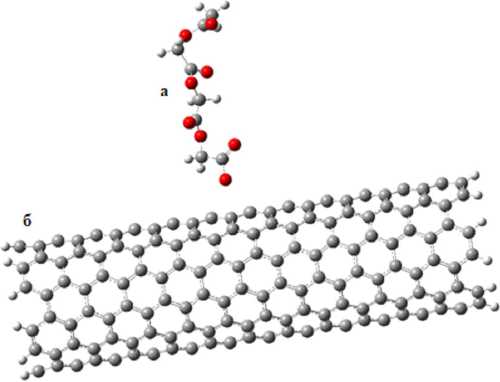
Рис. 3. Модель оптимизированного комплекса «PMC ( а ) + CNT ( б )»
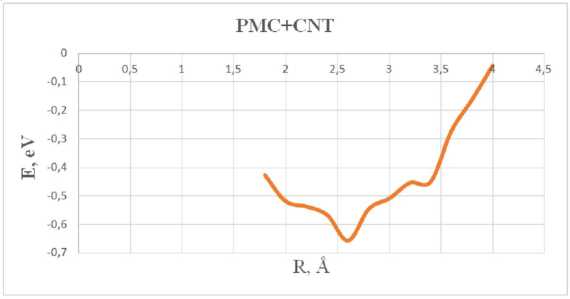
Рис. 4. Энергетическая кривая зависимости энергии адсорбции (эВ) от расстояния (Å) комплекса «PMC + CNT»
НАНОТЕХНОЛОГИИ И НАНОМАТЕРИАЛЫ
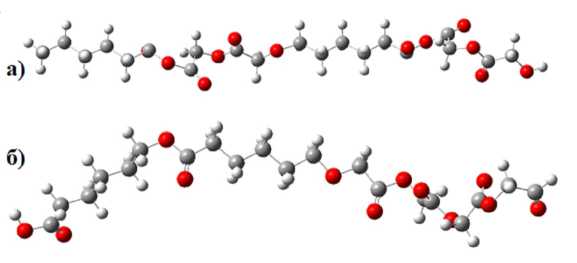
Рис. 5. Оптимизированные модели предложенных в качестве полимера-носителя сополимеров:
а – типа A-B-A-B-A-B; б – типа AAA-BBB
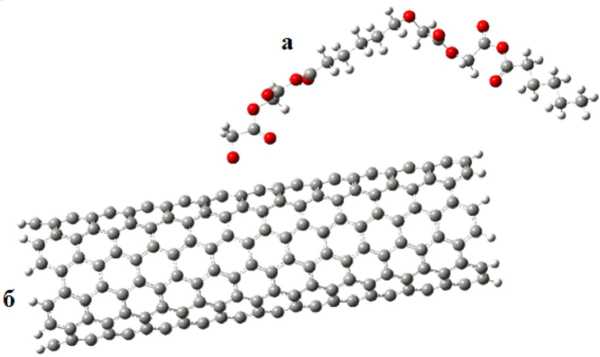
Рис. 6. Сополимер типа A-B-A-B-A-B ( а ) в приближении к углеродной нанотрубке ( б )
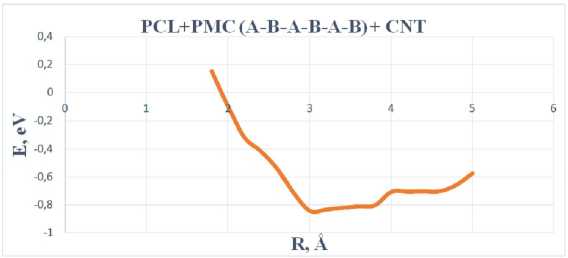
Рис. 7. График зависимости энергии адсорбции (эВ) от расстояния (Å) комплекса «сополимер типа A-B-A-B-A-B + CNT»
хности углеродной нанотрубки. Нормировка была произведена таким же образом, как с сополимером типа A-B-A-B-A-B.
График зависимости (рис. 7) показал, что процесс адсорбции реализуется при минимуме энергии E адс = – 0,84 эВ на расстоянии 3,0 Å, а на рисунке 8 минимум энергии соответствует расстоянию 2,6 Å и E адс = – 0,59 эВ.
Таким образом, сравнивая полученные значения энергии адсорбции, выявили, что сополимер типа A-B-A-B-A-B является энергетически более выгодным, чем сополимер типа AAA-BBB (рис. 9). Об этом свидетельствует меньшее значение энергии адсорбции.
Сополимер типа A-B-A-B-A-B + УНТ + доксорубицин
Завершающий этап выполнения расчетов заключался в изучении взаимодействия сложного молекулярного комплекса «PCL с PMC + CNT + DOX». Процесс приближения доксорубицина к оптимизированному комплексу «CNT + сополимер» производился с шагом
0,2 Å; расстояние, в котором варьировались значения, было взято в диапазоне от 1,8 Å до 5,0 Å. Модель сложного комплекса представлена на рисунке 10.
На основе анализа результатов расчетов присоединения доксорубицина к комплексу «сополимер + УНТ» был построен график зависимости потенциальной энергии взаимодействия компонентов покрытия (рис. 11).
Наличие минимума кривой на расстоянии 2,4 Å, соответствующего энергии Eадс = -5,17 эВ и расстоянию физического взаимодействия между доксорубицином и центром комплекса, состоящего из сополимера и УНТ, доказывает возможность достаточно легкой десорбции лекарственного препарата из полиме- ра-носителя и его постепенного поступления в организм.
Необходимость улучшения технологии эндобилиарного стентирования требует от исследователей эффективных путей решения проблем возникающих рестеноза и тромбоза. Поскольку проведение натурных медицинских экспериментов требует детальной подготовки и больших временных, экономических затрат, а также связано с риском причинения вреда здоровью человека, наиболее целесообразным становится предварительное компьютерное моделирование исследуемых материалов.
Предложенное в данной статье нанопокрытие сформировано из наиболее эф-
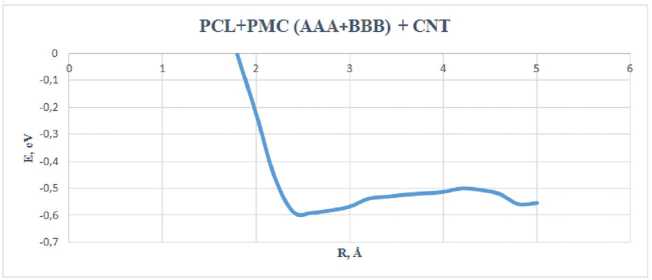
Рис. 8. График зависимости энергии адсорбции (эВ) от расстояния (Å) комплекса «сополимер типа AAA-BBB + CNT)
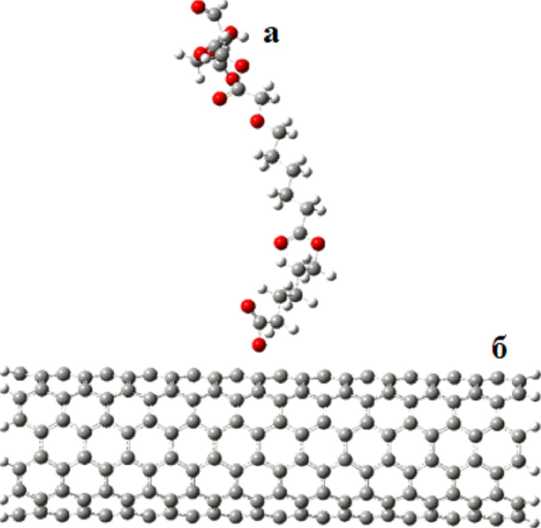
Рис. 9. Сополимер типа AAA-BBB ( а ) в приближении к углеродной нанотрубке ( б )
НАНОТЕХНОЛОГИИ И НАНОМАТЕРИАЛЫ
фективных для решения существующих проблем материалов: это полимеры поликапролактон и полимолочная кислота, улучшающие механические и химические свойства стента; углеродные нанотрубки, чьи уникальные особенности давно сделали их одним из востребованных материалов нанотехнологии; а также доксорубицин – лекарственный препарат, позволяющий существенно снижать риск возникновения опухолей.
В ходе модельного эксперимента был детально представлен механизм формирования лекарственного нанопокрытия, определен наиболее вероятный тип сополимера, а также представлено взаимодействие полученного комплекса с лекарственным препаратом.
Проведенные исследования теоретически доказывают возможность создания лекарственного нанопокрытия «PCL с PMC + CNT + DOX» с сополимером типа A-B-A-B-A-B, что открывает широкие возможности для внедрения данного материала в медицинской практике.
Список литературы Исследование возможности создания лекарственного покрытия билиарных стентов на основе сополимера «полимолочная кислота - поликапролактон», модифицированного углеродными нанотрубками и доксорубицином
- Антеградное билиарное стентирование в лечении механической желтухи / А. В. Андреев, В. М. Дурлештер, А. И. Левешко [и др.] // Анналы хирургической гепатологии. - 2019. - № 24 (2). - С. 25-35. -.
- Баимова, Ю. А. Графен, нанотрубки и другие углеродные наноструктуры / Ю. А. Баимова, Р. Р. Мулюков. - М.: Российская академия наук, 2018. - 212 с. - 10.31857/S97859070363 69000001.
- Технология полимеров медико-биологического назначения. Полимеры природного происхождения / М. И. Штильман, А. В. Подкорытова, С. В. Немцев [и др.]. - 2-е изд. - М.: Лаборатория знаний, 2016. - 331 c.
- Recent Advances in Density Functional Theory Approach for Optoelectronics Properties of Graphene / A. L. Olatomiwa, T. Adam, C. O. Edet [et al.] // Heliyon. - 2023. - № 9. - P. 1-26. - 10.1016/j.Heliyon.2023. e14279.
- Tacar, O. Doxorubicin: an Update on Anticancer Molecular Action, Toxicity and Novel Drug Delivery Systems / O. Tacar, P. Sriamornsak, C. R. Dass // The Journal Pharmacy and Pharmacology. - 2013. - № 65. - P. 157-170.


