Исследование возможных радиопротекторных свойств деанола ацеглумата при действии ионизирующего излучения на клетки человека
Автор: Выпова Е.Р., Купцова П.С., Комарова Л.Н., Берсенева А.А., Балдов Д.А., Котляров А.А.
Рубрика: Научные статьи
Статья в выпуске: 3 т.32, 2023 года.
Бесплатный доступ
Возникновение осложнений в результате проведения лучевой терапии при лечении злокачественных новообразований является одной из важных и актуальных проблем в радиобиологии и клинической онкологии. Применение радиопротекторных препаратов при лучевой терапии пациентов с онкологическим диагнозом предназначено для снижения повреждающего действия ионизирующего излучения на здоровые ткани, облучённые вместе с опухолью. Современные радиопротекторы имеют существенные недостатки. В связи с этим приоритетным направлением исследований является поиск новых радиопротекторов для защиты здоровых клеток при лучевой терапии. Цель проведённого исследования - изучение возможных радиозащитных свойств деанола ацеглумата при действии гамма-излучения и ионов 12С на фибробласты человека (hTERT) и подбор оптимального времени предлучевого инкубирования клеток с соединением. Действие излучения оценивали по критериям времени удвоения и клоногенной активности клеток. Показано, что деанола ацеглумат в концентрации 1000 мкМ оказывает радиопротекторное действие на фибробласты человека при действии гамма-излучения. Оптимальное время предлучевого инкубирования клеток с соединением составляет 24 ч для проявления наибольшего радиозащитного эффекта. Деанола ацеглумат в концентрации 1000 мкМ не проявляет радиозащитного действия на нормальные клетки при облучении их ионами 12С за пиком Брэгга. Установлено, что проявление радиопротекторных свойств препарата существенно зависит от качества ионизирующего излучения. Применение деанола ацеглумата в качестве радиопротектора может быть перспективным как один из способов снижения лучевой нагрузки на нормальные клетки человека при проведении лучевой терапии онкологических больных.
Онкология, лучевая терапия, радиопротекторы, антиоксиданты, деанола ацеглумат, фибробласты клеточной линии человека htert, гамма-излучение, ионы 12с, выживаемость, клоногенный анализ, время удвоения
Короткий адрес: https://sciup.org/170200557
IDR: 170200557 | УДК: 615.849.1.015.25 | DOI: 10.21870/0131-3878-2023-32-3-38-49
Текст научной статьи Исследование возможных радиопротекторных свойств деанола ацеглумата при действии ионизирующего излучения на клетки человека
Для лечения онкологических заболеваний наиболее часто применяется лучевая терапия, являющаяся в настоящее время одним из ведущих и высокоэффективных методов лечения злокачественных новообразований (ЗНО) различного генеза. Целью лучевой терапии является достижение максимального уничтожения опухолевых клеток при минимальном повреждении нормальных тканей (терапевтический интервал) [1]. Существующие на сегодняшний день радиологические методы, использующие фотонное и электронное излучение, оказываются малоэффективными для лечения неоперабельных, глубокорасположенных, а также радиорезистентных опухолей. В настоящее время наиболее перспективным методом лучевой терапии для преодоления высокой радиорезистентности некоторых форм ЗНО является использование плотноионизирую-щего излучения (протоны и ионы 12С), которое характеризуется прямым поражающим действием в отношении опухолевых клеток [2]. Однако, применение тяжёлых заряженных частиц также имеет ряд существенных недостатков, ограничивающих их применение для лечения онкологи-
Выпова Е.Р.* – зав. лаб.; Купцова П.С. – преподаватель, м.н.с. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России; Комарова Л.Н. – проф., д.б.н.; Берсенева А.А. – магистр 2-го курса; Балдов Д.А. – магистр 2-го курса; Котляров А.А. – декан мед. факультета, начальник отд., д.м.н., проф. ИАТЭ НИЯУ МИФИ.
ческих заболеваний. Так, например, происходит деление их на осколки, имеющие большой пробег по отношению к первичным ионам, что увеличивает вероятность повреждения нормальных клеток организма человека [3, 4]. При этом, с увеличением глубины растёт количество осколков, которое достигает своего максимума вблизи пика Брэгга. К вторичным продуктам при ионно-уг-леродной терапии относятся гамма-кванты, нейтроны, электроны, позитроны, протоны, дейтроны, тритоны, альфа-частицы и т.д. [4].
Несмотря на существенные преимущества лучевой терапии в целом, использование источников ионизирующего излучения приводит к серьёзным побочным эффектам, таким как лучевые поражения слизистых, кожных покровов, сосудистой системы, а также более глубокорасположенных тканей [5]. Механизм действия редкоионизирующего излучения осуществляется путём запуска окислительного стресса. Ионизирующее излучение вызывает ряд серьёзных повреждений ДНК, таких как размыкание пуринового кольца, фрагментация или разрушение пуриновых оснований, а также одно- и двуцепочечные разрывы. Активные формы кислорода (АФК), образующиеся вследствие действия ионизирующего излучения, приводят к разрушению азотистых оснований, дезоксирибозы и индукции новых ковалентных связей [6]. Активация свободнорадикального окисления негативно сказывается не только на клетках опухоли, но затрагивает клетки здоровых тканей. Снижение активности вышеописанных процессов поможет снизить риск возникновения радиационных повреждений, вызванных ионизирующим излучением. Применение радиопротектор-ных средств при радиотерапии предназначено для повышения радиорезистентности нормальных, попадающих под повреждающее действие ионизирующего излучения при локальном облучении опухолей, в том числе для снижения оксидативного стресса за счёт антиоксидантного действия конкретного препарата.
В связи с этим актуальным является поиск эффективных соединений, обладающих антиоксидантной активностью, которые будут использованы в качестве средств для радиозащиты нормальных клеток при лучевой терапии онкологических больных.
Перспективным соединением, которое может использоваться в качестве радиопротектора, является деанола ацеглумат (торговое название «Деманол»). Это соединение известно как малотоксичный ноотропный препарат. Препарат по своему химическому строению схож с естественными метаболитами мозга (γ-аминомасляная кислота, глутаминовая кислота). Протекторные свойства деанола ацеглумата могут быть связаны со снижением уровня малонового диальдегида в печени, трансаминаз в сыворотке крови, с улучшением показателей липидного обмена, а именно, с уменьшением уровня триглицеридов, свободного холестерина, а также с корригирующим влиянием на процессы перекисного окисления липидов и повышением активности ферментов антиоксидантной защиты [7]. Помимо всего прочего, имеются данные, свидетельствующие о гепатозащитной и антиоксидантной активности деанола ацеглумата [8].
Цель исследования – изучение возможных радиопротекторных свойств деанола ацеглу-мата при действии излучения ионов 12С и гамма-излучения на нормальные клетки человека и определение оптимального времени предлучевого инкубирования клеток с препаратом.
Материалы и методы
Объект исследования
Объектом исследования была выбрана клеточная линия фибробластов человека hTERT – нормальные клетки соединительной ткани, полученные из ООО «БиолоТ» (Россия). Культивирование клеток проводилось по стандартной методике [9]. Культивация осуществлялась в пласти-39
ковых культуральных флаконах ( «Eppendorf» , Германия) в виде монослоя в полной питательной среде DMEM («ПанЭко», Россия), которая содержит 10% фетальной сыворотки крупного рогатого скота («Gibco», США), пенициллин (50000 ед/л) («ПанЭко», РФ), стрептомицин (50 мг/л) («ПанЭко», Россия) и глютамин (292 мг/л) («ПанЭко», Россия). Жизнеспособность клеточной культуры поддерживали в СО 2 -инкубаторе при температуре 37 °С («CB 53 Binder», Германия) при 5% содержании СО 2 .
Исследуемый препарат: деанола ацеглумат.
Тесты: анализ клоногенной активности (выживаемость). Инкубация клеток осуществлялась в течение 7-14 дней до формирования колоний, которые видны невооружённым глазом (в диаметре не менее 0,75 мм). После питательную среду удаляли, затем колонии фиксировали этиловым спиртом (95%). Окрашивание колоний было осуществлено 2%-ным раствором метиленового синего в 50% этаноле [10].
Время удвоения: клетки после облучения высеивали в чашки Петри в концентрации 1·104 клеток на чашку. Период культивирования клеток 48 ч. По окончании времени питательную среду сливали и промывали раствором Трипсина-Версена, затем добавляли 1 мл указанного раствора и оставляли в термостате на 30 мин. Снятые с поверхности чашки клетки подсчитывали в камере Горяева. Время удвоения рассчитывали по формуле 1:
TD = tpx -^- , (1)
1°9
где tp – время культивирования; N 1 – начальное количество клеток; N 2 – конечное количество клеток.
Токсичность исследуемого соединения оценивали по стандартной методике МТТ-теста [11].
Для осуществления эксперимента готовили суспензию клеток концентрацией 105 клеток в 1 мл пол- ной питательной среды DMEM. Далее клетки сеяли в 96-луночный планшет в количестве 100 мкл клеточной суспензии на лунку (104 клеток в каждой лунке), к культуре клеток hTERT добавляли методом раститровки различные концентрации деанола ацеглумата (1000, 100, 50, 25, 12,5, 6,25, 3,12 и 1,56 мкМ), далее помещали в СО2-инкубатор [12]. Через 72 ч инкубирования фибробластов с исследуемым соединением в различной концентрации вносили в каждую лунку по 20 мкл рабочего раствора МТТ и инкубировали ещё 2 ч. После чего заменяли в каждой лунке среду на рас- твор диметилсульфоксида. Затем определяли оптическую плотность каждой лунки при длине волны 570 нм. Расчёт выживаемости производили по формуле 2:
Выживаемость =
ОП опытных лунок-ОП среды ОП контр.лунок- ОП среды
х 100% ,
где ОП – это оптическая плотность.
Стандартное отклонение рассчитывали по формуле 3:
_ I £(х-х)
V (п-1) ’ где x ‒ величина отдельного значения выборки; x̅ ‒ среднее арифметическое выборки; n ‒ размер выборки.
Перед началом облучения флаконы с монослоем трипсинизировали раствором Трипсина-Версена (раствор готовили в соответствии с типом клеток, для hTERT подходит соотношение 1:1), готовили суспензию клеток, осуществляли подсчёт клеток в камере Горяева, доводя суспензию до нужной концентрации (5⋅104 кл/мл). Затем фибробласты перемещали в пробирки типа «Эппендорф» объёмом 1,5 мл для последующего облучения. Клетки инкубировали с исследуемым препаратом в концентрации 1000 мкМ, основываясь на результатах МТТ-теста на токсичность исследуемого соединения, проведённых предварительно авторами статьи. Транспортировка клеток осуществлялась при температуре тающего льда.
Источники ионизирующего излучения и условия облучения
Первую группу клеток подвергали действию только ионизирующего излучения, вторую группу клеток облучали с препаратом. Третья группа подвергалась комбинированному действию. Контролем служили необлучённые и необработанные препаратом клетки.
Облучение гамма-квантами проводили на уникальной научной установке ФГБНУ ВНИИРАЭ (Обнинск) «ГУР-120» (источник ионизирующего излучения 60Со, Е ср =1,25 МэВ). Мощность дозы составила 0,9 Гр/мин. Дозы облучения: 2, 6, 8 и 12 Гр.
Облучение ионами 12С проводили на каскаде ускорителя «У-70» Института физики высоких энергий (ИФВЭ) ФГБУ ГНЦ РФ «Курчатовский институт» (Протвино). Облучение осуществлялось в водном фантоме со средней энергией 455,8 МэВ/нуклон. Дозы облучения: 2, 6, 8 и 12 Гр. Облучение проводилось за пиком Брэгга.
Каждая серия опытов повторялась 3-5 раз. Обработка полученной информации проводилась с использованием пакета приложений Microsoft Office 2010. Графические изображения созданы в программе SigmaPlot 11.0. Значимость различий средних величин выживаемости, полученных в разных сериях опытов, оценивали с применением непараметрического критерия Крамера-Уэлча, т.к. длина вариационного ряда не превышала 3 значений. Наблюдаемые различия считали статистически значимы при уровне значимости P<0,05.
Результаты
На первом этапе изучения возможных радиопротекторных свойств деанола ацеглумата необходимо было найти оптимальную нетоксичную концентрацию препарата, оказывающую наибольший радиозащитный эффект при действии ионизирующего излучения на нормальные клетки человека. С помощью МТТ-теста нами было показано, что деанола ацеглумат не оказывает токсического действия на фибробласты человека во всех исследуемых концентрациях (1000, 100, 50, 25, 12,5, 6,25, 3,12 и 1,56 мкМ). Полученные результаты хорошо согласуются с данными других авторов, которые также пришли к выводу, что деанола ацеглумат нетоксичен для организма человека [13, 14]. Далее, был проведён тест (по показателю выживаемости клеток) на определение рабочей концентрации, при которой возможный радиопротекторный эффект будет наиболее выражен при облучении клеток γ-квантами. Результаты представлены на рис. 1. На рисунке видно, что при инкубировании клеток с деанола ацеглуматом в концентрации 1000 мкМ наблюдается наиболее выраженный радиопротекторный эффект при облучении γ-квантами. Таким образом, для дальнейших исследований наиболее подходящей концентрацией является концентрация препарата 1000 мкМ.
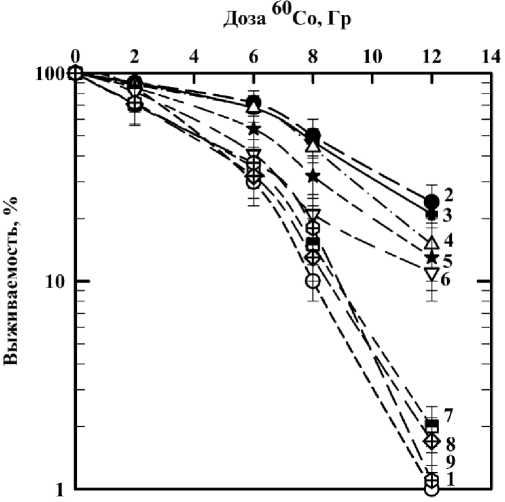
Рис. 1. Влияние деанола ацеглумата при различной концентрации на выживаемость фибробластов человека, облучённых γ-квантами:
кривая 1 ‒ действие γ -излучения; кривая 2 – γ -облучение фибробластов человека, инкубированных с препаратом в концентрации 1000 мкМ; кривая 3 ‒ γ -облучение фибробластов, инкубированных с препаратом в концентрации 100 мкМ; кривая 4 – действие излучения на клетки, инкубированные с препаратом в концентрации 50 мкМ; кривая 5 ‒ действие γ -квантов на клетки, инкубированные с препаратом в концентрации 25 мкМ; кривая 6 ‒ действие излучения на фибробласты, инкубированные с препаратом в концентрации 12,5 мкМ; кривая 7 – в концентрации препарата 6,25 мкМ.
Кривые 8 и 9 ‒ действие γ -излучения на клетки, инкубированные с препаратом в концентрациях 3,12 и 1,56 мкМ соответственно.
На следующем этапе исследования основной задачей было определение оптимального времени предлучевого воздействия деанола ацеглумата в концентрации 1000 мкМ для наибольшего проявления радиопротекторного эффекта при действии ионизирующего излучения. Клетки инкубировали с препаратом 30 мин, 3 и 24 ч до облучения и затем облучали. На рис. 2 представлен результат исследования действия ионизирующего излучения (60Co) на фибробласты человека без препарата и в присутствии препарата с различным временем предлучевого инкубирования.
На рис. 2 видно, что деанола ацеглумат в исследуемой концентрации при добавлении его за 30 мин до воздействия γ - излучения в дозах 2, 6, 8 и 12 Гр проявляет наименьший радиозащит-ный эффект в отношении фибробластов человека при действии γ-излучения. Фактор изменения дозы (ФИД), определяемый отношением изоэффективных доз D o , составил 1,82±0,28. Наибольшее радиопротекторное действие было отмечено для исследуемого соединения, инкубированного с клетками в течение 24 ч до облучения, ФИД при этом составил 2,12±0,21. При добавлении соединения за 3 ч до облучения показатели выживаемости были схожи с данными, полученными в результате добавления препарата за 30 мин до облучения, ФИД=1,83±0,34.
Так же оптимальное время предлучевого инкубирования клеток в водном растворе деанола ацеглумата определяли по показателю времени удвоения. В суспензию клеток вносили препарат в концентрации 1000 мкМ, время воздействия деанола ацеглумата на клетки перед облучением γ-квантами составляло 30 мин, 3 и 24 ч. На рис. 3 представлены результаты изменения времени удвоения фибробластов человека.
Доза ^®Со, Гр
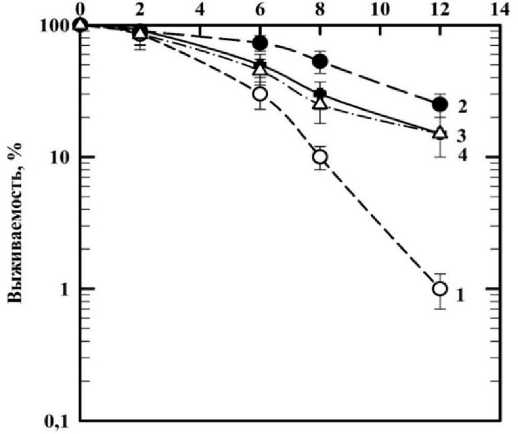
Рис. 2. Влияние деанола ацеглумата на выживаемость фибробластов человека, облучённых γ-квантами при различном времени предлучевой инкубации клеток с препаратом: кривая 1 ‒ облучение γ -квантами; кривая 2 ‒ действие излучения на клетки в присутствии деанола ацеглумата со временем предлучевого инкубирования 24 ч; кривая 3 ‒ время предлучевого инкубирования 3 ч; кривая 4 ‒ премя предлучевого инкубирования 30 мин.
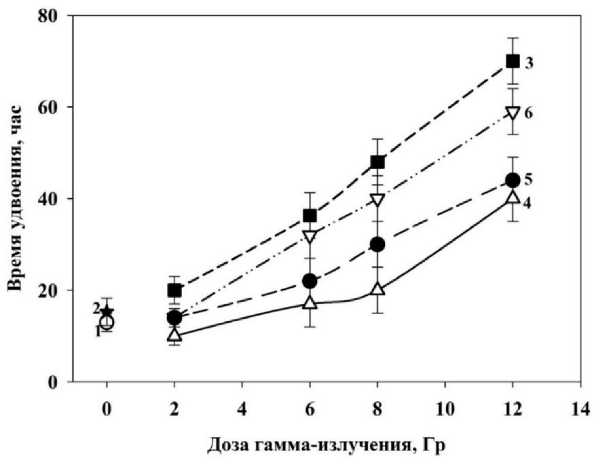
Рис. 3. Влияние деанола ацеглумата на время удвоения фибробластов человека, облучённых γ-квантами при различном времени предлучевой инкубации клеток с препаратом: точки 1 и 2 ‒ время удвоения интактных клеток и клеток, инкубированных с препаратом 24 ч без облучения; кривая 3 ‒ действие γ -излучения; кривая 4 – действие γ -излучения на фибробласты человека, инкубированные с препаратом в течение 24 ч; кривая 5 ‒ время предлучевого инкубирования 3 ч; кривая 6 – время предлучевого инкубирования 30 мин.
На рис. 3 видно, что при инкубации клеток только с препаратом без облучения время удвоения практически не увеличивалось. Напротив, при действии γ - излучения в присутствии деанола ацеглумата время удвоения было меньше, чем время удвоения клеток при действии только ионизирующего излучения. Следовательно, наибольшее радиозащитное действие проявляется при инкубировании фибробластов человека с деанола ацеглуматом в течение 24 ч до облучения (препарат снижал время удвоения клеток в 1,75 раза по сравнению с одним облучением в дозе 12 Гр). При действии гамма-излучения в дозе 12 Гр инкубирование клеток с препаратом в течение 30 мин и 3 ч снижало время удвоения клеток в 1,1 и 1,5 раза соответственно.
Таким образом, оптимальное время предлучевого воздействия деанола ацеглумата составило 24 ч (ФИД=2,12±0,21) для наибольшего проявления радиозащитного эффекта. Проявление радиопротекторного действия деанола ацеглумата хорошо объясняется его антиоксидантными свойствами, которые значительно снижают косвенное действие гамма-излучения, связанное с активацией ионизирующим излучением свободнорадикального окисления, приводящего впоследствии к оксидативному стрессу.
Представляло интерес изучить защитное действие деанола ацеглумата с другими видами ионизирующего излучения. Так как радиотерапия пучком ионов 12С является наиболее перспективным методом лечения вследствие того, что, являясь плотноионизирующим излучением, оно имеет большее поражающее действие на опухолевые клетки, чем редкоионизирующее излучение (гамма-излучение), при этом оказывая меньшее негативное влияние на здоровые ткани организма за счёт возможности облучения опухоли в пике Брэгга. Биологическая эффективность ионов углерода выше, чем у гамма-квантов, и данный вид терапии находит применение при лечении определённых видов рака: радиорезистентные опухоли головы и шеи, меланома, глиома, саркома мягких тканей, опухоли слюнных желез, а также гастроэнтерологического тракта, рак поджелудочной железы и т.д. Мы предположили, что деанола ацеглумат может оказывать защитное действие от вторичных продуктов ионно-углеродной терапии.
Была оценена степень радиозащитного действия деанола ацеглумата в концентрации 1000 мкМ при действии ионизирующего излучения (12С) на клетки человека, результаты представлены на рис. 4. На рисунке видно, что при облучении клеток ионами 12С деанола ацеглумат не оказывает значимого защитного действия от вторичных продуктов деления тяжёлых заряженных частиц, ФИД при этом составил 1,0±0,1.
Далее на рис. 5 представлены данные оценки радиозащитного действия по показателю времени удвоения фибробластов человека, инкубированных с деанола ацеглуматом в исследуемой концентрации при действии ионизирующего излучения (12С). На графике видно, что исследуемый препарат также не оказывает значимого радиопротекторного действия в отношении нормальных клеток человека при облучении ионами 12С за пиком Брэгга. Препарат незначительно снижает время удвоения клеток в 1,1 раза при облучении дозой 12 Гр.
Полученные результаты можно объяснить тем, что основными источниками, вносящими вклад в дозу от вторичных частиц, являются протоны, 11С, альфа-частицы и 11В [4]. Эти вторичные продукты также, как и ионы 12С, имеют высокую относительную биологическую эффективность.
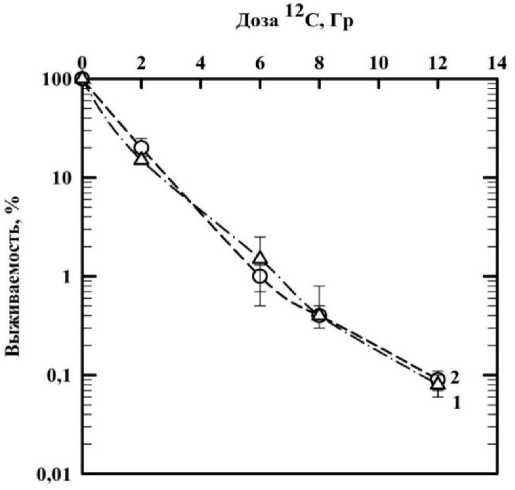
Рис. 4. Влияние деанола ацеглумата на выживаемость клеток фибробластов человека, облучённых ионами 12С:
кривая 1 ‒ действие ионизирующего излучения (12С) без препарата; кривая 2 ‒ действие 12С на клетки человека в присутствии препарата, инкубированного с клетками 24 ч.
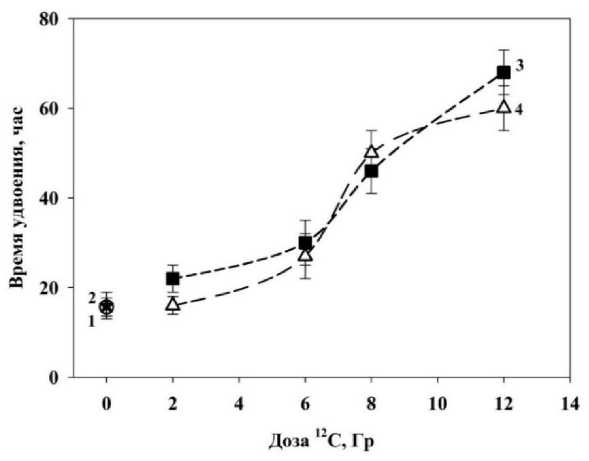
Рис. 5. Влияние деанола ацеглумата на время удвоения фибробластов человека, облучённых ионами 12С:
точки 1 и 2 ‒ время удвоения клеток в контроле и клеток, инкубированных с препаратом 24 ч; кривая 3 ‒ время удвоения клеток, облучённых только ионами 12С; кривая 4 – действие ионов 12С на фибробласты, инкубированные с препаратом в течение 24 ч.
При сравнении радиопротекторного потенциала деанола ацеглумата при действии ионизирующего излучения разного качества – гамма-излучение и ионы 12C, видно, что применение исследуемого соединения оказывает радиозащитное действие на фибробласты человека при облучении их гамма-квантами в дозах 2, 6, 8, 12 Гр, как отмечалось выше (рис. 2 и 3). Деанола ацеглумат при облучении нормальных клеток ионами 12С в дозах 2, 6, 8, 12 Гр не проявляет ра-диопротекторных свойств (рис. 4 и 5). Это может быть связано с тем, что сравниваемые излучения отличаются друг от друга по качеству: гамма-излучение относится к редкоионизирующему излучению, повреждающее действие которого основано на косвенном взаимодействии излучения с веществом, а облучение ионами 12С является плотноионизирующим излучением, механизмом которого является прямое действие, вызывающее большое количество двунитевых разрывов ДНК, которые сложно устраняются системой репарации клетки. Вследствие того, что деанола ацеглумат обладает антиоксидантными свойствами, его защитный механизм направлен на устранение АФК и свободных радикалов, поэтому препарат может быть эффективен в радиозащите от действия редкоионизирующего излучения (γ-кванты).
Заключение
Данная работа была нацелена на изучение возможных радиопротекторных свойств деанола ацеглумата при действии излучения ионов 12С и гамма-излучения на нормальные клетки человека, а также на подбор оптимального времени предлучевого инкубирования клеток в водном растворе деанола ацеглумата для наибольшего проявления радиопротекторного эффекта. Показано, что оптимальное время предлучевого инкубирования клеток с препаратом составляет 24 ч для проявления наибольшего радиозащитного эффекта. Водный раствор деанола ацеглу-мата в концентрации 1000 мкМ является нетоксичным для клеток человека. Исследуемое соединение оказывает радиопротекторный эффект при действии гамма-излучения на нормальные клетки человека и не защищает клетки при облучении ионами 12С.
Возможной причиной возникновения радиопротекторного эффекта деанола ацеглумата является его известная антиоксидантная активность [8]. В частности, антиоксидантное действие направлено на снижение косвенного действия ионизирующего излучения ‒ на снижение активности свободных радикалов. Это хорошо коррелирует с полученными результатами, так как ингибирующее действие гамма-квантов обусловлено возникновением АФК и свободных радикалов. Напротив, облучение ионами 12С характеризуется прямым действием, вызывающим нерепари-руемые повреждения нитей ДНК.
Представляет интерес дальнейшее изучение деанола ацеглумата с целью более глубокого познания его радиопротекторных свойств. Такие исследования обусловлены необходимостью поиска перспективных препаратов, которые будут использоваться в качестве модификаторов действия ионизирующего излучения на живые организмы. Радиопротекторы особенно актуальны в онкологии для снижения лучевой нагрузки для здоровых клеток человека при проведении радиотерапии, а также в космической медицине и военном деле в качестве противорадиационных препаратов.
Список литературы Исследование возможных радиопротекторных свойств деанола ацеглумата при действии ионизирующего излучения на клетки человека
- Ruba T., Tamilselvi R. Radiosensitizers and radioprotectors for effective radiation therapy - a review //Asian J. Appl. Sci. Technol. 2018. V. 2, N 1. P. 77-86.
- Hwang E. J., Gorayski P., Le H., Hanna G.G., Kenny L., Penniment M., Buck J., Thwaites D., Ahem V. Particle therapy tumour outcomes: an updated systematic review //J. Med. Imaging Radiat. Oncol. 2020. V. 64, N 5. P. 711-724.
- Arico G., Gehrke T., Gallas R., Mairani A., Jakel O., Martisikova M. Investigation of single carbon ion fragmentation in water and PMMA for hadron therapy //Phys. Med. Biol. 2019. V. 64, N 5. P. 055018. DOI: 10.1088/1361-6560/aafa46.
- Johnson D., Chen Y., Ahmad S. Dose and linear energy transfer distributions of primary and secondary particles in carbon ion radiation therapy: a Monte Carlo simulation study in water //J. Med. Phys. 2015. V. 40, N 4. P. 214-219.
- Васин М.В., Ушаков И.Б. Радиопротекторы как средства защиты здоровых тканей при радиохимиотерапии //Радиобиологические основы лучевой терапии: сб. докладов 3-й Российской конференции с международным участием, 17-18 октября 2019 г. Дубна: ОИЯИ, 2019. С. 25-28.
- Sancar A. DNA excision repair //Annu. Rev. Biochem. 1996. V. 65. P. 43-81.
- Микуляк Н.И., Микуляк А.И., Дементьева Р.Е., Ионичева Л.В. Защитные свойства нооклерина при цитостатических повреждениях //Образовательный вестник «Сознание». 2012. № 9. С. 247-248.
- Бабукова Ю.М., Кустикова И.Н., Моисеева И.Я., Водопьянова О.А. Сравнительное исследование влияния соединений с антиоксидантным типом действия деанола ацеглумата и мексидола на некоторые показатели перекисного окисления липидов и антиоксидантной защиты в плазме крови кроликов при экспериментальном радиационном воздействии //Современные проблемы отечественной медико-биологической и фармацевтической промышленности. Развитие инновационного и кадрового потенциала Пензенской области: сб. докладов I Международной научно-практической конференции, 29-30 ноября 2011 г. Пенза: Пензенский гос. университет, 2011. С. 101-103.
- Прилепский А.Ю., Дроздов А.С., Богатырев В.А., Староверов С.А. Методы работы с клеточными культурами и определение токсичности наноматериалов: учебно-методическое пособие. СПб.: Университет ИТМО, 2019. 43 с.
- Guda K., Natale L., Markowitz S.D. An improved method for staining cell colonies in clonogenic assays //Cytotechnology. 2007. V. 54, N 2. P. 85-88.
- Методика определения цитотоксичности веществ МТТ-тестом на культуре нормальных клеток человека НЕК293. СТП-14.621.21.0008.12-2015. Черноголовка: ИФАВ РАН, 2015. 13 с.
- Фрешни Р.Я. Культура животных клеток: практическое руководство /Пер. с 5-го английского издания Ю.Н. Хомякова, Т.И. Хомяковой. М.: Бином. Лаборатория знаний, 2010. 691 с.
- Grossman R. The role of dimethylaminoethanol in cosmetic dermatology //Am. J. Clin. Dermatol. 2005. V. 6, N 1. P. 39-47.
- Сернов Л.Н., Зорькина А.В., Скачилова С.Я., Ермакова Г.А. Деанола ацеглумат, проявляющий анти-ульцерогенную, гастропротекторную и энтеропротекторную активности, комбинация, обладающая анти-ульцерогенной, гастропротекторной и энтеропротекторной активностями (варианты), фармацевтическая композиция. Патент № 2010103415/15 РФ. Заявл. 03.02.2010, опубл. 10.12.2011, Бюл. № 34. 17 с.


