Исследование закономерностей биоаккумуляции меди представителями автотрофных и гетеротрофных организмов
Автор: Фокина Анна Ивановна, Олькова Анна Сергеевна, Лялина Екатерина Игоревна, Даровских Лариса Вячеславовна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 6 (151), 2015 года.
Бесплатный доступ
Предложена методика инверсионного вольтамперометрического определения содержания меди в цианобактериях и дафниях. С ее помощью установлено, что чем продолжительнее экспозиция культуры цианобактерий с раствором сульфата меди (II), тем больше меди концентрируется на поверхности клеток. Практически полное извлечение ионов меди Сu 2+ из раствора за 14 суток говорит о том, что культура может быть пригодна для разработки биосорбента. С увеличением доли глутатиона в растворе увеличивается накопление ионов меди Сu 2+ цианобактериями, а дафниями уменьшается, что отражается на результатах биотестирования, проводимого с использованием данных организмов. Острой токсичностью по отношению к дафниям обладают растворы с минимальным, а для цианобактерий - растворы с максимальным содержанием глутатиона.
Биоаккумуляция, медь, цианобактерии, дафнии, тест-организмы
Короткий адрес: https://sciup.org/14750952
IDR: 14750952 | УДК: 579.0+579.695+57.044
Текст научной статьи Исследование закономерностей биоаккумуляции меди представителями автотрофных и гетеротрофных организмов
Аккумулировать металлы способны практически все живые организмы. В ряде случаев металлы могут накапливаться организмами в значительных количествах [1], [4], [6], [13], [22]. Научно-практическая значимость исследования аккумуляции металлов организмами отмечена многими авторами [2], [3], [5], [11], [17], [18], [19], [21], [25], [26], [27], [28]. Научные данные о накоплении тяжелых металлов (ТМ) различными организмами и их адаптации к такой нагрузке служат фундаментальной основой, необходимой для интерпретации результатов биотестирования. Исследование механизмов и закономерностей биоаккумуляции металлов позволяет оценивать качество окружающей среды, находить чувствительных организмов-биоиндикаторов, разрабатывать биологические способы очистки сред от ТМ.
Целью работы было исследование биоаккумуляции меди автотрофными (Nosto c linckia) и гетеротрофными (Daphnia magna) организмами и применение полученных результатов в ин- терпретации данных биотестирования и поиске нового биосорбента.
МАТЕРИАЛЫ И МЕТОДЫ
Исследуемыми организмами были культуры Nostoc linckia (Roth.) Born. et Flah № 271 из коллекции кафедры биологии растений, селекции и семеноводства, микробиологии Вятской государственной сельскохозяйственной академии (г. Киров) и Daphnia magna Straus, культивируемые в аккредитованной экоаналитической лаборатории Вятского государственного гуманитарного университета (г. Киров). В экспериментах с N. linckia использовали суспензию цианобактерий с титром 1,16 ∙ 108кл/см3. Опыты с D. magna проводили по общепринятой методике: посадка 10 особей рачков (возраст не более 24 ч.) в 100 см3 тестируемой среды.
Выявление возможности использования микроорганизмов в качестве биосорбента Cu2+. Исследовали зависимость между накоплением меди культурой ЦБ и продолжительностью контакта организмов с раствором соли металла. Суспен-
зию культуры вносили в раствор CuSO 4 с концентрацией ионов меди Cu2+ 2 и 20 мг/дм3. Через 1 и 14 суток выделяли ионы меди Cu2+, сорбированные на поверхности клеток (десорбция раствором ЭДТА с поверхности клеток), поглощенные внутрь клетки и удерживаемые лиофильными компонентами (экстракция этанолом) и лиофобными веществами (экстракция четыреххлористым углеродом (ЧХУ)).
Исследование влияния восстановленного глутатиона на токсичность раствора CuSO 4 и накопление меди ЦБ и дафниями. Брали три типа растворов сульфата меди (с содержанием меди 1 мг/дм3) в смеси с глутатионом (GSH) в мольных соотношениях Cu:GSH, равных 1:0, 1:1 и 1:4. Токсичность растворов по отношению к ЦБ исследовали биолюминесцентным и тетразо-льно-топографическим методами [7], [8]. При биотестировании с использованием дафний руководствовались методикой, основанной на определении смертности и изменении плодовитости рачков [20].
Содержание меди в организмах после их экспозиции в различных средах определяли методом инверсионного вольтамперометрического анализа (ИВА) с помощью адаптированной нами методики определения меди на приборе марки «Эко-тест-ВА» с дисковым вращающимся электродом.
Для определения металла в биомассе организмов последние отделяли от тестируемой среды: цианобактерий – центрифугированием, дафний – отлавливанием на специальный сачок.
РЕЗУЛЬТАТЫ
Адаптация метода ИВА для определения меди в цианобактериях и дафниях. Вследствие маленькой биомассы тест-организмов и небольшого в соответствии с этим содержания накопленного металла, метод определения меди должен обладать высокой чувствительностью. Таким методом является ИВА, но аттестованной методики определения меди в изучаемых нами организмах нет. За основу взята методика определения металла в природных водах [15]. Разделение соединений меди, в состав которых входит накапливаемый организмом металл, на фракции проводили по методике, предложенной С. Г. Васильевой [3]. В дафниях определяли общее содержание ме- талла, не разделяя на фракции. Этап пробопод-готовки фракций ЦБ и биомассы дафний (минерализация до влажных солей), предложенный разработчиком методики, усовершенствовали добавлением концентрированного раствора H2O2, что позволило ускорить данный этап работы.
Применимость методики определения меди в цианобактериях и дафниях проверили методом «введено-найдено» (табл. 1 и 2). Добавку вносили в пробу перед минерализацией [14].
Таблица 1
Проверка правильности количественного определения меди во фракциях цианобактерий Nostoc linckia 271
|
Фракция |
Введено, мкг/дм3 |
Найдено, мкг/дм3 |
|
Экстракт ЭДТА |
60,0 |
70,0 ± 21,0 |
|
Лиофильная фракция |
10,0 |
9,3 ± 2,8 |
|
Лиофобная фракция |
4 |
3,6 ± 1,1 |
Примечание. Количество введенной добавки брали, исходя из количества меди, определенного в каждой фракции ЦБ.
Таблица 2
Проверка правильности количественного определения меди в биомассе рачков
D. magna
|
Введено Cu2+, мкг/дм3 |
Найдено Cu2+, мкг/дм3 |
|
10 |
9,4 ± 2,9 |
Примечание. Количество введенной добавки брали, исходя из количества меди, определенного в дафниях.
Полученные данные свидетельствуют о возможности применения методики для определения меди в исследуемых объектах.
Выявление возможности использования ЦБ в качестве биосорбента ионов меди Cu2+. Результаты определения содержания меди (II) в различных фракциях ЦБ после экспозиции организмов с медьсодержащими растворами представлены в табл. 3.
Ионы меди Cu2+ обнаружены в лиофильной фракции уже через сутки, причем в большем количестве там, где концентрация металла в растворе была выше. Это может быть связано как с поступлением металла в клетку по градиенту концентраций, так и с нарушением токсикологических барьеров вследствие токсического эффекта меди. Концентрация Сu2+ в лиофобной
Таблица 3
Содержание меди во фракциях ЦБ после экспозиции культуры с растворами сульфата меди в течение 1 и 14 суток (Х∙10-3, мг/г ЦБ) и суммарная степень извлечения металла из раствора (%)
|
Концентрация ионов меди, мг/дм3 |
Через 1 сутки |
Через 14 суток |
||||||
|
Спирт |
ЧХУ |
ЭДТА |
Степень извлечения |
Спирт |
ЧХУ |
ЭДТА |
Степень извлечения |
|
|
2 |
2,56 ± 0,13 |
1,05 ± 0,05 |
4,18 ± 0,21 |
1,52 ± 0,07 |
<< |
1,47 ± 0,03 |
7,84 ± 0,39 |
1,82 ± 0,08 |
|
20 |
17,23 ± 0,86 |
2,51 ± 0,13 |
94,0 ± 4,7 |
21,87 ± 1,09 |
0,94 ± 0,08 |
2,83 ± 0,14 |
520,0 ± 5,1 |
100 ± 5 |
Примечание. «<<» – меньше предела обнаружения.
фракции в течение 14 суток практически не изменяется. К концу опыта резко уменьшается содержание металла в лиофильной фракции, а возрастает в той ее части, которая выделяется с поверхности клеток раствором ЭДТА. Это может указывать на выведение ионов из внутриклеточного пространства и накопление их на поверхности клеток. Это один из признаков адаптации культуры к негативному воздействию ионов меди: идет активный транспорт токсиканта из клетки.
Значения степеней извлечения меди из раствора в варианте с концентрацией ионов меди Cu2+ 20 мг/дм3 возрастают от 21 % в течение суток и до 100 % в течение двух недель. Такие результаты говорят о высоком сорбционном потенциале культуры Nostoc linckia 271 , что, несомненно, указывает на возможность ее применения в качестве биосорбента. При создании технологической схемы очистки среды от Сu2+ или изготовления активной добавки следует учесть динамику содержания меди в различных фракциях клеток, так как Сu2+ удерживаются компонентами различных фракций с разной силой. Например, при определенных условиях перемешивания, уровне рН, нагревании может произойти десорбция.
Влияние восстановленного глутатиона на накопление Cu организмами . На процесс биоаккумуляции металлов влияют многие факторы. В первую очередь, имеет значение биологический вид организмов. Не менее важны концентрация металла в среде обитания, а также его химическая форма. Большинство металлов являются активными комплексообразователями и в окружающей среде могут присутствовать в комплексах с органическими компонентами. Эффективностью и емкостью связывания металлов организмами можно варьировать путем проведения реакций комплексообразования, в результате которых образующиеся соединения обладают новыми свойствами, способствующими поглощению металлов. Отмечено влияние комплексообразования на накопление металлов живыми организмами [9], [10], [23], [27]. Медь обладает высокой комплексообразующей способностью, поэтому токсический эффект зависит от наличия и концентрации потенциальных лигандов. В роли такого лиганда может выступать глутатион.
Глутатион (GSH) – это уникальный пептид, содержащийся в клетках не только всех эукариотических организмов, но и многих прокариотов. Это соединение является признанным биогенным протектором внутриклеточного действия [16]. В рамках исследования нами была поставлена практическая задача – оценить экзогенное влияние глутатиона как активного биолиганда на биоаккумуляцию меди. Моделировали воздействие ионов меди в присутствии восстановленного глутатиона (GSH) на автотрофную культуру N. linckia и гетеротрофных D. magna .
При исследовании трех типов тестируемых сред, содержащих сульфат меди в смеси с глутатионом (GSH) в мольных соотношениях Cu:GSH, равных 1:0, 1:1 и 1:4 (содержание меди во всех вариантах 1 мг/дм3), выявлено, что глутатион увеличивает накопление меди в культуре ЦБ: чем выше доля глутатиона, тем больше меди обнаружено в клетках (рис. 1). В опыте с дафниями наблюдается тенденция к уменьшению содержания меди в организмах с увеличением доли глутатиона в тестируемом растворе (рис. 2).
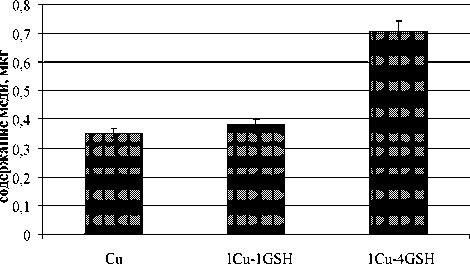
вариант
Рис. 1. Содержание меди в клетках Nostoc linckia 271 . Варианты обозначены согласно соотношению Cu:GSH
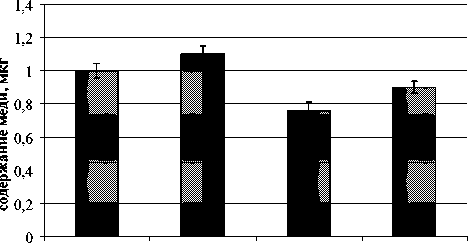
Си ICu-lGSH lCu-2GSH lCu-4GSH вариант
Рис. 2. Содержание меди в Daphnia magna . Варианты обозначены согласно соотношению Сu: GSN
Такие результаты объясняются тем, что клеточная мембрана ЦБ представляет собой бислой фосфолипидных молекул, ориентированных гидрофобными концами молекул внутрь бислоя, а гидрофильными наружу. Глутатион облегчает поступление в клетку меди за счет связывания ее ионов в прочный комплекс, который обладает липофильными свойствами и поэтому может быстро пересечь клеточную мембрану, в то время как сами ионы меди Cu2+ таким свойством не обладают.
Составляющей хитинового покрова D. magna является полисахарид хитозан, который содержит большое количество свободных аминогрупп, что позволяет ему связывать и прочно удерживать Cu2+. Глутатион не только снижает активную концентрацию меди в растворе, но и уменьшает ее количество на поверхности организмов, тем самым снижая накопление.
Установлено, что растворы с соотношением Cu:GSH 1:0 и 1:1 обладают острой токсичностью по отношению к дафниям, организмы погибли в течение первых суток экспозиции. Вариант 1:4 по показателям плодовитости и смертности приближается к контролю. В случае с ЦБ наблюдается сильная негативная взаимосвязь (коэффициент корреляции Пирсона составляет -0,8) между степенью накопления меди внутри клеток и жизнеспособностью культуры. Увеличение доли GSH в растворе приводит к увеличению накопления меди внутри клеток, уменьшению жизнеспособности, соответственно, результаты биотестирования с использованием ЦБ указывают на то, что растворы с большей добавкой глутатиона обладают большей токсичностью [12].
Таким образом, глутатион по отношению к дафниям обладает протекторным действием, а для ЦБ усиливает токсичность за счет усиления биодоступности меди. Явление усиления биодоступности может быть использовано для разработки цианобактериальных препаратов, насыщенных таким микроэлементом, как медь. Знания о биопротекторных свойствах позволят разрабатывать системы защиты от медных загрязнений.
ВЫВОДЫ
-
1. Адаптирована методика определения содержания меди в природных водах методом инверсионной вольтамперометрии для определения указанного металла в биомассе цианобактерий и дафний.
-
2. Установлен высокий биоаккумуляцион-ный потенциал цианобактерий Nostoc linckia по отношению к меди. Чем продолжительнее экспозиция культуры ЦБ с раствором сульфата меди, тем больше меди концентрируется на поверхности клеток. За 14 суток из раствора с концентрацией Cu2+ 20 мг/дм3 цианобактериальной суспензией было извлечено почти 100 % ионов металла. Это указывает на перспективность ЦБ Nostoc linckia как основы для создания биосорбента.
-
3. На примере модельных водных сред, содержащих сульфат меди (II), с разной добавкой глутатиона показано, что с увеличением доли биолиганда относительно концентрации металла накопление ионов меди цианобактериями увеличивается, а дафниями – уменьшается. Модельные водные среды с минимальным содержанием глутатиона обладали острой токсичностью по отношению к дафниям, а для цианобактерий, напротив, – токсичнее оказались растворы с максимальной долей глутатиона.
* Работа выполнена при финансовой поддержке гранта Президента РФ МК-3964.2015.5.
Список литературы Исследование закономерностей биоаккумуляции меди представителями автотрофных и гетеротрофных организмов
- Богачева А. С. Чувствительность цианобактерий к токсическому действию солей тяжелых металлов: Автореф. дисс.. канд. биол. наук. СПб., 2011. 24 с.
- Ваганов А. С. Накопление тяжелых металлов тканями и органами промысловых видов рыб различных экологических групп Куйбышевского водохранилища: Дисс.. канд. биол. наук. Ульяновск, 2012. 120 с.
- Васильева С. Г. Накопление V, Li и Co клетками цианобактерии рода Spirulina: Автореф. дисс.. канд. биол. наук. М., 2012. 21 с.
- Василевская Н. В., Лукина Ю. М. Влияние техногенного загрязнения на динамику роста и мезоструктуру листьев Betula czerepanovii Orlova//Ученые записки Петрозаводского государственного университета. Сер. «Естественные и технические науки». 2011. № 8 (121). С. 14-18.
- Голтвянский А. В. Биоаккумуляция ионов металлов клетками Dunaliella viridis Teod. (Chlorophyta)//Альгология. 1999. Т. 9. № 2. С. 33.
- Голтвянский А. В. Биоаккумуляция ионов металлов клетками зеленых водорослей и получение биомассы, обогащенной микроэлементами: Дисс.. канд. биол. наук. Харьков, 2002. 125 с.
- Домрачева Л. И., Кондакова Л. В., Огородникова С. Ю., Олькова А. С., Фокина А. И. Применение тетразольно-топографического метода определения дегидрогеназной активности цианобактерий в загрязненных средах//Биологический мониторинг природно-техногенных систем. Сыктывкар, 2011. С. 113-120.
- Домрачева Л. И., Фокина А. И., Огородникова С. Ю., Зыкова Ю. Н., Кондакова Л. В. Адаптационные реакции микроорганизмов на стрессовые воздействия//Особенности урбоэкосистем подзоны южной тайги Европейского Северо-Востока. Киров, 2009. С. 180-232.
- Душенков В., Раскин И. Фиторемедиация: зеленая революция: Доклад/Ратгерский университет. Нью-Джерси, 1999. С. 48-49.
- Ильин В. Б. Тяжелые металлы в системе почва -растение. Новосибирск: Наука. Сиб. отд-ние, 1991. 151 с.
- Карамушка В. И., Грузина Т. Г, Ульберг З. Р. Особенности биосорбции тяжелых металлов из смешанных растворов клетками Spirulinaplatensis//Коллоидный журнал. 1998. Т. 60. № 3. С. 327-330.
- Лялина Е.И., Фокина А.И., Олькова А. С., Сивкова С. А., Катаргина В.С., Черезов а К.О., Зворыгина В. С., Кузнецова Е. О. Отклик тест-организмов различной систематической принадлежности на действие ионов меди (II) в присутствии глутатиона//Материалы XII Всероссийской научно-практической конференции с международным участием. Книга 2. Киров, 2014. С. 210-215.
- Немова Н. Н., Богдан В. В., Шкляревич Г. А. Амфиподы как индикаторы характера воздействия антропогенных факторов на прибрежные акватории Белого моря//Ученые записки Петрозаводского государственного университета. Сер. «Естественные и технические науки». 2012. № 4 (125). С. 7-12.
- РМГ 76-2004 ГСИ. Внутренний контроль качества результатов количественного химического анализа. М.: Стандарт-информ, 2006. 81 с.
- Сборник методик измерений массовой концентрации ионов меди, свинца, кадмия, цинка, висмута, марганца, никеля и кобальта методом вольтамперометрии на вольтамперометрическом анализаторе «Экотест-ВА». М.: ООО «Эконикс-Эксперт», 2004. 61 с.
- Смирнов Л. П., Суховская И. В. Роль глутатиона в функционировании систем антиоксидантной защиты и биотрансформации (обзор)//Ученые записки Петрозаводского государственного университета. Сер. «Естественные и технические науки». 2014. № 6 (143). С. 34-40.
- Фокина А. И. Влияние свинца на структуру фототрофных микробных комплексов почвы: Автореф. дисс.. канд. биол. наук. Сыктывкар, 2008. 23 с.
- Фокина А. И., Злобин С. С., Березин Г. И., Зыкова Ю. Н., Огородникова С. Ю., Домрачева Л. И., Ковина А. Л., Горностаева Е. А. Состояние цианобактерий Nostocpaludosum в условиях загрязнения среды никелем и нефтепродуктами и перспективы ее использования в качестве биосорбента//Теоретическая и прикладная экология. 2008. Т. 1. С. 4-10.
- Фокина А. И., Домрачева Л. И., Зыкова Ю. Н., Березин Г. И., Злобин С. С. Микроорганизмы как биосорбенты поллютантов//Особенности урбоэкосистем подзоны южной тайги Европейского Северо-Востока/Под ред. Т. Я. Ашихминой, Л. И. Домрачевой. Киров: Изд-во ВятГГУ, 2012. С. 232-253.
- ФР 1.39.2007.03222. Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод, отходов по смертности и изменению плодовитости дафний. М.: Акварос, 2007. 48 с.
- Чубуков В. Ф. Микробы запасают металлы//Химия и Жизнь. 1982. № 11. С. 53-55.
- Шашурина Е. А., Доронкин Ю. В., Лупова Е. И. Экологический мониторинг территорий и миграция цезия-137 в цепи почва -продукты пчеловодства//Ученые записки Петрозаводского государственного университета. Сер. «Естественные и технические науки». 2011. № 2 (115). С. 21-23.
- Aristilde L., Xu Y., Morel F. Weak Organic Ligands Enhance Zinc Uptake in Marine Phytoplankton//Environ. Sci. Technol. 2012. № 46 (10). P. 5438-5445.
- Gummuluru S., Krishnamurti R., Megharaj M., Naidu R. Bioavailability of Cadmium-Organic Complexes to Soil Alga-An Exception to the Free Ion Model//J. Agric. Food Chem. 2004. № 52 (12). P. 3894-3899.
- Kayser G., Koeckritz T., Markert B. Bioleaching zur Reinigung schwermetallbelasteter Boden mit Thiobacillus spp.//Wasser und Boden. 2001. Vol. 53. № 1-2. P. 54-58.
- Kumar N., Dushenkov V., Motto H., Raskin I. Phytoextraction: The Use of Plants To Remove Heavy Metals from Soils//Environ. Sci. Technol. 1995. № 29 (5). P. 1232-1238.
- Ledin M., Krantz-Rulcker C., Allard B. Microorganisms as metal sorbents. Comparison with other soil constituents in multi-compartment systems//Soil Biol. and Biochem. 1999. Vol. 31. № 12. P. 1639-1648.
- Quintelas C., Tavares T. Lead (II) and Iron (II) removal from aqueous solution: Biosorption by a bacteril biofilm//Resour. and Environ. Biotechnol. 2002. Vol. 3. № 4. P. 193-202.


