Исследование зависимости фармакокинетических и дозиметрических характеристик меченных 188Re фосфоновых кислот от их структуры в организме крыс на основе камерного моделирования
Автор: Матвеев А.В., Петриев В.М., Тищенко В.К.
Рубрика: Научные статьи
Статья в выпуске: 1 т.32, 2023 года.
Бесплатный доступ
Фосфоновые кислоты, меченные радионуклидом 188Re, являются наиболее перспективными радиофармацевтическими лекарственными препаратами (РФЛП) для радионуклидной терапии костных метастазов. Цель работы - разработка камерной математической модели кинетики меченных 188Re фосфоновых кислот в организме интактных крыс и расчёт на её основе фармакокинетических и дозиметрических характеристик данных РФЛП с разной химической структурой. Объектами исследования являлись четыре РФЛП, содержащие от двух до пяти фосфоновых групп. Для идентификации параметров модели и расчёта характеристик были использованы количественные данные о биораспределении меченных 188Re фосфоновых кислот в организме интактных крыс. Разработана камерная модель кинетики и предложены два подхода к идентификации её транспортных констант - через функционал невязки и с помощью аппроксимации моноэкспоненциальными функциями. По данным фармакокинетического моделирования все исследуемые РФЛП селективно накапливаются в костных тканях, причём химическая структура фосфоновых кислот влияет на их накопление и выведение. По уровню накопления активности в скелете структуры РФЛП можно расположить в порядке убывания: пять фосфоновых групп > две > четыре. При этом медленнее всего из костных тканей выводится РФЛП с двумя фосфоновыми группами, что является его преимуществом. Скорости выведения РФЛП из крови и других органов в среднем в 3 раза выше, чем из костных тканей. Выведение радиоактивности из организма происходит в основном через почечный клиренс. Наибольшие значения поглощённых доз формируются в костных тканях (бёдра, рёбра, череп, позвоночник) и органе выведения - почках. При этом максимальные значения поглощённых доз в костных тканях получены для РФЛП с пятью и двумя фосфоновыми группами, что в совокупности с их фармакокинетическими свойствами позволяет рассматривать их как перспективные остеотропные РФЛП для терапии костных метастазов.
Камерное моделирование, фармакокинетика, дозиметрия, фосфоновые кислоты, рений-188, радиофармпрепарат, ядерная медицина, радионуклидная терапия, поглощённые дозы, костные метастазы
Короткий адрес: https://sciup.org/170197394
IDR: 170197394 | УДК: 615.849.2.03:547.241:546.719.02.188]-092.9 | DOI: 10.21870/0131-3878-2023-32-1-168-182
Текст научной статьи Исследование зависимости фармакокинетических и дозиметрических характеристик меченных 188Re фосфоновых кислот от их структуры в организме крыс на основе камерного моделирования
В настоящее время системная радионуклидная терапия является одним из эффективных методов паллиативного лечения костных метастазов [1]. В качестве перспективных радиофармацевтических лекарственных препаратов (РФЛП) для этой цели хорошо зарекомендовали себя фосфоновые кислоты, меченные изотопом 188Re [2]. Преимущества этого радионуклида состоят в том, что он является генераторным и может быть использован для получения РФЛП непосредственно перед инъекцией пациенту [3]. Терапевтический эффект 188Re в костной ткани обусловлен β–-излучением, а наличие в спектре γ-квантов позволяет отслеживать распределение РФЛП в организме с помощью гамма-камеры.
В работе [4] получены экспериментальные данные фармакокинетики меченных 188Re кислот с разным числом фосфоновых групп в организме интактных крыс. Там же изучено влияние
химической структуры этих РФЛП на их фармакокинетические свойства в организме крыс после внутривенного введения. На основе экспериментальных результатов с помощью статистических методов было показано, что химическая структура фосфоновых кислот влияет на накопление меченых соединений в костной ткани.
Камерное моделирование кинетики РФЛП в организме экспериментальных животных позволяет количественно описать течение процесса in vivo , математически рассчитывать скорости перехода РФЛП между органами и тканями (камерами модели), а также зависимые от них фармакокинетические и дозиметрические характеристики. Кроме того, метод камерных моделей и построения экспоненциальных функций камерного накопления-выведения даёт естественную возможность строить индивидуальные модели кинетики РФЛП в критических органах и патологических очагах и тем самым обеспечить более адекватную оценку уровней их внутреннего радиационного облучения, чем применение стандартных методик из рекомендаций Международной комиссии по радиологической защите [5]. Таким образом, цель работы заключалась в разработке камерной математической модели кинетики меченных 188Re фосфоновых кислот и расчёте на её основе фармакокинетических и дозиметрических характеристик данных РФЛП с разной химической структурой в организме интактных крыс.
Материалы и методы
Объектами исследования являлись меченные 188Re четыре препарата, содержащие от двух до пяти фосфоновых групп: 1-гидроксиэтилиден-1,1-дифосфоновая кислота (188Re-ОЭДФ), окса-бис(этиленнитрило)тетра(метиленфосфоновая кислота) (188Re-ОЭНТМФ), N,N,N’,N’-этилен-диаминтетракис(метиленфосфоновая кислота) (188Re-ЭДТМФ) и диэтилентриаминопентакис(ме-тилфосфоновая кислота) (188Re-ПФК). В структуре ОЭДФ содержится две фосфоновые группы, ОЭНТМФ и ЭДТМФ – четыре фосфоновые группы, ПФК – пять фосфоновых групп. Методика получения этих РФЛП описана в работе [4].
Исследования фармакокинетики РФЛП проводили на белых беспородных крысах-самцах весом 180±40 г. Всего было использовано 80 животных, которые были поделены на четыре группы (по 20 крыс в каждой). На животных первой, второй, третьей и четвёртой групп исследовали фармакокинетику 188Re-ОЭДФ, 188Re-ОЭНТМФ, 188Re-ЭДТМФ и 188Re-ПФК соответственно. Введение меченых препаратов осуществлялось внутривенно (в хвостовую вену) по 370 кБк (10 мкКи). Через определённые интервалы времени (5 мин, 1, 3, 24 и 48 ч) по четыре животных в каждый срок забивали под наркозом декапитацией, выделяли пробы органов и тканей, помещали в пластиковые пробирки, взвешивали на электронных весах «Sartorius» (Германия) и проводили радиометрию с помощью автоматического гамма-счётчика «Wizard» версии 2480 фирмы «PerkinElmer/Wallac» (Финляндия). По данным радиометрии на каждый срок наблюдения для каждого РФЛП рассчитывали удельную активность на 1 г ткани в процентах от введённого количества. Статистически обработанные результаты радиометрии приведены в работе [4].
Функции удержания активности РФЛП в камерах обозначены как F 0 , F 1 , F 2 , F 3 , F 4 , F 5 , F 6 , F 7 , F 8 (они же функции накопления-выведения). Транспортные константы (биологические константы скорости перехода РФЛП между камерами) имеют обозначения K ab , где первый индекс a указывает на камеру, из которой выводится РФЛП, и второй индекс b – на камеру, в которой он накапливается. Константы K 1 и K 2 определяют скорости почечного и печёночного клиренса соответственно. Также в модели учтён радиоактивный распад изотопа 188Re, постоянная распада которого λ ≈0,041 ч–1 и период полураспада T 1/2 ≈17,0 ч.
A0
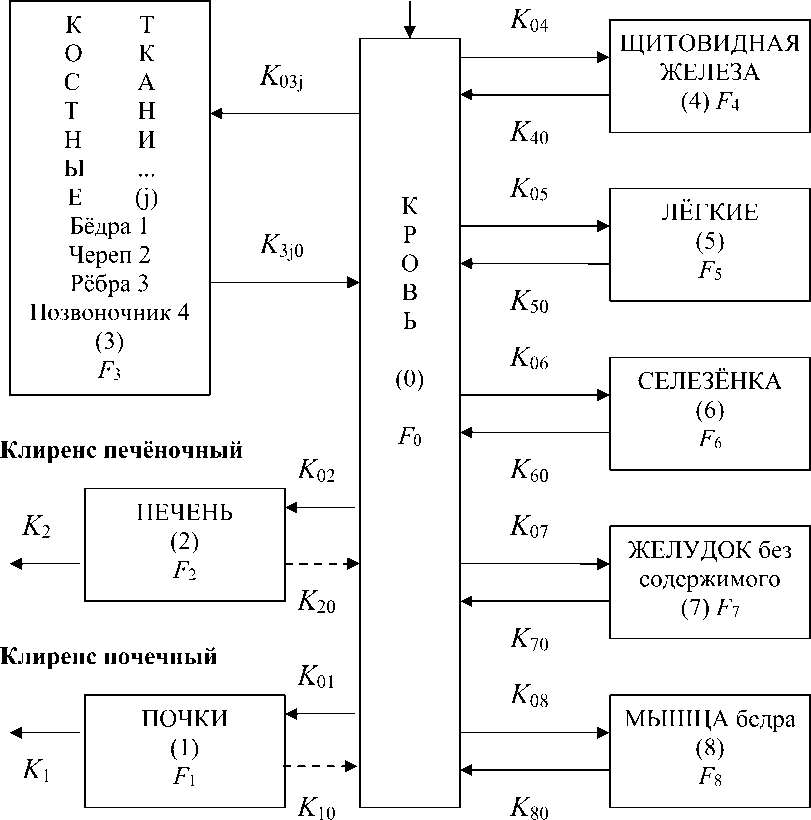
Рис. 1. Иллюстрация камерной модели.
Математическая интерпретация данной камерной модели в рамках химической кинетики первого порядка [6] сводится к следующей системе линейных дифференциальных уравнений с постоянными коэффициентами:
Г™ = TU^F^t) - (Е * =1 к о , +A)F 0 (t), ^ = K o tF o (t) - (Kt + Кю + X)F i (^) - при i = 1,2,
« = K oi F o (t)-(K io +2)F i (t)
<- при i > 3.
Функции накопления-выведения F i удобно выразить в относительных единицах (на единицу введённой активности A о ) и, таким образом, они могут принимать значения от 0 до 1. С учётом внутривенного введения РФЛП начальные условия для системы уравнений (1) запишутся в виде:
F o (0) = 1, F i (0) = 0 при i =1,2, ..., 8. (2)
Система (1) с условиями (2) представляет собой задачу Коши, решение которой может быть найдено аналитически или при помощи численных методов, например, методом Розен-брока или методами Рунге-Кутты [7]. При аналитическом решении получаются очень громоздкие математические выражения, которые приводить здесь не будем.
Методика идентификации параметров модели. Задача идентификации кинетических параметров модели (транспортных констант) решается с помощью функционала невязки фK ab ,K i ,K 2 ) , который задаёт меру отклонения теоретической (модельной, расчётной) характеристики (в нашем случае это функции F i ) от её экспериментальных значений в заданные моменты времени t j . В качестве таких значений использовались результаты радиометрии органов и тканей крыс, приведённые в работе [4]. Тогда функционал невязки принимает вид:
Ф(К) = X i* (, v ; , :/; ■ ■ Uj - F^)}2 , (3)
где К =[ K ab , K i , K 2 ] - вектор кинетических параметров модели; N - количество экспериментальных значений для i - камеры модели ( / =0, 1, ..., 8).
Для определения истинных значений транспортных констант требуется решить вариационную задачу по нахождению минимума функционала (3), т.е.
5Ф(К)| Kab>o, =o , 520>o , (4)
K1>o,K2>o при условии положительных значений всех транспортных констант, которые в данном случае приобретают смысл вариационных параметров. Найденные таким образом значения транспортных констант далее подставляются в решения системы уравнений (1) для построения фармакокинетических кривых «Концентрация-время» (без учёта физического распада РФЛП) или «Активность-время» (с учётом распада РФЛП).
Методика аппроксимации моноэкспоненциальными функциями. Вышеописанная процедура нахождения транспортных констант с использованием выражений (1)-(4) относится к классу так называемых обратных задач, решение которых в общем случае не может быть найдено с абсолютной точностью [8]. Кроме того, при большом количестве вариационных параметров в процессе поиска решений приходится опираться на численные алгоритмы и методы. В результате решение задачи идентификации транспортных констант может быть получено лишь с точностью величины погрешности численной реализации, формируемой на всех этапах поиска.
Из решения системы уравнений (1) следует, что фармакокинетические кривые F i для всех камер выражаются через линейную комбинацию экспоненциальных функций, т.е. являются по-лиэкспоненциальными со многими константами скорости накопления и выведения. Пример такой кривой приведён на рис. 2.
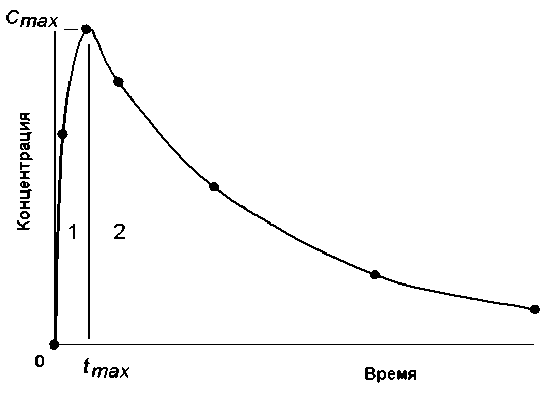
Рис. 2. Пример динамики накопления-выведения РФЛП в периферических камерах.
При условии быстрого накопления РФЛП в камере (когда значение константы скорости накопления много больше значения константы скорости выведения), например для камеры костных тканей ( K 03 >> K 30 ), из решения системы (1) следует, что при построении фармакокинетических кривых экспериментально измеренные значения (кружочки на рис. 2) можно аппроксимировать моноэкспоненциальными функциями:
F(t) = Cmax(l-exp(-K03t)) (5)
-
- для области накопления РФЛП при t < t max (цифра 1 на рис. 2),
F(t) = С тах exp(-K 30 (t - t max )) (6)
-
- для области выведения при t > t max (цифра 2).
Из выражения (5) также следует, что константа накопления может быть определена через тангенс угла наклона касательной, проведённой к фармакокинетической кривой на начальном участке её подъёма:
К оз С тах = F ' (t = 0) = tg(a) . (7)
Методика расчёта фармакокинетических и дозиметрических характеристик. Зная константы скорости выведения в каждой камере, можно рассчитать биологические и эффективные периоды полувыведения РФЛП из камеры (органа/ткани) по формулам:
Т ЬЮ * t max + 1П 2/К , T e ff = , (8)
” ТЫо +Т 1/2
где t max - время достижения максимальной концентрации С тах в камере (рис. 2); K - биологическая константа выведения РФЛП для данной камеры. Также значения периодов полувыведения можно определить по построенным фармакокинетическим кривым «Концентрация-время» (биологический период полувыведения) и «Активность-время» (эффективный период полувыведения) как время, за которое количество РФЛП уменьшается вдвое по сравнению с его максимальным значением в камере.
Другими важными фармакокинетическими характеристиками для оценки функциональной пригодности РФЛП являются клиренс крови и кажущийся объём распределения [6]. Клиренс Cl отражает элиминацию РФЛП из крови путём его экскреции (преимущественно почками и печенью) или биотрансформации и рассчитывается по формуле:
Cl = A0/AUC , (9)
где AUC (area under curve) – площадь под кривой «Активность-время», физическим смыслом которой является число ядерных распадов РФЛП в камере. Зная клиренс крови, можно найти кажущийся объём распределения V d , который характеризует условный объём, занимаемый РФЛП с текущей (средней) концентрацией C в камере (10):
Vd = Cl/(K + A) , C = A0/Vd . (10)
К дозиметрическим характеристикам РФЛП относятся накопленные и полные поглощённые дозы в органах и тканях организма (камерах модели). Рассчитать их можно для всех камер модели с использованием фармакокинетических кривых «Активность-время». Причём достаточно учесть вклад только от β-частиц, так как именно они оказывают существенный терапевтический эффект, а вкладом от γ-излучения РФЛП можно пренебречь. Накопленная к моменту времени t j поглощённая доза в i -органе (ткани) определяется через площадь AUC i в соответствующей i -камере [9]:
Dt(tj) = kA^AUCtj), AUCt(tj) = ^F^dt, (11) *“i где
Результаты и обсуждение
Идентификация транспортных констант камерной модели проводилась с использованием численных методов (наименьших квадратов, Хука-Дживса, Рунге-Кутты) [7]. Для осуществления процедур минимизации (4) и аппроксимации моноэкспоненциальными функциями (5) и (6) нами была разработана и написана программа на языке программирования C++.
В качестве примера на рис. 3 приведены рассчитанные в результате моделирования фармакокинетические кривые для кости бедра интактных крыс с использованием РФЛП «188Re-ОЭДФ». Сплошной линией изображена кривая, полученная на основе решения системы уравнений (1) с использованием процедуры минимизации (4). Штриховой линией изображена кривая, полученная на основе аппроксимации моноэкспоненциальными функциями (5) и (6). Также на рис. 3 кружочками показаны экспериментальные значения с учётом их погрешности [4].
Как видно из рис. 3, рассчитанные разными методами кривые демонстрируют схожую динамику накопления-выведения, и в пределах указанных погрешностей существенных различий между ними не наблюдается. Внутривенно введённый РФЛП очень быстро накапливается в кости бедра, достигая своей максимальной концентрации C max =2,22 %/г (рис. 3а) и 2,29 %/г (рис. 3б) за время t max =55 мин и 60 мин соответственно. Далее следует более медленная и продолжительная фаза выведения РФЛП, что подтверждается соотношением значений идентифицированных транспортных констант накопления K 03 =7,19 ч–1 (рис. 3а), K 03 =7,27 ч–1 (рис. 3б) и выведения K 30 =0,016 ч–1 (рис. 3а), K 03 =0,017 ч–1 (рис. 3б). Аналогичная ситуация наблюдается для других органов и тканей (камер модели).
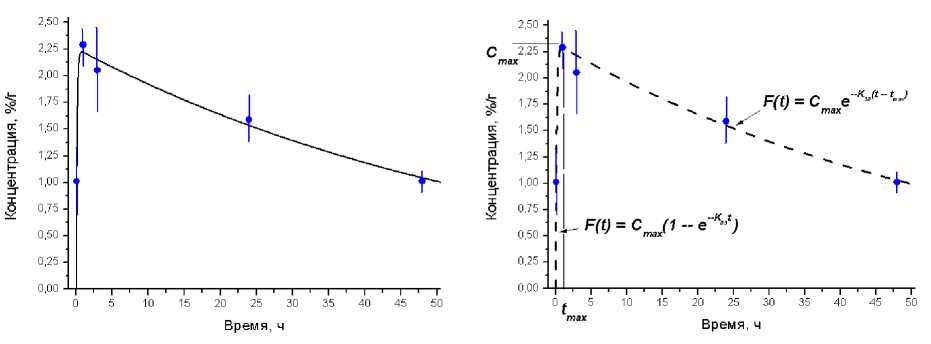
а) б)
Рис. 3. Кривые накопления-выведения 188Re-ОЭДФ для кости бедра, рассчитанные: а) на основе решения системы уравнений (1) и б) с использованием аппроксимации моноэкспоненциальными функциями.
В табл. 1 приведены фармакокинетические характеристики, рассчитанные на основе аппроксимации моноэкспоненциальными функциями (5) и (6) экспериментальных значений кинетики РФЛП «188Re-ОЭДФ», «188Re-ОЭНТМФ», «188Re-ЭДТМФ» и «188Re-ПФК» в организме интактных крыс [4]. В скобках указаны приближённые значения констант накопления, определённые через тангенс угла наклона касательной по формуле (7). Периоды полувыведения рассчитывались по формулам (8) с момента введения РФЛП ( t =0).
Анализ результатов моделирования и расчётов характеристик, представленных в табл. 1, показал, что после внутривенного введения происходит максимально быстрая миграция всех исследуемых РФЛП из крови в периферические камеры (рассматриваемые в рамках данной модели органы и ткани). В то время как биологическое выведение РФЛП из всех камер (органов/тка-ней) происходит значительно медленнее – рассчитанные константы выведения в 100-1000 раз меньше констант накопления. Все РФЛП в значительных количествах накапливаются в костных тканях и почках. При этом константы выведения из костных тканей существенно меньше, чем из других органов, что указывает на эффект депонирования исследуемых РФЛП в костных тканях.
Следует отметить, что накопление всех РФЛП в печени существенно меньше, чем в почках, а транспортные константы имеют примерно одинаковые значения. Например, для 188Re-ЭДТМФ максимальные концентрации в камерах почек и печени достигаются при t =5 мин от начала исследования и равны 5,79 и 0,66 %/г соответственно, константы накопления в обеих камерах имеют одинаковое значение 12,5 ч–1, а константы выведения (определяющие клиренс крови) равны 0,050 и 0,043 ч–1. Из чего можно сделать вывод, что РФЛП выводятся из крови преимущественно почками. Кроме того, как показали расчёты константы обратного всасывания РФЛП из камер почек и печени в кровь K 10 и K 20 (см. рис. 1) значительно меньше констант клиренса K 1 и K 2 соответственно, и ими можно пренебречь при расчётах фармакокинетических и дозиметрических характеристик.
Как видно из табл. 1, в костных тканях (бёдра, череп, рёбра, позвоночник) выявляется следующая закономерность среди исследуемых РФЛП. 188Re-ПФК имеет самые большие значения максимальных концентраций в костных тканях и высокую скорость выведения из них (большие значения констант выведения) по сравнению с другими РФЛП. Значения максимальных концен- траций в костных тканях у 188Re-ОЭДФ почти в 1,5-2 раза меньше, чем у 188Re-ПФК, при этом он имеет самую низкую скорость выведения из них (меньшие значения констант выведения). Максимальные концентрации активности 188Re-ЭДТМФ и 188Re-ОЭНТМФ в костных тканях ещё меньше, и скорости выведения этих РФЛП из них высокие. Относительно констант накопления исследуемых РФЛП в костных тканях каких-либо закономерностей не выявлено. Таким образом, наиболее оптимальным терапевтическим РФЛП с учётом депонирования в костных тканях (достаточно высокие значения максимальных концентраций и низкие скорости выведения) является 188Re-ОЭДФ.
Таблица 1 Рассчитанные фармакокинетические характеристики РФЛП
|
Ткань/орган |
Структура РФЛП, меченная 188Re |
C max , %/г (мл) |
t max , ч |
Транспортные константы, ч–1 |
Периоды полувыведения, ч |
||
|
накопления |
выведения |
биологические |
эффективные |
||||
|
ОЭДФ |
0,45 |
0 |
– |
0,059 |
11,7 |
6,9 |
|
|
Кровь |
ОЭНТМФ |
0,25 |
0 |
– |
0,042 |
16,5 |
8,4 |
|
ЭДТМФ |
0,54 |
0 |
– |
0,067 |
10,3 |
6,4 |
|
|
ПФК |
0,71 |
0 |
– |
0,068 |
10,2 |
6,4 |
|
|
ОЭДФ |
2,29 |
1 |
7,27 (5,31) |
0,017 |
41 |
12,0 |
|
|
Кость бедра |
ОЭНТМФ |
1,17 |
1 |
4,29 (3,50) |
0,017 |
41 |
12,0 |
|
ЭДТМФ |
1,59 |
1 |
12,06 (10,46) |
0,022 |
32 |
11,1 |
|
|
ПФК |
3,31 |
1 |
9,72 (6,52) |
0,029 |
25 |
10,1 |
|
|
ОЭДФ |
1,19 |
1 |
10,11 (6,70) |
0,010 |
70 |
13,7 |
|
|
Кость черепа |
ОЭНТМФ |
0,88 |
1 |
5,87 (4,52) |
0,017 |
41 |
12,0 |
|
ЭДТМФ |
0,90 |
1 |
9,86 (9,37) |
0,026 |
28 |
10,6 |
|
|
ПФК |
1,91 |
1 |
9,21 (8,83) |
0,023 |
31 |
11,0 |
|
|
ОЭДФ |
1,50 |
24 |
0,84 (5,06) |
0,005 |
163 |
15,4 |
|
|
Кость ребра |
ОЭНТМФ |
0,89 |
1 |
4,93 (3,93) |
0,021 |
34 |
11,3 |
|
ЭДТМФ |
0,73 |
1 |
12,00 (10,24) |
0,023 |
31 |
11,0 |
|
|
ПФК |
3,07 |
1 |
6,74 (5,02) |
0,018 |
40 |
11,9 |
|
|
ОЭДФ |
1,13 |
1 |
14,00 (10,77) |
0,021 |
34 |
11,3 |
|
|
Кость |
ОЭНТМФ |
0,81 |
3 |
2,81 (4,76) |
0,015 |
49 |
12,6 |
|
позвоночника |
ЭДТМФ |
1,04 |
1 |
23,00 (11,94) |
0,025 |
29 |
10,7 |
|
ПФК |
1,62 |
1 |
12,10 (10,34) |
0,026 |
28 |
10,6 |
|
|
ОЭДФ |
0,27 |
0,08 |
> 12,5 (12,5) |
0,032 |
22 |
9,6 |
|
|
Печень |
ОЭНТМФ |
0,25 |
0,08 |
> 12,5 (12,5) |
0,060 |
12 |
7,0 |
|
ЭДТМФ |
0,66 |
0,08 |
> 12,5 (12,5) |
0,043 |
16 |
8,2 |
|
|
ПФК |
0,41 |
0,08 |
> 12,5 (12,5) |
0,057 |
12 |
7,0 |
|
|
ОЭДФ |
4,19 |
1 |
8,00 (7,68) |
0,034 |
21 |
9,4 |
|
|
Почки |
ОЭНТМФ |
1,79 |
1 |
8,00 (7,54) |
0,023 |
31 |
11,0 |
|
ЭДТМФ |
5,79 |
0,08 |
> 12,5 (12,5) |
0,050 |
14 |
7,7 |
|
|
ПФК |
4,78 |
1 |
12,50 (10,36) |
0,040 |
18 |
8,7 |
|
|
ОЭДФ |
0,74 |
3 |
3,57 (10,42) |
0,031 |
25 |
10,1 |
|
|
Щитовидная |
ОЭНТМФ |
1,81 |
1 |
8,47 (8,79) |
0,017 |
41 |
12,0 |
|
железа |
ЭДТМФ |
0,81 |
3 |
4,19 (10,11) |
0,042 |
19 |
9,0 |
|
ПФК |
1,44 |
0,08 |
> 12,5 (12,5) |
0,044 |
16 |
8,2 |
|
|
ОЭДФ |
0,62 |
0,08 |
> 12,5 (12,5) |
0,067 |
10 |
6,3 |
|
|
Лёгкие |
ОЭНТМФ |
0,49 |
0,08 |
> 12,5 (12,5) |
0,084 |
8 |
5,4 |
|
ЭДТМФ |
0,83 |
0,08 |
> 12,5 (12,5) |
0,073 |
10 |
6,3 |
|
|
ПФК |
1,22 |
0,08 |
> 12,5 (12,5) |
0,087 |
8 |
5,4 |
|
|
ОЭДФ |
0,19 |
0,08 |
> 12,5 (12,5) |
0,039 |
18 |
9,3 |
|
|
Селезёнка |
ОЭНТМФ |
0,17 |
0,08 |
> 12,5 (12,5) |
0,062 |
11 |
6,7 |
|
ЭДТМФ |
0,33 |
0,08 |
> 12,5 (12,5) |
0,032 |
22 |
9,6 |
|
|
ПФК |
0,30 |
0,08 |
> 12,5 (12,5) |
0,060 |
12 |
7,0 |
|
|
ОЭДФ |
0,50 |
3 |
4,23 (10,60) |
0,049 |
17 |
8,5 |
|
|
Желудок без |
ОЭНТМФ |
0,36 |
1 |
6,82 (6,69) |
0,063 |
12 |
7,0 |
|
содержимого |
ЭДТМФ |
0,88 |
3 |
2,10 (6,71) |
0,076 |
12 |
7,0 |
|
ПФК |
0,72 |
0,08 |
> 12,5 (12,5) |
0,067 |
10 |
6,3 |
|
|
ОЭДФ |
0,28 |
0,08 |
> 12,5 (12,5) |
0,077 |
9 |
5,9 |
|
|
Мышца бедра |
ОЭНТМФ |
0,10 |
0,08 |
> 12,5 (12,5) |
0,071 |
10 |
6,3 |
|
ЭДТМФ |
0,21 |
0,08 |
> 12,5 (12,5) |
0,076 |
9 |
5,9 |
|
|
ПФК |
0,42 |
0,08 |
> 12,5 (12,5) |
0,092 |
8 |
5,4 |
|
Через транспортные константы определяются и другие важные фармакокинетические характеристики РФЛП, такие как площадь под фармакокинетической кривой, клиренс крови, кажущийся объём распределения, средняя концентрация активности, которые в отличие от самих транспортных констант зависят ещё и от максимальной концентрации C max [6]. Результаты расчёта их эффективных (с учётом радиоактивного распада РФЛП) значений для камеры крови представлены в табл. 2. Значения рассчитаны на основе средних статистических данных фармакокинетики РФЛП в крови крыс, приведённых в [4].
Таблица 2
Значения эффективных фармакокинетических характеристик для камеры крови
|
РФЛП |
Площадь под кривой «Активность-время», кБк·ч/мл |
Клиренс крови, мл/ч |
Кажущийся объём распределения, мл |
Средняя концентрация активности, кБк/мл |
|
188Re-ОЭДФ |
16,7 |
22,2 |
222,2 |
1,7 |
|
188Re-ОЭНТМФ |
11,1 |
33,3 |
401,6 |
0,9 |
|
188Re-ЭДТМФ |
18,5 |
20,0 |
185,2 |
2,0 |
|
188Re-ПФК |
24,1 |
15,4 |
141,1 |
2,6 |
Как следует из формулы (9), при снижении AUC прямо пропорционально увеличивается клиренс крови от РФЛП. Увеличение же клиренса крови приводит к снижению лучевых нагрузок на кровеносную систему в связи с уменьшением активности РФЛП. Из табл. 2 можно видеть, что наибольший клиренс крови достигается для 188Re-ОЭНТМФ (33,3 мл/ч). С другой стороны, кажущийся объём распределения даёт информацию о распределении РФЛП в организме крыс. Как следует из формулы (10), чем больше значение Vd, тем ниже концентрация РФЛП в крови. Большие значения кажущегося объёма распределения по сравнению с общим объёмом крови крыс (примерно 14 мл) указывают на депонирование РФЛП в органах и тканях. Для 188Re-ОЭНТМФ получено наибольшее значение Vd=401,6 мл и наименьшее значение C=0,9 кБк/мл, что в совокупности с высоким значением клиренса указывает на лучшее депонирование данного РФЛП в органах и тканях по сравнению с другими исследуемыми РФЛП. Однако его повышенное накопление в щитовидной железе (что уже обсуждалось выше) не позволяет рекомендовать 188Re-ОЭНТМФ в качестве перспективного остеотропного РФЛП. Напротив, 188Re-ОЭДФ с Cl=22,2 мл/ч и Vd=222,2 мл (в 1,5-1,8 раза меньше) и минимальным накоплением в щитовидной железе и других органах по сравнению с депонированием в костных тканях является наилучшим остеотроп-ным РФЛП. Кроме того, он имеет и наименьшую скорость выведения из костных тканей по сравнению с другими исследуемыми РФЛП (см. значения констант выведения в костных тканях, приведённые в табл. 1). Отметим, однако, что данные результаты моделирования получены для организма интактных крыс. При исследовании фармакокинетики РФЛП в организме крыс с костной патологией их фармакокинетические характеристики могут существенно изменяться [10].
В табл. 3 приведена динамика накопления поглощённых доз внутреннего облучения органов и тканей интактных крыс, полученная на основе камерной модели, для четырёх исследуемых РФЛП. Поглощённые дозы рассчитывались по формуле (11) при величине вводимой активности A 0 =370 кБк. В скобках указаны значения дозиметрических характеристик, при расчёте которых была использована константа накопления, вычисленная через тангенс угла наклона касательной по приближённой формуле (7).
Рассчитанные дозиметрические характеристики РФЛП (мГр)
Таблица 3
|
Структура |
Время после введения РФЛП |
||||||
|
Ткань/орган |
РФЛП, ме- |
||||||
|
5 мин |
1 ч |
3 ч |
24 ч |
48 ч |
∞ |
||
|
ченная 188Re |
|||||||
|
ОЭДФ |
0,06 |
0,71 |
1,94 |
6,81 |
7,43 |
7,50 |
|
|
Кровь |
ОЭНТМФ |
0,03 |
0,40 |
1,10 |
4,33 |
4,92 |
5,02 |
|
ЭДТМФ |
0,07 |
0,85 |
2,30 |
7,70 |
8,28 |
8,33 |
|
|
ПФК |
0,10 |
1,12 |
3,02 |
10,05 |
10,79 |
10,85 |
|
|
ОЭДФ |
0,08 (0,06) |
3,28 (3,09) |
10,47 (10,28) |
51,72 (51,52) |
64,79 (64,60) |
69,14 (68,95) |
|
|
Кость |
ОЭНТМФ |
0,03 (0,02) |
1,50 (1,41) |
5,17 (5,08) |
26,24 (26,15) |
32,92 (32,83) |
35,15 (35,06) |
|
бедра |
ЭДТМФ |
0,08 (0,07) |
2,42 (2,39) |
7,39 (7,36) |
34,58 (34,55) |
42,31 (42,28) |
44,51 (44,48) |
|
ПФК |
0,14 (0,10) |
4,94 (4,66) |
15,21 (14,93) |
67,94 (67,66) |
80,80 (80,53) |
83,77 (83,49) |
|
|
ОЭДФ |
0,05 (0,04) |
1,78 (1,68) |
5,54 (5,45) |
28,62 (28,52) |
37,15 (37,05) |
40,72 (40,62) |
|
|
Кость |
ОЭНТМФ |
0,03 (0,02) |
1,21 (1,14) |
3,98 (3,91) |
19,83 (19,75) |
24,85 (24,78) |
26,52 (26,45) |
|
черепа |
ЭДТМФ |
0,04 (0,04) |
1,34 (1,34) |
4,15 (4,14) |
18,92 (18,91) |
22,77 (22,76) |
23,74 (23,73) |
|
ПФК |
0,08 (0,08) |
2,83 (2,82) |
8,79 (8,78) |
41,12 (41,11) |
50,12 (50,10) |
52,60 (52,58) |
|
|
ОЭДФ |
0,01 (0,04) |
0,81 (2,00) |
4,75 (6,99) |
56,88 (59,35) |
93,18 (95,65) |
111,32 (113,79) |
|
|
Кость |
ОЭНТМФ |
0,02 (0,02) |
1,18 (1,11) |
3,96 (3,89) |
19,34 (19,27) |
23,81 (23,74) |
25,12 (25,05) |
|
ребра |
ЭДТМФ |
0,04 (0,03) |
1,11 (1,10) |
3,39 (3,37) |
15,75 (15,73) |
19,18 (19,17) |
20,13 (20,12) |
|
ПФК |
0,10 (0,08) |
4,35 (4,09) |
13,98 (13,72) |
68,69 (68,44) |
85,67 (85,41) |
91,14 (90,89) |
|
|
ОЭДФ |
0,06 (0,05) |
1,74 (1,70) |
5,28 (5,24) |
24,80 (24,76) |
30,47 (30,43) |
32,14 (32,10) |
|
|
позвоноч- |
ОЭНТМФ ЭДТМФ |
0,01 (0,02) 0,08 (0,05) |
0,90 (1,07) 1,65 (1,58) |
3,56 (3,76) 4,89 (4,82) |
20,22 (20,41) 22,14 (22,07) |
25,73 (25,93) 26,74 (26,67) |
27,69 (27,89) 27,93 (27,86) |
|
ПФК |
0,08 (0,07) |
2,47 (2,43) |
7,51 (7,47) |
34,11 (34,07) |
41,04 (41,00) |
42,79 (42,75) |
|
|
ОЭДФ |
0,01 |
0,41 |
1,19 |
5,10 |
5,99 |
6,18 |
|
|
Печень |
ОЭНТМФ |
0,01 |
0,38 |
1,06 |
3,77 |
4,10 |
4,14 |
|
ЭДТМФ |
0,03 |
1,00 |
2,87 |
11,36 |
12,89 |
13,13 |
|
|
ПФК |
0,02 |
0,62 |
1,75 |
6,32 |
6,93 |
6,99 |
|
Продолжение таблицы 3
|
Ткань/орган |
Структура РФЛП, меченная 188Re |
Время после введения РФЛП |
|||||
|
5 мин |
1 ч |
3 ч |
24 ч |
48 ч |
∞ |
||
|
ОЭДФ |
0,16 (0,15) |
6,09 (6,06) |
19,03 (19,00) |
82,54 (82,51) |
96,44 (96,41) |
99,21 (99,18) |
|
|
Почки |
ОЭНТМФ |
0,07 (0,06) |
2,60 (2,58) |
8,19 (8,17) |
38,49 (38,47) |
46,92 (46,90) |
49,24 (49,22) |
|
ЭДТМФ |
0,30 |
8,77 |
24,97 |
94,22 |
104,94 |
106,30 |
|
|
ПФК |
0,25 (0,22) |
7,31 (7,18) |
21,98 (21,85) |
90,32 (90,19) |
103,45 (103,32) |
105,65 (105,52) |
|
|
ОЭДФ |
0,01 (0,03) |
0,90 (1,11) |
3,35 (3,57) |
16,69 (16,91) |
19,80 (20,03) |
20,48 (20,71) |
|
|
Щитовидная |
ОЭНТМФ |
0,07 (0,07) |
2,65 (2,67) |
8,34 (8,35) |
40,93 (40,94) |
51,27 (51,28) |
54,71 (54,72) |
|
железа |
ЭДТМФ |
0,02 (0,04) |
1,03 (1,21) |
3,72 (3,91) |
17,12 (17,31) |
19,59 (19,78) |
19,98 (20,17) |
|
ПФК |
0,08 |
2,19 |
6,26 |
24,59 |
27,82 |
28,30 |
|
|
ОЭДФ |
0,03 |
0,93 |
2,61 |
8,87 |
9,54 |
9,59 |
|
|
Лёгкие |
ОЭНТМФ |
0,03 |
0,73 |
2,02 |
6,22 |
6,54 |
6,55 |
|
ЭДТМФ |
0,04 |
1,24 |
3,47 |
11,37 |
12,12 |
12,17 |
|
|
ПФК |
0,06 |
1,82 |
5,00 |
15,19 |
15,90 |
15,93 |
|
|
ОЭДФ |
0,01 |
0,29 |
0,83 |
3,38 |
3,88 |
3,97 |
|
|
Селезёнка |
ОЭНТМФ |
0,01 |
0,26 |
0,72 |
2,52 |
2,74 |
2,76 |
|
ЭДТМФ |
0,02 |
0,50 |
1,46 |
6,23 |
7,32 |
7,55 |
|
|
ПФК |
0,02 |
0,45 |
1,28 |
4,52 |
4,92 |
4,96 |
|
|
Желудок без содер- |
ОЭДФ |
0,01 (0,02) |
0,64 (0,75) |
2,30 (2,42) |
10,15 (10,27) |
11,39 (11,51) |
11,55 (11,67) |
|
ОЭНТМФ |
0,01 (0,01) |
0,51 (0,51) |
1,59 (1,59) |
5,75 (5,74) |
6,23 (6,23) |
6,28 (6,27) |
|
|
ЭДТМФ |
0,01 (0,03) |
0,85 (1,25) |
3,69 (4,17) |
15,14 (15,62) |
16,15 (16,63) |
16,22 (16,70) |
|
|
ПФК |
0,04 |
1,08 |
3,03 |
10,30 |
11,08 |
11,14 |
|
|
ОЭДФ |
0,01 |
0,42 |
1,16 |
3,73 |
3,95 |
3,97 |
|
|
Мышца |
ОЭНТМФ |
0,01 |
0,15 |
0,42 |
1,39 |
1,48 |
1,49 |
|
бедра |
ЭДТМФ |
0,01 |
0,31 |
0,87 |
2,82 |
2,99 |
3,00 |
|
ПФК |
0,02 |
0,62 |
1,71 |
5,06 |
5,27 |
5,28 |
|
Из табл. 3 видно, что наибольшие значения поглощённых доз формируются в костных тканях (бёдра, рёбра, череп, позвоночник), а также в органе выведения – почках. В костных тканях наибольшие значения дозиметрических характеристик получены для 188Re-ПФК и 188Re-ОЭДФ. Также следует отметить высокие значения поглощённых доз (примерно в 2 раза большие, чем в костных тканях) для 188Re-ОЭНТМФ, формирующихся в щитовидной железе, что обусловлено его повышенным накоплением в этом органе (см. табл. 1). В остальных органах и тканях дозиметрические характеристики всех исследуемых фосфоновых кислот имеют более низкие значения, что соответствует динамике накопления поглощённых доз внутреннего облучения для остеотропных РФЛП.
Выводы
-
1. Разработана камерная математическая модель кинетики меченных 188Re фосфоновых кислот при их внутривенном введении в организм интактных крыс. С использованием экспериментальных данных радиометрии органов и тканей получены и проанализированы фармакокинетические кривые в камерах модели, а также определены фармакокинетические и дозиметрические характеристики четырёх РФЛП с разным числом фосфоновых групп (транспортные константы накопления и выведения, биологические и эффективные периоды полувыведения, максимальные концентрации и времена их достижения, клиренс крови и кажущийся объём распределения, накопленные поглощённые дозы внутреннего облучения).
-
2. Анализ рассчитанных фармакокинетических характеристик показал, что химическая структура фосфоновых кислот влияет на накопление меченых соединений в костной ткани и скорость выведения из них. Так, по уровню накопления активности в скелете РФЛП можно
-
3. Анализ рассчитанных дозиметрических характеристик показал, что наибольшие значения поглощённых доз формируются в костных тканях (бёдра, рёбра, череп, позвоночник) и органе выведения – почках. Для 188Re-ОЭНТМФ также характерны высокие значения поглощённых доз в щитовидной железе (в 2 раза большие, чем в костных тканях). В костных тканях наибольшие значения поглощённых доз получены для 188Re-ПФК и 188Re-ОЭДФ, что в совокупности с их фармакокинетическими свойствами позволяет рассматривать их как перспективные остеотропные РФЛП для терапии костных метастазов.
Список литературы Исследование зависимости фармакокинетических и дозиметрических характеристик меченных 188Re фосфоновых кислот от их структуры в организме крыс на основе камерного моделирования
- Murray I., Du Y. Systemic radiotherapy of bone metastases with radionuclides //Clin. Oncol. 2021. V. 33, N 2. P. 98-105.
- Lungu V., Niculae D., Bouziotis P. Pirmettis I., Podina C. Radiolabeled phosphonates for bone metastases therapy //J. Radioanal. Nucl. Chem. 2007. V. 273, N 3. P. 663-667.
- Pillai M.R., Dash A., Knapp F.F.Jr. Rhenium-188: availability from the (188)W/(188)Re generator and status of current applications //Curr. Radiopharm. 2012. V. 5, N 3. P. 228-243.
- Тищенко В.К., Петриев В.М., Сморызанова О.А., Михайловская А.А. Влияние химической структуры фосфоновых кислот, меченных 188Re, на их поведение в организме лабораторных животных //Радиация и риск. 2017. Т. 26, № 1. С. 78-88.
- Meerkhan S., Sjögreen Gleisner K., Larsson E., Strand S.E., Jönsson B.A. Testis dosimetry in individual patients by combining a small-scale dosimetry model and pharmacokinetic modeling-application of (111)In-Ibritumomab Tiuxetan //Phys. Med. Biol. 2014. V. 59, N 24. P. 7889-7904.
- Сергиенко В.И., Джеллифф Р., Бондарева И.Б. Прикладная фармакокинетика: основные положения и клиническое применение. М.: Изд-во РАМН, 2003. 208 с.
- Галанин М.П., Ходжаева С.Р. Разработка и тестирование методов решения жестких обыкновенных дифференциальных уравнений //Математическое моделирование и численные методы. 2014. № 4. С. 95-119.
- Ватульян А.О. Математические модели и обратные задачи //Соросовский образовательный журнал. 1998. № 11. С. 143-148.
- Матвеев А.В. Особенности расчёта индивидуальных фармакокинетических и дозиметрических характеристик радиофармпрепаратов у больных с метастазами в кости при проведении радионуклидной терапии //Инновационное развитие науки: фундаментальные и прикладные проблемы: монография. Петрозаводск: МЦНП "Новая наука", 2021. С. 49-72.
- Петриев В.М., Матвеев А.В., Тищенко В.К. Камерное моделирование кинетики 188Re-пентафосфоновой кислоты в организме крыс с костной мозолью //Химико-фармацевтический журнал. 2021. Т. 55, № 10. С. 3-9.


