Исследования динамики развития молочнокислых микроорганизмов при двухстадийном процессе ферментирования капусты белокочанной сорта Парус
Автор: Кондратенко Владимир Владимирович, Посокина Наталья Евгеньевна, Семенова Жанна Александровна, Терешонок Владимир Иванович
Журнал: Овощи России @vegetables
Рубрика: Агрохимия
Статья в выпуске: 5 (49), 2019 года.
Бесплатный доступ
Актуальность. Leuconostoc mesenteroides, Lactobacillus plantarum и Leuconostoc fallax являются тремя основными молочнокислыми бактериями, развивающимися при производстве квашеной капусты. Процесс производства ферментированных пищевых продуктов, а также их характеристики определяются ферментирующей активностью используемых микроорганизмов. Многие пищевые продукты (вызревшие сыры, кислая капуста и др.) являются консервированными продуктами: для них срок значительно увеличен по сравнению со сроком хранения сырья, из которого эти продукты изготавливаются. Их характерной чертой является не только высокая стабильность при хранении, но и ярко выраженный вкусо-ароматический букет, обусловленный прямым или косвенным действием ферментирующих микроорганизмов. Материалы и методы. Микробиологические методы консервирования плодов и овощей основаны на образовании естественных консервантов - молочной кислоты и спирта, накапливающихся в результате сбраживания сахаров молочнокислыми бактериями или дрожжами...
Направленное ферментирование, штаммы молочнокислых микроорганизмов, белокочанная капуста, консорциум, модельная среда
Короткий адрес: https://sciup.org/140245792
IDR: 140245792 | УДК: 635.342:631.563.2 | DOI: 10.18619/2072-9146-2019-5-88-93
Текст научной статьи Исследования динамики развития молочнокислых микроорганизмов при двухстадийном процессе ферментирования капусты белокочанной сорта Парус
Relevance. Leuconostoc mesenteroides, Lactobacillus plantarum and Leuconostoc fallax are the three main lactic acid bacteria developing in the production of sauerkraut. The process of production of fermented foods, as well as their characteristics are determined by the fermenting activity of microorganisms used. Many food products (matured cheeses, sauerkraut, etc.) are canned products: for them, the term is significantly increased compared to the shelf life of the raw material from which these products are made. Their characteristic feature is not only high stability during storage, but also a pronounced flavor bouquet, due to the direct or indirect action of fermenting microorganisms.
Material and methods. Microbiological methods of preserving fruits and vegetables are based on the formation of natural preservatives – lactic acid and alcohol, which accumulate as a result of fermentation of sugars by lactic acid bacteria or yeast. The intensity of lactic acid fermentation and the amount of accumulated lactic acid depend on several conditions: the presence of lactic acid bacteria, the content of sugars and other chemicals in the raw material, the addition of spice-aromatic plants, anaerobic conditions, temperature. Due to the accumulation of lactic acid, the development of other microorganisms, and then the lactic acid bacteria themselves, is suspended. The dynamics of development of lactic acid microorganisms and their consortia on the model media, pretreated by the culture of Leuconostoc mesenteroides species, at the main stage of step fermentation of white cabbage of the "Parus"variety are investigated.
Results. Dynamics of development of monocultures of L. brevis, L. casei and L. plantarum and their paired consortia at the main technological stage at two stages of fermentation are investigated. It is established that a preliminary fermentation of a model medium with a culture of Leuconostoc mesen-teroides generates adverse conditions for the development of L. brevis and L. casei in the monoculture (pseudotensorial) and in consortium with each other, but favorable conditions for the development of L. plantarum in pseudotensorial and in pairwise combinations with L. brevis and L. casei .
С охранение здоровья и увеличение продолжительности жизни населения страны является приоритетным направлением государственной политики Российской Федерации. Известно, что здоровье человека, прежде всего, зависит от его полноценного и сбалансированного питания. Не менее значимыми факторами являются экологические, что обусловливает необходимость расширения объёмов и ассортимента продуктов питания, обладающих бифидогенным потенциалом – проявляющих про- и пре-биотические свойства [1].
Принимая во внимание многокомпонентность состава и многовариантность полезных для организма человека свойств растительного сырья, целесообразно его использование в технологии производства функциональных продуктов питания [2].
Квашение и соление овощей в России получило широкое распространение как массовый вид переработки [3]. При этом успешное производство всех ферментированных продуктов зависит от наличия, роста и метаболизма специфических микроорганизмов [4].
Безопасность пищевых продуктов стала международным приоритетом, и, в целом, существует нулевая толерантность к патогенам или другим опасностям в ферментированных продуктах. Пищевая промышленность ферментированных продуктов эволюционировала из практики, основанной на искусстве или ремесле, в практику, основанную на современной науке и технике. Очевидно, что вопросы безопасности, санитарии, качества и согласованности относятся ко всем обработанным продуктам, а не только к ферментированным продуктам. Тем не менее, пищевая промышленность ферментированных продуктов уникальна – это отрасль, в которой потребительский успех продукта зависит, в том числе, и от роста и активности микроорганизмов [4].
Стандартизация микроорганизмов, используемых для инициирования ферментации, в отличие от других ингредиентов представляет сложную задачу, поскольку их биохимическая активность и даже их концентрация могут значимо варьировать от партии к партии. Пищевая ценность ферментированных продуктов давно признана. При этом научные основы для многих требований к питанию были только недавно изучены [4].
Белокочанная капуста широко используется в качестве субстрата для ферментации, что во многом обусловлено характером процесса, поскольку он включает несколько различных нативных видов микроорганизмов, действующих как часть единой экосистемы [4].
В настоящее время в группу молочнокислых бактерий входят 13 родов грамположительных бактерий: Carnobacterium, Enterococcus, Lactococcus, Lactobacillus, Lactosphaera, Leuconostoc, Oenococcus, Pediococcus, Paralactobacillus, Streptococcus, Tetragenococcus, Vagococcus, Weisella. Несмотря на то, что границы группы «молочнокислые микроорганизмы» неточные, всем членам этой группы присуще одно общее свойство: продуцирование молочной кислоты при метаболизме гексоз. В зависимости от конечных продуктов метаболизма углеводов, молочнокислые бактерии делятся на две группы. Микроорганизмы, продуцирующие молочную кислоту в качестве главного и единственного продукта сбраживания глюкозы, называются гомоферментативными. Гомоферментативные молочнокислые микроорганизмы (гомолакты) способны вырабатывать вдвое больше энергии из одного количества глюкозы, чем гетероферментативные (гетеролакты). Молочнокислые микроорганизмы, продуцирующие наравне с молочной кислотой также СО2 и этанол, называются гетероферментативными. Гетероферментативные молочнокислые микроорганизмы играют бульшую, чем гомолак-ты роль при образовании вкусо-ароматических соедине- ний, таких как ацетальдегид и диацетил. Род Lactobacillus исторически был подразделён на три подрода: Betabacterium, Streptobacterium и Thermobacterium. Streptobacterium (например, L.casei и L.plantarum) при оптимальной температуре (30ºС) продуцируют до 1,5% молочной кислоты при ферментации капусты [5].
Молочнокислые бактерии обладают высокой бродильной способностью и отличаются отсутствием большинства биосинтетических путей. Это обусловливает высокую требовательность рассматриваемых бактерий к субстрату, которая удовлетворяется лишь на таких средах, как ткани растений, молоко, содержимое желудочно-кишечного такта животных [6].
Молочнокислые бактерии развиваются в довольно широком диапазоне температур. Для большинства видов предпочтительны температуры от 7 до 42ºС, при оптимуме 30-40ºС [6].
Многие молочнокислые бактерии успешно размножаются в диапазоне рН 5,5-8,8, однако более для этого подходит нейтральная реакция среды [6]. В таблице 1 приведено разделение молочнокислых микроорганизмов на гомо- и гетероферментативные формы.
Микроорганизмы, развивающиеся в процессе фермен-
Таблица 1. Некоторые гомо- и гетероферментативные молочнокислые бактерии [5]
Table 1. Some homo- and heteroenzymatic lactic acid bacteria [5]
Гомоферментативные Homoenzymatic
Lactobacillus
L. acidophilus
L. casei
-
L. delbrueckii subsp. bulgaricus subsp. delbrueckii subsp.lactis
P. acidilactici Streptococcus
S. salivarius subsp.salivarius subsp.thermophilus
Гетероферментативные Heteroenzymatic
Lactobacillus
L. brevis
L. fermentum
L. pontis
L .paralimentarius Leuconostoc
L. fallax
L. lactis
L. mesenteroides subsp. cremoris subsp. dextranicum subsp. mesenteroides Carnobacterium
C. divergens
C. gallinarum Oenococcus
O. oeni Weisella W. cibaria
W. paramesenteroides
Tetragenococc us
T. halophilus
Vagococcus
V. fluvialis
тирования растительного сырья, в основном принадлежат родам Lactobacillus и Leuconostoc .
Род Lactobacillus
Таксономические методы, которые вошли в широкое использование в 1980-х годах, были применены к определению и идентификации микроорганизмов этого рода. В результате некоторые виды, ранее к нему относящиеся, в более поздних изданиях Определителя бактерий Берджи были перемещены в другие роды [5].
Микроорганизмы, относящиеся к данному роду, представляют собой грамположительные каталазоотрицательные палочки, которые часто встречаются в длинных цепочках. Хотя те бактерии, что обнаруживаются в пищевых продуктах – типичные микроаэрофилы, большинство штаммов – истинные анаэробы, особенно обитающие в толстом кишечнике и рубце. Они в большинстве случаев, если не всегда, встречаются на овощах, наряду с некоторыми другими молочнокислыми бактериями [5].
Род Leuconostoc
Микроорганизмы этого рода – грамположительные, каталазоотрицательные кокки, которые являются гетеро-ферментативными [5].
В практике промышленной переработки как правило применяют закваски – основные стартовые культуры, – которые могут состоять как из монокультур, так и консорциума штаммов [5].
Leuconostoc mesenteroides, Lactobacillus plantarum и Leuconostoc fallax являются тремя основными молочнокислыми бактериями, развивающимися при производстве квашеной капусты. В естественном производстве соленых огурцов принимают участие следующие молочнокислые бактерии (в порядке увеличения распространённости): L. mesenteroides, E. faecalis, P. cerevisiae, L. brevis и L. plantarum [5].
Процесс производства ферментированных пищевых продуктов, а также их характеристики определяются ферментирующей активностью используемых микроорганизмов [5]. Многие пищевые продукты (вызревшие сыры, кислая капуста и др.) являются консервированными продуктами: для них срок значительно увеличен по сравнению со сроком хранения сырья, из которого эти продукты изготавливаются. Их характерной чертой является не только высокая стабильность при хранении, но и ярко выраженный вкусо-ароматический букет, обусловленный прямым или косвенным действием ферментирующих микроорганизмов. Кроме того, для некоторых продуктов этой группы присущи повышенное содержание витаминов. В некоторых случаях ферментация снижает токсичность продуктов.
Термин «брожение» («ферментация») в прошлом имело много оттенков значения. Он вошёл в обиход до исследований вин Пастером. Prescott, Dunn и Doelle рассмотрели историю понятия «ферментация», и эти авторы отмечали, что в широком смысле, в котором термин обычно используется, это « … процесс, в котором химические превращения осуществляются в органическом веществе под действием ферментов, вырабатываемых микроорганизмами … ». С биохимической точки зрения брожение (ферментация) – метаболический процесс, в котором углеводы и родственные им соединения частично окисляются с высвобождением энергии при отсутствии какого-либо внешнего акцептора электронов. Конечный акцептор электронов – органические соединения, синтезирующиеся непосредственно при распаде углеводов. Следовательно, происходит неполное окисление исходных компонентов, и в процессе высвобождается только небольшое количество энергии. Продукты ферментации состоят из небольшого числа органических соединений, которые имеют меньшую молярную массу, чем исходные [5].
Микробиологические методы консервирования плодов и овощей основаны на образовании естественных консервантов — молочной кислоты и спирта, накапливающихся в результате сбраживания сахаров молочнокислыми бактериями или дрожжами [7]. Интенсивность молочнокислого брожения и количество накопившейся молочной кислоты зависят от нескольких условий: наличия молочнокислых бактерий, содержания сахаров и других химических веществ в сырье, добавления пряноароматических растений, анаэробных условий, температуры. Благодаря накоплению молочной кислоты приостанавливается развитие других микроорганизмов, а затем и самих молочнокислых бактерий. Только дрожжи и плесени могут развиваться в кислых средах, но их жизнедеятельность ограничивают созданием анаэробных условий и добавлением поваренной соли. Количество накопившейся молочной кислоты
(0,7...2,5%) обусловлено наличием и активностью рас молочнокислых бактерий. При молочнокислом брожении, особенно при мочении плодов, содержащих значительное количество сахаров, может происходить спиртовое брожение под действием дрожжей [7].
На основании обширной генетической информации о микроорганизмах, участвующих в ферментации пищи стало возможно производить ферментированные продукты с не только специфичным вкусом и другими функциональными характеристиками, но также возможно придавать питательные свойства, которые приносят пользу потребителям [4]. Понимание изменений, происходящих в сельскохозяйственном сырье под действием консорциумов микроорганизмов, позволяет целенаправленно воздействовать на биохимические процессы, происходящие в сырье, и получать заданный функционально-программный продукт [8].
Производство квашеной капусты и многих других ферментированных овощей зависит от преемственности организмов, которые присутствуют в сырье. Некоторые появляются на ранней стадии в процессе ферментации, выполняют конкретную функцию, а затем исчезают из продукта. Другие организмы, напротив, появляются позже в ферментации, а затем остаются на умеренном и высоком уровнях в течение всего ферментационного и пост-фер-ментационного процесса. Однако, рост этих организмов в большей степени зависит от условий, какие им создали первые микроорганизмы. Т.е. успех основного этапа ферментации зависит от того, насколько эффективно прошел предферментативный этап [4].
Lactobacillus plantarum часто спонтанно встречаются в больших количествах в продуктах, прошедших молочнокислое брожение, особенно если продукт – на основе растительного сырья, например, в квашеной капусте, солёных огурцах [9]. Квашеная капуста – продукт ферментации свежей капусты. Стартовой культурой для производства квашеной капусты обычно служит нативная смешанная микробиота капусты. Добавление 2,25- 2,5% соли ограничивает рост и активность грамотрицательных бактерий, тогда как молочнокислые палочки и кокки развиваются беспрепятственно [5].
Учитывая важность проведения двухстадийной ферментации овощного сырья с тем, чтобы на первом этапе создать оптимальные условия для развития «основного» пула молочнокислых микроорганизмов, актуальным становится проведения комплекса исследований, направленных на воспроизведения «природоподобного» процесса, в котором на первом этапе основную роль играют бактерии рода Leuconostoc mesenteroides, на втором – монокультуры молочнокислых микроорганизмов и их консорциумы.
Цели и задачи:
Исследование динамики развития молочнокислых микроорганизмов и их консорциумов на модельных средах, прошедших предварительную обработку культурой вида Leuconostoc mesenteroides, на основном этапе ступенчатого ферментирования белокочанной капусты сорта «Парус». Исследование динамики развития монокультур L. brevis, L. casei и L. plantarum и их парных консорциумов на основной технологической стадии при двухстадийном процессе ферментирования белокочанной капусты сорта Парус.
Материалы и методы
В качестве объектов исследований были взяты:
– штаммы микроорганизмов рода Leuconostoc mesen-teroides, Lactobacillus brevis, Lactobacillus casei и Lactobacillus plantarum , предоставленные ФГУП ГосНИИгенетика;
– стерилизованная модифицированная модельная среда на основе белокочанной капусты сорта «Парус».
Модельную среду готовили последовательными операциями, включающими мойку сырья проточной водой, шинкование на полоски толщиной не более 8 мм, гомогенизацию на измельчителе растительного сырья до получения однородной кашицеобразной массы. В полученную массу вносили NaCl в количестве 1,5% от массы среды и перемешиванием до полного растворения. Среду фасовали в стеклянные банки объёмом 0,1 дм3 с винтовым типом укупорки, герметично укупоривали и стерилизовали при избыточном давлении 1 бар в течение 20 мин с последующим охлаждением до комнатной температуры, затем в стерильных условиях добавляли аскорбиновую кислоту в количестве 35 мг на 100 г среды, перемешивали до полного растворения и вторично укупоривали также в стерильных условиях.
Процесс ферментации осуществляли в два последовательных этапа. На первом (предварительном) этапе модельную среду инокулировали суспензией L. mesenteroides с концентрацией микроорганизмов 104 КОЕ/г в количестве 1,76% от массы среды и инкубировали в чашках Петри при температуре 23...25°С в течение 72 ч. На втором (основном) этапе в подготовленные среды вносили инокулят монокультур (штаммы L. brevis, L. casei и L. plantarum ) и консорциумов (« L. brevis + L. casei », « L. brevis + L. plantarum » и « L. plantarum + L. casei ») молочнокислых микроорганизмов с общей концентрацией 104 КОЕ/г в количестве 2% от массы среды. Основной этап ферментации проводили при температуре +25°С в течение 32 суток. Отбор проб на основной стадии ферментации проводили как в контрольном варианте с L. mesenteroides через 0, 1, 2, 3, 7 и 10 суток, так и в вариантах с культурами Lactobacillus и их консорциумами через 0, 3, 7, 8, 9, 14, 18, 23 и 32 суток, отсчитывая с момента начала первой стадии ферментирования. В силу объективного присутствия в начальный период основного этапа ферментации некоторой остаточной концентрации практически неактивных клеток микроорганизмов L. mesenteroides , общий микробиологический состав сред после внесения монокультур лактобацилл рассматривали как псевдоконсорциумы, в отличие и истинных консорциумов, образуемых при внесении одновременно двух монокультур лактобацилл.
Определение скорости культивирования микроорганизмов проводили путём контроля концентрации микроорганизмов в модельной среде в процессе культивирования в точках отбора проб на протяжении всего процесса ферментации путем посева в агаризованную питательную среду разведений отобранного образца. Посевы инкубировали при температуре 30°С в течение 72/120 часов с последующим подсчётом общего количества всех видимых колоний.
Для уменьшения статистической погрешности, каждый эксперимент проводили в трёхкратной повторности с отбраковкой статистически недостоверных данных.
Отбор проб при исследовании первого этапа ферментации с культурой L.mesenteroides проводили на 0-3-4-56-7 сутки. Отбор проб при исследовании второй стадии ферментации с культурами Lactobacillus и их консорциумами проводили для каждой культуры и консорциума по истечении 0, 3, 7, 8, 9, 14, 18, 23 и 32 суток ферментирования, отсчитывая с момента инокуляции.
Для предотвращения контаминации исследуемых образцов сторонней микрофлорой, отбор проб проводили в боксе стерильными инструментами. Образцы отбирали в одноразовые чашки Петри по 1 г для микробиологических исследований.
Концентрацию молочнокислых микроорганизмов определяли по [10, 11]. Определение проводили путем посева в агаризованную питательную среду разведений отобранных проб, инкубирования посевов при температуре 30°С в течение 72/120 часов и подсчёта всех видимых колоний.
Математическую обработку и моделирование проводили с использованием табличного процессора Microsoft Excel 2010 (Microsoft Corporation) с установленными надстройками «Анализ данных», «Поиск решения» и «Подбор параметра», а также специализированного программного обеспечения – TableCurve 2D v.5.01 (SYSTAT Software Inc.) и Wolfram Mathematica v.10.4 (Wolfram Research Inc.)
Обработку экспериментальных данных проводили по следующему алгоритму:
-
а) отсеивали статистически ненадёжные экспериментальные данные в повторностях по существующим методикам;
-
б) массив данных, представляющих динамику исследуемого или промежуточного показателя, аппроксимировали двухфакторными функциями вида при следующих граничных условиях:
– квадрат коэффициента корреляции должен быть не менее 0,96;
– вид аппроксимирующей функции должен подчиняться логике процесса (также и при экстраполяции);
– коэффициенты и константа должны быть значимы по критерию Стьюдента при α ≤ 0,05;
– вся функция в целом должна быть адекватна по критерию Фишера при α ≤ 0,05.
Результаты
Анализ экспериментальных данных показал, что функциональные зависимости, наиболее адекватно аппроксимирующие экспериментальные данные, имеют вид:
Характеристики аппроксимирующих функций для каждого варианта исследований представлены в таблице 2.
1g ^ = exp
a + cT
1 + br+d-T2
где
N- концентрация микроорганизмов, КОЕ/г г- продолжительность ферментации, ч а - константа b, c.dwf- коэффициенты
-для псевдоконсорциума L mesenteroides \ L. brevis:
1g ^ = exp
- для псевдоконсорциума L mesenteroides \ L. casei:
lg W--
1 + ехр
а
- для псевдоконсорциума L mesenteroides \ L. plantarum:
lg?/ = exp
- для консорциума L mesenteroides \ L. brevis * L. casei:
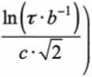
\gN-yerfc -
-
- для консорциума L mesenteroides \ L. brevis +I. plantarum: IgN = ехр^а+Ь-т+с-т2 + -tj
-
- для консорциума I. mesenteroides \ L. casei ♦ L. plantarum: \gN-ехр^а+Ь-т + с-т2 +dr3 + f‘tA^
На рисунках 1-3 приведены зависимости концентрации микроорганизмов (в псевдоконсорциумах) и их консорциумов от продолжительности ферментации, а также аддитивные функции концентрации микроорганизмов в
Таблица 2. Характеристики аппроксимирующих функций по вариантам исследований Table 2. Characteristics of approximating functions by research options
|
Монокультуры |
||||||
|
микроорганизмов |
Константа и коэффициенты / Constant and coefficients |
|||||
|
и их консорциумы / |
||||||
|
Monocultures |
||||||
|
microorganisms |
a |
b |
c |
d |
e |
f |
|
and their consortia |
||||||
|
Предварительное ферментирование |
||||||
|
L. mesenteroides |
8,5321 |
7,2456 ‧ 10-2 |
2,1652 |
5,32275 ‧ 10-4 |
||
|
Основное ферментирование |
||||||
|
псевдоконсорциумы |
||||||
|
L. mesenteroides \ L. casei |
8,275 ‧ 107 |
84,49217 |
-2,84546 |
|||
|
L. mesenteroides \ L. brevis |
18,4623 |
-5,9596 ‧ 10-3 |
-0,1282 |
1,01265 ‧ 10-5 |
||
|
L. mesenteroides \ L. plantarum |
18,8891 |
0,11826 |
1,59107 |
-3,4402 ‧ 10-4 |
-2,325 ‧ 10-3 |
3,6857 ‧ 10-7 |
|
консорциумы |
||||||
|
L. mesenteroides \ L. brevis, L. casei |
1,635 ‧ 108 |
77,4505 |
-0,1036 |
|||
|
L. esenteroides \ L. brevis + L. plantarum |
19,1225 |
-4,7869 ‧ 10-2 |
2,6164 ‧ 10-4 |
-3,2199 ‧ 10-7 |
||
|
L. mesenteroides \ L. casei + L. plantarum |
18,4695 |
-3,7658 ‧ 10-2 |
2,415 ‧ 10-4 |
-4,0243 ‧ 10-7 |
1,330 ‧ 10-10 |
|
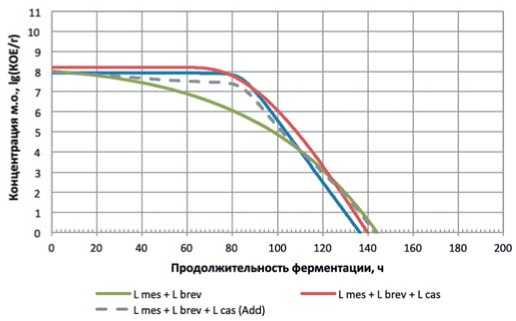
Рис. 1. Зависимость концентрации микроорганизмов и их консорциумов от продолжительности ферментации Псевдоконсорциумы: L mes + L casei –L mes + L brev – L. mesenteroides \ L. brevis; консорциум: L mes + L brev + L cas – L. mesenteroides \ L. brevis + L. casei; L mes + L brev + L cas (Add) – аддитивная зависимость
Fig. 1. The dependence of the concentration of microorganisms and their consortia on the duration of fermentation
Продолжительность ферментации, ч
— L mes ♦ L plan —— L mes ♦ L cas
““““ L mes ♦ L cas ♦ L plan — — L mes ♦ L cas ♦ L plan (Add)
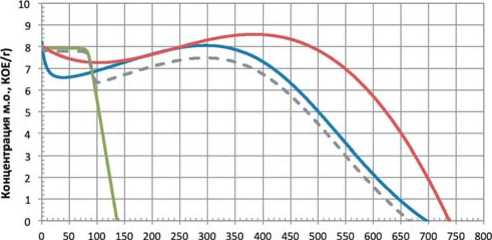
Рис. 3. Зависимость концентрации микроорганизмов и их консорциумов от продолжительности ферментации
Псевдоконсорциумы: L mes + L plan – L. mesenteroides \ L. plantarum; L mes + L cas – L. mesenteroides \ L. casei; консорциум: L mes + L cas + L plan – L. mesenteroides \ L. casei + L. plantarum; L mes + L cas + L plan (Add) – аддитивная зависимость
Fig. 3. The dependence of the concentration of microorganisms and their consortia on the duration of fermentation
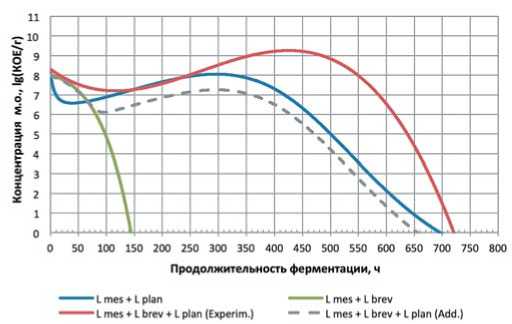
Рис.2. Зависимость концентрации микроорганизмов и их консорциумов от продолжительности ферментации
Псевдоконсорциумы: L mes + L plan – L. mesenteroides \ L. plantarum; L mes + L brev – L. mesenteroides \ L. brevis; консорциум: L mes + L brev + L plan – L. mesenteroides \ L. brevis + L. plantarum; L mes + L brev + L plan (Add) – аддитивная зависимость
Fig. 2. The dependence of the concentration of microorganisms and their consortia on the duration of fermentation
консорциумах.
Начало отсчёта продолжительности основной ферментации соответствовало моменту времени внесения инокулята целевых культур рода Lactobacillus в субстрат, прошедший этап предварительной ферментации культурой L. mesenteroides .
Анализ результатов экспериментальных данных показывает, что условия модельной среды, модифицированной на этапе предварительной ферментации, являются относительно неблагоприятными для развития микроорганизмов рода L. brevis , концентрация которых сравнительно быстро снижается, начиная с момента инокуляции.
Для микроорганизмов рода L. casei характерно наличие выраженной лаг-фазы, после чего, предположительно, условия среды оказываются окончательно неблагоприятны для их жизнедеятельности, что характеризуется практически линейной динамикой убывания концентрации. Тем не менее, концентрации обеих культур в составе псевдоконсорциумов сходит на нет по истечении 136–144 часов ферментации. Примечательно, что динамика концентрации консорциума « L. mesenteroides \ L. brevis + L.
casei» практически идентична таковой для L. casei, что указывает на доминирование последнего. В отличие от предыдущих двух культур, микроорганизмы рода L. plantarum по прошествии некоторой фазы угнетения в течение первых 40 часов культивирования демонстрировали уверенный прирост концентрации в течение следующих 260-270 часов культивирования. При этом, несмотря на в целом негативную динамику развития L. brevis и L. casei в составе псевдоконсорциумов, совместное культивирование этих культур с L. plantarum благотворно сказался как на динамике развития таких консорциумов, достигая пика по истечении ~ 400 (L. mesenteroides \ L. brevis + L. plantarum) и ~ 460 (L. mesenteroides \ L. casei + L. plantarum) часов основного ферментирования. При этом сам пик в консор- циумах на 0,5-1,2 порядка превышал пиковую концентрацию L. plantarum в составе псевдоконсорциума.
Выводы
Установлено, что предварительное ферментирование модельной среды культурой Leuconostoc mesenteroides формирует неблагоприятные условия для развития L. brevis и L. casei как в монокультуре (псевдоконсорциуме), так и при в консорциуме друг с другом, но благоприятные условия для развития L. plantarum как в псевдоконсорциуме, так и в парных сочетаниях с L. brevis и L. casei .
Об авторах:
Vladimir V. Kondratenko – Deputy Director for Science,
Candidate of Technical Sciences (Ph.D.)
Nataliya E. Posokina – Head of the laboratory,
Candidate of Technical Sciences (Ph.D.)
Jeanne A. Semenova – Researcher
Vladimir I. Tereshonok – Senior Researcher, Cand. Sci.
(Agriculture)
-
• Литература
-
1. Огнева О.А. Разработка технологий фруктово-овощных продуктов с бифи-догенными свойствами. Автореферат диссертации на соискание учёной степени кандидата технических наук. – Краснодар, СКЗНИИСиВ, 2015. 24с.
-
2. Дрофичева Н.В. Разработка технологии производства многокомпонентных функциональных продуктов питания на основе плодового сырья. Автореферат диссертации на соискание учёной степени кандидата технических наук. Краснодар, СКЗНИИСиВ, 2013. 24 с.
-
3. Выщепан А.Г., Мельман М.Е. Физико-химические основы соления и квашения овощей. М.: Госторгиздат, 1952. 158 с.
-
4. Hutkins R.W. Microbiology and technology of fermented foods. IFT Press Blackwell Publishing, 2006. 473 р.
-
5. Джей Дж.М., Ллсснер М.Дж., Гольден Д.А. Современная пищевая микробиология. Пер. 7-го англ. изд. М.: БИНОМ - Лаборатория знаний, 2017. 886 с.
-
6. Емцев В.Т., Мишустин Е.Т. Микробиология: учебник для бакалавров. 8-е изд., испр. и доп. М.: Издательство Юрайт, 2012. 445 с.
-
7. Широков Е. П., Полегаев В. И. Хранение и переработка продукции растениеводства с основами стандартизации и сертификации. Часть 1. Картофель, плоды, овощи. М.: Колос, 2000. 254 с.
-
8. Хорольский В.В., Митасева Л.Ф., Габараев А.Н., Машенцева Н.Г. Ким Д.В. Разработка технологии пищевых продуктов на основе нестандартного сельскохозяйственного сырья, биотрансформированного консорциумами микроорганизмов. Пища. Экология. Человек: Материалы пятой международной научно-технической конференции. М.: МГУПБ, 2003. С.55-56.
-
9. Yu-Long Zh.; Ping H.; Jian-Long Zh. Research of fermented sauerkraut and its advancement. Journal of Food Safety and Quality. 2014;5(12):3998-4003.
-
10. ГОСТ 10444.11-2013 (ISO 15214:1998) Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета количества мезофильных молочнокислых микроорганизмов. М.: Стандартинформ, 2014. 23 с.
-
11. ГОСТ ISO 7218-2015 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям. М.: Стандартинформ, 2015. 70 с.
-
-
• References
-
1. Ogneva O.A. Development of technologies for fruit and vegetable products with bifidogenic properties. Abstract of dissertation for the degree of candidate of technical sciences. - Krasnodar, SKZNIISiV, 2015. 24 р. (In Russ.)
-
2. Droficheva N.V. Development of technology for the production of multicomponent functional food products based on fruit raw materials. Abstract of dissertation for the degree of candidate of technical sciences. Krasnodar, SKZNIISiV, 2013. 24 р. (In Russ.)
-
3. Cleaved A.G., Melman M.E. Physico-chemical basis of salting and pickling vegetables. M.: Gostorgizdat, 1952. 158 p. (In Russ.)
-
4. Hutkins R.W. Microbiology and technology of fermented foods. IFT Press Blackwell Publishing, 2006. 473 р.
-
5. Jay J.M., Lцssner M.J., Golden D.A. Modern food microbiology. M.: BINOM -Laboratory of Knowledge, 2017. 886 p. (In Russ.)
-
6. Yemtsev V.T., Mishustin E.T. Microbiology: a textbook for bachelors. 8th ed., Rev. and add. M.: Publishing house Yurayt, 2012. 445 p. (In Russ.)
-
7. Shirokov E.P., Polegaev V.I. Storage and processing of crop products with the basics of standardization and certification. Part 1. Potatoes, fruits, vegetables. M.: Kolos, 2000. 254 p. (In Russ.)
-
8. Khorolsky V.V., Mitaseva L.F., Gabaraev A.N., Mashentseva N.G., Kim D.V. Development of food technology based on non-standard agricultural raw materials, biotransformed by consortia of microorganisms. Food. Ecology. Man: Proceedings of the Fifth International Scientific and Technical Conference. M., 2003. P.55-56. (In Russ.)
-
9. Yu-Long Zh.; Ping H.; Jian-Long Zh. Research of fermented sauerkraut and its advancement. Journal of Food Safety and Quality. 2014;5(12):3998-4003.
-
10. GOST 10444.11-2013 (ISO 15214: 1998) Microbiology of food and animal feed. Methods for identifying and counting the number of mesophilic lactic acid microorganisms. M.: Standartinform, 2014. 23 p. (In Russ.)
-
11. GOST ISO 7218-2015 Microbiology of food and animal feed. General requirements and recommendations for microbiological research. M.: Standartinform, 2015. 70 p. (In Russ.)
-
Список литературы Исследования динамики развития молочнокислых микроорганизмов при двухстадийном процессе ферментирования капусты белокочанной сорта Парус
- Огнева О.А. Разработка технологий фруктово-овощных продуктов с бифидогенными свойствами. Автореферат диссертации на соискание учёной степени кандидата технических наук. - Краснодар, СКЗНИИСиВ, 2015. 24с.
- Дрофичева Н.В. Разработка технологии производства многокомпонентных функциональных продуктов питания на основе плодового сырья. Автореферат диссертации на соискание учёной степени кандидата технических наук. Краснодар, СКЗНИИСиВ, 2013. 24 с.
- Выщепан А.Г., Мельман М.Е. Физико-химические основы соления и квашения овощей. М.: Госторгиздат, 1952. 158 с.
- Hutkins R.W. Microbiology and technology of fermented foods. IFT Press Blackwell Publishing, 2006. 473 р.
- Джей Дж.М., Ллсснер М.Дж., Гольден Д.А. Современная пищевая микробиология. Пер. 7-го англ. изд. М.: БИНОМ - Лаборатория знаний, 2017. 886 с.
- Емцев В.Т., Мишустин Е.Т. Микробиология: учебник для бакалавров. 8-е изд., испр. и доп. М.: Издательство Юрайт, 2012. 445 с.
- Широков Е. П., Полегаев В. И. Хранение и переработка продукции растениеводства с основами стандартизации и сертификации. Часть 1. Картофель, плоды, овощи. М.: Колос, 2000. 254 с.
- Хорольский В.В., Митасева Л.Ф., Габараев А.Н., Машенцева Н.Г. Ким Д.В. Разработка технологии пищевых продуктов на основе нестандартного сельскохозяйственного сырья, биотрансформированного консорциумами микроорганизмов. Пища. Экология. Человек: Материалы пятой международной научно-технической конференции. М.: МГУПБ, 2003. С.55-56.
- Yu-Long Zh.; Ping H.; Jian-Long Zh. Research of fermented sauerkraut and its advancement. Journal of Food Safety and Quality. 2014;5(12):3998-4003.
- ГОСТ 10444.11-2013 (ISO 15214:1998) Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета количества мезофильных молочнокислых микроорганизмов. М.: Стандартинформ, 2014. 23 с.
- ГОСТ ISO 7218-2015 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям. М.: Стандартинформ, 2015. 70 с.


