История трансплантации почки
Автор: Каабак М.М., Яремин Б.И.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Общественное здоровье, организация здравоохранения
Статья в выпуске: 1 т.15, 2025 года.
Бесплатный доступ
Статья посвящена истории становления трансплантации почки как медицинской технологии, охватывающей три ключевых этапа: период осознания, формирования и становления. В работе подробно рассмотрены эволюция представлений о функции почек, начиная с древних времен, и развитие методов заместительной почечной терапии, включая диализ и первые эксперименты по трансплантации. Особое внимание уделено вкладу ученых и хирургов, таких как Эмерих Ульман, Алексис Каррель, Юрий Вороной и Джозеф Мюррей, в разработку хирургических техник и преодоление иммунологических барьеров. Описаны ключевые достижения в области консервации органов, тканевой иммунологии и иммуносупрессии, которые сделали возможными успешные аллотрансплантации. Отдельно освещена история развития трансплантологии в России, включая первые эксперименты В.П. Демихова и успешные клинические операции под руководством Б.В. Петровского. Статья подчеркивает, что современная трансплантация почки является результатом многовековых усилий множества исследователей, чьи работы заложили основы для спасения тысяч жизней.
Трансплантация почки [d007682), история медицины [d006666), заместительная почечная терапия [d012078], диализ [d003968], иммуносупрессия [d007165], сохранение тканей и органов [d014001], трансплантационная иммунология [d014181], аллотрансплантаты [d000437], ксенотрансплантация [d020170], гистосовместимость [d006660], трансплантация, гомологичная [d014181]
Короткий адрес: https://sciup.org/143184373
IDR: 143184373 | УДК: 616.61-089.843:61(091) | DOI: 10.20340/vmi-rvz.2025.1.OZOZ.1
Текст научной статьи История трансплантации почки
Competing interests. B.I. Yaremin is the executive secretary of the editorial board of the journal, M.M. Kaabak is a member of the editorial board of the journal. They did not take part in the decision to publish the work.
Financing. The study was conducted without sponsorship.
Любая история становления новой хирургической технологии написана множеством людей, которые искали и иногда по наитию вносили вклад, который порой стоит больше тех, кому довелось всё-таки стать первыми. Трансплантация почки не была продумана и разработана одним человеком, многие авторы и школы в разных странах мира развивали технологии лечения заболеваний почек и тем самым приблизили появление того стабильного и эффективного вида медицинской помощи, которым является трансплантация почки сегодня. Их жизни, их беспрецедентные усилия позволяют сохранять и продлевать тысячи жизней.
В развитии любой медицинской технологии можно выделить три принципиальных этапа – период осознания, период формирования, период становления.
Период осознания
Эволюция представления о строении и функции почки
Древнее описание почек можно найти в египетском папирусе, датированном 1550 годом AC и открытом немецким египтологом Георгом Эберсом (1837–1989). Он содержал наблюдения, сделанные древними врачами, и иллюстрации человеческих мумий с кистами и камнями в почках. В ходе обрядов мумификации древние египтяне удаляли все органы из тела, кроме сердца и почек. Считалось, что почка является средством суда в загробной жизни. Эту веру разделяли евреи Египта и описали в Древней Греции. Считалось, что две почки символизируют добро и зло; правая почка даёт человеку хороший совет, а левая почка — плохой. В загробной жизни почки и сердце будут исследоваться, чтобы решить судьбу души. Похожая концепция встречается в традиционной китайской медицине, где две почки символизируют баланс и гармонию, удерживают Инь и Ян тела, определяют жизнь и смерть и являются резервуаром энергии.
Древнегреческий врач Гиппократ Косский (460– 370 до н.э.) также описал заболевания и состояния почек и мочевого пузыря в своем Corpus Hippocraticum. Аристотель (387–322 до н.э.) описал анатомию почек человека на основе эмпирических наблюдений за рыбами и птицами. Гален Пергам-ский (130–201 гг. н.э.), один из самых известных греческих врачей и хирург императоров и гладиаторов, был первым, кто заметил, что основной функцией почек является выработка мочи. Он даже выдвинул идею, что почки функционируют как фильтр.
Несколько столетий спустя Орибасий (326–403 гг. н.э.), врач римского императора Юлиана Отступника, описал функцию почек в Collectiones Medicae. Он попытался описать почечное кровообращение, заявив, что почки поглощают мочу из крови, а также выделил мочеточники и уретру.
Феофил Протоспатарий (VI–VII в. AD) считался самым важным уроскопистом Византийской империи; даже император Ираклий хотел, чтобы он был придворным врачом. Ранние уроскописты исследовали мочу на цвет, мутность и осадок, чтобы диагностировать аномалии почек и мочевыводящих путей. По мере развития этой практики с помощью уроскопии также диагностировались такие состояния, как диабет, беременность и печёночная недостаточность. Теофил Протоспатарий написал De Urinis («О моче»), небольшую книгу, описывающую результаты исследования мочи и проблемы с почками у пожилых людей. Эти описания и практики использовались преподавателями западной медицины более 500 лет в известных медицинских школах, таких как Schola Medica Salernitana в Салерно, Италия.
Одним из самых выдающихся врачей в истории был Абу Али аль-Хусейн ибн-Абдулла ибн Сина, который жил в Персии с 980 по 1037 год нашей эры. Он вобрал в себя медицинские знания своих предшественников в древней Персии и Греции и расширил их собственными исследованиями. Его особое внимание уделялось анатомии брюшной полости и описанию пищеварительного аппарата и связанных с ним органов. Ибн Сина утверждал, что печень является основным метаболическим органом, и что продукты её деятельности фильтруются и выводятся почками в виде мочи. Он предположил, что, поскольку печень косвенно способствует выработке мочи, анализ мочи также может указывать на здоровье печени. Свои наблюдения он обобщил в знаменитом «Каноне медицины».
В эпоху Возрождения произошло много прорывов в анатомии и медицине. Андреас Везалий (1514–1564), считающийся отцом анатомии, записал 200 рисунков анатомических структур, включая почку, в своем шедевре De Humani Corporis Fabrica. В Болонье Марчелло Мальпиги (1628–1694), который ввел микроскопическую анатомию, написал и иллюстрировал документы об анатомическом строении почки. Мальпиги идентифицировал клубочки и почечные канальцы. Другие микроскопические структуры почек были идентифицированы позже Якобом Генле (1809–1885) и Уильямом Боуменом (1816–1892), которые сделали точные рисунки и подробные описания гистологических наблюдений за почками животных и человека.
Около 1820 года достижения в области клинической медицины были достигнуты Томасом Ходжкином (1798–1866), Томасом Аддисоном (1793–1860) и Ричардом Брайтом (1789–1858). Они внесли большой вклад в область нефрологии, работая в больнице Гая в Лондоне. Ричард Брайт, считающийся отцом современной нефрологии, организовал в больнице исследовательское отделение, где проводил аутопсии и описывал симптомы заболеваний почек. Первоначальное выделение болезней почек как независимого от других медицинских состояний заболевания многие приписывают книге Ричарда Брайта «Отчеты о медицинских случаях», вышедшей в 1827 году, в которой подробно описывались особенности и последствия болезни почек. В течение последующих 100 лет термин «болезнь Брайта» использовался для обозначения любого типа заболевания почек. Результаты исследований Брайта привели к широкому распространению практики анализа мочи на белок – одного из первых диагностических тестов в медицине. Изучение болезней почек продолжилось благодаря описанию Уильямом Хаушипом Дикинсоном острого нефрита в 1875 году и открытию Фредериком Акбаром Махомедом связи между болезнями почек и гипертонией в 1870-х годах. В XX веке такие исследователи, как Гомер Смит, раскрыли основную физиологию почек. Результаты исследований Смита привели к созданию важных методов лечения различных заболеваний почек.
В области физиологии Клод Бернар (1813–1878) описал как клетки организма сохраняют свою функцию благодаря постоянству среды, находящейся в окружающем внеклеточном жидкостном пространстве. Это состояние было названо Milieu Intérieur (внутренняя среда), теперь известное как гомеостаз и получившее развитие в трудах американского физиолога Уолтера Брэдфорда Кэннона (1871–1945).
В начале XX века все ещё не было ясно как секреция и реабсорбция могут происходить одновременно через эпителий почечных канальцев – теорию, которую Артур Робертсон Кушни защищал в своей монографии «Секреция мочи», опубликованной в 1917 году. Он также выяснил, что кислоты обнаруживаются в моче людей и других плотоядных животных, тогда как у травоядных моча была щелочной, если их не кормили белковой диетой.
Несомненно, развитие теории о строении и функции почек сформировало базу для последующей их трансплантации.
Идея заместительной почечной терапии и диализа Острая и хроническая почечная недостаточность, которая может привести к смерти, если её не лечить в течение нескольких дней или недель, известна с древних времён. В раннем Риме и позже, в средние века, лечение уремии включало использование горячих ванн, усиленного потоотделения, кровопускание и клизмы.
Первые научные описания идеи диализа датируются XIX веком и исходят от шотландского химика Томаса Грэма, который стал известен как «отец диализа». Сначала осмос и диализ стали популярны как методы, позволяющие отделять растворённые ве- щества или удалять воду из растворов через полупроницаемые мембраны в условиях лаборатории. Значительно опередив свое время, Грэм указал в своей работе на потенциальное использование этих процедур в медицине.
В 1913 году Абель, Раунтри и Тернер в эксперименте диализировали наркотизированных животных, направляя их кровь за пределы тела через трубки из полупроницаемых мембран, изготовленных из коллодия — материала на основе целлюлозы. Невозможно с уверенностью сказать, намеревались ли Абель и его коллеги с самого начала использовать эту процедуру для лечения почечной недостаточности. Георг Хаас провёл диализ первого пациента с почечной недостаточностью в Гиссенском университете летом 1924 года после серии подготовительных экспериментов. К 1928 году Хаас провёл диализ ещё шести пациентам, ни один из которых не выжил, вероятно, из-за критического состояния и недостаточной эффективности диализного лечения.
Осенью 1945 года Виллем Кольфф из Нидерландов использовал разработанную им вращающуюся барабанную почку для проведения недельного диализного лечения 67-летнего пациента, поступившего в больницу с острой почечной недостаточностью. Впоследствии пациент был выписан с нормальной функцией почек. Во вращающейся барабанной почке Кольффа использовались мембранные трубки, изготовленные из нового материала на основе целлюлозы, целлофана. Во время лечения заполненные кровью трубки были обернуты вокруг деревянного барабана, который вращался в растворе диализата.
В клинике Питера Брента Бригама в Бостоне эти машины были модифицированы и как искусственная почка Кольффа-Бригама в период с 1954 по 1962 год были отправлены из Бостона в 22 больницы по всему миру. Почка Кольффа-Бригама во время Корейской войны позволила улучшить среднюю выживаемость солдат, страдающих посттравматической почечной недостаточностью. В 1947 году Нильс Алвалл разработал модифицированный диализатор, который мог выполнять необходимую комбинацию диализа и ультрафильтрации лучше, чем оригинальная почка Кольффа. Целлофановые мембраны, используемые в этом диализаторе, выдерживают более высокое давление благодаря их расположению между двумя защитными металлическими решетками. Все мембраны находились в герметично закрытом цилиндре, что позволяло создавать различные соотношения давлений.
Важным технологическим решением было создание Белдингом Скрибнером в 1960 году в США шунтов. Этот новый метод обеспечил относительно простой способ доступа к системе кровообращения пациента, который можно было использовать в тече- ние нескольких месяцев, а это означает, что пациентов с хронической болезнью почек впервые можно было лечить с помощью диализа. Шунт находился на небольшой пластине, которая прикреплялась к телу пациента, например к руке. Одну тефлоновую канюлю хирургическим путём имплантировали в вену, а другую — в артерию. Вне тела канюли соединились в петлю, шунт. Во время диализа шунт открывался и прикреплялся к диализатору. Дальнейшее развитие привело к появлению в 1962 году улучшенных шунтов, полностью изготовленных из гибких материалов. Тем не менее, самый решающий прорыв в области сосудистого доступа произошёл в 1966 году благодаря Майклу Брешиа и Джеймсу Чимино, разработавших идею нативной артериовенозной фистулы. Эта разработка позволила проводить длительное лечение пациентов с хронической почечной недостаточностью. Весной 1960 года Скрибнер имплантировал шунт американцу Клайду Шилдсу в Сиэтле. Шилдс стал первым хроническим пациентом, находящимся на гемодиализе, и лечение диализом позволило ему прожить ещё одиннадцать лет, прежде чем он умер от болезни сердца. Эти успехи заложили благодатную основу для первой в мире программы хронического гемодиализа, которая в последующие годы была создана в Сиэтле.
Таким образом были сформированы представления об острой и хронической почечной недостаточности и появилось осознание необходимости замещения утраченной почечной функции.
Период формирования
Неудачные эксперименты
Экспериментальная база трансплантаций почки основана на исследованиях физиолога Зигмунда фон Экснера (1846–1926) и его сына, хирурга Альфреда фон Экснера-Эвартена (1875–1931). Однако оба потерпели неудачу из-за проблемы сосудистого анастомоза. Ещё в 1895 году они проводили эксперименты на кроликах в Институте физиологии в Вене.
Альфред фон Декастелло-Рехтвер (1872–1960) участвовал в подобных попытках в 1899 году, независимо от Экснера. Фон Декастелло проводил аллотрансплантацию на собаках, также используя сосудистый шов, разработанный Пайром. Почки вырабатывали мочу, богатую альбумином. Из-за несостоятельности анастомоза животное погибло через 40 часов в результате кровотечения в брюшную полость.
Удачный эксперимент
История экспериментальной трансплантации почки начинается 7 марта 1902 года в зале заседаний Общества врачей в Вене. Австро-венгерский хирург Эмерих Ульман (1861–1937) сообщает о пересадке собачьей почки из её первоначального положения на шею. Анастомоз почечных артерий был сформирован с сонной артерией, почечная вена была анастомозирована с v. jugularis externa. Конец мочеточника был открыт наружу на шею животного и выделял мочу в течение 5 дней до смерти животного. Для анастомоза Ульман использовал небольшие магниевые трубки – распространённый в то время способ соединения сосудов. Живая собака была продемонстрирована в большом лекционном зале Венского общества врачей, а оригинальная лекция Ульмана была опубликована в «Венском клиническом еженедельнике» 13 марта 1902 года. В том же году, 27 июня 1902 года, он также выполнил первую ксенотрансплантацию, пересадив почки собаки козе. Хирург Рудольф Штих (1875–1960) первым в Германии воспроизвёл эксперименты на животных по сосудистому анастомозу Карреля и Жабуле с 1907 года. Между 1909 и 1910 годами берлинский хирург Эрнст Унгер (1875–1938) выполнял пересадку почек между собаками разных пород. К 1910 году Унгер выполнил более 100 трансплантаций. Он пересаживал почки на шею, а также подвздошные сосуды. Многие из этих трансплантатов (в том числе и аллогенные) поначалу работали, но все они через какое-то время погибали.

Рисунок 1. Эмерих Ульман. Из коллекции Венского медицинского университета. По Hatzinger, M., Stastny, M., Grützmacher.
Figure 1. Emerich Ullmann. From the collection of the Medical University of Vienna. After Hatzinger, M., Stastny, M., Grützmacher.
Алексис Каррель (1873–1944) начал эксперименты по оптимизации сосудистого шва с целью выполнения сложных трансплантаций органов в Лионе (Франция) в 1901 году. Из-за политической позиции и участия в экспертизе исцеления Марии Байи в Лурде, вызвавшего скандал, Каррель был вынужден покинуть Лион, переехать в Париж, оттуда – в Монреаль, оттуда – в Чикагский университет, а оттуда – в Университет Джонса Хопкинса и в Институт Рокфеллера. Именно это обессмертило его имя, так как в США он нашёл двух соавторов. С Чарльзом Гатри (1880–1963) он обнаружил, что искусственное охлаждение органов может уменьшить обмен веществ и, таким образом, сохранить органы на более длительный срок, с ним же он детально отработал технику прецизионного сосудистого шва. В 1908 году, когда Каррель аностомозировал сердце собаки с шейными сосудами другой собаки, он хотел лишь продемонстрировать практичность своих сосудистых швов. Тем не менее, он стал первым, кто пересадил сердце в эксперименте, длившемся в течение 2 часов. С 1908 года он работал в Рокфеллеровском институте в Нью-Йорке вместе с Чарльзом Линдбергом (1902–1974), в частности над разработкой аппаратной перфузии донорских органов. В знак признания его новаторской медицинской работы в области разработки сосудистых швов, трансплантации сосудов и органов ему была присуждена Нобелевская премия по медицине в 1912 году. Успех Карреля в пересадке органов зависел не от нового метода наложения швов, а от использования тонких игл и шовного материала, его исключительного технического мастерства и его одержимости строгой асептикой.

Рисунок 2. Алексис Каррель ок. 1907 г. из коллекции Американской хирургической ассоциации. По По К.Ф. Баркеру, Д.Ф. Марк-манну.
Figure 2. Alexis Carrel ca. 1907, from the collection of the American Surgical Association. After K.F. Barker, D.F. Markmann.
Алексис Каррель был бесспорно гениальным врачом и учёным, однако его взгляды по улучшению человеческой расы и искоренению преступности были ультраправыми, он показал себя евгеником, не отрицающим эвтаназию для улучшения человеческой расы. Его возвращение во Францию и работа в 1941–1944 гг. в Министерстве здравоохранения режима Виши при маршале Петене (1856–1951) привела к тому, что во многих западных странах в настоящее время к Каррелю применяют политику отмены, его имя вымарывают из учебников, переименовывают ранее названные в его честь улицы и площади. Осуждая такие взгляды Карреля, необходимо отметить, что он не был признан пособником нацизма, не был фашистом или антисемитом, не участвовал в опытах на людях и прочих преступлениях нацистского режима. Его вклад в развитие трансплантологии бесспорен.
Подобного рода эксперименты проводил и Е.Г. Черняховский в Киеве в 1914 г. В Херсоне Ю.Ю. Вороной в экспериментах на собаках пересаживал собственную почку животного на правую сторону шеи, почечные артерию и вену соединял с общей сонной артерией и наружной яремной веной. Пластику кожи осуществлял с помощью двух лоскутов, выкроенных таким образом, чтобы они прикрывали трансплантат; мочеточник выводил наружу. Аутотрансплантат почки у собаки, оперированной Ю.Ю. Вороным, хорошо прижился, почка правильно функционировала, давность пересадки к моменту демонстрации составляла более 6 месяцев.
Эксперименты продолжились, и выживаемость животных стала увеличиваться. С 1908 по 1914 год уролог Йоханнес Хенрикус Заайер (1876–1932) проводил дальнейшие эксперименты в Лейдене. Он в основном экспериментировал на сосудистом анастомозе, и его группа сообщила о выживаемости 6 лет у трансплантированной собаки. Исследовательская группа в Лионе под руководством Эжена Виллара (1868–1953) и Луи Тавернье (1878–1951) добилась выживания трансплантированной собаки до 68 дней при хорошей функции трансплантата. Из той же клиники Морель (1880–1960) и Папин (1881–1947), в продолжение исследований Карреля и Жабуле, экспериментировали с карамельным анастомозом вместо обычного сосудистого анастомоза из магниевых трубочек по Пайру. Этот анастомоз должен рассосаться сам в послеоперационном течении, так как он состоял из сахара. Кроме того, была разработана специальная методика имплантации мочеточника в мочевой пузырь, так называемая пластырная техника.
Ксенотрансплантация почки человеку
Первая ксенотрансплантация целой почки человеку была выполнена в 1906 году Матье Жабуле (1860–1913) в Лионе. Он пересадил почку свиньи 49-летней женщине, страдающей болезнью Брайта с прогрессирующей почечной недостаточностью. Орган изъяли за 3 часа до пересадки. Жабуле пересадил орган в сгиб левого локтя и анастомозировал почечные сосуды с плечевой артерией и v. cephalica. Трансплантат работал всего несколько часов, и пациентка погибла через 3 дня. В ходе расширенной ксенотрансплантации Жа-буле пересадил почку козы в сгиб локтя 50-летней женщины. Жабуле трагически погиб в железнодорожной катастрофе в возрасте всего 53 лет, а Первая мировая война резко поставила крест на всех дальнейших исследованиях. Подобную попытку предпринял и Эмерих Ульман. Он пересадил свиную почку в сгиб левого локтя больного уремией – к сожалению, безуспешно.
В 1910 году Унгер пересадил обе почки от борне-оской обезьяны 21-летней пациентке с прогрессирующей почечной недостаточностью. Он расположил трансплантат в подвздошной ямке пациентки, анастомозировал сегменты аорты и полой полости с сосудами бедра. Устье мочеточника, а также часть стенки мочевого пузыря он анастомозировал на бедро. Пациентка погибла через 32 часа от отёка лёгких, и Унгер пришёл к выводу, что между человеком и человекообразными обезьянами должен существовать некий биохимический барьер, который предотвратит неудачу трансплантации. Столь же неудачной, как и ксенотрансплантация Унгера, была пересадка почки обезьяны человеку берлинским хирургом Шёнштад-том (1880–1939) в 1913 году. Он пересадил орган на руку молодой девушке с почечной недостаточностью после отравления ртутью. Трансплантат произвёл всего несколько капель мочи, содержащей белок, а затем погиб. Пациентка скончался через несколько часов после этой операции.
Неудачные аллотрансплантации почки
В 1933 году была выполнена первая аллотрансплантация почки от посмертного донора, а в 1936 году она была опубликована в испанском журнале El Siglo Medico. Советский хирург Юрий Вороной (1895–1961) 3 апреля 1933 г. трансплантировал почку, изъятую из трупа 60-летнего мужчины через 6 часов после смерти от черепно-мозговой травмы, 26-летней пациентке с острой почечной недостаточностью, развившейся вследствие отравления сулемой. Почка была пересажена на переднемедиальную поверхность правого бедра в его средней трети на бедренные артерию и вену. Данная попытка имела многие факторы, приведшие к неудаче, – несовместимость по АВО, донор имел группу крови B+, реципиент O+, аллотрансплантат был под угрозой из-за остаточного риска острого отравления ртутью (в результате попытки самоубийства), которое вызвало почечную недостаточность реципиента. Аллотрансплантат не выделял мочи в течение 48 часов посттрансплантационной выживаемости пациента.
С трансплантированной почкой больная прожила двое суток. С помощью техники наложения сосудистых швов Карреля он пересадил трупную почку в сосуды правого бедра. Цель трансплантации состояла в том, чтобы преодолеть острую почечную недостаточность до тех пор, пока собственный орган пациента не восстановится. Вороной полагал, что блокада иммунной системы, вызванная отравлением ртутью, приведёт к лучшему принятию аллотрансплантата. После того, как почки первоначально восстановили диурез, после переливания крови развилась органная недостаточность, и пациентка умерла через 48 часов после операции. Безуспешной оказалась и пересадка трупной почки в 1945 г. американцами Эрнестом Карлом Ландштейнером (1917–2007) и Чарльзом Хафнагелем (1916–1989) на плечо пациента.

Рисунок 3. Матье Жабуле и коллеги (1903). По Hatzinger, M., Stastny, M., Grützmacher.
Figure 3. Mathieu Jaboulet and colleagues (1903). After Hatzinger, M., Stastny, M., Grützmacher.

Рисунок 4. Ю.Ю. Вороной с коллегами. 1930 годы
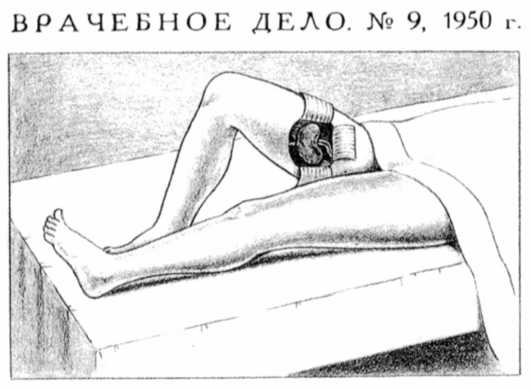
Рисунок 5. Схема операции Ю.Ю. Вороного
Аллотрансплантации почки с временным эффектом Реализуя описанную ранее концепцию, в Бостоне в 1945 году Дэвид Хьюм (1917–1973) пересадил трупную почку в локтевую ямку пациента с острой почечной недостаточностью из-за септического шока. Трансплантированный орган функционировал в течение 4 суток и, таким образом, смог преодолеть острую почечную недостаточность и спасти пациента. Решающий технический прорыв произошёл с операцией американца Ричарда Х. Лоулера (1895– 1982). 17 июня 1950 г. он выполнил первую операцию по пересадке почки, которая, по крайней мере, была временно успешной. 44-летней пациентки была трансплатирована почка пациента, который умер от цирроза печени. Трансплантат функционировал в течение 53 дней и был удалён хирургическим путём через 10 месяцев.
Великие французские хирурги с 1950 по 1953 год предприняли большую серию попыток трансплантации почки, обеспечивших кратковременную функцию. Рене Кюсс (1913–2006), Шарль ДюБост (1914–1991) и Жан Гамбургер (1909–1992) в Париже, а также Марсо Сервелль (1912–2002) в Страсбурге реализовывали программы параллельно. Некоторые органы были взяты у живых доноров, у которых они изымались из-за других заболеваний, или это были органы преступников, приговорённых к смертной казни. Первая трансплантация от живого родственника была выполнена в Париже в 1952 году Луи Мишоном (1892–1973). Это была попытка спасти жизнь, в ходе которой мать пожертвовала почку своему сыну, которому пришлось удалить единственную почку после падения с лестницы. Трансплантат функционировал в течение 23 дней, потом погиб, как и реципиент.
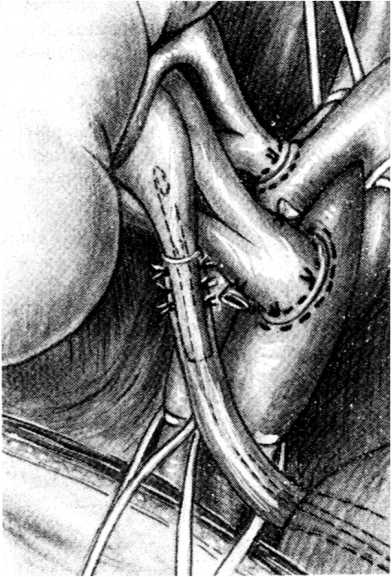
Рисунок 6. Французская техника трансплантации почки, Морис Ренар, Больница Неккер, 1952
Figure 6. French kidney transplant technique, Maurice Renard, Necker Hospital, 1952
В 1953 году французский хирург Жан Гамбургер (1909–1992) предпринял ещё одну попытку живого донорства почки у 16-летнего мальчика, который получил почку своей матери в больнице Necker в Париже. В 1955 г. Дэвид Хьюм (1917–1973) описал в общей сложности 9 неудачных аллогенных трансплантаций почек у человека в период с 1951 по 1953 гг. Органы были пересажены на бедро, так как Хьюм считал это место наиболее подходящим. Один пациент прожил чуть менее 6 месяцев, а у других четырёх пациентов почки возобновили работу. Среди прочего, 11 февраля 1953 года он пересадил трупную почку 26-летнему врачу с хроническим гломерулонефритом. Тем не менее, французские хирурги создали технику трансплантации почки, применяющуюся и сегодня.
Первые успешные аллотрансплантации почки между братьями/сестрами
Используя французскую технику, профессор Джозеф Эдвард Мюррей (1919–2012) в больнице Питера Бента Брихама в Бостоне выполнил первую успешную пересадку почки, имевшую эффект в долгосрочной перспективе. 23.12.1954 г. он пересадил почку братьям-близнецам Ричарду (1931–1963) и Рональду Херрикам (1931–2010). Бостонская группа использовала хирургическую технику, разработанную в Париже, при которой трансплантат имплантировали в подвздошную ямку, а мочеточник – в мочевой пузырь. Почка возобновила свою функцию через 82 минуты ишемии и функционировала отлично. Чтобы предотвратить ротацию трансплантата, почку зафиксировали в своём положении швами, а косые мышцы живота и фасцию зашили. Операция длилась в общей сложности 3,5 часа. Пациент быстро восстановился после операции и основного заболевания и смог выписаться на 37-й день после операции. Вскоре пациент смог вернуться к работе и завести семью. Он прожил 9 лет с нормальной функцией трансплантата, а затем скончался от инфаркта миокарда. К апрелю 1958 года в Бостонской больнице было проведено ещё 6 пересадок таким же образом между монози-готными близнецами. Мюррей был удостоен Нобелевской премии по медицине в Стокгольме в 1990 году вместе с Доналлом Томасом (1920–2012) «За открытия в области трансплантации органов и клеток как клинического метода лечения». Гордон Мюррей (1894–1976) в Торонто провёл первую успешную трансплантацию у разнояйцевых близнецов в 1959 году. Для иммуносупрессии применяли низкодозную лучевую и стероидную терапию. Пациент умер от сердечной недостаточности через 20 лет.
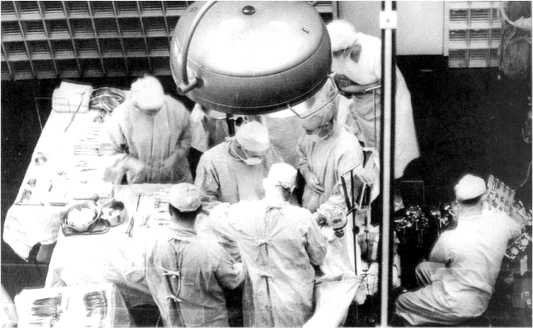
Рисунок 7. Первая трансплантация почки от живого родственного донора в клинике Бента Брихама. По К.Ф. Баркеру, Д.Ф. Марк-манну.
Figure 7. The first kidney transplant from a living related donor at the Bent Brigham Hospital. After K. F. Barker, D. F. Markmann.
В 1960 году Рене Кюсс (1913–2006) и Марсель Ле-грейн (1923–2003) провели первые три успешные трансплантации между братьями и сестрами в Сю-рене. Этому предшествовало тотальное облучение тела в общей дозе 400 Гр, облучение селезёнки и, в качестве профилактики надпочечниковой недостаточности, введение 50–75 мг кортизона в послеоперационном периоде. Несмотря на хорошую функцию почек, у пациента, у которого изначально была гипернефрома, развились прогрессирующие мета- стазы в печень, и он умер через 4 месяца после операции. В 1962 году Рене Кюсс и его команда успешно провели первую трансплантацию между генетически неродственными людьми. Его вклад в становление трансплантации почек огромен. Ретроперитонеальное положение донорского органа, хирургические аспекты сосудистого анастомоза и введение иммуносупрессивной терапии для предотвращения удаления трансплантата являются его достижениями.

Рисунок 8. Рене Кюсс (1913–2006). По Hatzinger, M., Stastny, M., Grützmacher.
Figure 8. René Cuysse (1913–2006). After Hatzinger, M., Stastny, M., Grützmacher.
Период становления технологии
Методики консервации трансплантатов почек
Идея сохранения органов развилась из примитивной концепции экстракорпорального кровообращения, которая впервые появилась в 1812 году в монографии Сезара Жюльена Жана Ле Галлуа. Он предположил, что «если бы место сердца могло быть заменено насосом — и если бы для регулярного продолжения работы этого насоса можно было бы обеспечить достаточное количество артериальной крови, будь то естественной или искусственно сформированной, предполагая, что такое образование возможно, — тогда жизнь могла бы поддерживаться бесконечно в любой части». В 1849 году немецкий учёный Карл Эдуард Лебель описал в своей диссертации «Первые эксперименты по перфузии изолированных свиных почек», что ярко-красная артериальная кровь, перфузируемая через свиные почки, становилась тёмной и вязкой по мере прохождения через почечные вены. В 1885 году Макс фон Фрей и Макс Грубер сконструировали первую закрытую систему искусственного кровообращения, которая имеет много общего с современными системами перфузии органов. В 1895 году Джейкобдж создал аппарат двойного кровообращения, который использовал изолированное лёгкое в качестве оксигенатора и обеспечивал перфузию органа в течение нескольких часов. Эти ранние исследования привели к разработке экстракорпоральной мембранной оксигенации (ЭКМО) и последующей разработке перфузионных систем для сохранения органов.
Исторически кровь использовалась в качестве перфузата в ранних аппаратах. Для работы примитивных перфузионных аппаратов требовался большой запас крови, в результате чего объёма собственной крови животного было недостаточно. Люди пытались заменить собственную кровь животного кровью другого вида животных. Использование межвидовой крови было токсичным для трансплантата и приводило к его быстрому разрушению. Затем авторы разбавили собственную кровь животного обычным физиологическим раствором или раствором Рингера. Эти методы привели к развитию сильного отёка в органах, особенно в лёгком. Эти ранние исследования привели к осознанию ксеноиммунитета и разработке растворов для переливания крови.
В 1908 году Алексис Каррель перфузировал изолированные щитовидные железы кошек в аппарате Линдберга раствором Тирода, состоящим из глюкозы, ионов и 40–50% гомологичной сыворотки. Он обнаружил, что органы были жизнеспособны в течение 3–21 дня. Однако культивирование в течение 6 дней показало тенденцию к гиперплазии. В 1949 году Хоу и др. культивировали нормальные плаценты человека в химически определённой питательной среде. Плаценты сохраняли жизнеспособность не менее 14 дней, но строма претерпела значительные изменения в течение 3-х дней. Эти исследования продемонстрировали, что органы или ткани способны выживать вне организма в течение нескольких дней в нормотермических условиях в питательной среде. Первоначально органы подвергались перфузии при комнатной температуре. В 1876 году Бунге и Шмидеберг добавили в контур водяную баню для поддержания перфузионной крови при физиологических температурах. Позже учёные начали предполагать, что использование более низких температур может уменьшить повреждение органов во время перфузии за счёт снижения клеточного метаболизма. В 1960-х годах был проведён ряд экспериментов с охлаждённой разбавленной сывороткой или гепаринизированной кровью, и перфузия почек была увеличена с часов до суточной. Однако использование холодной крови также вызывало множество проблем, таких как спазм сосудов при пересадке почки.
В 1960-х годах почки успешно сохранялись в течение 3–5 дней путём непрерывной перфузии охлаждённой, насыщенной кислородом крови или плазмы. Однако этот метод требовал сложного и дорогостоящего оборудования, что ограничивало его доступность и чрезвычайно затрудняло транспортировку органов. В 1969 году Коллинз смог успешно сохранить собачьи почки на 12 часов, погрузив их в солевой раствор со льдом, а позже он ещё больше увеличил время хранения в холодильнике – до 30 часов – с помощью разработанного им же раствора. Этот простой метод сохранения органов был более экономичным и удобным для транспортировки, чем его предшественники. Появление статической холодовой консервации (SCS) заменило методы динамической перфузии и стало стандартным методом сохранения органов.
Методы консервации (температура, аппаратура, условия перфузии и т.д.) и перфузионные растворы являются основными областями исследований в области сохранения органов.
В 1980 году раствор Коллинза был модифицирован за счёт непроницаемого состава и улучшенной химической стабильности. Решение Висконсинского университета (UW) было представлено в середине 1980-х годов и продолжает использоваться сегодня для консервации органов брюшной полости.
Тканевая иммунология и иммуносупрессия
Ключевыми отправными точками в формировании трансплантационной иммунологии стали открытие главного комплекса гистосовместимости (MHC), в частности, человеческого лейкоцитарного антигена (HLA) в 1952 году Жаном Доссе, Барухом Бена-серрафом и Джорджем Снеллом, а также реакции отторжения трансплантата и иммунотолерантности Питером Брайаном Медаваром в 1944–1947 годах.
Индукция неонатальной толерантности, связанной с химеризмом, была продемонстрирована Биллинге-мом, Брентом и Медаваром в 1953 году. Вторая демонстрация состоялась в 1962–1962 годах. В 1963 г. удалось доказать, что аллотрансплантаты органов могут самостоятельно вызывать толерантность с помощью иммуносупрессии.
После того, как в 1944 году Медавар продемонстрировал, что отторжение является иммунологическим событием, логичным и неизбежным вопросом было как снизить интенсивность реакции отторжения трансплантата.
Основываясь на демонстрации в 1950 году, что воспалительные заболевания можно лечить стероидами надпочечников, естественно было предполагать использовать глюкокортикоиды для предотвращения тяжёлого воспаления отторжения трансплантата. Описания дополнили отчёт Мишона и Гамбургера о случае с живым донором из Франции и исследования на собаках, проведённые Мортеном Симонсеном из Дании и У. Джеймс Демпстер в Англии. Примечательно, что Хьюм лечил некоторых своих пациентов стероидами коры надпочечников. Из экспериментальных исследований уже было известно, что стероидная терапия незначительно смягчала первичное отторжение кожного трансплантата, даже замедляла ускоренное отторжение у предварительно чувствительных реципиентов.
В качестве второго компонента иммуносупрессии было предложено тотальное облучение тела. Эта идея была протестирована на кроликах в течение 1950–1951 годов с использованием кортизона. Оба метода продлевают приживаемость кожного трансплантата всего на несколько дней. Ни эти результаты, ни те, о которых сообщили Кэннон и Лонгмайр при применении кортизона в 1952 году с моделью трансплантации куриной кожи, не вызвали большой оптимизм. Достижение приобретённой неонатальной толерантности Биллингемом и соавторами в 1953 году значительно повысило интерес к трансплантации. Два года спустя Мейн и Прен попытались смоделировать у взрослых мышей среду, которая позволила приобрести неонатальную толерантность. Тремя этапами были: 1) нанесение ущерба иммунной системе с помощью супралетального тотального облучения всего тела; 2) замена его аллогенным костным мозгом (получение гематолимфоэзной химеры); 3) пересадка кожи от того же инбредного штамма, что и у донора костного мозга. Эксперименты были успешными, летального исхода реакции «трансплан-тат-против-хозяина» можно избежать только при наличии «слабых» барьеров гистосовместимости.
Применяя стратегию химеризма при трансплантации почки собакам породы бигль в Куперстауне, Нью-Йорк, Манник и соавт. сообщили о хорошей функции почечного аллотрансплантата у реципиента, получившего супралетальное облучение, которому также вводили донорский костный мозг и который был химерой; животное прожило 73 дня, прежде чем умереть от пневмонии.
Оказавшись в тупике, специалисты по трансплантации костного мозга и цельных органов пошли разными путями. Трансплантация костного мозга зависела априори от классической индукции приобретённой толерантности, связанной с химеризмом, определённой в самом начале Биллингемом, Брентом и Медаваром в неонатальной модели. Несмотря на тот факт, что могли быть использованы только доноры с высокой гистосовместимостью, клинический успех приживления костного мозга был достигнут в 1963 году Mathe и соавт. в Париже, пациент которого прожил 2 года с хронической РТПХ до совершения самоубийства. Пять лет спустя Гатти, Гуд и др. в Миннеаполисе и Бах и др. в Университете Висконсина – каждый трансплантировал костный мозг реципиентам с отличным отдалённым результатом. Пожизненные усилия Томаса, ван Беккума и других способствовали превращению трансплантации костного мозга в общепринятую клиническую терапию многочисленных гематологических заболеваний (включая злокачественные новообразования), приобретенных иммунодефицитных расстройств, врожденных нарушений метаболизма и ряда других показаний.
Напротив, клиническая трансплантация органов, широкое клиническое применение которой на десятилетие предшествовало трансплантации костного мозга, оказалась оторванной от рациональной базы, когда был сделан вывод, что приживление органа, по-видимому, не зависит от химеризма. Расширение стратегии Прена (летальное обучение тела, за которым следует аллотрансплантация костного мозга и почки, как у собаки Манника) было использовано Мюрреем только в двух случаях, оба в 1958 году. Следующие 10 реципиентов почки в Бостоне были обусловлены сублетальной ЧМТ без трансплантации костного мозга. Одиннадцать из двенадцати облучённых пациентов умерли через 0–28 дней.
В 1960–1962 годы серии трансплантации почки от разнояйцевых близнецов показали результаты выживания трансплантатов продолжительностью более 1 года. В двух случаях Рене Кюсса доноры не были родственниками. При этом инфузия костного мозга не была необходимым условием для длительного выживания почечных аллотрансплантатов и предположительно устраняла требование химеризма.
На самом деле, и Гамбургер, и Кюсс упоминали использование стероидов коры надпочечников в качестве дополнения к облучению тела; но ни доза, ни показания к применению стероидов не были описаны. Кроме того, Кюсс вторично вводил 6-меркаптопурин (6-МП) одному из своих пациентов на основании экспериментов Роя Кална.
Ещё в 1964 году было высказано предположение, что ключевым механизмом приживления аллотрансплантата, индуцированного почкой, является клональное истощение. Индукция активированного клона аллоантигеном была описана с помощью макрофагов хозяина, а не с помощью антигенпредстав-ляющих дендритных клеток, которые, однако, не были описаны до 1973 года. Кроме того, Симонсен предположил в 1960 году, что клональное истощение, вызванное аллогенными спленоцитами, может привести к приобретению толерантности у взрослых животных в отсутствии иммуносупрессии.
После того, как стало известно, что одно только тотальное облучение тела может привести к пролонгации функции почечных аллотрансплантатов, было логично сосредоточить поиск иммуносупрессивных препаратов на миелотоксичных агентах, действие которых имитировало облучение. В сентябре 1960 года Уиллард Гудвин из Лос-Анджелеса вызвал тяжёлое угнетение костного мозга метотрексатом и циклофосфамидом у молодой женщины, получившей почку своей матери. У пациентки впоследствии развились множественные отторжения, которые были связаны с восстановлением костного мозга. Их временно устраняли преднизоном несколько раз в течение 143 дней выживания. Это был первый пример длительного восстановления функции аллотрансплантата почки человека при одном медикаментозном лечении.
Трансплантологи быстро поняли, что депрессии костного мозга следует избегать, а не навязывать её намеренно. Шварца и Дамечек показали, что 6-мер-каптопурин (6-МП) в нетрансплантированной модели на кроликах оказывает иммуносупрессивное действие в субмиелотоксичных дозах. Зная об этих результатах, но независимо друг от друга, Калн из Лондона и Зукоски, Ли и Хьюм в Ричмонде, штат Вирджиния, продемонстрировали то же самое на модели пересадки почки собаке. В июне 1960 года Калн перешёл из Королевской бесплатной больницы к Мюррею в больницу Питера Бента Бригама (Бостон) для дальнейших доклинических исследований 6-МП и его аналога азатиоприна.
Первоначально эти два препарата были разработаны Гертрудой Элион и Джорджем Хитчингсом в качестве противолейкозных средств. Их возможное использование для трансплантации сначала было встречено с лихорадочным энтузиазмом, поскольку в целом признавалось, что цитоабляция реципиенту позволит добиться успеха лишь в редких случаях трансплантации почки человека. Хотя примерно 95% реципиентов почек беспородных собак, получавших 6-МП или азатиопри, были зарегистрированы редкие случаи длительного или кажущегося постоянным приживления аллотрансплантата.
Хотя были протестированы кортикальные стероиды надпочечников, они, по-видимому, не усиливали действие азатиоприна, что побудило Мюррея в его клиническом исследовании сделать выбор в пользу дополнительных цитотоксических средств, таких как азасерин и актиномицин С.
Обратимость была легко достигнута путём временного добавления беспрецедентно высоких доз преднизолона (200 мг/сут) к базовой иммуносупрессии азатиоприном.
К концу 1970-х годов центры, имевшие доступ к AЛГ, сообщали об улучшении показателей выживаемости при трансплантации почек. Тем не менее, многие пациенты испытывали тяжёлые побочные эффекты стероидов. Открытие циклоспорина (CsA) и его первое клиническое применение в 1978 году изменили трансплантацию. Результаты также улучшились благодаря широкому доступу к эффективной терапии АЛГ - поликлональными антителами (АТ), а затем и с первой моноклональной АТ-терапией муро-монаб-CD3-, которая может снизить зависимость от высоких доз стероидов. Многие усовершенствования в медицинском, хирургическом, анестезиологическом и интенсивном лечении улучшили клинические результаты. Рост трансплантации сердца, печени, поджелудочной железы и лёгких создал программы трансплантации в наши дни. CsA, блокирующий транскрипционную активацию IL-2 и других цитокинов в Т-клетках, внёс значительный вклад в фундаментальную науку об активации Т-клеток.
Алкилирование ДНК объясняет химиотерапевтические, цитотоксические и мутагенные эффекты алкилирующих агентов. До и во время Второй мировой войны азотные кислоты изучались как возможные боевые химические агенты; было обнаружено, что некоторые из них оказывают цитотоксическое действие на лимфоидную ткань (Гилман и Филлипс, 1946).
В 1946 году информация об азотной горчице была рассекречена, и эти соединения были исследованы для лечения рака. Стендер и др. (1959) обнаружили, что циклофосфамид, подобно радиации, подавляет образование антител. Сантос и др. (1964) показали, что это справедливо и для людей, и представили применение Cy для трансплантации костного мозга.
Основным продуктом является 4-гидроксициклофосфамид и ациклический таутомер альдофосфамид; при расщеплении последнего образуется фос-форамид иприт, который может алкилировать (Элион, 1989). Было обнаружено, что антилейкеми-ческой активностью обладают как 6-меркаптопурин (6-MP), так и пролекарство, азатиоприн (AZA). В 1959 году Шварц и Дамешек обнаружили, что 6-МП подавляет образование антител против чужеродных эритроцитов, а в 1960 году они показали, что 6-МП задерживает отторжение кожного трансплантата (Шварц и Дамешек, 1959, 1960). В течение следующих нескольких лет несколько исследователей обнаружили, что AZA задерживает отторжение трансплантата органа, и Murray и соавт. (1963) использовали AZA для подавления отторжения пересаженных почек человека. AZA и стероиды вводились регулярно с этой целью до тех пор, пока в коктейль не добавляли CsA. AZA был иммуносупрессивным препаратом первого поколения, влияющим на синтез пуринов. Однако эти эффекты являются широкими, а не избирательными, так что пролиферация многих типов клеток ингибируется в сопоставимой степени; следовательно, подавление костного мозга происходит при дозах, близких к терапевтически полезным. Общее ингибирование синтеза пуриновых рибонуклеотидов может приводить к гепатотоксичности. Более того, мутагенные эффекты AZA могут повышать риск развития злокачественных новообразований.
Исследовательская программа Хитчингса и Эли-она в Burroughs Wellcome по синтезу аналогов пуринов в качестве противолейкозных препаратов была начата в 1942 году. In vivo AZA неферментативно превращается в 6-MP, который метаболизируется до 6-тиогуаниновых нуклеотидов.
Метотрексат (MTX) является антагонистом фолиевой кислоты, который был синтезирован для лечения злокачественных новообразований (Farber и соавт., 1956). MTX вызывал поразительные, хотя и временные ремиссии при лейкозах, что позволяет предположить, что он также может оказывать воздействие на нормальную лимфоидную ткань. Было показано, что MTX ингибирует как образование антител, так и развитие отсроченной гиперчувствительности у морских свинок (Friedman и соавт., 1961). Последний эффект, по-видимому, проявляется на фазе индукции, поскольку MTX не подавляет отсроченные реакции при сенсибилизации лимфоцитов
Циклоспорин А, липофильный циклический пептид, выделенный из гриба Hypocladium inflatum gams, обладает иммуносупрессивной активностью. CsA широко применялся для предотвращения отторжения аллотрансплантата до того, как был установлен механизм его действия. Кронке и др. (1984) показали, что CsA блокирует экспрессию гена IL-2 в активированных Т-лимфоцитах. Liu и соавт. (1991) обнаружили, что комплекс CsA и циклофилина ингибирует фосфатазную активность кальциневрина. Предотвращая их кальциневрин-опосредованное дефосфорилирование, CsA ингибирует транслокацию транскрипционных факторов семейства NFAT из цитоплазмы в ядро активированных Т-клеток.
FK506, макроциклический триен выделенный из фильтрата культуры Streptomyces tsukubaensis, также называемый FK506, подобно CsA, ингибирует пути передачи сигнала, связанные с Т-клеточным рецептором антигена, на уровне JNK и киназы p38. Эти два действия на кальциневрин и пути JNK/ p38 фокусируют действие FK506 на Т-клетки, хотя также наблюдается воздействие на другие типы клеток. Клинические испытания FK506, переименованного в такро-лимус, показали эффективность, аналогичную эффективности CsA, но также нефротоксичность и некоторые другие побочные эффекты CsA. Такролимус уже занял прочное место в трансплантационной терапии, и местное применение может быть полезным для лечения атопической экземы и других кожных заболеваний, как описано в сопроводительной статье (Assmann et al., 2000).
Микофеноловая кислота была выделена Gosio (1896) из культур кукурузного бульона, содержащих Penicillum, и было показано, что она обладает слабой антибактериальной активностью: возможно, это первая признанная антибиотическая активность. Интерес продлился до 1960-х годов, когда учёные из I.C.I. обнаружили, что препарат ингибирует инозин 5 X. Противовоспалительная и иммуносупрессивная активность лефлуномида была признана Шлейерба-хом (1978), и систематически отслеживалась на экспериментальных животных моделях аутоиммунных заболеваний Бартлеттом (1986) и Бартлеттом с со-авт. (1993). Лефлуномид и родственные ему малони-трилоамиды также продемонстрировали активность в нескольких моделях трансплантации (Xiao et al., 1994; Waer, 1996). Лефлуномид фактически является пролекарством с меньшей токсичностью для желудочно-кишечного тракта, чем его метаболит с открытым кольцом AA771726. Основной механизм действия метаболита, ингибирование синтеза пиримидиновых нуклеотидов, был идентифицирован в Syntex Червински и др. (1995). Согласно обзору Herrmann и соавт. (2000) в этом выпуске, ингибирование дигидрооротатдегидрогеназы в настоящее время признано в качестве механизма, посредством которого опосредуется подавление пролиферации лимфоцитов. Лефлуномид нашёл место в клинике для лечения ревматоидного артрита. Десять лет спустя Эли Лилли сотрудничал с дерматологами в открытом исследовании, предполагающем, что MPA обладает эффективностью при лечении псориаза (Epinette et al., 1987). Ни одна из этих версий не была проверена. Исследовательская программа Syntex, ведущая к разработке пролекарства MPA, микофенолата мофетила (MMF, CellCeptw ), в качестве иммуносупрессивного средства была начата в 1982 году и описана в сопроводительной статье (Allison and Eugui, 2000).
Сиролимус – макроциклический триеновый антибиотик, был первоначально выделен из Streptomyces hygroscopicus, получен из образца почвы, собранного на острове Пасхи для тестирования в рамках противогрибковой программы скрининга в исследование (Меле и Халлоран, 2000). Было показано, что соединение предотвращает отторжение аллотрансплантата (Morris et al., 1991), а также сахарный диабет у мышей NOD и заболевание у мышей MRL/lpr (Carlsonet al., 1993). Хотя рапамицин по структуре подобен FK-506, первый не является ингибитором кальциневрина и не предотвращает выработку IL-2; однако препарат блокирует пролиферативные реакции лимфоцитов на IL-2 (Abraham and Wiedderecht, 1996).
Неоценимый вклад в решение проблем иммуносупрессии внесли два основоположника клинической трансплантации – Рой Калн и Томас Старзл.

Рисунок 9. Рой Калн (1930–2024)
Figure 9. Roy Calne (1930–2024)
Том Старзл, основоположник и «отец» современной трансплантации, родился 11 марта 1926 года в городе ЛеМарс, в Айове. Он учился в Вестминстерском колледже в Фултоне, штат Миссури, где получил степень бакалавра наук в области биологии. Старзл учился в медицинской школе Северо-Западного университета в Чикаго, где в 1950 году он получил степень магистра наук по анатомии, а в 1952 году – степень доктора философии по нейрофизиологии и степень доктора медицины с отличием. Старзл провёл дополнительный год в медицинской школе, используя это время для получения докторской степени по нейрофизиологии в 1952 году. Он написал основополагающую статью, описывающую методику записи электрических реакций глубоких структур мозга на сенсорные стимулы, такие как вспышка света или громкий звук. После получения медицинской степени Старзл стажировался по хирургии в больнице Джона Хопкинса в Балтиморе и Мемориальной больнице Джексона в Майами. В обоих местах он проводил лабораторные исследования и исследования на животных, проявляя большой интерес к биологии печени.
Старзл был хирургом и исследователем в зарождающейся в то время области трансплантации органов в Университете Колорадо с 1962 года до своего переезда в Питтсбургский университет в 1981 году. Старзл исследовал клиническую эффективность циклоспорина А в 1982 году и такролимуса в 1991 году, что привело к одобрению FDA. Разработал многочисленные технические приёмы в области сохране- ния, заготовки и трансплантации органов, определил показания и ограничения к трансплантации органов брюшной полости.

Рисунок 10. Томас Старзл (1926–2017). Основоположник современной трансплантации
Figure 10. Thomas Starzl (1926–2017). The founder of modern transplantation
В настоящее время одним из наиболее перспективных направлений трансплантации почки является её ксенотрансплантация. Трансплантация почек нокаутированных свиней в настоящее время представляется перспективной благодаря работам Монтгомери и соавт.
История трансплантации почки в России
В нашей стране имелся большой задел экспери- ментов по трансплантации почки, которые привели в итоге к уже описанной трансплантации почки, выполненной Ю.Ю. Вороным. В 1914 г. киевский хирург Е.Г. Черняховский в экспериментах на собаках пересаживал почки в паховую область и также на сосудистых анастомозах. П.А. Герцен в 1922 г. организовал отделение экспериментальной хирургии при воз- главляемой им клинике, где были выполнены различные эксперименты по трансплантации органов и тканей.
В настоящее время ряд источников описывает якобы бывший случай трансплантации почки козы или телёнка, выполненный в ссылке в 1924 году в Енисейске В.Ф. Войно-Ясенецким. Анализ источников находит, что впервые указанная история увидела свет в книге диссидента и эмигранта М.А. Поповского «Жизнь и житие святителя Луки (Войно-Ясенец-кого), архиепископа и хирурга». Указанная книга вышла в Париже в 1979 году, в России в 1990 переиздана в журнале «Октябрь». Поповский, не являющийся ни историком медицины, ни богословом, неоднократно обвинялся в недостоверности информации, её тенденциозной и однобокой подаче. Родственник и признанный биограф свт. Луки В.А. Лисичкин называет этот труд «полулегенда, полупасквиль». На страницах книги Поповский утверждает, что указанный эпизод произошёл в 1924 году, ссылаясь только на устный рассказ местной жительницы. Тем не менее, как достоверный этот сюжет мигрирует в различные источники. В последующих публикациях свинья меняется не телёнка, больной мужчина на дочь надзирателя (это совершенно необычная отсылка к святому Валентину Римскому, по легенде написавшему письмо слепой дочери надзирателя, вернувшее ей зрение). Анализ исторического контекста позволяет усомниться в подлинности приведённого сюжета. Мы знаем В.Ф. Войно-Ясенецкого как острейшего думающего хирурга, клинического анатома, строгого и ответственного учёного. Не имея условий, подготовки, в ссылке, где по свидетельству очевидцев не было нормальных инструментов, нитей, перфузионных машин, он вряд ли стал бы подвергать жизнь пациента такому неоправданному риску. Да, к 1924 году в мире имелись выполненные ксенотрансплантации почек Жабуле, Ульманом, Унгером, Шёнштадтом – все почки анастомозировались на время на руку пациентов. Методика трансплантации к подвздошным сосудам будет разработана только в 1950–1953 гг. французскими хирургами. Далее, сделав бы настолько сложную операцию, как бы мог В.Ф. Войно-Ясенецкий не описать её? Зная его блестящий стиль, его глубокий методический подход, как он мог бы проигнорировать столь ценный опыт и не описать его нигде? Наконец, это гетерогенная ксенотрансплантация. И сегодня при наличии нокаутированных животных, иммуносупрессивной терапии эффекта такая пересадка не даёт. Это значит, что описанный случай не мог окончиться положительно. Приведённая история, вероятнее всего, является городской легендой (Я.А. Вертелецкий, 2023).
В 1948 г. В.П. Демихов начал производить пересадку аллогенных почек собакам. К 1955 г. он выпол- нил 30 пересадок почек, половина из которых функционировала более недели, а одна из оперированных собак прожила с пересаженной почкой 19 суток. В 1948 г. А.А. Вишневский и В.П. Демихов в Институте хирургии АМН СССР выполнили в эксперименте на собаках пересадку почки на заднебрыжеечную артерию.
Большим достижением советской медицины стало изобретение В.Ф. Гудовым в 1947 г. первого в мире сосудосшивающего аппарата. В 1949 г. с помощью одной из ранних моделей этого аппарата Г.А. Рихтер и Н.П. Петрова успешно произвели пересадку почки на шею собаки.
Современная эра клинической трансплантации началась в середине ХХ века. В 1950 г. Ю.Ю. Вороной, работавший тогда в Институте экспериментальной биологии и патологии им. А.А. Богомольца в Киеве, описал 5 наблюдений пересадок трупной почки после продолжительной (12–28 суток) консервации.
Большим шагом к созданию трансплантационных программ в нашей стране стало создание в 1957 г. в НИИ хирургической аппаратуры и инструментов МЗ РСФСР аппарата «искусственная почка».
В 1960 г. увидели свет монографии В.П. Демихова «Пересадка жизненно важных органов в эксперименте» и А.Н. Филатова и соавт. «Пересадки и замещения тканей и органов».
В апреле 1965 г. академик Б.В. Петровский выполнил первую в нашей стране успешную трансплантацию почки человеку. Вскоре подобные операции начали производить Г.М. Соловьев, Н.А. Лопаткин, Ю.М. Лопухин, В.И. Шумаков, В.С. Крылов, И.С. Ярмолинский, И.А. Беличенко и другие хирурги.
Вначале для трансплантации использовали почки от живых родственных доноров, а позднее стали применять трупные органы. Развитие этого направления активно поддержала научная медицинская общественность, а Минздрав СССР разрешил изъятие трупных почек для целей трансплантации. Академией медицинских наук СССР в 1967 г. была организована лаборатория по пересадке органов и тканей (руководитель – В.В. Кованов), в которой изучали вопросы преодоления тканевой несовместимости, её морфологические формы и рациональные способы консервирования трупных органов. В 1967 г. во Всесоюзном научно-исследовательском институте клинической и экспериментальной хирургии (ВНИИКиЭХ) МЗ СССР был организован первый в стране Центр трансплантации почки, где ученики Б.В. Петровского развернули широкое изучение и поиск путей и методов преодоления тканевой несовместимости. Была разработана программа исследований и научно обоснованы три основных направления: подбор иммуногенетически совместимых пар; подавление иммунологического сопротивления организма реципиента; воздействие на трансплантат с целью снижения активности антигенов несовместимости. В 1969 г. по инициативе академика Б.В. Петровского организован Институт трансплантации органов и тканей АМН СССР (ныне – Федеральный научный центр трансплантологии и искусственных органов (ФНЦТИО) им. акад. В.И. Шумакова), который возглавили представители научной школы Б.В. Петровского: с 1969 по 1974 г. – Г.М. Соловьёв, с 1974 по 2004 г. – В.И. Шумаков, с 2005 г. – С.В. Готье.
В 1986 г. Президиум АМН СССР обсудил вопрос о современном состоянии проблемы пересадки жизненно важных органов. Минздравом СССР был издан приказ № 236 от 17 февраля 1987 г. и «Временная инструкция по констатации смерти на основании диагноза смерти мозга», в результате чего были созданы условия для дальнейшего прогресса трансплантологии в нашей стране. В 1992 г. Президентом РФ Б.Н. Ельциным был принят Закон РФ «О трансплантации органов и (или) тканей человека», до сих пор регламентирующий деятельность по трансплантологии в нашей стране. В 1997 г. в Москве организован Московский центр по забору и типированию органов. На него возложена ответственность за подбор доноров и реципиентов, а также за координацию распределения трупных почек среди московских центров трансплантации.
В феврале 2002 года С.В. Готье впервые выполнил в России одномоментную пересадку печени и почки одному реципиенту, а в октябре 2003 года впервые в мире произвёл одновременную трансплантацию правой доли печени и почки от живого родственного донора. С октября 2002 года С.В. Готье впервые в России начал выполнение родственной трансплантации фрагмента поджелудочной железы по поводу сахарного диабета 1-го типа у взрослых и детей. Таким образом, впервые в отечественной практике осуществлено радикальное лечение сахарного диабета.
В 2003 году в РНЦХ им. Б.В. Петровского М.М. Ка-абак и Н.Н. Бабенко успешно выполнили первую трансплантацию почки ребёнку младше 5-летнего возраста, а в 2005 М.М. Каабак и А.К. Зокоев – первую успешную сочетанную трансплантацию почки и поджелудочной железы.
В 2010 году М.С. Михайлов, Д.А. Черновалов, Б.И. Яремин впервые в России выполнили симультанную трансплантацию почки и протезирование брюшной аорты при её аневризме.
В 2016 году В.Л. Медведев в Краснодаре впервые выполнил трансплантацию почки при помощи робота ДаВинчи.
Яркая и славная история трансплантация почки продолжается. Её пишут ежедневно в операционных, палатах реанимации новые учёные, хирурги, нефрологи, так же отдающие себя делу трансплантации.


