Изменчивость биохимических показателей и адаптация краснопыльниковой и жёлтопыльниковой форм сосны (Pinus sylvestris L.) в условиях избыточного увлажнения
Автор: Аганина Юлия Евгеньевна, Тарханов Сергей Николаевич
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 2-1 т.18, 2016 года.
Бесплатный доступ
Изучена динамика содержания фотосинтетических пигментов (хлорофиллов и каротиноидов), свободного пролина, стрессовых белков, аскорбиновой кислоты и активности пероксидаз в хвое форм сосны ( Pinus sylvestris ), различающихся цветом микростробилов, в условиях постоянного избыточного увлажнения почв в низовье р. Северная Двина. Определены уровни индивидуальной изменчивости данных показателей в разные календарные периоды. Выявлены существенные различия в сезонной динамике биохимических показателей, свидетельствующие о большей чувствительности и нуждаемости в развитии защитных функций краснопыльниковой сосны по сравнению с жёлтопыльниковой.
Сосна, изменчивость, адаптация, краснопыльниковая и жёлтопыльниковая форма, фото-синтетические пигменты, пероксидазная активность, свободный пролин, стрессовые белки, аскорбиновая кислота, увлажнение, почва
Короткий адрес: https://sciup.org/148204411
IDR: 148204411 | УДК: 631.524.6:582.475.4
Текст научной статьи Изменчивость биохимических показателей и адаптация краснопыльниковой и жёлтопыльниковой форм сосны (Pinus sylvestris L.) в условиях избыточного увлажнения
Высокий уровень генетического полиморфизма лесообразующих хвойных видов, проявляющийся в их формовом разнообразии, связывается с действием разнообразных механизмов адаптации и условий среды. Адаптивные возможности растений выявляются по их ответным реакциям на внешние воздействия. По мнению Н.Е Судачковой [12], можно допустить, что древесные растения, испытывающие стресс в экстремальных условиях местообитания в течение всей жизни, как например, болотные, притундровые леса, постоянно находятся в стадии стабилизации, т.е. не на том уровне метаболизма, который определён дереву его генетическими возможностями, а на том, который позволяет компенсировать затраты на стрессовый метаболизм. Постоянное избыточное увлажнение почв приводит к корневой гипоксии, вызывая хронический стресс у хвойных деревьев. В этих условиях дефицит кислорода отражается на интенсивности физиолого-биохимических процессов, как корневой системы, так и наземных органов.
Наибольшее число сведений, касающихся стрессового метаболизма у древесных растений, относится к исследованиям по обнаружению низкомолекулярных метаболитов с защитной функцией. Всего, по разным оценкам, насчитывается порядка 15-20 различных признаков неспецифической составляющей стресса у растений [16, 6, 10]. Для гипоксического стресса (не у всех видов и тканей древесных растений) характерно накопление крахмала, аминокислот и белков, органических кислот, анаэробной части цикла Кребса [17].
Цель работы : изучение сезонной динамики биохимических показателей хвои в связи с адаптацией разных форм сосны ( Pinus slvestris ), различающихся цветом пыльников, в стрессовых условиях.
Методика исследования. Объектами исследований являются северотаёжные сосняки кустарничковосфагновые на верховых торфяных почвах в низовье Северной Двины. В сосняках кустарничково-сфагновых
торф – сфагновый или пушице-сфагновый, низкой степени разложения. Торф имеет сильнокислую реакцию среды (рН солевой суспензии 2,6-3,2), высокую обменную и гидролитическую кислотность, очень низкую степень насыщенности основаниями (11-14%). Содержание зольных элементов в верхнем торфе составляет 2-4%. Торф верхних горизонтов характеризуется низкой объёмной массой, высокой полевой влажностью, близкой к полной влагоёмкости (90-94%).
Для определения биохимических признаков у форм сосны, выделенных по цвету пыльников (жёлтопыльниковая и краснопыльниковая), в 2015 г. отбирали образцы хвои на 10 деревьях каждой формы. Учитывая сезонную изменчивость этих признаков, отбор образцов производили на одних и тех же деревьях в начале роста побегов (конец мая), в конце завершения их линейного прироста (середина июля), в конце вегетационного периода (конец сентября) и перед перезимовкой (начало ноября). В лабораторных условиях спектрофотометрическим методом (на спектрофотометре NanoDrop 2000C) у разных форм сосны в хвое, сформировавшейся в 2014 году, определяли содержание фотосинтетических пигментов [20, 9], пероксидазную активность [2], содержание свободного пролина [22], стрессовых белков, аскорбиновой кислоты [1, 8, 19]. Долю хлорофиллов в светособирающем комплексе (ССК) расчитывали по формуле [23, 24]. Уровни изменчивости признаков оценивали по эмпирической шкале С.А Мамаева [7]. При сравнении одноимённых признаков и свойств использовали критерий F -Фишера и t -Стъюдента [11]. Дисперсионный анализ проводили с использованием пакета лицензионных программ Excel.
Экспериментальная часть, анализ, обобщение и разъяснение полученных данных. Содержание и состав фотосинтетических пигментов являются показателями основного метаболизма растений. Процессы ассимиляции в первую очередь связаны с фотосинтезом, а значит, и с пигментным аппаратом. Деревья разных форм могут сильно различаться по содержанию фотосинтетических пигментов из-за различного диапазона нормы их реакции на воздействие условий среды. Менее вариабельным является содержание в хвое хлорофилла а и каротиноидов (C.V.<20%). Более изменчивым является содержание хлорофилла b. Коэффициенты вариации этого показателя в определённые периоды могут достигать очень высокого уровня (C.V.>40%). В разные календарные периоды и годы индивидуальная вариабельность содержания хлорофиллов и каротиноидов может сильно различаться. Можно отметить повышение индивидуальной изменчивости содержания хлорофилла b осенью, особенно у краснопыльниковой формы (C.V. - до 54%), что, по-видимому, связано с более выраженными индивидуальными различиями в ответных реакциях деревьев этой формы на действие стрессовых факторов в связи с сезонными изменениями климатических и почвенногидрологических условий.
Уровни индивидуальной изменчивости относительных величин содержания пигментов: хлорофилла а и b (Х а /Х b ), хлорофиллов и каротиноидов (Х а + b /К) также выше осенью, особенно у краснопыльниковой формы. Причём относительный показатель Х а /Х b варьирует в большей степени ( C.V. =19-41% - у краснопыльниковой формы и C.V. =10-47% - у жёлтопыльниковой) по сравнению с показателем Х а + b /К ( C.V. =8-26% и C.V. =6-20%, соответственно). Это свидетельствует о больших различиях деревьев краснопыльниковой формы между собой в соотношении фотосинтетических пигментов.
То же самое было отмечено ранее при изучении индивидуальной изменчивости этих показателей в целом для этой популяции сосны в низовье Северной Двины. Изменение величины Ха+b/К рассматривается как приспособительная реакция свето-собирающего комплекса (ССК) фотосинтетических пигментов деревьев на условия внешней среды. Доля хлорофиллов, локализованных в ССК, у деревьев разных форм варьирует в пределах 20-70% от общего фонда зелёных пигментов. Причём величина коэффициента вариации показателя ССК также больше осенью (C.V.=22-32%) по сравнению с весенне-летним периодом (C.V.=13-17% - у краснопыльниковой формы и C.V.=7-8% - у жёлтопыльниковой). Соответственно, индивидуальная изменчивость этого показателя в весенне-летний период у краснопыльниковой формы характеризуется средним, а у жёлтопыльниковой формы - низким уровнем. Эти амплитуды связаны с адаптацией фотосинтетического аппарата сосны в сосняках кустарничково-сфагновых к световым условиям в высоких широтах. Осенью индивидуальные различия между деревьями по величине Ха/Хb становятся существенными, особенно у жёлтопыльниковой формы (F=14,5-79,5; F0,05=3,2; Fo,oi=5,5), что связано с широтой нормы реакции (реакцией генотипов на условия среды). Это же можно отметить для показателя ССК у жёлтопыльниковой формы, хотя и в меньшей степени (F=4,8-5,1; Fo,05=3,2; F0,01=5,5). Установлены достоверные различия дисперсий выборок деревьев краснопыльниковой и жёлтопыльниковой сосны по величине Ха/ХЬ в весеннелетний период (период линейного роста побегов) (F=4,1-5,1; F0,05=3,2; F0,01=5,5), ССК - в начале роста (F=4,0; F0,05=3,2). Однофакторный дисперсионный анализ подтверждает влияние фактора «форма» на изменчивость параметров фотосинтетического аппарата в конце мая, перед началом линейного роста побегов (F=7,10-20,45; F0,05=4,41).Двухфакторный дисперсионный анализ показывает совместное влияние факторов «форма» и «сезон» на количественное содержание фотосинтетических пигментов, а также величины Хa+b/К и ССК сосны (F=2,94-10,72; F0,05=2,73). Уровень индивидуальной изменчивости пероксидазной активности хвои у краснопыльниковой формы больше (очень высокий, C.V. >40%) по сравнению с жёлтопыльниковой (высокий, C.V.<40%) во все календарные периоды. Причём, осенью индивидуальная вариабельность активности пероксидаз повышается по сравнению с весенне-летним периодом у обеих форм (F=3,3-5,9; F0,05=3,2; F0,01=5,5). Это свидетельствует о более широкой норме реакции деревьев краснопыльниковой формы на влияние условий среды, по сравнению с жёлтопыльниковой, особенно в осенний период. Уровень индивидуальной изменчивости содержания свободного пролина средний (C.V.<20%) и повышенный (C.V.>20%) у обеих форм. Причём, осенью у краснопыльниковой сосны он снижается (C.V.=13-19%) по сравнению с весенне-летним периодом (C.V.=24-29%). Различия дисперсий этого показателя в выборках деревьев в ноябре и других календарных периодах достоверны на принятых условиях значимости у обеих форм (F=3,5-19,8; F0,05 = 3,2; F0,01 = 5,5). Более существенные различия наблюдаются у краснопыльниковой сосны (F=7,4-19,8), что также свидетельствует о более широкой норме реакции этой формы по данному показателю в ноябре, перед перезимовкой. Уровень индивидуальной изменчивости содержания в хвое стрессовых белков очень высокий у обеих форм (C.V. =40-107%), причём в выборках деревьев жёлтопыльниковой сосны различия дисперсий этого показателя между разными календарными периодами существенны (F=3,2-29,2; F0,05=3,2; F0,01=5,5). Уровень индивидуальной вариабельности содержания аскорбиновой кислоты в хвое у обеих форм больше в весеннелетний период (C.V. =31-59%) по сравнению с осенью (C.V.=10-16%). Это свидетельствует о более выраженных индивидуальных различиях реакций деревьев по этому показателю на действие внешних факторов в период активной вегетации.
Ритмичность физиолого-биохимических процессов влияет на устойчивость сосны к воздействию внешних факторов и может иметь решающее значение при адаптации. Количественное содержание и качественный состав фотосинтетических пигментов, изменение их соотношения в листьях - важные и чувствительные показатели физиологического состояния растений, направленности адаптивных реакций при воздействии стрессовых факторов [3]. В период вегетации содержание фотосинтетических пигментов зависит от фенофаз развития деревьев. Характер сезонной изменчивости показателей фотосинтетического аппарата у форм с разным цветом микростробилов довольно сходный (рис. 1). Перед перезимовкой наблюдается сущест-венное снижение содержания хлорофиллов a и b у обеих форм по сравнению с весенне-летним периодом ( t =2,54-3,17; t 0,05 =2,26-3,25). Осенью происходит существенное повышение содержания каротиноидов у обеих форм t =12,26-14,03; 1 0,01 = 4,78. Однако наблюдаются и различия в сезонной динамике пигментов у этих форм. После завершения линейного роста (середина июля) у желтопыльниковой формы существенно больше концентрация хлорофилла b по сравнению с его содержанием в начале роста побегов (конец мая) и сентябре ( t =2,32-3,58; t 0,05 =2,26; t 0,01 =3,25).
Таким образом, у жёлтопыльниковой формы чётко выражен летний максимум этого показателя, в отличие от краснопыльниковой формы, у которой июльский максимум в период вегетации 2015 г. проявляется несущественно ( t < t 0,05 ).
Изменения соотношений пигментов в листьях -важные и чувствительные показатели физиологического состояния, направленности адаптивных реакций растений при воздействии стрессовых условий [3]. Известно [5], что водный стресс (в том числе и в случае насыщения почвы водой вокруг корней растений) наиболее сильно действует на свето-собирающий хлорофилл а / b - белковый комплекс. Осенью в листьях в условиях водного стресса хлорофилл а разрушается быстрее хлорофилла b . Действие плохой аэрации почвы является до некоторой степени косвенным: синтез хлорофилла задерживается вследствие общего нарушения метаболизма.
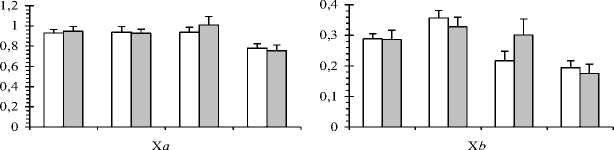
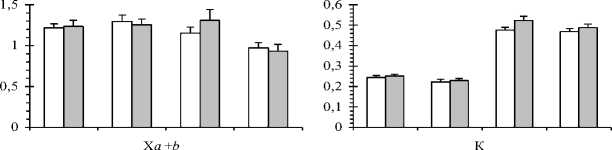
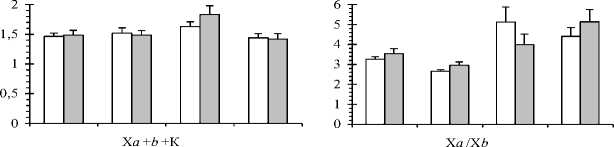
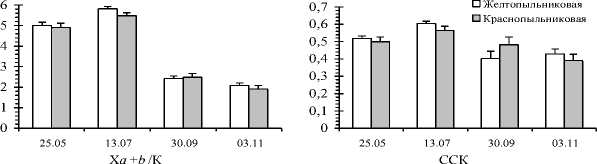
Рис. 1. Сезонная динамика (среднее значение с ошибкой) показателей фотосинтетического аппарата в 2015 г. у форм сосны с разным цветом микростробилов
Ха, ХЬ - содержание хлорофиллов а и b соответственно, мг/г воздушно сухой массы хвои; Ха+b - суммарное содержание хлорофиллов а и b соответственно, мг/г воздушно сухой массы хвои; К - содержание каротиноидов, мг/г воздушно сухой массы хвои; Ха+b+K - общая сумма пигментов, мг/г воздушно сухой массы хвои; Ха/Хb - отношение хлорофилла а к хлорофиллу b; Ха+b/K - отношение суммы хлорофиллов а и b к каротиноидам; ССК - доля хлорофиллов светособирающего комплекса
Установлено [15], что в сосняках сфагновой группы адаптация деревьев сосны к воздействию внешних факторов через увеличение емкости ССК у разных форм может проявляться по-разному. Показано [13], что увеличение величины соотношения хлорофиллов а и b свидетельствует о негативном влиянии внешней среды на ССК хлоропластов. По нашим данным, доля хлорофиллов, локализованных в ССК в разные сезонные периоды (конец мая - начало ноября 2015 г.) составляет в среднем 39-57% от общего фонда пигментов хвои в выборках деревьев с красной окраской микростробилов и 46-60% - с желтой окраской пыльников (рис. 1). Эта амплитуда связана с адаптацией фотосинтетического аппарата сосны в сосняках кустарничково-сфагновых к световым условиям в высоких широтах [14]. Различия этих форм по доле хлорофиллов, локализованных в ССК общего фонда пигментов, в другие периоды вегетации (конец мая - сентябрь) не достоверны по t -критерию на 5%-ном уровне значимости.
Каротиноиды играют важную роль в фотосинтезе, выполняя функции светосборников и фитопротекторов [21]. По величине отношения суммы хлорофиллов к каротиноидам, величине отношения содержания хлорофилла а к хлорофиллу b достоверные различия при критических значениях t-критерии между этими формами также отсутствует. Соответственно можно предполагать, что обе формы испытывают сходное негативное воздействие внешней среды. Видимо, в хвое, подверженной действию водного и гипоксического стресса, сосна с красной и желтой окраской микростробилов не различается по интенсивности разрушения хлорофиллов.
Нами установлены достоверные сезонные различия по величине отношения хлорофилла а к хлорофиллу b у желтопыльниковой формы (t=2,42-4,23; to,05=2,26; to,oi=3,25). Существенно меньше этот показатель в середине лета, а значительно больше - в конце мая (начало роста) и особенно, осенью (конец вегетации). У краснопыльниковой сосны этот показатель существенно увеличивается в ноябре, после завершения периода вегетации (t=2,37-3,36; t0,05=2,26; to,oi=3,25). Очевидно, отрицательное воздействие внешних факторов на деревья этой формы сильнее проявляется осенью. Из-за увеличения содержания каротиноидов осенью у обеих форм показатель Хa+b/К меньше по сравнению с летним (t=2,28-4,17) и весенним периодами (t=8,76-22,22; Zo,o5=2,26; 6o,oi=3,25; t0,001=4,78). Эти пигменты защищают хлорофилл от фотоокисления и являются более устойчивыми к действию неблагоприятных факторов в осенне-зимний период. Увеличение содержания каротиноидов рассматривается как адаптивная реакция, направленная на повышение устойчивости фотосинтетического аппарата, предотвращение фотодинамической деструкции в суровых северных условиях [3]. В весенний период (да начала линейного роста побегов) величина отношения хлорофиллов к каротиноидам значительно больше, чем осенью. Причем эти различия более выражены у желтопыльниковой формы (t=4,17; 6o,oi=3,25), чем у краснопыльниковой (t= 2,28; t0,05=2,26). Это можно рассматривать как при- способительную реакцию ССК фотосинтетических пигментов этих форм на изменение условий внешней среды, причем у желтопыльниковой сосны она имеет более выраженный характер.
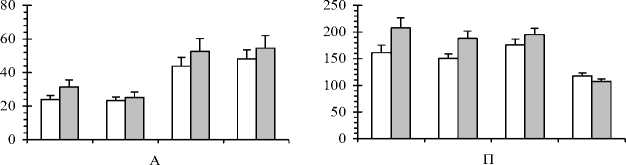
Увеличение активности пероксидаз можно рассматривать как защитную реакцию растений на воздействие стрессовых факторов, препятствующую развитию неконтролируемых окислительных процессов. По нашим данным, пероксидазная активность у обеих форм сосны почти в 2 раза выше осенью, по сравнению с весенне-летним периодом (рис. 2). В начале и при завершении линейного роста побегов и хвои этот показатель значительно меньше (t=2,45-4,32; t0,05=2,26; to,oi=3,25). Следовательно, осенью деревьям присущ более напряженный обмен веществ и для обеспечения нормального прохождения окислительных процессов пероксидазная активность хвои повышается.
Аккумуляция пролина считается типичным ответом растения на воздействие различных отрицательных факторов [4]. Наблюдалось достоверное снижение содержания свободного пролина у обеих форм сосны при критических значениях t -критерия в ноябре, после завершения вегетации. Причем, более значительно снижалось содержание пролина у краснопыльниковой сосны ( t =5,11-7,03; t 0,05 =2,26; t o,oi =3,25; t o,ooi =4,78) по сравнению с желтопыльниковой ( t =2,87-4,90; t o,o5 =2,26; t o,oi =3,25; t o,ooi =4,78). Можно предполагать, что его сезонная динамика связана с ритмикой ростовых процессов и оттоком энергетических и пластических веществ, в т.ч и свободных аминокислот, во вновь образующиеся побеги.
□ Желтопыльниковая
Краснопыльниковая

24.05 13.07 30.09 03.11
АК
Рис. 2. Сезонная динамика биохимических показателей (среднее значение с ошибкой) хвои в 2015 г. у форм сосны с разным цветом микростробилов
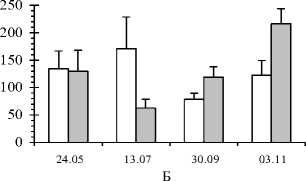
А - активность пероксидаз, усл. ед.; П - содержание пролина, мкг/г воздушно сухой массы хвои; Б - содержание стрессовых белков, мкг/г воздушно-сухой массы хвои; АК - содержание аскорбиновой кислоты, мкг/г воздушно-сухой массы хвои
В процессе адаптации к стрессовым условиям происходит формирование новых изоэнзимов или стрессовых белков. Согласно нашим данным, содержание стрессовых белков у краснопыльниковой сосны больше весной и повышается осенью, особенно в ноябре. Очевидно, эта форма более чувствительная к воздействию стрессовых факторов в отношении этого показателя весной и осенью по сравнению с желтопыльниковой. В начале ноября наблюдается существенное повышение содержания стрессовых белков у краснопыльниковой формы по сравнению с жёлтопыльниковой сосной ( t =2,46; t o,o5 =2,26). Влияние фактора «форма» на изменчивость этого показателя перед перезимовкой подтверждается однофакторным дисперсионным анализом ( F =6,06; F o,o5 =4,41). В середине июля, в период завершения линейного роста побегов хвоя деревьев краснопыльниковой формы накапливает больше свободного пролина по сравнению с жёлтопыльниковой ( t =2,26; t o,o5 =2,26) (рис. 2). Это свидетельствует в пользу того, что краснопыльниковая сосна более подвержена воздействию стрессовых факторов и в большей степени нуждается в развитии защитных функций. Дисперсионный анализ подтверждает влияние фактора «форма» на изменчивость содержания пролина в июле, после завершения линейного роста ( F =5,13-7,45; F 3,05 =3,97-4,41).
Аскорбиновая кислота (витамин С) наряду с другими соединениями участвует в регуляции окислительновосстановительного потенциала, с которым связана активность многих ферментов и физиолого-биохимических ре- акций, в т.ч. таких жизненно необходимых как фотосинтез и дыхание. Её содержание тесно связано с условиями произрастания и физиологическим состоянием растений [18]. Содержание аскорбиновой кислоты в хвое к осени у обеих форм резко увеличивается (t=8,75-20,50; to,oo1=4,78). Это может быть связано с повышением роли аскорбиновой кислоты как антиоксиданта растительных клеток при воздействии экстремальных факторов среды.
Выводы: в условиях постоянного избыточного увлажнения почвы выявлены существенные различия в сезонной динамике биохимических показателей у форм сосны, свидетельствующие о большей чувствительности и нуждаемости в развитии защитных функций краснопыльниковой сосны по сравнению с жёлтопыльниковой. Наблюдается снижение концентрации хлорофиллов перед перезимовкой и повышение содержания каротиноидов осенью, вследствие общего замедления метаболизма сосны. Установлено увеличение пероксидазной активности осенью (почти в 2 раза) у обеих форм и концентрации стрессовых белков перед перезимовкой у краснопыльниковой сосны, в связи с более экстремальными условиями. Наблюдается существенное снижение содержания свободного пролина после окончания периода вегетации, особенно у краснопыльниковой формы ( t > t o,oo1 ). Осенью происходит значительное увеличение содержания аскорбиновой кислоты у обеих форм сосны.
Исследования выполнялись в рамках государственного задания Федерального исследовательского центра комплексного изучения Арктики РАН (проект № 0410-2014-0025).
Список литературы Изменчивость биохимических показателей и адаптация краснопыльниковой и жёлтопыльниковой форм сосны (Pinus sylvestris L.) в условиях избыточного увлажнения
- Воскресенская, О.Л. Большой практикум по биоэкологии. Ч. 1: учеб. пособие//О.Л. Воскресенская, Е.А. Алябышева, М.Г. Половникова. -Йошкар-Ола.: Мар. гос. ун-т. 2006. 107 с.
- Бояркин, А.Н. Быстрый метод определения активности пероксидазы//Биохимия. 1951. Вып.1, № 4. С. 352-357.
- Головко, Т.К. Пигментный комплекс растений природной флоры Европейского Северо-Востока // Т.К. Головко, И.В. Далькэ, О.В. Дымова, И.Г. и др. // Известия Коми научного центра УрО РАН. 2010. Т. 1. С. 39-46.
- Климов, С.В. Адаптация растений к стрессам через изменение донорно-акцепторных отношений на разных уровнях структурной организации//Успехи современной биологии. 2008. Т. 128, № 3. С. 281-299.
- Крамер, П.Д. Физиология древесных растений: Пер с анг.//П.Д. Крамер, Т.Т. Козловский. -М.: Лесн. Пром-ть, 1983. 464 с.
- Лукаткин, А.С. Холодовое повреждение теплолюбивых растений и окислительный стресс. -Саранск: Изд-во Мордов. ун-та, 2002. 208 с.
- Мамаев, С.А. Формы внутривидовой изменчивости древесных растений (на примере семейства Pinaceae на Урале). -М.: Наука, 1972. 284 с.
- Методы биохимического исследования растений. -М.: Агропромиздат. 1987. 430 с.
- Третьяков, Н.Н. Практикум по физиологии растений//Н.Н. Третьяков, Т.В. Карнаухов, Л.А. Паничкин и др. -М.: Агропромиздат, 1990. 271 c.
- Пятыгин, С.С. Стресс у растений: физиологический подход//Журнал общей биологии. 2008. Т. 69, №. 4. С. 294-298.
- Свалов, В.В. Вариационная статистика. -М.: Лесная промышленность, 1977. 178 с.
- Судачкова, Н.Е. Состояние и перспективы изучения влияния стрессов на древесные растения//Лесоведение. 1998. № 2. С. 3-9.
- Тарханов, С.Н. Лесные экосистемы Северной Двины в условиях атмосферного загрязнения: диагностика состояния//С.Н. Тарханов, Н.А. Прожерина, В.Н. Коновалов. -Екатеринбург: УрО РАН, 2004. 333 с.
- Тарханов, С.Н. Морфоструктура и изменчивость биохимических признаков популяции сосны (Pinus sylvestris L.) в стрессовых условиях устья Северной Двины/С.Н. Тарханов, С.Ю. Бирюков//Сиб. экол. журн. 2014. №2. С. 319-327.
- Тарханов, С.Н. Формы внутрипопуляционной изменчивости хвойных в условиях атмосферного загрязнения (на примере Северо-Двинского бассейна). -Екатеринбург: Изд-во УрО РАН, 2010. 230 с.
- Тарчевский, И.А. Метаболизм растений при стрессе. -Казань: Фэн. 2001. 448 с.
- Чиркова, Т.В. Метаболизм этанола и лактата в тканях древесных растений, различающихся по устойчивости к недостатку кислорода//Физиология растений. 1975. Т. 22. Вып. 5. С. 952-958.
- Чупахина, Г.Н. Адаптация растений к нефтяному стрессу/Г.Н. Чупахина, П.В. Масленников//Экология. 2004. № 5. С. 330-335.
- Чупахина, Г.Н. Количественное определение аскорбиновой кислоты колориметрическим методом: специальный практикум по биохимии и физиологии растений. -Томск: Изд-во Томского ун-та, 1974. С. 27-31.
- Шлык, А.А. Определение хлорофиллов и каротиноидов в экстрактах зелёных листьев/Биологические методы в физиологии растений. -М., 1971. С. 154-170.
- Шуляковская, Т.А. Динамика содержания основных метаболитов в сеянцах сосны обыкновенной/Т.А. Шуляковская, Л.А. Чиненова, С.М. Шредерс, Г.К. Канючкова//Лесоведение. 2005. № 2. С. 53-61.
- Bates, L.S. Rapid determination of free proline for water-stress studies/L.S. Bates, R.P. Waldren, J.D. Teare//Plant and Soil. 1973. Vol. 39. № 1. P. 205-206.
- Lichenthaler, H.K. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes//Methods in Enzymology, 1987. Vol. 148. P. 350-382.
- Lichenthaler, H.K. Vegetation stress: an introduction to the stress concept in plant//J. Plant Physiol. 1996. Vol. 148. P. 4-14.


