Изменчивость конститутивной активности этоксирезоруфин-о-деэтилазы в печени леща ( Abramis brama L.)
Автор: Юрченко Виктория Викторовна
Журнал: Вестник Тверского государственного университета. Серия: Биология и экология @bio-tversu
Рубрика: Биохимия
Статья в выпуске: 3, 2015 года.
Бесплатный доступ
Исследование посвящено изменчивости ЭРОД-активности в печени леща в размерно-возрастном ряду рыб, а также в период репродуктивной активности особей. Согласно полученным результатам, зависимость ЭРОД-активности от размерно-возрастных характеристик леща отсутствует. Отмечена тенденция к повышению активности фермента в печени рыб перед нерестом и снижению во время него. Наибольшие половые различия ЭРОД-активности наблюдались в преднерестовый период. Существующую изменчивость ЭРОД-активности в печени леща следует учитывать при планировании и проведении мониторинговых исследований.
Этоксирезоруфин-о-деэтилаза, эрод, конститутивная активность, лещ
Короткий адрес: https://sciup.org/146116597
IDR: 146116597 | УДК: 574.522
Текст научной статьи Изменчивость конститутивной активности этоксирезоруфин-о-деэтилазы в печени леща ( Abramis brama L.)
Введение. Цитохром Р450-зависимые монооксигеназы играют основную роль в окислительной трансформации широкого спектра эндогенных и экзогенных соединений, таких как стероиды, жирные кислоты, простагландины, а также промышленные загрязнители, биоциды и т. д. (Арчаков, Карузина, 1988; Andersson, Forlin, 1993; Omura, 1999; Estabrook, 2003). Индукция ферментов семейства цитохрома Р450 в организме животных является показателем воздействия ксенобиотиков. В мировой практике каталитическая активность этих ферментов широко используется в качестве биомаркера загрязнения окружающей среды (Payne et al., 1986; Behrens, Segner, 2001; Burger, 2006). В частности, повышенная активность этоксирезоруфин-О-деэтилазы (ЭРОД) в печени рыб свидетельствует о загрязнении водной среды полициклическими ароматическими и/или полигалогенированными углеводородами (Goksoyr, Forlin, 1992; Hahn, Stegeman, 1994).
Использование ЭРОД-активности в целях оценки качества водной среды предполагает изучение конститутивной активности фермента в организме рыб (Balk et al., 1996). В строгом понимании, в
Работа выполнена при поддержке РФФИ (грант № 11-04-01168-а, № 12-05-005 72-а).
-69- естественной популяции нельзя наблюдать конститутивную ЭРОД-активность, так как индукторы этого фермента встречаются в водной среде повсеместно. В данном исследовании под конститутивной понимается ЭРОД-активность, наблюдаемая в печени рыб, не подверженных стрессовому воздействию ксенобиотиков.
Возможно, ЭРОД-активность в некоторой степени зависит от размерно-возрастных характеристик леща, поскольку они могут быть связаны со скоростью метаболизма в организме рыб, а также степенью развития у них жировой ткани, накапливающей стойкие загрязняющие вещества. Вариабельность ЭРОД-активности в годовом цикле может быть связана с нормальными физиологическими изменениями, происходящими в организме рыб. Так, во время нереста уровень ЭРОД-активности может заметно изменяться, сопровождаясь появлением значительных половых различий (Forlin, Haux, 1990; Larsen et al., 1992; Arukwe, Goksoyr, 1997).
В качестве объекта настоящего исследования выступал лещ (Abramis brama L.) Рыбинского вдхр. - массовый вид, регулярно учитываемый методом траловой съёмки (Герасимов, Новиков, 2001). Целью работы было изучение изменчивости конститутивной ЭРОД-активности в печени рыб. В задачи исследования входило измерить ферментативную активность в размерно-возрастном ряду рыб, а также определить значения показателя в преднерестовый, нерестовый и нагульный периоды.
Методика. Для изучения изменчивости ЭРОД-активности в размерно-возрастном ряду рыб отлавливали тралом в Волжском плёсе Рыбинского вдхр. в конце сентября 2012 г. Для исследования изменений ЭРОД-активности в годовом репродуктивном цикле использовался лещ, пойманный неводом в устье р. Сутки, впадающей в водохранилище. Отлов рыб проводили в конце апреля, середине мая и начале октября 2012 г., что соответствует преднерестовому, нерестовому и нагульному периодам.
Рыб, пойманных тралом, помещали в контейнеры с забортной водой и обрабатывали в лаборатории на борту исследовательского судна. Леща, отловленного неводом, пересаживали в контейнеры с речной водой и перевозили в лабораторию для отбора проб. Далее рыб механически обездвиживали, измеряли длину тела (AD) и массу порки, иссекали печень и отбирали чешую для определения возраста. Пробы печени замораживали в жидком азоте.
ЭРОД-активность определяли флюориметрическим методом в постмитохондриальном супернатанте (Whyte et al., 2000). Навеску печени гомогенизировали в фосфатном буфере (100 мМ Na2HPO4, 25
мМ КН2РО4; pH 7.4) в соотношении 1:3. Гомогенат центрифугировали с ускорением 10000 х g при 4°С в течение 30 мин. Супернатант отбирали и хранили в жидком азоте до проведения аналитической процедуры (не более недели). ЭРОД-активность измеряли в 96-луночных планшетах на спектрофлюориметре LS55 (PerkinElmer). Аликвоту супернатанта вносили в реакционную смесь, состоящую из фосфатного буфера, 4.3 мМ Р-НАДФН, 0.01 мМ 7-этоксирезоруфина. Планшеты инкубировали 10 мин при 27°С. Интенсивность флюоресценции резоруфина, образовавшегося в результате реакции, измеряли при длинах волн возбуждения/испускания - 555/585 нм. Количество полученного резоруфина вычисляли с помощью калибровочной кривой, построенной с использованием коммерческого аналога резоруфина (MP Biomedicals). Содержание белка измеряли с использованием 1.08 мкМ раствора флюорескамина в ацетоне при длинах волн возбуждения/испускания — 400/460 нм (Lorenzen, Kennedy, 1993). Количество белка вычисляли на основании калибровочного графика, построенного с использованием стандартных растворов бычьего сывороточного альбумина. Каждую пробу анализировали в трёх повторностях, далее работали со средними значениями. Активность фермента представлена в нмоль резоруфина, образовавшегося за 1 мин и приходящегося на 1 мг белка.
Статистический анализ результатов проводили с использованием непараметрических методов статистики, так как распределение изучаемого признака отличалось от нормального. Статистическую значимость различий между анализируемыми выборками определяли при помощи одностороннего дисперсионного анализа Краскела-Уоллиса и критерия Манна-Уитни-Уилкоксона. Для выявления корреляционных зависимостей ЭРОД-активности в печени леща от длины, массы тела и возраста рыб применяли коэффициент ранговой корреляции Спирмена.
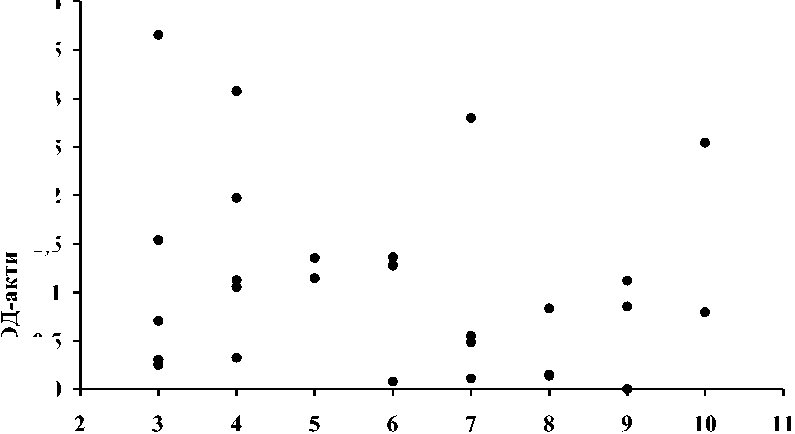
Результаты и обсуждение. Для определения изменчивости ЭРОД-активности в печени леща в размерно-возрастном ряду использовано 28 особей (возраст от 2+ до 10+ лет, длина 139-363 мм, масса порки 48-925 г). Полученные коэффициенты корреляции ЭРОД-активности и длины/массы/возраста рыб указывают на отсутствие статистически значимой связи переменных (гд = -0,23; гм = -0,25; гв = -0,23; р>0,05). ЭРОД-активность в печени рыб в размерном и возрастном рядах представлена на рис. 1 и 2, соответственно.
Я Я
S я Ч с 3
Я
4 1
3,5 -
3 -
2,5 -
2 -
я аа я н У я
1,5 -
1 -
О
0,5 -
0 4—
Длина тела (AD), мм
Рис.
1 .
Изменчивость ЭРОД-активности в печени леща в размерном ряду рыб
3,5
2,5
1,5
я м
Я Я 3
0,5
m
о
Возраст, полных лет
Рис. 2. Изменчивость ЭРОД-активности в печени леща в возрастном ряду рыб
3 "я ч о 3 с
Для исследования изменчивости ЭРОД-активности, связанной с нерестом, использовано 52 особи леща. Размерные характеристики рыб и результаты анализа представлены в табл. 1. Наибольшая ферментативная активность в печени рыб наблюдалась в конце апреля, что соответствовало преднерестовому периоду. Во время нереста
(середина мая) ЭРОД-активность опустилась до уровня, наблюдаемого в нагульный период (начало октября).
В весенний период наблюдались половые различия изучаемого показателя (рис. 3). ЭРОД-активность самцов и самок в большей степени отличалась в преднерестовый период, но различие между выборками не было статистически значимым (критерий Колмогорова-Смирнова, р>0,05).
Таблица 1 ЭРОД-активность в печени леща в преднерестовый, нерестовый и нагульный периоды
|
Дата отлова |
N |
ЭРОД-активность, пмоль/мг/мин |
AD, мм |
М, г |
|
28.04.2012 |
20 |
0,83±0,14Ь |
357±5а |
844±42а |
|
15.05.2012 |
20 |
0,15±0,02а |
395±4b |
1085±31b |
|
04.10.2012 |
12 |
0,18±0,06 а |
359±10а |
806±68а |
|
р-величина |
<0,001 |
<0,001 |
<0,001 |
|
Примечание. N - количество особей в выборке; AD - промысловая длина тела; М -масса порки. Значения приводятся в виде среднего арифметического и его стандартной ошибки; р — величины получены при проведении одностороннего дисперсионного анализа Краскела-Уоллиса; буквенные индексы присвоены значениям по результатам попарного сравнения выборок с применением критерия Колмогорова-Смирнова
В естественной среде обитания лещ, будучи бентофагом, постоянно испытывает то или иное влияние загрязняющих веществ, сорбированных донными отложениями. Поэтому с возрастом в тканях рыб может происходить увеличение концентрации стойких органических загрязнителей (Monod, Keck, 1982). Накопление ксенобиотиков в организме сопровождается индукцией ЭРОД, поэтому у взрослых особей может наблюдаться более высокая активность фермента (Hugla et al., 1995; Sleiderink et al., 1995). В настоящем же исследовании не было установлено зависимости ЭРОД-активности от размерно-возрастных характеристик леща. Полученные данные указывают на то, что молодые особи в локальной группировке могут иметь более высокую ЭРОД-активность по сравнению с взрослыми рыбами. Об отсутствии связи между ЭРОД-активностью и возрастом леща также сообщается в исследовании, проведённом на рыбах из р. Эльбы (Jedamski-Grymlas et al., 1995).
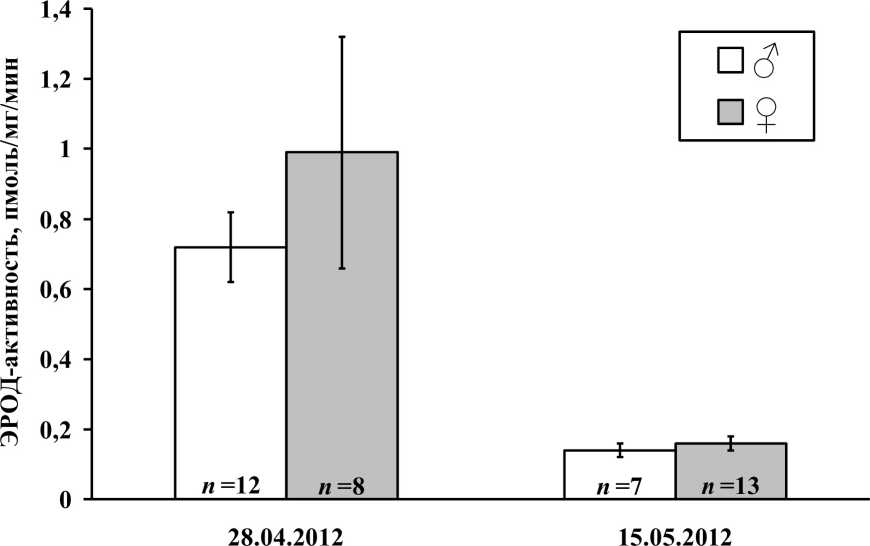
Рис. 3 . ЭРОД-активность в печени леща в весенний период.
Диаграмма построена на основании средних значений параметра в печени самцов и самок леща; ^-погрешности обозначают ошибку среднего арифметического; п - количество особей в выборке
Изменения уровня ЭРОД-активности в печени рыб, связанные с репродуктивной активностью, характеризуются как межвидовыми, так и половыми различиями. Так, например, ЭРОД-активность самок палтуса (Scophthalmus maximus L.) в нерестовый период возрастала и оставалась высокой в постнерестовый период, а у самцов - значительно снижалась во время нереста и возрастала после (Arukwe, Goksoyr, 1997). У лосося (Salmo salar L.) отмечена тенденция к увеличению ЭРОД-активности в период нереста и уменьшению в постнерестовый период; при этом уровень активности фермента в печени самок может превышать таковой у самцов (Larsen et al., 1992). У леща же в соответствии с полученными данными в преднерестовый период ЭРОД-активность повышается, а во время нереста снижается до обычного уровня. Половые различия в большей степени проявляются в преднерестовый период.
Преднерестовые изменения в организме рыб связаны с синтезом половых стероидов. Так, 17|3-эстрадиол вызывает в печени интенсивный синтез вителлогенина, предшественника белков желтка ооцитов (Shapiro, 1982; Mommsen, Walsh, 1988). Многие стероиды являются естественными индукторами ЭРОД (Danielson, 2002), поэтому с увеличением содержания половых стероидных гормонов во время активного созревания гонад следовало бы ожидать повышение ЭРОД- активности в печени рыб. Однако, в ряде исследований было показано, что 17Р-эстраднол, напротив, подавляет синтез цитохрома Р450 и, соответственно, снижает ЭРОД-активность в печени рыб (Pajor et al., 1990; O’Hare et al., 1995). Поэтому на данном этапе исследования трудно объяснить наблюдаемые изменения уровня ЭРОД-активности. Можно лишь констатировать, что физиологические перестройки, происходящие в организме рыб в связи с нерестом, определяют вариабельность ферментативной активности в печени рыб в годовом репродуктивном цикле.
Заключение. В настоящем исследовании отмечено отсутствие статистически значимой связи ЭРОД-активности в печени леща и размерно-возрастных характеристик рыб. Выявлена тенденция к повышению ЭРОД-активности в преднерестовый период относительно уровня, наблюдаемого в нерестовый и нагульный периоды. Также показано, что половые различия изучаемого показателя в большей степени проявляются на преднерестовой стадии. Существующие флуктуации ЭРОД-активности в печени леща следует учитывать при планировании и проведении мониторинговых исследований с использованием этого вида рыб.
Благодарности. Автор благодарен Ю.В. Герасимову и Г.М. Чуйко за организацию полевых исследований, Д.Д. Павлову, А.А. Морозову и Т.Б. Лапировой - за помощь в сборе материала, Т.П. Крицыной - за предоставленные данные о возрасте рыб.
Юоченко В.В. Изменчивость конститутивной активности этоксирезоруфин-о-деэтилазы в печени леща (Abramis brama L.) / В.В. Юрченко // Вести. ТвГУ. Сер.: Биология и экология. 2015.№ 3. С. 69-77.
Список литературы Изменчивость конститутивной активности этоксирезоруфин-о-деэтилазы в печени леща ( Abramis brama L.)
- Арчаков А.И., Карузина И.И. 1988. Окисление чужеродных соединений и проблемы токсикологии//Вестн. АМН СССР. № 1. С. 14-18.
- Герасимов Ю.В., Новиков Д.А. 2001. Ихтиомасса и распределение рыб в Рыбинском водохранилище//Экологические проблемы Верхней Волги/ред. А.И. Копылов. Ярославль: ЯГТУ. С. 194-202.
- Andersson T., Förlin L. 1992. Regulation of the cytochrome P450 enzyme system in fish//Aquat. Toxicol. V. 24. P. 1-20.
- Arukwe A., Goksøyr A. 1997. Changes in three hepatic cytochrome P450 subfamilies during a reproductive cycle in turbot (Scophthalmus maximus L.)//J. Exp. Zool. V. 277. P. 313-325.
- Balk L., Larsson A., Förlin L. 1996. Baseline studies of biomarkers in the feral female perch (Perca fluviatilis) as tools in biological monitoring of anthropogenic substanses//Mar. Environ. Res. V. 42. № 1-4. P. 203-208.
- Behrens A., Segner H. 2001. Hepatic biotransformation enzymes of fish exposed to non-point sourse pollution in small streams//J. Aquat. Ecosys. Stress Recov. V. 8. P. 281-297.
- Burger J. 2006. Bioindicators: types, development, and use in ecological assessment and research//Envir. Bioin. 2006. V. 1. P. 22-39.
- Danielson P.B. 2002. The Cytochrome P450 Superfamily: Biochemistry, Evolution and Drug Metabolism in Humans//Curr. Drug Metab. V. 3. № 6. P. 561-597.
- Estabrook R.W. 2003. A passion for P450s (remembrances of the early history of research on cytochrome P450)//Drug Metab. Dispos. V. 31. P. 1461-1473.
- Förlin L., Haux C. 1990. Sex differences in hepatic cytochrome P-450 monooxygenase activities in rainbow trout during an annual reproductive cycle//J. Endocrinol. V. 124. P. 207-213.
- Goksøyr A., Forlin L. 1992. The cytochrome P-450 system in fish, aquatic toxicology and environmental monitoring//Aquat. Toxicol. V. 22. P. 287-312.
- Hahn M.E., Stegeman J.J. 1994. Regulation of cytochrome P4501A1 in Teleosts: sustained induction of CYP1A1 mRNA, protein, and catalytic activity by 2,3,7,8-tetrachlorodibenzofuran in the marine fish Stenotomus chrysops//Toxicol. Appl. Pharm. V. 127. Is. 2. P. 187-198.
- Hugla J.L., Philippart J.C., Kremers P., Goffinet G., Thome J.P. 1995. PCB contamination of the common barbel, Barbus barbus (Pisces, Cyprinidae), in the River Meuse in relation to hepatic monooxygenase activity and ultrastructural liver change//Neth. J. Aquat. Ecol. V. 29, № 1. P. 135-145.
- Jedamski-Grymlas J., Kammann U., Tempelmann A., Karbe L., Siebers D. 1995. Biochemical responses and environmental contaminants in breams (Abramis brama L.) caught in the River Elbe//Ecotox. Environ. Safe. V. 31. P. 49-56.
- Larsen H.E., Celander M., Goksøyr A. 1992. The cytochrome P450 system of Atlantic salmon (Salmo salar): II. Variations in hepatic catalytic activities and isozyme patterns during an annual reproductive cycle//Fish Physiol. Biochem. V. 10, № 4. P. 291-301.
- Lorenzen A., Kennedy S.W. 1993. A fluorescence based protein assay for use with microplate reader//Anal. Biochem. V. 214. № 1. P. 346-348.
- Mommsen T.P., Walsh P.J. 1988. Vitellogenesis and oocyte assembly//Fish Physiology/W.S. Hoar, D.J. Randall, Eds. New York: Academic Press. Р. 347-406.
- Monod G., Keck G. 1982. PCBs in Lake Geneva (Lake Leman) Fish//B. Environ. Contam. Tox. V. 29. P. 570-576.
- O'Hare D.B., Siddall R., Robotham P.W.J., Gill R.A. 1995. Influence of oestradiol on induction of EROD activity in roach (Rutilus rutilus L.)//Chemosphere. V. 30. № 8. P. 1423-1428.
- Omura T. 1999. Forty years of cytochrome P450//Biochem. Bioph. Res. Co. V. 266. № 3. P. 690-698.
- Pajor A.M., Stegeman J.J., Thomas P., Woodin B.R. 1990. Feminization of the hepatic microsomal cytochrome P-450 system in brook trout by estradiol, testosterone, and pituitary factors//J. Exp. Zool. V. 253. № 1. P. 51-60.
- Payne J.F., Fancey L.L., Rahimtula A.D., Porter E.L. 1987. Review and perspective on the use of mixed-function oxygenase enzymes in biological monitoring//Comp. Biochem. Phys. C. V. 86. № 2. P. 233-245.
- Shapiro D. 1982. Steroid hormone regulation of vitellogenine gene expression//CRC Crit. Rev. Biochem. V. 12. P. 187-203.
- Sleiderink H.M., Oostingh L., Goksøyr J., Boon J.P. 1995. Sensitivity of cytochrome P450 1A induction in dab (Limanda limanda) of different age and sex as a biomarker for environmental contaminants in the southern North Sea//Arch. Environ. Con. Tox. V. 28. P. 423-430.
- Whyte J.J., Jung R.E., Schmitt C.J., Tillitt D.E. 2000. Ethoxyresorufin-O-deethylase (EROD) activity in fish as a biomarker of chemical exposure//Crit. Rev. Toxicol. V. 30. № 4. P. 347-570.


