Изменчивость полифенолоксидазной и пероксидазной активности агродерново-подзолистой почвы разной окультуренности с биоуглем
Автор: Рижия Е.Я., Бойцова Л.В., Вертебный В.Е., Horak J., Москвин М.А., Дубовицкая В.И., Хомяков Ю.В.
Журнал: Сельскохозяйственная биология @agrobiology
Статья в выпуске: 3 т.57, 2022 года.
Бесплатный доступ
Биоуголь относится к новым видам органогенных мелиорантов. Он производится посредством высокотемпературного бескислородного пиролиза из возобновляемой биомассы для секвестрации углерода в почвах и снижения эмиссии парниковых газов. Перспектива использования биоугля на землях сельскохозяйственного назначения обусловливает пристальное внимание к различным аспектам его воздействия на свойства и функционирование компонентов агроценозов. В представленной работе мы впервые установили, что двухлетнее нахождение биоугля в дерново-подзолистой супесчаной почве способствовало изменчивости функциональных групп на его поверхности, что выразилось в росте количества гидроксильных (-ОН), карбонильных (С=О) и карбоксилатных (СОО-) групп по сравнению с исходным биоуглем и в тенденции к увеличению минерализации органического вещества, исходя из активности полифенолоксидазы и пероксидазы. Цель работы - оценка изменчивости полифенолоксидазной и пероксидазной активности в агродерново-подзолистой почве с разной степенью окультуренности при внесении в нее биоугля, а также определение окисленности поверхности биоугля после инкубации в почве. Полевые исследования проводили в течение вегетационных периодов 2019 и 2020 годов на территории экспериментальной опытной станции Агрофизического научно-исследовательского института (пос. Меньково, Гатчинский р-н, Ленинградская обл.). Опытные делянки размером 4 м2 размещали на почве со средней (СОК) и высокой (ВОК) степенью окультуренности. Схема опыта включала по два варианта в 3-кратной повторности: контроль (без биоугля) и опыт (почва с биоуглем в дозе 20 т/га, который вносили в верхний слой 0-10 см). Использовали древесный уголь из березы ( Betula pendula Roth) сорта Премиум, произведенный быстрым пиролизом при температуре 600 °C. Химическая характеристика биоугля: Сорг. - 88,9 %, Nобщ. - 0,43 %, H - 3,2 %, O - 5,1 %, pHН2О 8,3, Wгв - 3,1 %, зольность - 1,8 %. В 2019 году на делянках возделывали викоовсяную смесь (вика посевная яровая Vicia sativa L. сорта Льговский и овес яровой Avеna satíva L. сорта Боррус в соотношении 30 % к 70 %) из расчета 200 кг/га (или по 85 г на 4 м2). В 2020 году возделывался люпин белый ( Lupinus albus L.) сорта Дега как сидерат под озимую пшеницу из расчета 200 кг/га. Отбор почвенных образцов и биоугля при помощи почвенного бура Эндельмана («Royal Eijkelkamp B.V.», Нидерланды) из слоя гумусового горизонта 0-10 см проводили с интервалом 14 сут с мая по август включительно. Активность пероксидазы и полифенолоксидазы изучали фотоколориметрическим методом по А.Ш. Галстяну соответственно при λ = 440 нм и λ = 590 нм. Расчет коэффициента гумификации (Кгум.) проводился по отношению активности полифенолоксидазы (ПФО) к активности пероксидазы (ПО). Для оценки временных изменений окисленности поверхности биоугля определяли содержание кислородсодержащих групп методом ИК-спектрометрии (спектрометр ФСМ 2202 типа Майкельсона, «Инфраспек», Россия). Была выявлена общая тенденция повышения активности изучаемых ферментов при внесении биоугля в почву: в среднем на 13 % (средняя степень окультуренности) и 12 % (высокая степень окультуренности). Активность ПО была в среднем в 1,5 раза выше, чем активность ПФО, и статистически значимо (p гум. в почве с СОК был примерно на 20 % ниже, чем в почве с ВОК, где сформировались оптимальные условия (температура, влажность, количество органического вещества) для процессов синтеза гумуса. Оказалось, что во всех вариантах опыта Кгум. 1, что свидетельствует о преобладании процессов минерализации гумусовых веществ в почве над их иммобилизацией. При этом биоуголь усиливал минерализацию органического вещества в среднем на 11,5 % по сравнению с почвами без биоугля. После инкубации биоугля в почве в течение 17 мес отмечена тенденция роста количества гидроксильных (-ОН), карбонильных (С=О) и карбоксилатных (СОО-) групп по сравнению с исходным биоуглем, что согласуется с данными по увеличению активности ПФО и ПО в исследуемых почвах. Основываясь на результатах изменения значений ПФО, ПО, ИК-спектров, можно утверждать, что внесенный биоуголь оставался в стабильной форме и не оказывал существенного влияния на ферментативную активность почв.
Дерново-подзолистая супесчаная почва, биоуголь, пероксидаза, кф 1.11.1.7, полифенолоксидаза, кф 1.10.3.1, ик-спектры биоугля
Короткий адрес: https://sciup.org/142236338
IDR: 142236338 | УДК: 631.4/.6:631.95:57.042 | DOI: 10.15389/agrobiology.2022.3.476rus
Текст научной статьи Изменчивость полифенолоксидазной и пероксидазной активности агродерново-подзолистой почвы разной окультуренности с биоуглем
Использование биоугля как высокоуглеродистого пористого мелиоранта, произведенного из отходов различной биомассы, вызывает огромный 476
интерес из-за его потенциальных преимуществ для устойчивого развития сельского хозяйства и снижения негативного воздействия аграрной деятельности на окружающую среду (1-4). При бескислородном пиролизе алифатические цепи углерода в исходной биомассе переходят в устойчивые ароматические и могут сохраняться в почве в течение сотен лет (5). После попадания в почвенную среду начинается так называемое старение биоугля из-за происходящих в почве водно-физических процессов — увлажнения, иссушения, замораживания и оттаивания (6-10). Еще до внесения в почву биоуголь, будучи гидрофобным по своей химической структуре, начинает окисляться в воздушной среде и увеличивать гидрофильность (11). Гидрофильность угля во многом зависит от температуры пиролиза и типа сырья. Так, содержание доступной воды в биоугле, произведенном из виноградной лозы, увеличивалось с повышением температуры пиролиза, при этом оптимальные результаты достигаются при 700 °C (12). Анализ древесных и травяных биоуглей, полученных при 400 и 650 °C и находящихся как в почве, так и непосредственно на воздухе в течение 15 мес, показал относительное увеличение количества O-содержащих функциональных групп, включая замещенный арил-, карбоксил- и карбонил-C в результате абиотического и микробного окисления биоугля, а также потери O-алкильных групп вследствие выщелачивания (13).
Кроме того, в почве начинает действовать биохимический процесс разложения биоугля микроорганизмами (14, 15). Он лимитируется факторами внешней среды, доступностью органических соединений, необходимых для жизнедеятельности микроорганизмов, и проявляется в изменении функциональных групп на поверхности биоугля (16, 17). Многие вопросы, связанные с влиянием биоугля на компоненты природной среды, в частности направленность биохимических изменений, протекающих в почве, до сих пор мало изучены.
В представленной работе мы впервые установили, что двухлетнее нахождение биоугля в дерново-подзолистой супесчаной почве способствовало изменчивости функциональных групп на его поверхности, что выразилось в росте количества гидроксильных (–ОН), карбонильных (С=О) и карбоксилатных (СОО–) групп по сравнению с исходным биоуглем и в тенденции к усилению минерализации органического вещества, исходя из активности полифенолоксидазы и пероксидазы.
Цель работы — оценка изменчивости полифенолоксидазной и пероксидазной активности в агродерново-подзолистой почве с разной степенью окультуренности при внесении в нее биоугля, а также определение окисленности поверхности биоугля после инкубации в почве.
Методика. Полевые исследования проводили в течение вегетационных периодов 2019 и 2020 годов на территории экспериментальной опытной станции Агрофизического научно-исследовательского института (пос. Мень-ково, Гатчинский р-н, Ленинградская обл.).
Опытные делянки размером 4 м2 размещали на парцеллах Агрофизического стационара на почве со средней (СОК) и высокой степенью окультуренности (ВОК), а также на контрольных участках без внесения минеральных удобрений. Содержание физической глины в среднеокультурен-ной почве составляло 12-15 %, в высокоокультуренной — 17-19 %. Схема опыта включала по два варианта в 3-кратной повторности: контроль (без биоугля) и опыт (почва с биоуглем в дозе 20 т/га, который вносили в верхний слой 0-10 см). Среднеокультуренная почва характеризовалась следующими параметрами: содержание С орг. — 1,53 %, N общ. — 0,17 %, N-NO 3 —
-
16,4 мг/кг, N-NH 4 — 5,6 мг/кг почвы, подвижные P 2 O 5 — 255 мг/кг, K 2 O — 112 мг/кг почвы (по Кирсанову), рН KCl 5,3; высокоокультуренная почва: С орг. — 2,92 %, N общ. — 0,28 %, N-NO 3 — 22,3 мг/кг, N-NH 4 — 6,7 мг/кг почвы; подвижные P 2 O 5 — 994 мг/кг, K 2 O = 542 мг/кг почвы, рН KCl 6,4.
Использовали древесный уголь из березы ( Betula pendula Roth) сорта Премиум (марки А; фракция с размером частиц угля 0,5-2 см), произведенный быстрым пиролизом при температуре 600 °C. Химическая характеристика биоугля: С орг. — 88,9 %, N общ. — 0,43 %, H — 3,2 %, O — 5,1 %, pH Н2О 8,3, W гв — 3,1 %, зольность — 1,8 %.
В 2019 году на делянках возделывали викоовсяную смесь (вика посевная яровая Vicia sativa L. сорта Льговский и овес яровой Avena sativa L. сорта Боррус в соотношении 30 % к 70 %) из расчета 200 кг/га (или по 85 г на 4 м2). Посев проводили 21 мая. В 2020 году возделывали люпин белый ( Lupinus albus L.) сорта Дега как сидерат под озимую пшеницу из расчета 200 кг/га, дата посева — 15 мая, дата запашки — 16 августа. Посев озимой пшеницы состоялся 3 сентября 2020 года.
Метеорологические данные фиксировались на метеостанции, расположенной в 200 м от экспериментального участка.
Образцы почвы и биоугля отбирали при помощи почвенного бура Эндельмана («Royal Eijkelkamp B.V.», Нидерланды) из слоя гумусового горизонта 0-10 см с интервалом 14 сут с мая по август включительно. Активность пероксидазы и полифенолоксидазы изучали фотоколориметрическим методом по А.Ш. Галстяну соответственно при X = 440 и X = 590 нм (18). Коэффициент гумификации (К гум. ) рассчитывали по отношению активности полифенолоксидазы (ПФО) к активности пероксидазы (ПО). Для оценки временных изменений окисленности поверхности биоугля определяли содержание кислородсодержащих групп методом ИК-спектрометрии. Применяли приставку для измерения многократного нарушенного полного внутреннего отражения с кристаллом ZnSe на спектрометре ФСМ 2202 типа Майкельсона («Инфраспек», Россия) с самокомпенсацией (не требует динамической юстировки в диапазоне волновых чисел 7800-600 см - 1).
Статистическую обработку данных осуществляли в программах Microsoft Excel и Statistics 8.0, вычисляли средние значения ( M ), стандартные отклонения (±SEM) и коэффициенты линейной корреляции при уровне значимости p < 0,05. Достоверность различий средних значений оценивали с помощью дисперсионного анализа (ANOVA).
Результаты . Опыты проводили в Нечерноземной зоне России, относящейся к умеренно-холодному поясу (19). Сравнивая вегетационные периоды 2019 и 2020 годов, можно отметить общие черты гидрометеорологических показателей по месяцам. Май был холодным, со средним количеством осадков до 80 мм, июнь — жарким и засушливым, июль — теплым и влажным, август — теплым, но в 2020 году еще и влажным по сравнению с умеренно-влажным 2019 годом, сентябрь — холодным и умеренно-влажным. За вегетационный период 2019 года выпало 451 мм осадков, 2020 года — 517 мм осадков.
Интенсивность ферментативных процессов зависит от конкретных условий, складывающихся в почве, и изменчива в пространстве. Горизонтальная изменчивость зависит от температуры, влажности и интенсивности поступления свежей органики, вертикальный градиент — от качества органического вещества и физических свойств почвы (20). Полифенолоксидаза (ПФО; о-дифенол:кислород-оксидоредуктаза, КФ 1.10.3.1) — один из важнейших ферментов, участвующий в окислении органических соединений ароматического ряда и процессе образования гумуса (21).
В наших опытах между вариантами с разной окультуренностью почвы существовала достоверная разница (p < 0,05) по активности ПФО, в то время как внесение биоугля приводило лишь к несущественному увеличению показателя на 10-13 % (рис. 1).
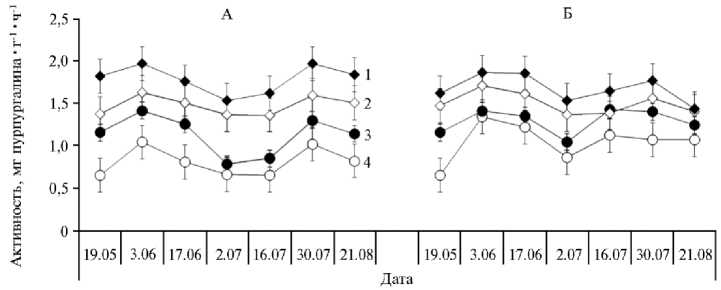
Рис. 1. Динамика полифенолоксидазной (КФ 1.10.3.1) активности дерново-подзолистых почв со средней (СОК) и высокой (ВОК) степенью окультуренности под влиянием биоугля, полученного пиролизом из древесины березы сорта Премиум, при выращивании викоовсяной смеси в 2019 году (А) и люпина белого в 2020 году (Б) : 1 — ВОК с биоуглем, 2 — ВОК без биоугля, 3 — СОК с биоуглем, 4 — СОК без биоугля (пос. Меньково, Гатчинский р-н, Ленинградская обл.).
Динамика ПФО в почве как со средней, так и с высокой степенью окультуренности описывалась возрастающей кривой в начальные периоды вегетации выращиваемых культур (викоовсяной смеси и люпина), что, как правило, связано с активным ростом корней растений, достаточно низкими температурами почвы и оптимальной влажностью. Ко II декаде июня, когда температура почв начинала расти, но фиксировалась засуха, наблюдалось снижение этого показателя. К концу июля с увеличением количества выпавших осадков отмечалось существенное (p < 0,05) возрастание активности ПФО, а к концу вегетационного периода — снижение. Относительно возросшие значения активности полифенолоксидазы к концу июля представляются как суммарный результат созревания растений, роста численности микроорганизмов, интенсификации разложения растительных остатков в условиях более благоприятного гидротермического режима (22).
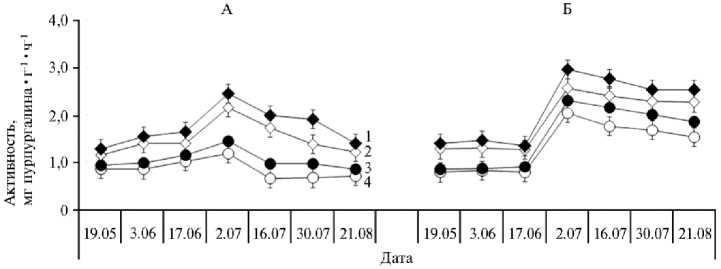
Рис. 2. Динамика пероксидазной (КФ 1.11.1.7) активности дерново-подзолистых почв со средней (СОК) и высокой степенью окультуренности (ВОК) под влиянием биоугля, полученного пиролизом из древесины березы сорта Премиум, при выращивании викоовсяной смеси в 2019 году (А) и люпина белого в 2020 году (Б) : 1 — ВОК с биоуглем, 2 — ВОК без биоугля, 3 — СОК с биоуглем, 4 — СОК без биоугля (пос. Меньково, Гатчинский р-н, Ленинградская обл.).
Пероксидаза (ПО, КФ 1.11.1.7) — фермент, окисляющий органические вещества с участием пероксида водорода (органического вещества почвы, в том числе гумусовых веществ) (22, 23). Активность ПО в дерновоподзолистой супесчаной почве была в среднем за вегетацию в 1,5 раза выше, чем активность ПФО, и достоверно (p < 0,05) зависела от степени окульту-ренности, то есть чем выше была окультуренность почвы, тем выше оказывалась ее пероксидазная активность (рис. 2). Кроме того, в отличие от ПФО, активность ПО с повышением температуры существенно увеличивалась.
Внесение биоугля, помимо влияния на скорость потребления кислорода, оказывало воздействие на продуцирование пероксидазы, которая как в почве с СОК, так и с ВОК, увеличилась на 13 %. Максимальные показатели активности этого фермента во всех вариантах опыта наблюдались в начале июля, достигая значений 2,3 и 3,0 мг пурпургалина•г - 1•ч - 1 соответственно для вариантов почвы с СОК и ВОК.
Интенсивность гумусообразования характеризуется коэффициентом гумификации (К гум. ), который представляет собой отношение активности полифенолоксидазы к активности пероксидазы (24). Расчеты показали, что во всех вариантах эксперимента К гум. < 1, что свидетельствовало о преобладании процессов минерализации гумусовых веществ, растительных остатков и неспецифических органических соединений в почве над их синтезом. К гум. в почве с СОК был примерно на 20 % ниже, чем в почве с ВОК. Внесение биоугля способствовало увеличению К гум. в среднем на 11-12 % по сравнению с почвами без биоугля.
А
Б
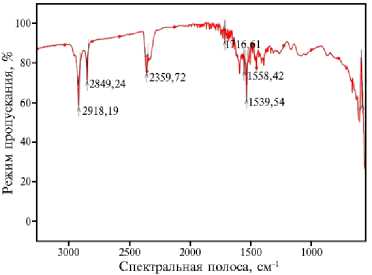
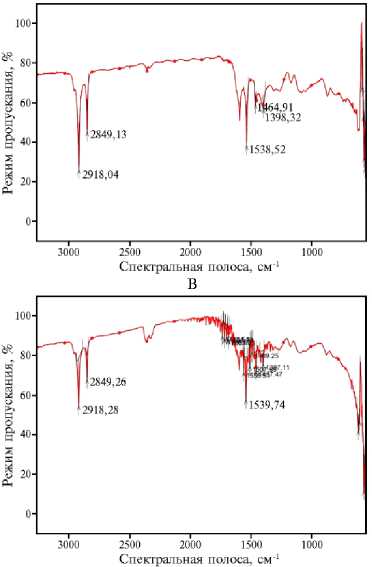
Рис. 3. ИК-спектры образцов биоугля, полученного пиролизом из древесины березы сорта Премиум: А — нативный биоуголь (контроль) (май 2019 года), Б — биоуголь после инкубации в почве со средней степенью окультуренности (в конце вегетации, август 2020 года), В — биоуголь после инкубации в почве с высокой степенью окультуренности (в конце вегетации, август 2020 года) (пос. Меньково, Гатчинский р-н, Ленинградская обл.).
Основные изменения в ферментативной активности почв с био- углем могут быть связаны с преобра зованием органических функциональных групп на поверхности биоугля
(увеличением количества –COO– и –O– групп), а также со способностью частиц биоугля поглощать ионы H+. Изменение ферментативной активности почвы происходит за счет сорбции на поверхности биоугля ферментов с образованием матрично-ферментных комплексов, которые более устойчивы и стабильны в почве, обладают большей ферментативной активностью. Также уголь сорбирует из почвенного раствора различные низкомо- лекулярные и растворимые высокомолекулярные органические соединения (углеводы, органические кислоты, соединения ароматического ряда, в том числе фенолкарбоновые кислоты, фенолы и др.), которые могут быть идентифицированы методами ИК Фурье-спектрометрии функциональных групп. Они локализованы на поверхности угля и служат субстратами для деятельности микроорганизмов, сорбированных на угле.
Исследования временных изменений окисленности поверхности биоугля позволило выявить на ИК-спектрах в режиме поглощения ряд зон с увеличенной интенсивностью колебаний, характеризующих изменение поверхности угля после нахождения его в почвах. Исходный уголь (рис. 3, А) имел полосы в области 1500-1100 см - 1, характерные для групп С–О и С=О, и полосы в районе 2900 см - 1, которые указывали на наличие алифатических групп, в том числе характерных для альдегидов (связи С–Н в состоянии sp3-гибридизации) (25). Также наблюдалась выраженная интенсивность колебательного спектра в области 1600 см - 1, характерная для хиноидных групп ароматических соединений.
После инкубации биоугля в почве в течение 17 мес наблюдалось увеличение содержания различных кислородсодержащих групп, кроме хиноидных, где интенсивность колебаний в области 1600 см - 1 убывала более чем в 2 раза по сравнению с контролем, а также уменьшилось содержание алифатических групп (полосы в районе 2900 см - 1). В содержании гидроксильных (–ОН), карбонильных (С=О) и карбоксилатных (СОО–) групп на поверхности биоугля отмечен тренд их увеличения (1539-1540 см - 1). В целом биоуголь за два вегетационных периода практически остался в стабильном состоянии, а значительное уменьшение доли алифатических групп при незначительной динамике кислородсодержащих свидетельствовало о взаимодействии с компонентами почвенного раствора.
В большинстве работ по изучению влияния биоугля на микробную активность в почвах показано, что она увеличивается, но интенсивность воздействия зависит от свойств исходной биомассы, из которой произведен биоуголь, условий пиролиза (продолжительности и температуры) и той почвы, в которую биоуголь непосредственно вносят (1, 26, 27). Биомасса обычно определяет химический состав, количество макропор и содержание питательных веществ в биоугле, а условия пиролиза — изменения морфологии и структуры поверхности в исходном сырье и соотношение С:Н (28).
Следует отметить, что сведения о воздействии различных биоуглей на ферментативную активность и связанные с ней химические свойства почв до настоящего времени противоречивы. Так как ферменты — это белки, все факторы, влияющие на белок, будут влиять и на активность фермента, а внесенный в почву биоуголь, как уже доказано, изменяет газообмен и удельную поверхность почвы, ее водоудерживающую способность и другие физические и химические свойства (1, 29). Большая удельная поверхность биоугля помогает адсорбировать лабильные вещества из окружающей среды, что сказывается на активности различных ферментов, расщепляющих такие вещества до простых молекул, которые используются в дальнейшем бактериями и грибами в первичном и вторичном метаболизме (30).
Мы в своих опытах выявили общую тенденцию повышения активности пероксидазы и полифенолоксидазы при внесении биоугля в почву: в среднем на 13 % (средняя степень окультуренности) и 12 % (высокая степень окультуренности). Активность ПО была в среднем в 1,5 раза выше, чем активность ПФО, и статистически значимо (p < 0,05) зависела от степени окультуренности почвы. J. Park с соавт. (31) и S. Kumar с соавт. (32)
отмечали положительное влияние биоугля на ферменты, судя по усиливающему поглощению углерода, азота и фосфора из почвы. J. Paz-Ferreiro с соавт. (33), F. Wu с соавт. (34) и J. Lehman с соавт. (1) указывали на негативные эффекты биоуглей, снижающие ферментативную активность по сравнению с почвами без биоугля. Механизмы, объясняющие подобные противоречивые наблюдения, долгое время не были выявлены. Оказалось, что сорбция вещества и внеклеточных ферментов, различающихся по функциональным группам на поверхности биоугля, способна усиливать или ограничивать ферментативную реакцию, а характеристики биоугля как сорбента могут меняться со временем (11). Наша работа описывает процессы, приводящие к изменению состояния функциональных групп на поверхности биоугля с течением времени. В других исследованиях также показано, что старение мелиоранта приводит к появлению на его поверхности большего количества карбоксильных функциональных групп, более высокому содержанию кислорода в биоугле и более низкому — общего углерода (35). F.V.D.N. Tozzi с соавт. (36) оценили стабильность углерода в биоугле и его влияние на поверхностно-активные вещества при использовании древесного биоугля для секвестрации углерода в почве. После 120 сут инкубации было установлено увеличение степени минерализации углерода на 0,4-9,3 % (в зависимости от типа почвы), что свидетельствовало о его высокой стабильности. Это также подтверждается нашими данными о незначительном изменении содержания углерода в древесном биоугле за двухлетнее нахождение в почве.
Окисление биоугля в почвах может приводить к увеличению плотности кислородсодержащих функциональных групп на его поверхности. Высокая плотность кислородcодержащих функциональных групп, выявляемых методом ИК-спектроскопии (37), способствует увеличению сродства поверхности биоугля к адсорбции молекул воды, питательных элементов и органических соединений (38-40).
Таким образом, за 17 мес эксперимента активность полифенолокси-дазы (ПФО) и пероксидазы (ПО) в дерново-подзолистых супесчаных почвах при внесении биоугля возрастала в среднем на 13 % (средняя степень окультуренности) и 12 % (высокая степень окультуренности) по сравнению с вариантами без биоугля. Активность ПО была в среднем в 1,5 раза выше, чем активность ПФО и достоверно (p < 0,05) зависела от степени окульту-ренности почвы. Коэффициент гумификации в почве с СОК был примерно на 20 % ниже, чем в почве с ВОК, и во всех вариантах опыта оказался меньше 1, что свидетельствует о преобладании процессов минерализации гумусовых веществ в почве над их иммобилизацией. При внесении биоугля наблюдалось увеличение показателя К гум. на 11-12 % по сравнению с почвами без биоугля. В биоугле после инкубации в почве отмечена тенденция роста количества гидроксильных (–ОН), карбонильных (С=О) и карбоксилатных (СОО–) групп по сравнению с исходным биоуглем. Основываясь на результатах изменения значений ПФО, ПО, ИК-спектров, можно утверждать, что внесенный биоуголь оставался в стабильной форме и не оказывал существенного влияния на ферментативную активность почв.
Список литературы Изменчивость полифенолоксидазной и пероксидазной активности агродерново-подзолистой почвы разной окультуренности с биоуглем
- Lehmann J., Rillig M.C., Thies J., Masiello C.A., Hockaday W.C., Crowley D. Biochar effects on soil biota — a review. Soil Biology and Biochemistry, 2011, 43(9): 1812-1836 (doi: 10.1016/j.soilbio.2011.04.022).
- Huang Z., Hu L, Dai J. Effects of ageing on the surface characteristics and Cu(II) adsorption behaviour of rice husk biochar in soil. Open Chemistry, 2020, 18(1): 1421-1432 (doi: 10.1515/chem-2020-0164).
- Beusch C. Biochar as a soil ameliorant: how biochar properties benefit soil fertility — a review. Journal of Geoscience and Environment Protection, 2021, 9(10): 28-46 (doi: 10.4236/gep.2021.910003).
- Nie T., Hao P., Zhao Z., Zhou W., Zhu L. Effect of oxidation-induced aging on the adsorption and co-adsorption of tetracycline and Cu2+ onto biochar. Science of The Total Environment, 2019, 673: 522-532 (doi: 10.1016/j.scitotenv.2019.04.089).
- Zheng H., Wang Z., Deng X., Herbert S., Xing B. Impacts of adding biochar on nitrogen retention and bioavailability in agricultural soil. Geoderma, 2013, 206: 32-39 (doi: 10.1016/j.ge-oderma.2013.04.018).
- Rechberger M.V., Kloss S., Rennhofer H., Titner J., Watzinger A., Soja G., Lichtenegger H., Zehetner F. Changes in biochar physical and chemical properties: accelerated biochar aging in an acidic soil. Carbon, 2017, 115: 209-219 (doi: 10.1016/j.carbon.2016.12.096).
- Li H., Lu X., Xu Y., Liu H. How close is artificial biochar aging to natural biochar aging in fields? A meta-analysis. Geoderma, 2019, 352: 96-103 (doi: 10.1016/j.geoderma.2019.06.006).
- Gámiz B., Velarde P., Spokas K.A., Celis R., Cox L. Changes in sorption and bioavailability of herbicides in soil amended with fresh and aged biochar. Geoderma, 2019, 337: 341-349 (doi: 10.1016/j.geoderma.2018.09.033).
- Huang Z., Hu L., Zhou Q., Guo Y., Tang W., Dai J. Effect of aging on surface chemistry of rice husk-derived biochar. Environmental Progress & Sustainable Energy, 2018, 37(1): 410-417 (doi: 10.1002/ep.12694).
- Fuertes A.B., Camps Arbestain M., Sevilla M., Maciá-Agullo J.A., Fiol S., López R., Smer-nik R.J., Aikenhead W.P., Arce F., Macías F. Chemical and structural properties of carbonaceous products obtained by pyrolysis and hydrothermal carbonization of corn stover. Australian Journal of Soil Research, 2010, 48(7): 618-626 (doi: 10.1071/SR10010).
- Batista E.M.C.C., Shultz J., Matos T.T.S., Fomari M.R., Ferreira T.M., Szpoganicz B., de Freitas R.A., Mangrich A.S. Effect of surface and porosity of biochar on water holding capacity aiming indirectly at preservation of the Amazon biome. Scientific Reports, 2018, 8: 10677 (doi: 10.1038/s41598-018-28794-z).
- Marshall J., Muhlack R., Morton B.J., Dunnigan L., Chittleborough D., Kwong C.W. Pyrolysis temperature effects on biochar—water interactions and application for improved water holding capacity in vineyard soils. Soil Syst., 2019, 3(2): 27 (doi: 10.3390/soilsystems3020027)
- Mukheqee A., Zimmerman1 A.R., Hamdan R., Cooper W.T. Physicochemical changes in pyro-genic organic matter (biochar) after 15 months field aging. Solid Earth Discuss, 2014, 6: 731-760 (doi: 10.5194/sed-6-731-2014).
- Шахназарова В.Ю., Орлова Н.Е., Орлова Е.Е., Банкина Т.А., Якконен К.Л., Рижия Е.Я., Кичко А.А. Изменения таксономического состава и структуры прокариотного сообщества агродерново-подзолистой почвы при внесении биоугля. Сельскохозяйственная биология, 2020, 55(1): 163-173 (doi: 10.15389/agrobiology.2020.1.163rus).
- Gornjalves Lopes E.M., Mendes Reis M., Leidivan Almeida Frazro, da Mata Terra L.M., Lopes E.F., dos Santos M.M., Fernandes L.A. Biochar increases enzyme activity and total microbial quality of soil grown with sugarcane. Environmental Technology & Innovation, 2021, 21: 101270 (doi: 10.1016/j.eti.2020.101270).
- Wang D., Li C., Parikh S.J., Scow K.M. Impact of biochar on water retention of two agricultural soils — a multi-scale analysis. Geoderma, 2019, 340: 185-191 (doi: 10.1016/j.geoderma.2019.01.012).
- Sánchez-García M., Sánchez-Monedero M. A., Roig A., López-Cano I., Moreno B., Benitez E., Cayuela M.L. Compost vs biochar amendment: a two-year field study evaluating soil C build-up and N dynamics in an organically managed olive crop. Plant and Soil, 2016, 408(1/2): 1-14 (doi: 10.1007/s11104-016-2794-4).
- Хазиев Ф.Х. Методы почвенной энзимологии. М., 2005.
- Бойцова Л.В., Рижия Е.Я., Дубовицкая В.И. Динамика кислотности и емкости катионного обмена дерново-подзолистой супесчаной почвы при внесении биоугля. Агрохимия, 2021, 9: 23-31 (doi: 10.31857/S0002188121090052).
- Гулько А.Е., Хазиев Ф.Х. Фенолоксидазы почв: продуцирование, иммобилизация, активность. Почвоведение, 1992, 11: 55-67.
- Методы почвенной микробиологии и биохимии /Под общ. ред. Д.Г. Звягинцева. М., 1991.
- KeiluweIt M., Nico P.S., Johnson M.G., Kleber M. Dynamic molecular structure of plant bio-mass-derived black carbon (biochar). Environmental Science & Technology, 2010, 44(4): 12471253 (doi: 10.1021/es9031419).
- Njuma O.J., Davis I., Ndontsa E.N., Krewall J.R., Liu A., Goodwin D.C. Mutual synergy between catalase and peroxidase activities of the bifunctional enzyme KatG is facilitated by electron hole-hopping within the enzyme. Journal of Biological Chemistry, 2017, 292(45): 8408-18421 (doi: 10.1074/jbc.M117.791202).
- Libra J. A., Ro K.S., Kammann C., Funke, Berge N.D., Neubauer Y., Titirici M.M., Fühner C., Bens O., Kern J., Emmerich K.-H. Hydrothermal carbonization of biomass residuals: a comparative review of the chemistry, processes and applications of wet and dry pyrolysis. Biofuels, 2011, 2(1): 71-106 (doi: 10.4155/bfs.10.81).
- Чундерова А.И. Активность полифенолоксидазы и пероксидазы в дерново-подзолистых почвах. Почвоведение, 1970, 7: 22-26.
- Lammirato C., Miltner A., Kaestner M. Effects of wood char and activated carbon on the hydrolysis of cellobiose by p-glucosidase from Aspergillus niger. Soil Biology and Biochemistry, 2011, 43(9): 1936-1942 (doi: 10.1016/j.soilbio.2011.05.021).
- Ahmad M., Rajapaksha A.U., Lim E.U., Zhang M., Bolan N., Mohan D., Vithanage M., Lee S.S., Ok Y.S. Biochar as a sorbent for contaminant management in soil and water: a review. Chemosphere, 2014, 99: 19-33 (doi: 10.1016/j.chemosphere.2013.10.071).
- Ibrahim M.M., Tong C., Hu K., Zhou B., Xing S., Mao Y. Biochar-fertilizer interaction modifies N-sorption, enzyme activities and microbial functional abundance regulating nitrogen retention in rhizosphere. Science of The Total Environment 2020, 739: 140065 (doi: 10.1016/j.sci-totenv.2020.140065)
- Ameloot N., De Neve S., Jegajeevagan K., Yildiz G., Buchan D., Funkuin Y.N., Prins W., Bouckaert L., Sleutel S. Short-term CO2 and N2O emissions and microbial properties of biochar amended sandy loam soils. Soil Biology and Biochemistry, 2013, 57: 401-410 (doi: 10.1016/j.soil-bio.2012.10.025).
- Bailey V.L., Fansler S.J., Smith J.L., Bolton H. Reconciling apparent variability in effects of biochar amendment on soil enzyme activities by assay optimization. Soil Biology and Biochemistry, 2011 43(2): 296-301 (doi: 10.1016/j.soilbio.2010.10.014).
- Park J., Choppala G., Bolan N, Chung J., Chuasavathi T. Biochar reduces the bioavailability and phytotoxicity of heavy metals. Plant Soil, 2011, 348: 439-451 (doi: 10.1007/s11104-011-0948-y).
- Kumar S., Mastro R., Ram L., Sarkar P., George J., Selvi V. Biochar preparation from Parthe-nium hysterophorus and its potential use in soil application. Journal of Ecological Engineering, 2013, 55: 67-72 (doi: 10.1016/j.ecoleng.2013.02.011).
- Paz-Ferreiro J., Gasco G., Gutierrez B., Mendez A. Soil biochemical activities and the geometric mean of enzyme activities after application of sewage sludge and sewage sludge biochar to soil. Biology and Fertility of Soils, 2012, 48: 511-517 (doi: 10.1007/s00374-011-0644-3).
- Wu F., Jia Z., Wang S., Chang S., Startsev A. Contrasting effects of wheat straw and its biochar on greenhouse gas emissions and enzyme activities in a Chernozemic soil. Biology and Fertility of Soils, 2013, 49: 555-565 (doi: 10.1007/s00374-012-0745-7).
- Kuzyakov Y., Bogomolova I., Glaser B. Biochar stability in soil: decomposition during eight years and transformation as assessed by compound-specific 14C analysis. Soil Biology and Biochemistry, 2014, 70: 229-236 (doi: 10.1016/j.soilbio.2013.12.021).
- Tozzi F.V.D.N., Coscione A.R., Puga A.P., Carvalho C.S., Cerri C.E.P., de Andrade C.A. Carbon stability and biochar aging process after soil application. Horticult. Int. J., 2019, 3(6): 320329 (doi: 10.15406/hij.2019.03.00148).
- Носенко Т.Н., Ситникова В.Е., Стрельникова И.Е., Фокина М.И. Практикум по колебательной спектроскопии. СПб, 2021.
- Ahmad M., Lee S.S., Dou X., Mohan D., Sung J.-K., Yang J.E, Ok Y.S. Effects of pyrolysis temperature on soybean stover and peanut shell-derived biochar properties and TCE adsorption in water. Bioresource Technology, 2012, 118: 536-544 (doi: 10.1016/j.biortech.2012.05.042).
- Naisse C., Girardin C., Lefevre R., Pozzi A., Maas R., Stark A., Rumpel K. Effect of physical weathering on the carbon sequestration potential of biochars and hydrochars in soil. GCB Bioen-ergy, 2015, 7: 488-496 (doi: 10.1111/gcbb.12158).
- Ghaffar A., Ghosh A., Li F., Dong X., Zhang D., Wu M., Li H., Pan B. Effect of biochar ageing on surface characteristics and adsorption behavior of dialkyl phthalates. Environmental Pollution,


