Изменение активности каталазы и пероксидаз в листьях овса посевного под влиянием отдельного и комбинированного воздействия засоления и рН-уровня корневой среды
Автор: Четина Оксана Александровна, Боталова К.И., Мошева Виктория Андреевна, Лучникова Ксения Игоревна
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Экология
Статья в выпуске: 4, 2018 года.
Бесплатный доступ
Изучены некоторые физиолого-биохимические показатели в листьях овса посевного Avena sativa L. при совместном воздействии засоления и разных рН-уровней корневой среды. Через 30 мин. отмечено увеличение содержания перекиси водорода на всех опытных вариантах. Активность каталазы и пероксидаз усилилась при отдельном действии исследуемых факторов корневой среды. На фоне комбинированного стресса в листьях растений не выявлено существенного увеличения активности этих антиоксидантных ферментов. Возможно, разбалансировка между АФК-генерирующими системами и системами антиоксидантной защиты при сочетании неблагоприятных условий корневой среды связана с недостаточным количеством времени для формирования адаптивного ответа. Наибольшее негативное влияние на ростовые показатели овса оказывало сочетание засоления и кислой реакции корневой среды.
Активные формы кислорода, каталаза, пероксидазы, окислительный стресс, адаптация
Короткий адрес: https://sciup.org/147227051
IDR: 147227051 | УДК: 581.1 | DOI: 10.17072/1994-9952-2018-4-423-429
Текст научной статьи Изменение активности каталазы и пероксидаз в листьях овса посевного под влиянием отдельного и комбинированного воздействия засоления и рН-уровня корневой среды
Среди природных стрессоров засоление занимает одно из ведущих мест. По оценке FAO (Food and Agriculture Organization) засоленными являются 22% мировых земель, находящихся в сельскохозяйственном использовании [Гарифзянов, Жуков, 2013]. На протяжении долгого времени адаптацию растений к засолению рассматривали через призму регуляторных механизмов поддержания ионного и осмотического гомеостаза. Однако, как известно, повышенная концентрация NaCl приводит к окислительному стрессу, сопряженному с избыточной генерацией ак- тивных форм кислорода (АФК), таких как супероксидный анион радикал (О2•-), перекись водорода (Н2О2) и гидроксильный радикал (•ОH) [Meneguzzo, Navani-Izzo, Izzo, 1999; Mittler, 2002; Полесская, Каширина, Алехина, 2006; Гарифзянов, Жуков, Ивани-щев, 2011]. Наряду с выполнением необходимых сигнальных или иных функций, АФК, как высокореактивные вещества, способны наносить вред биологическим структурам клетки и физиологобиохимическим процессам, протекающим в ней.
Антиоксидантная защитная система клетки растения – это множество взаимосвязанных окислительно-восстановительных реакций, в которых участвуют антиоксидантные ферменты и низкомо-
лекулярные метаболиты. В нормальных условиях и при окислительном стрессе супероксиддисмутазы, пероксидазы, каталаза и ферменты аскорбат-глутатионового цикла, играют важную роль в поддержании определенного безопасного уровня АФК. В ответ на усиление генерации АФК, как правило, наблюдается активация элементов антиоксидантной защитной системы. [Sies, 1997; Колупаев, 2007; Jones, 2008 и др.].
В почвах накопление солей может сопровождаться увеличением щелочности, техногенное засоление развивается и на фоне кислой реакции среды [Еремченко, Митракова, Шестаков, 2017]. В свою очередь, для большинства сельскохозяйственных культур, в особенности для молодых растений, требуется благоприятная среда, близкая к pH 6.5. Следовательно, актуальность изучения механизмов адаптации растений к совместному воздействию засоления и кислотности/щелочности обусловлена тем, что эти факторы сочетаются в природных и техногенных почвах. В современной физиологии растений недостаточно изучена ответная реакция растений на комбинированное воздействие этих факторов на состояние корневой среды, в том числе, участие ферментов антиоксидантной защиты в устойчивости растений.
Цель работы – изучить изменение активности каталазы и пероксидаз в листьях овса посевного под влиянием отдельного и комбинированного воздействия засоления и рН-уровня корневой среды.
Объекты и методы исследования
В качестве объекта исследования использовали овес посевной Avena sativa L. Предварительно замоченные семена высаживали в вермикулит. На 7й день после посадки на корневую среду воздействовали стресс-факторами: 100 мМ NaCl, 200 мМ NaCl, pH 3, pH 10, 100 мМ NaCl + рН 3, 100 мМ NaCl + рН 10, 200 мМ NaCl + рН 3, 200 мМ NaCl + рН 10. Щелочная среда создавалась буфером глицин-KOH (pH10), кислая – уксусной кислотой. Устойчивость реакции среды в вермикулите под воздействием щелочных и кислых растворов контролировали путем измерения на рН-метре в течение 48 ч. Контрольный полив производили дистиллированной водой. Через 30 мин. после воздействия стресс-фактором определяли содержание пероксида – по ферротиоцианатному методу [Sagisaka, 1976], пероксидазную функцию в растительном материале по методу А.Н. Бояркина [Ермаков и др., 1987], активность каталазы – титрометрическим методом по А.Н. Баху и А.И. Опарину [Воскресенская, Алябышева, По-ловникова, 2006]. Биологическая и аналитическая повторность определений – трехкратная. Ростовые показатели определяли через 24 и 48 ч. в 30- кратной повторности. Полученные данные обработаны методами статистики, регрессионного и дисперсионного анализов.
Результаты и их обсуждение
Общим интегральным процессом, характеризующим негативное действие стрессоров различной природы, является усиление генерации активных форм кислорода. Пероксид водорода, обладающий наибольшим временем жизни (около 1 мс) и способный диффундировать от места образования, является одним из важнейших кислородных редуктантов, который в клеточных компартментах приводит к окислению липидов, углеводов, белков, повреждению ДНК и РНК, дезорганизации цитоскелета [Foyer, Noctor, 2005; Полесская, 2007; Pol-jsak, Milisav, 2012; Miura, Tada, 2014; Радюкина 2015].
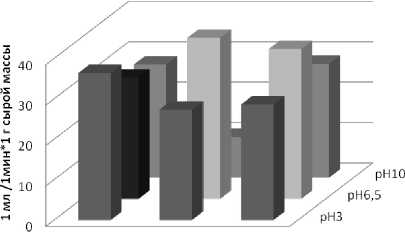
Результаты нашего эксперимента показали, что на всех опытных вариантах после воздействия стресс-факторов наблюдалось повышенное содержание пероксида водорода в листьях овса в сравнении с контролем (рис. 1). Наибольшее количество пероксида зафиксировано при действии отдельных факторов: растворов с рН3 и рН10 и засоления NaCl 100мМ, содержание его в растениях было в 8–10 раз выше контрольного уровня. При сочетании засоления и кислотности, засоления и щелочности корневой среды, особенно растворов с NaCl 200мМ, количество перекиси было ниже опытных вариантов с действием отдельных факторов, что может быть обусловлено функционированием антиоксидантной системы.
В последнее время активно обсуждается вопрос о способности АФК выступать в качестве сигнальных молекул и регуляторов экспрессии генов, детерминирующих защитный ответ растения. Определенный уровень АФК необходим для протекания ряда метаболических реакций в клетке и не вызывает повреждений биомолекул. Образование повышенного количества АФК опасно в случае нарушения баланса их образования и разрушения. Наиболее распространенными ферментами, способными детоксифицировать пероксид, являются каталаза и большое семейство пероксидаз [Blokhina, Virolainen, Fagerstedt, 2003; Mittova et all., 2003; Apel, Hirt, 2004; Mittler et al., 2004; Gechev et al., 2006; Полесская, 2007; Abogadallah, 2010, Poljsak, Milisav, 2012; Радюкина 2015; Foyer, Noctor, 2015].
В ходе эксперимента в надземной части овса посевного при разном уровне засоления корневой среды происходило достоверное увеличение активности каталазы (на 24–33%) по сравнению с контролем (рис. 2). Увеличение активности этого фермента (на 21%) отмечено и после воздействия кислого раствора без засоления. На остальных ва- риантах опыта, сочетающих оба стрессовых фактора корневой среды, не было значимых различий с контролем по активности каталазы.
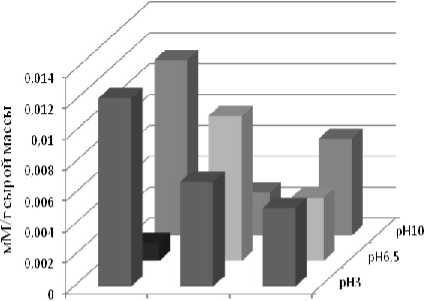
ОмМ ЮОглМ ZOOmM
концешрадй NaCl и pH кнесимеи' рас спора
Рис. 1 . Содержание перекиси в листьях овса посевного под влиянием отдельного и комбинированного воздействия засоления и рН-уровня корневой среды (черным цветом выделен контрольный вариант опыта)
О ЮОмМ 200мМ
Рис. 2 . Активность каталазы в листьях овса посевного под влиянием отдельного и комбинированного воздействия засоления и рН-уровня корневой среды (черным цветом выделен контрольный вариант опыта)
Сущность каталитического действия каталазы состоит в разложении перекиси водорода с выделением молекулярного кислорода. Данная реакция протекает с очень высокой скоростью, одна молекула фермента способна вызвать распад 6 x 10 6 молекул перекиси водорода в секунду. В то же время каталаза имеет низкое сродство к субстрату (H 2 O 2 ) и начинает работать только при достаточно высоком содержании перекиси. В связи с этим, а также, поскольку каталаза практически отсутствует в ряде компартментов клетки, существует необходимость функционирования других ферментов, задействованных в детоксикации перекиси водорода [Рогожин, 2004; Гарифзянов, Жуков, Иванищев, 2011].
Активность пероксидаз в листьях овса относительно контроля возрастала на 50–60% при действии отдельного засоления корневой среды (рис. 3). Близкое к этому усиление пероксидазной функции наблюдалось и при отдельном воздействии рН-уровня корневой среды: на 52 – на кислой и на 57% – на щелочной среде. При сочетании факторов засоления и кислотности/щелочности корневой среды существенных различий по активности пероксидаз в надземных органах овса посевного относительно контроля через 30 мин. после воздействия не обнаружено.
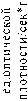
100мМ 200мМ
Рис. 3 . Пероксидазная функция в надземной части овса под влиянием отдельного и комбинированного воздействия засоления и рН-уровня корневой среды (черным цветом выделен контрольный вариант опыта)
Наш эксперимент подтверждает сбалансированность окислительно-восстановительных реакций в растительных клетках, т. к. были выявлены прямые зависимости между содержанием перекиси (y 1 ) и активностью каталазы (х 1 ), а также между содержанием перекиси и активностью пероксидаз (y 2 ) в листьях овса посевного (х 2 ): y 1 = 23.91+924.7х 1 ; коэффициент корреляции R=0.37; уровень значимости нулевой гипотезы P=0.0005; y 2 = 27.26 + 1565x 2 ; R=0.5; Р=1.2 х 10-6.
Наиболее общим проявлением и первым симптомом действия стрессоров является подавление роста и развития растений. В природе степень устойчивости к действию стрессора часто характеризуется обратной корреляцией со скоростью роста. Медленный рост позволяет растениям выживать при стрессе, так как освобождает множество ресурсов (строительных блоков и энергии), необходимых для реализации защитной программы [Алехина и др., 2005; Deinlein et al., 2014].
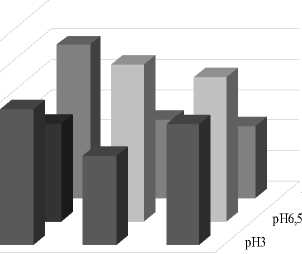
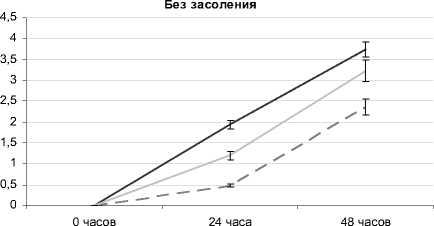
Данные нашего исследования показали, что высота надземной части растений овса посевного через 24 ч. после воздействия растворов с разным рН-уровнем (без засоления) достоверно ниже контрольного варианта. На кислой среде прирост длины надземной части тормозится на 75% в сравнении с контролем, на щелочной – на 38% (рис. 4). Через 48 ч. после воздействия стресс-фактора существенные различия по приросту высоты надземной части наблюдаются только между контрольным вариантом и рН 3 (меньше контроля на 37%).
контроль 200мМ 200мМ+рН3 200мМ+рН10
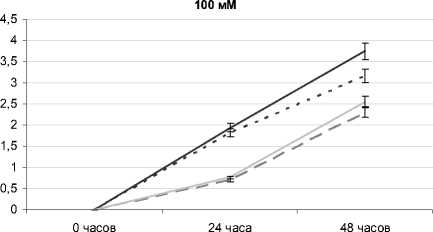
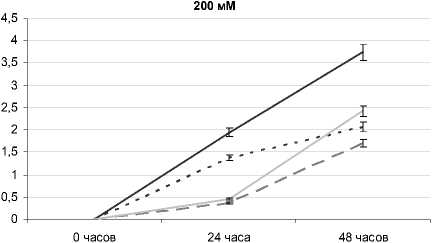
Рис. 4 . Высота надземной части растений овса посевного при отдельном и комбинированном воздействии засоления и разных рН-уровней корневой среды
При отдельном воздействии засоления 100 мМ через 24 ч. значимых различий по приросту с контролем не обнаружено, через 48 ч. отмечено торможение на 16%. При комбинированном действии засоления 100 мМ NaCl с разными рН-уровнями корневой среды надземная часть растений так же замедляет свой рост по сравнению с контролем. Через 24 ч. после воздействия стрессового фактора наиболее сильное угнетение наблюдается на вариантах NaCl 100 мМ + рН 3 и NaCl 100 мМ + рН 10 (угнетение прироста на 64 и 61% соответственно). Через 48 ч. прирост растений на варианте NaCl 100 мМ + рН 10 тормозился на 32% относительно контроля, а на варианте NaCl 100 мМ + рН 3 – на 39%.
После комбинированного воздействия засоления корневой среды NaCl 200 мМ и разных уровней рН существенные различия отмечаются между всеми вариантами опыта и контролем. Через 24 ч. наибольшее угнетение происходило на вариантах
NaCl + рН 3 и NaCl + рН 10 (прирост надземной части меньше на 81 и 77% по сравнению с контролем соответственно). Через 48 ч. угнетение наблюдалось на всех вариантах относительно контроля: при отдельном воздействии засоления – на 45, при рН 10 – на 35, при рН 3 – на 55%.
Аналогичные результаты получены и при изучении других ростовых показателей (площади листовой пластинки и массы надземной части растений овса посевного), где через 24 ч. произошло торможение роста на всех опытных вариантах, а через 48 ч. существенные различия с контролем отмечались у вариантов с кислой корневой средой (как отдельного фактора, так и в сочетании с засолением 100 мМ). При комбинации факторов засоления NaCl 200 мМ и разных рН корневой среды значимые различия высоты растений относительно контроля наблюдались в течение 2 сут. По мнению В.И. Полонского и Н.А. Сурина [2003], чувствительность зерновых культур к кислым почвам наиболее высока в фазе проростков, что согласуется с нашими данными. Резкий сдвиг рН в ту или иную сторону оказывает вредное, а иногда и губительное действие на растение, при этом менее вреден сдвиг рН почвы в щелочную сторону. Н.А. Гаевский, Т.И. Голованова, В.М. Гольд [2012] объясняют это тем, что клетки корня растения выделяют СО 2 , а иногда и органические кислоты, которые нейтрализуют избыточную щелочность.
Заключение
Через 30 мин. после отдельного и комбинированного воздействия засоления NaCl и рН-уровня корневой среды было отмечено усиление окислительно-восстановительных реакций в листьях овса посевного. На всех опытных вариантах повысилось содержание пероксида водорода в сравнении с контролем, наибольшее его количество было одновременно зафиксировано при действии отдельных факторов: кислой (рН 3) и щелочной реакции (рН 10), а также засоления NaCl 100 мМ. Активность каталазы и пероксидаз усилились при отдельном действии всех исследуемых факторов корневой среды. На фоне комбинированного стресса в листьях растений не выявлено существенного увеличения активности этих антиоксидантных ферментов. Возможно, разбалансировка между АФК-генерирующими системами и системами антиоксидантной защиты при сочетании неблагоприятных условий корневой среды связана с недостаточным количеством времени для формирования адаптивного ответа. Не исключено и угнетение защитных механизмов растений, т.к. прирост за 24-48 ч. на этих вариантах минимален. Наибольшее негативное влияние на рост овса оказывало сочетание засоления NaCl и кислой реакции (рН 3) корневой среды.
Список литературы Изменение активности каталазы и пероксидаз в листьях овса посевного под влиянием отдельного и комбинированного воздействия засоления и рН-уровня корневой среды
- Алехина Н.Д. и др. Физиология растений / под ред. И.П. Ермакова. М.: Академия, 2005. 640 с.
- Воскресенская О.Л., Алябышева Е.А., Половникова М.Г. Большой практикум по биоэкологии: учеб. пособие. Йошкар-Ола: Изд-во Мар. ун-та, 2006. Ч. 1. 107 с.
- Гаевский Н.А., Голованова Т.И., Гольд В.М. Избранные главы экологической физиологии растений: конспект лекций. Красноярск, 2012. 91 с.
- Гарифзянов А.Р., Жуков Н.Н. АФК-индуцированные процессы в клетках xTriticosecale в условиях натрий-хлоридного засоления // Известия ТулГУ. Естеств. науки. 2013. № 1. С. 241-250.
- Гарифзянов А.Р., Жуков Н.Н., Иванищев В.В. Образование и физиологические реакции активных форм кислорода в клетках растений // Современные проблемы науки и образования. 2011. № 2. С. 161-183.
- Еремченко О.З., Митракова Н.В., Шестаков И.Е. Природно-техногенная организация почвенного покрова территории воздействия солеотвалов и шламохранилищ в Соликамско-Березниковском экономическом районе // Вестник Пермского университета. Сер. Биология. 2017. Вып. 3. С. 311-320.
- Ермаков А.И. и др. Методы биохимического исследования растений. Л.: Агропромиздат, 1987. С.41-43.
- Колупаев Ю.Е. Активные формы кислорода в растениях при действии стрессоров: образование и возможные функции // Вестник Харьковского нац. аграр. ун-та. Сер. Биология. 2007. С. 6-26.
- Полесская О.Г., Каширина Е.К., Алехина Н.Д. Влияние солевого стресса на антиоксидантную систему растений в зависимости от условий азотного питания // Физиология растений. 2006. № 2. С. 207-214.
- Полесская О.Г. Растительная клетка и активные формы кислорода / под ред. И.П. Ермакова. М., 2007. 140 с.
- Полонский В.И., Сурин Н.А. Оценка зерновых злаков на устойчивость к неблагоприятным экологическим факторам. Новосибирск: Изд-во СО РАСХН, 2003. 125 с.
- Радюкина Н.Л. Функционирование компонентов антиоксидантной системы дикорастущих видов растений при кратковременном действии стрессоров: автореф. дис.. д-ра биол. наук. М., 2015. 48 с.
- Рогожин В.В. Пероксидаза как компонент антиоксидантной системы живых организмов. СПб: ГИОРД, 2004. 240 с.
- Abogadallah G.M. Antioxidative defense under salt stress // Plant Signal Behav. 2010. Vol. 5. P. 369-374.
- Apel K., Hirt H. Reactive oxygen species: metabolism, oxidative stress and signal transduction // Annu. Rev. Plant Biol. 2004. Vol. 55. P. 373-399.
- Blokhina O., Virolainen E., Fagerstedt K.V. Antioxidants, Oxidative Damage and Oxygen Deprivation Stress: a Review // Ann. Botan. 2003. Vol. 91. P. 179-194.
- Deilein U. et al. Plant salt-tolerance mechanisms // Trend. In Plant Sci. 2014. Vol. 19. P. 371-377.
- Foyer C.H., Noctor G. Defining robust redox signalling within the context of the plant cell // Plant, Cell and Environment. 2015. Vol. 38. P. 239-239.
- Foyer C.H., Noctor G. Oxidant and antioxidant signaling in plants: a reevaluation of the concept of oxidative stress in a physiological context // Plant Cell Environ. 2005. Vol. 29. P. 1056-1071.
- Gechev T.S. et al. Reactive oxygen species as signals that modulate plant stress responses and programmed cell death // BioEssays/ Wiley Periodicals Inc. 2006. Vol. 28. P. 1091-1101.
- Jones D.P. Radical-free biology of oxidative stress // Am. J. Physiol. Cell physiol. 2008. Vol. 295. P. 849-868.
- Meneguzzo S., Navari-Izzo F., Izzo R. Antioxidative responses of shoots and roots of wheat to increasing NaCl concentrations // J. Plant. Physiol. 1999. № 155. P. 274-280.
- Mittler R. Oxidative stress, antioxidants and stress tolerance // Trends in Plant Science. 2002. № 7. P. 405-410.
- Mittler R. et al. Reactive oxygen gene network of plants // Trends in Plant Science. 2004. Vol. 9. P. 490-498.
- Mittova V. et al. Up-regulation of the leaf mitochondrial and peroxisomal antioxidative systems in response to salt-induced oxidative stress in the wild salt-tolerant tomato species Lycopersicon pennellii // Plant, Cell and Environ. 2003. Vol. 26. P. 845-856.
- Miura K., Tada Ya. Regulation of water, salinity and cold stress responses by salicylic acid // Frontiers in plant science. 2014. Vol. 5. P. 1-12.
- Poljsak B., Milisav I. The Neglected Significance of "Antioxidative Stress" // Oxidative Medicine and Cellular Longevity. 2012.
- DOI: 10.1155/2012/480895
- Sagisaka S. The occurrence of peroxide in a perennial plant, Populus gelrica // Plant Physiol. 1976. Vol. 57. P. 308-309.
- Sies H. Physiological society symposium: impaired endothelial and smooth muscle cell function in oxidative stress: oxidants and antioxidants // Experimental Physiology. 1997. Vol. 82. P. 291-295.


