Изменение биологических свойств чернозема обыкновенного североприазовского при загрязнении современными биоцидами
Автор: Акименко Юлия Викторовна, Казеев Камиль Шагидуллович, Колесников Сергей Ильич, Козунь Юлия Сергеевна, Мясникова Маргарита Алексеевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 2-2 т.18, 2016 года.
Бесплатный доступ
Рассмотрено изменение биологических свойств (3, 30, 90 суток) чернозема обыкновенного при загрязнении современными биоцидами (антибиотиками, пестицидами) в концентрации 500 мг/кг почвы. Загрязнение чернозема биоцидами приводит к снижению численности микроорганизмов и ферментативной активности почв. Корреляционный анализ полученных данных выявил положительную корреляцию ферментов двух классов (дегидрогеназы, инвертазы) с численностью микромицетов (r=0,63, r=0,65), каталазы с аммонифицирующими бактериями (r=0,73). Данные результаты позволяют судить о вкладе той или иной группы микроорганизмов в ферментативный пул почв. Отдельные параметры биологических свойств не восстанавливаются и спустя 90 суток после загрязнения.
Антибиотики, пестициды, загрязнение, микроорганизм, ферментативная активность, чернозем обыкновенный
Короткий адрес: https://sciup.org/148204468
IDR: 148204468 | УДК: 631.46;
Текст научной статьи Изменение биологических свойств чернозема обыкновенного североприазовского при загрязнении современными биоцидами
является увеличение их фоновых концентраций. В последнее время антибиотики все чаще обнаруживаются в почвах, грунтовой, питьевой воде и сточных водах [16]. В почву антибиотики попадают посредством применения навоза и сточных вод на сельскохозяйственных землях в качестве удобрения [13]. По различным данным, антибиотики тетрациклинового ряда обнаруживаются в почвах в концентрациях 1–900 мг/кг [14], макролидного ряда 1–800 мг/кг [12].
Цель исследования: изучить изменение биологических свойств чернозема обыкновенного североприазовского при загрязнении современными биоцидами (антибиотиками, пестицидами) в условиях модельного опыта.
Объекты и методы исследования. Из биоцидов были выбраны следующие препараты: антибиотики (тилозин, ампициллин, стрептомицин), широко используемые в медицине и сельском хозяйстве, а так же системный фунгицид (инпут). Характеристика биоцидов по С.М. Навашину и И.П. Фоминой [6].
Ампициллин - полусинтетический антибиотик пенициллиновой группы широкого спектра действия. Фармакологическое действие – бактерицидное. В медицинской практике применяют ампициллин, ампициллина натриевую соль, ампициллина тригидрат. Активен в отношении большинства Гр+ и Гр– микроорганизмов, а так же аэробных не спорообразующих бактерий. Не эффективен в отношении к пенициллиназообразующим штаммам. Стрептомицин - антибиотик группы аминогликозидов. Образуется в процессе жизнедеятельности актиномицетов Streptomyces globis-porus . В низких концентрациях оказывает бактериостатическое действие, в более высоких оказывает бактерицидный эффект. Имеет широкий спектр противо-микробного действия. Тилозин – макролидный антибиотик, продуцируемый Streptomyces fradiae. Широко применяется в животноводстве как в качестве лечебно–профилактического средства, так и стимулятора роста. В России зарегистрирован ряд пероральных препаратов тилозина: Тилан, Тиланик, Фармазин. Фармакологическое действие – бактериостатическое. Активен в отношении большинства Гр+ и некоторых Гр–бактерий. Инпут является системным фунгицидом, содержащий активно действующие вещества: протио-коназол ( Рrothioconazole ) и спироксамин ( Spiroxamine )
160, 300 г/кг/л, соответственно. Протиоконазол используется для обработки вегетирующих растений и для протравливания зерна против различных возбудителей. Основным почвенным метаболитом является про-тиоконазол–дестио. В почве ДT 50 протиоконазола– дестио составляет 16,3–72,3 дня. Спироксамин является представителем группы ингибиторов синтеза сте-ринов. Подавляет возбудителей мучнистой росы, ржавчины и септориоза зерновых злаковых культур. Относительно стабилен на свету и в почве (DT 50 = 50,5 дня; ДТ 50 = 35–64 дня, соответственно).
Для оценки последствий загрязнения почв биоцидами был исследован микробоценоз и ферментативная активность чернозема обыкновенного североприазовского Ботанического сада Южного федерального университета. Почву отбирали из пахотного слоя (0– 25см). Подготовленные образцы почвы загрязняли растворами биоцидов в концентрации 500 мг/кг почвы. Данные концентрации были выбраны исходя из литературных данных по остаточным количествам антибиотиков в окружающей среде [8, 15], а так же благодаря результатам ранее проведенных рекогносцировочных исследований [1-3]. Контролем служила почва, не загрязненная биоцидами. Изменение биологических свойств чернозема изучали через 3, 30, 90 суток после загрязнения.
Изучали следующие показатели биологической активности чернозема: численность аммонифицирующих и амилолитических бактерий, микромицетов, обилие бактерий р. Azotobacter ; активность ферментов класса оксидоредуктаз (каталаза, дегидрогеназа), гидролаз (инвертаза), а так же почвенное «дыхание». Аналитические определения выполняли в 3-кратной повторности для изучения почвенных микроорганизмов и в 6–ти кратной повторности для изучения ферментативной активности почв.
Лабораторные и аналитические модельные исследования выполнены с использованием широко распространенных методов биодиагностики и биондика-ции почв [5]. Исследование микробоценоза чернозема обыкновенного включало определение численности основных групп почвенных микроорганизмов методом глубинного посева на питательные среды: аммонификаторов – на МПА, амилолитиков – на КАА, микроми-цетов– на подкисленной среде Чапека, бактерий р.Azotobacter – на среде Эшби (метод комочков обрастания). Активность каталазы и дегидрогеназы измеряли методом Галстяна в модификации Хазиева, активность инвертазы с помощью модифицированного колориметрического метода Хазиева. Изменение интенсивности выделения углекислого газа изучали в течение 90 суток, с интервалом в 1 день в течение первых 14 суток после внесения биоцидов, с последующим увеличением интервала между измерениями от 3-х и более суток. Интенсивность выделения СО 2 измеряли с помощью портативного газоанализатора ПГА–7, в котором углеродсодержащие газы определяются с помощью ИФК-спектоскопии. Погрешность измерений 0, 01–0,02%.
Результаты и их обсуждение. Внесение в почву антибиотиков и их комплексов с фунгицидом приводит к изменению биологических свойств чернозема, наблюдается достоверное снижение всех исследуемых показателей. Степень снижения зависела от природы антибиотика и сроков исследования, подобные результаты были получены ранее и с другими классами антибиотиками [3]. Загрязнение чернозема антибиотиками приводит к снижению численности основных групп почвенных микроорганизмов. Максимальное подавляющее воздействие биоцидов на почвенный микро-боценоз проявляется на 3 сут. после загрязнения. Наибольшее подавляющее воздействие на численность аммонифицирующих бактерий оказывает антибиотик стрептомицин и его смесь с фунгицидом инпут (на 80– 90% от контроля, р<0,001, n=3). Ампициллин и тилозин снижают численность бактерий–аммонификаторов более чем на 50% от контроля. Инпут не оказывает достоверного подавляющего воздействия на численность аммонификаторов. Однако в сочетании инпута с антибиотиками рост бактерий-аммонификаторов ингибируется в большей степени, что свидетельствует о синергизме данных препаратов и усилении их отрицательного воздействия. Восстановление численности бактерий (смесь стрептомицин+инпут) не наблюдается и на 90 сут. исследования, разница в численности бактерий по сравнению с контролем составляет около 80%. Другие исследователи получали аналогичные результаты со смесями препаратов и выявили проявление синергетических эффектов смесей антибиотиков [10]. Однако причины таких эффектов все еще остаются невыясненными. Амилолитические бактерии оказались более устойчивы к загрязнению биоцидами, в отличие от аммонификаторов. При загрязнении чернозема ампициллином и стрептомицином численность амилолитиков практически не изменяется на всех сроках исследования. Тем не менее, тилозин, а так же смеси антибиотиков с фунгицидом приводят к снижению численности амилолитиков, причем с увеличением сроков исследования наблюдается уменьшение численности бактерий.
Антибиотики не оказывают достоверного воздействия на почвенных микромицетов, в отличие от их смесей с фунгицидом инпут. На 3 сут. исследования наблюдается максимальное снижение численности микромицетов в варианте с фунгицидом (на 56% от контроля, р<0,001, n=3). Численность микромицетов под действием комплекса препаратов снижается с течением сроков исследования, аналогично ситуации с амилолитиками. В вариантах с ампициллином и стрептомицином происходит постепенное увеличение численности микромицетов по сравнению с контролем, на 90 сут. исследования численность микромицетов в варианте с ампициллином превышает контроль практически в два раза (р<0,05, n=3). Это можно объяснить устранением конкуренции со стороны бактерий и активным заселением микромицетами экологической ниши. Бактерии р. Azotobacter оказались менее чувствительными к загрязнению биоцидами. Изменение в обилии бактерий наблюдали лишь на 3 сут. исследования (снижение на 30-40% от контроля при воздействии ампициллина и стрептомицина соответственно, и на 50–60%, при воздействии смесей ампициллин+инпут и стрептомицин+инпут, соответственно), на остальных сроках не наблюдали никаких изменений.
Таким образом, по степени устойчивости к антибиотикам, исследованные микроорганизмы образовали ряд: микромицеты > бактерии р.Azotobacter > бак-терии–амилолитики > бактерии–аммонификаторы.
В исследовании рассмотрено влияние биоцидов на активность почвенных ферментов класса оксидоредуктаз (каталаза, дегидрогеназа) и гидролаз (инвертаза). В целом оксидоредуктазы оказались наиболее устойчивыми к загрязнению биоцидами, чем гидролазы. Из ферментов оксидоредуктаз каталаза более устойчива к внесению антибиотиков, нежели дегидрогеназа. Наибольшее снижение активности каталазы наблюда- ли в вариантах со смесями антибиотиков и фунгицида. Например, смесь ампициллина и стрептомицина с фунгицидом приводит к снижению активности каталазы на 27% по сравнению с контролем (р<0,001, n=6). На протяжении всех сроков исследования наблюдается восстановление активности данного фермента. В отличие от активности каталазы, активность дегидрогеназы практически не изменяется на всех сроках исследования. Инвертаза иначе реагирует на внесение биоцидов. Если максимальное снижение активности оксидоредуктаз наблюдалось на 3 сут., то инвертазы на 30 сут. исследования. Смесь антибиотиков с инпутом приводит к наибольшему снижению активности исследуемых ферментов. По степени устойчивости к антибиотикам ферменты образовали ряд: каталаза > инвертаза > дегидрогеназа. Корреляционный анализ полученных данных выявил положительную корреляцию ферментов двух исследуемых классов (дегидрогеназы, инвертазы) с численностью микромицетов (r=0,63, r=0,65, соответственно), каталазы с аммонифицирующими бактериями (r=0,73). Что дает возможность судить о вкладе той или иной группы микроорганизмов в ферментативный пул почв.
Изменение интенсивности почвенного «дыхания» при загрязнении ксенобиотиками интересно в плане обсуждения характера связей между структурными и функциональными компонентами экосистем. Полученные данные свидетельствуют о достаточно сложном механизм интенсивности выделения СО 2 после загрязнения почв биоцидами (рис). На первые сутки исследования после внесения антибиотиков наблюдается значительный поток СО 2 из почвы как в контрольном образце, так и в загрязненных. Пики выделения СО 2 определяются в интервале 4–6 суток, в зависимости от вида вносимого вещества. По-видимому, увеличение выделения СО 2 на данном этапе связано уже не с физико–химическими процессами, а с активизацией микробиоты. Согласно данным Н.Д. Сорокина и др. [9] динамика численности эколого– трофических групп микроорганизмов четко коррелирует с интенсивностью их дыхания. Корреляционный анализ данных, полученных на 3 сутки после внесения препаратов, позволил установить обратную корреляцию между дыханием и численностью амилолитических бактерий (r= –0,79), дыханием и активностью каталазы (r= –0,63), а так же прямую корреляцию дыхания с активностью пероксидазы (r=0,64).
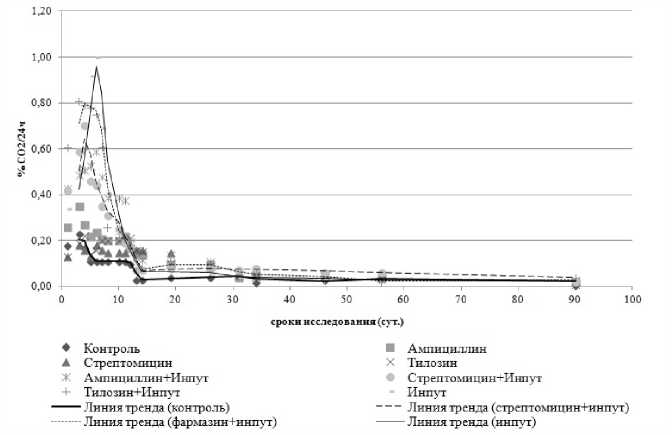
Рис. 1. Динамика интенсивности выделения СО 2 черноземом при внесении биоцидов
После 6–7 суток инкубации дыхание начинает резко падать, происходит почти двукратное его снижение. На восьмые сутки инкубации и в дальнейшем происходит некоторая стабилизация образования СО 2 . По–видимому, на данном этапе основным субстратом для микроорганизмов становится труднодоступное органическое вещество, разложение которого дает небольшой, но достаточно постоянный выход водорастворимого органического углерода. Подобно нашим результатам, в исследованиях Пуртовой и др. [7], было показано, что внесение минеральных удобрений в стандартных дозах (N 30 P 60 K 60 ) в почвах вызывает активизацию процессов выделения СО 2 . Полученные результаты показывают, что почвенное дыхание – сложная функциональная характеристика. Для установления основных закономерностей в изучении интенсивности выделения СО 2 в течение инкубационного периода с учетом использования антибиотических веществ необходимо проведение дальнейших исследований.
Выводы: загрязнение почв современными биоцидами приводит к снижению показателей биологической активности чернозема обыкновенно североприазовского. В наибольшей степени изменяются микробиологические показатели, чем ферментативная активность почв. Наиболее информативным из исследованных биологических показателей при загрязнении биоцидами является численность аммонифицирующих бактерий и активность дегидрогеназы. Наименее информативным является показатель активности каталазы. Показатель обилия бактерий р.Azotobacter при загрязнении антибиотиками неинформативен. При исследовании восстановления биологических свойств установлено, что восстановление, как микробиологических показателей, так и показателей ферментативной активности носит не прямолинейный характер, т.е. нельзя сказать, что с увеличением сроков исследования происходит все бóльшее их восстановление. Скорость восстановления биологических свойств зависит от природы и структуры вносимых веществ. От- дельные параметры биологических свойств не восстанавливаются и спустя 90 суток после загрязнения. Загрязнение почв антибиотиками в сочетании с фунгицидами приводит к значительному ухудшению биологических свойств почв, нежели действие этих препаратов по отдельности, проявляя тем самым синергетические эффекты, механизм действия которых нуждается в дальнейших исследованиях.
Исследование выполнено при поддержке Министерства образования и науки Российской Федерации (6.345.2014/K) и государственной поддержке ведущей научной школы Российской Федерации (НШ-9072.2016.11).
Список литературы Изменение биологических свойств чернозема обыкновенного североприазовского при загрязнении современными биоцидами
- Акименко, Ю.В. Влияние фармацевтических антибиотиков на динамику численности почвенных микроорганизмов//Известия высших учебных заведений. Северо-Кавказский регион. Серия: Естественные науки. 2014. №5 (183). С. 63-68.
- Акименко, Ю.В. Изменение биохимических свойств чернозема обыкновенного при загрязнении биоцидами/Ю.В. Акименко, К.Ш. Казеев, С.И. Колесников//Агрохимия. 2015. № 3. С. 81-87.
- Акименко, Ю.В. Экологические последствия загрязнения почв антибиотиками/Ю.В. Акименко, К.Ш. Казеев, С.И. Колесников, М.С. Мазанко//Известия Самарского научного центра Российской академии наук. 2013. Т. 15. № 3. С. 1196.
- Вальков, В.Ф. Почвы юга России/В.Ф. Вальков, К.Ш. Казеев, С.И. Колесников. -Ростов-на-Дону: Эверест, 2008. 276 с.
- Казеев, К.Ш. Биодиагностика почв: методология и методы исследований/К.Ш. Казеев, С.И. Колесников. -Ростов-на-Дону: Изд-во Южного федерального университета, 2012. 260 с.
- Навашин, С.М. Справочник по антибиотикам, 3 изд./С.М. Навашин, И.П. Фомина. -М.: Наука, 1974. 576 с.
- Пуртова, Л.Н. Эмиссия углекислого газа из почв природных и антропогенных ландшафтов юга приморья/Л.Н. Пуртова, Н.М. Костенков, В.А. Семаль, И.В. Комачкова//Фундаментальные исследования. 2013. № 1. С. 585-589.
- Самойленко, Н.Н. Влияние фармацевтических препаратов и их производных на окружающую среду/Н.Н. Самойленко, И.А. Ермакович//Вода и экология: проблемы и решения. 2014. № 2 (58). С. 78-87.
- Сорокин, Н.Д. Биологическая активность лесных почв Центральной Эвенкии/Н.Д. Сорокин, С.Ю. Евграфова//Почвоведение. 1999. №5. С. 634-638.
- Cernohorska, L. Antibiotic synergy against biofilm-forming Pseudomonas aeruginosa/L. Cernohorska, M. Votava//Folia Microbiol. 2008. V.53. P. 57-60.
- Halling-Sørensen, B. Inhibition of aerobic growth and nitrifycation of bacteria in sewage sludge by antibacterial agents//Arch. Environ. Contam. Toxicol. 2001. V.40. Р. 451-460.
- Höper, H. Eintrag und Berbleib von Tierarzneimit-telwirkstoffen in Boden/H. Höper, J. Kues, H. Nau, G. Hamscher//Bodenschutz. 2002. V.4. Р.141-148.
- Kemper, N. Veterinary antibiotics in the aquatic and terrest-rial environment a review//Ecological Indicators. 2008. V. 8. Р. 1-13.
- Pawelzick, H.T. A survey of the occurrence of various tetracyclines and sulfamethazine in sandy soils in northwestern Germany fertilized with liquid manure/H.T. Pawelzick, H. Höper, H. Nau, G. Hamscher//In: SETAC Euro 14th Annual Meeting, Prague, Czech Republic, 18-22 April, 2004. P. 23-28.
- Thiele-Bruhn, S. Sorption of sulfonamide pharmaceutical antibiotics on whole soils and particle-size fractions/S. Thiele-Bruhn, T. Seibicke, H-R. Schulten, P. Leinweber/J. Environ. Qual. 2004. V.33. Р. 1331-1342.
- Zhou, L.J. Trends in the occurrence of human and veterinary antibiotics in the sediments of the Yellow River, Hoi River and Liao River in northern China/L.J. Zhou, G.G. Ying, J.L. Zhao et al.//Environ. Pollut. V. 2011. V. 159. P. 1877.


