Изменение экспрессии aox1a, кодирование митохондриальной альтернативной оксидазы, влияние на морозоустойчивость растений Arabidopsis
Автор: Грабелныч Ольга И., Боровик Ольга А., Побежимова Тамара П., Королева Нина А., Любушкина Ирина В., Забанова Наталья Сергеевна, Войников Виктор К.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.12, 2016 года.
Бесплатный доступ
Сопротивление растений Arabidopsis thaliana (L.) Heynh (Columbia ecotype): линия Col-0 (дикий тип), линия AS-12 (растения, трансформированные конструкцией, несущей ген AOX1a под контролем промотора CAMV 35S в антисмысловой ориентации ) и линии XX-2 (растения, трансформированные конструкцией гена AOX1a в ориентационной ориентации) (Umbach et al., 2005), к действию отрицательной температуры. Показано, что изменение экспрессии AOX1a сопровождается изменением вклада AOX в дыхание и увеличением базовой морозостойкости растений Arabidopsis. В листьях растений с избыточной экспрессией АОХ1а была снижена активность общей супероксиддисмутазы (СОД), но была увеличена активность пероксидазы гваякола и была меньше содержания перекиси водорода. Было обнаружено, что холодное упрочнение в течение 7 дней при 5 ° С повышает устойчивость растений к последующему действию отрицательной температуры независимо от степени экспрессии АОХ1а. Затвердевание приводит к активации дыхания, увеличению вклада AOX в дыхание, значительному увеличению содержания водорастворимых углеводов и увеличению активности SOD и полных пероксидаз Guaiacol в листьях всех линий растений. В затвердевших растениях дикого типа Arabidopsis и трансформантов AOX1a обнаружены различия в содержании отдельных типов активных форм кислорода и активности антиоксидантных ферментов. Наблюдалась тенденция к уменьшению содержания пероксида водорода в линиях с измененной экспрессией AOX1a, но содержание супероксид-анионного радикала (SAR) было значительно ниже в линии AS-12 по сравнению с растениями Col-0 и XX-2 после затвердевания. Низкое содержание SAR в листьях линии AS-12 было частично вызвано увеличением активности SOD. Таким образом, мы выявили различия в основной морозостойкости растений Arabidopsis с измененной экспрессией AOX1a, но существенных различий в морозостойкости закаленных растений дикого типа и линий с измененной экспрессией AOX1a не обнаружено. Сделан вывод о том, что морозоустойчивость растений зависит от активности АОХ, но снижение его активности может быть компенсировано активацией других защитных систем, включая антиоксидантные ферменты.
Короткий адрес: https://sciup.org/14324005
IDR: 14324005
Текст научной статьи Изменение экспрессии aox1a, кодирование митохондриальной альтернативной оксидазы, влияние на морозоустойчивость растений Arabidopsis
Альтернативная оксидаза (AO) наряду с цитохромоксидазой является терминальной оксидазой дыхательной цепи митохондрий растений и катализирует окисление убихинола с восстановлением О 2 до Н 2 О, при этом она не является протон-транслоцирующей и при транспорте электронов через АО обходятся два пункта сопряжения в дыхательной цепи – комплексы III и IV (Lambers et al. , 2005). Альтернативная цианид-резистентная оксидаза митохондрий – высокорегулируемый фермент, который принимает участие в процессах адаптации растений к различным абиотическим и биотическим стрессам (Vanlerberghe, 2013). У Arabidopsis thaliana идентифицировано 5 генов, кодирующих АО ( AOX1a-d, AOX2 ) (Considine et al. , 2002). Из пяти генов изоформа AOX1a наиболее активно индуцируется стрессами или ингибированием цитохромного пути (Clifton et al. , 2006; Borecky et al. , 2006). Возможными функциями АО в условиях действия низкой температуры на растения являются: участие в термогенезе (Nagy et al. , 1972; Meeuse, 1975; Seymour, Schultze-Motel, 1999; Grabelnych et al. , 2003; Wagner et al. , 2008; Zhu et al. , 2011); участие в предотвращении образования активных форм кислорода (АФК) (Purvis and Shewfelt, 1993; Popov, 2003; Sugie et al. , 2006; Grabelnych et al. , 2011); участие совместно с ротенон-нечувствительными НАД(Ф)Н-дегидрогеназами (НАД(Ф)Н-ДГ II типа) в окислении цитозольного или матриксного НАД(Ф)Н (Michalecka et al. , 2003; Borovik et al. , 2013; Borovik, 2015); защита фотосинтетического аппарата от фотоингибирования при избыточном освещении (Zhang et al. , 2010).
Использование суспензионной культуры клеток табака с измененной экспрессией AOX1a обеспечили доказательства антиоксидантной роли АО в растениях (Maxwell et al., 1999). Перенос гена AOX1а пшеницы (WAOX1a) в клетки Arabidopsis thaliana подтвердил гипотезу об антиоксидантной функции АО в листьях растений при низкой температуре (Sugie et al., 2006). На растениях табака было показано, что при низкой температуре сверхэкспрессия AOX1a приводит к снижению содержания одного из продуктов перекисного окисления липидов (ПОЛ) – малонового диальдегида (МДА) и благоприятствует накоплению в клетках глюкозы и фруктозы (Wang et al., 2011). Повышение содержания водорастворимых углеводов, как известно, является одним из механизмов низкотемпературной адаптации растений (Trunova, 2007).
Исследования, проведенные на растениях арабидопсиса антисенсовой и сверэкспрессирующей АOX1а линий, не выявили значительных различий в содержании АФК в контрольных условиях, однако при обработке ингибитором цитохромного пути цианидом калия в листьях и корнях дефицитных по АО растений наблюдался повышенный уровень АФК (Umbach et al. , 2005). При росте на холоде в растениях арабидопсиса со сверхэкспрессией АOX1а увеличение продуктов ПОЛ было менее выражено, чем у растений дикого типа, растений, трансформированных пустым вектором и растений со сниженной экспрессией АOX1а (Fiorani et al. , 2005). В отличие от целых растений, у которых содержание АФК не различалось между линиями, в суспензионной культуре клеток арабидопсиса были выявлены различия в уровне АФК, причем в культуре клеток со сверхэкспрессией AOX1a наблюдали снижение, а в культуре клеток со сниженной экспрессией AOX1a – увеличение содержания супероксид анион-радикала (САР) и пероксида водорода (Tarasenko et al. , 2012). Сходная тенденция прослеживалась при обработке культуры клеток антимицином А, однако, что интересно, при обработке прооксидантами увеличение содержания АФК и снижение выживаемости было выше в культуре клеток, сверхэкспрессирующих AOX1a (Tarasenko et al. , 2012). На растениях арабидопсиса с выключенной экспрессией АOX1а (линия АOX1a knock-out) было установлено, что если у дикого типа низкая температура приводит к значительной экспрессии мРНК АОХ1а и увеличению цианид-резистентного дыхания в листьях, то у линии с выключенной экспрессией АOX1a в ответ на снижение температуры увеличивается цианидчувствительное дыхание и экспрессия NDB2 и UCP1
(Watanabe et al. , 2008). У растений линии АOX1a knock-out было ниже содержание МДА и выше экспрессия генов антиоксидантных ферментов ( GPX6, CAT1, MSD1 и FSD1 ). Усиление экспрессии генов антиоксидантных ферментов и снижение содержания МДА наблюдали и при холодовой обработке растений табака с сильной супрессией AOX1a (Wang et al. , 2011). Эти данные свидетельствуют о том, что АО является важным компонентом антиоксидантной защитной системы клеток растений, ее отсутствие при низкой температуре приводит к повышению экспрессии генов, участвующих в антиоксидантной защите, а также активирует другие пути альтернативного дыхания в митохондриях (Watanabe et al. , 2008).
Из данных, представленных выше, следует, что имеющиеся в литературе сведения относительно ответной реакции растений с измененной экспрессией AOX1a на действие низкой положительной температуры являются неоднозначными. С одной стороны показано, что экспрессия гена AOX1a играет важную роль в повышении устойчивости растений к низкой температуре (Wang et al. , 2011), с другой стороны – отсутствие данного гена или снижение его экспрессии приводит к активации экспрессии генов НАД(Ф)Н-ДГ II типа, разобщающих белков и антиоксидантных ферментов (Watanabe et al. , 2008), что также может приводить к росту холодо- и морозоустойчивости. Однако данных по участию альтернативной оксидазы в ответной реакции растений на действие отрицательной температуры нет.
В связи с этим целью настоящей работы явилось изучение устойчивости к действию отрицательной температуры растений Arabidopsis thaliana со сниженной и повышенной экспрессией гена АOX1a .
MATERIALS AND METHODS
В работе использовали растения A. thaliana (L.) Heynh линии Col-0 (растения дикого типа, экотип Columbia), линии AS-12 (растения, трансформированные конструкцией, несущей ген AOX1a под контролем промотора CAMV 35S в антисенсовой ориентации) и линии XX-2 (растения, трансформированные конструкцией, несущей ген AOX1a в сенсовой ориентации) (Umbach et al., 2005). Семена линий AS-12 и XX-2 были получены из Nottingham Arabidopsis Stock Centre (UK), stock number N6707 и N6591, соответственно, и любезно предоставлены В.И. Тарасенко (СИФИБР СО РАН).
Растения выращивали в стаканчиках объемом 200 см3 на опытной станции Фитотрон СИФИБР СО РАН в камере BINDER KBW 720 (Германия) при температуре 23/20 °С (день/ночь), 16 часовом фотопериоде и освещенности 250 мкмоль/(м2·с). В качестве субстрата для выращивания использовали торф, раз в неделю проводили подкормку ½ раствора Кнопа. В возрасте 36-38 дней растения подвергали холодовому закаливанию, которое проводили в камере BINDER KBW 720 (Германия) в течение 7 дней при 5 °С, 24 часовом фотопериоде и освещенности 180 – 200 мкмоль/(м2·с). Морозоустойчивость контрольных (в возрасте 40 дней) и закаленных растений оценивали путем промораживания растений в камере BINDER MKT 240 (Германия) при температурах -2, -4, -6 и -8 °С в течение 2 часов и последующего отрастания в течение 9 суток.
Количественное содержание сахаров в тканях листьев определяли с антроновым реактивом (Dishe, 1967). Плотность окрашенного раствора измеряли спектрофотометрически при 620 нм. Концентрацию водорастворимых углеводов выражали в процентах на суховоздушный вес проростков.
Определение интенсивности дыхания листьев проводили полярографически с платиновым электродом закрытого типа (электрод Кларка) в ячейке объемом 1,4 мл при 26 °С на приборе Oxytherm system (“Hansatech Inst.”, Англия). Листья предварительно инфильтровали с помощью шприца в растворе, содержащим 100 мМ сахарозы, 10 мМ MOPS-KOH (рН 6,6) и 0,2 мМ CaCl2, с добавлением или без добавления ингибиторов дыхания. Для ингибирования цитохромного пути (ЦП) дыхания использовали 1,2 мМ KCN, для ингибирования альтернативного пути (АП) дыхания – 3 мМ бензгидроксамовую кислоту (БГК). Такие же концентрации ингибиторов добавляли в ячейку полярографа. Поглощение кислорода, оставшееся после добавления KCN и БГК, считали неспецифическим и не принимали в расчет дыхательной активности.
Содержание пероксида водорода определяли с помощью окрашивания 3,3’-диаминобензидином (ДАБ) (Tarasenko et al. , 2012). Для этого листья инфильтровали в шприце (Александров, 1954) раствором ДАБ (0,2 мг/мл) в 10 мМ Трис-ацетатном буфере (pH 5,0) и инкубировали в темноте в течение 5 ч, затем помещали в 70% этанол и инкубировали при 80 °C до полного извлечения хлорофилла. Коричневый осадок, сформировавшийся во время полимеризации ДАБ, экстрагировали из ткани растиранием в ступке с 0,2 М хлорной кислотой. После центрифугирования при 13000 g в течение 10 мин оптическую плотность супернатанта измеряли спектрофотометрически при 450 нм. Содержание пероксида водорода рассчитывали в единицах (ед.) оптической плотности полимеров ДАБ на 1 г сырого веса.
Содержание САР определяли с помощью окрашивания нитросиним тетразолием (НСТ) (Tarasenko et al. , 2012). Для этого листья инфильтрировали в шприце раствором НСТ (0,05 мг/мл) в 10 мМ KH 2 PO 4 (pH 7,8) и инкубировали в темноте в течение 1 ч, затем помещали в 70% этанол и инкубировали при 80 ºC до полного извлечения хлорофилла. Голубой осадок формазана, сформировавшийся во время реакции, экстрагировали из ткани растиранием в смеси 2 М KOH и диметилсульфоксида (в соотношении 1 : 1). После центрифугирования при 13000 g в течение 10 мин оптическую плотность супернатанта измеряли спектрофотометрически при 700 нм. Содержание САР рассчитывали в ед. оптической плотности на 1 г сырого веса.
Активность общей СОД определяли по способности фермента ингибировать фотохимическое восстановление НСТ (Beauchamp and Fridovich, 1971). Активность СОД выражали в ед. оптической плотности на 1 мг белка.
Активность гваяколовых пероксидаз определяли по изменению оптической плотности при 580 нм в реакционной смеси следующего состава: 0,92 мл цитратно-фосфатного буфера (рН 5,5), 0,5 мл 0,3% Н2О2, 0,08 мл гваякола и 0,5 мл пробы. Активность фермента выражали в нКат на 1 мг белка (Bergmeyer, 1983).
Было проведено 3-6 независимых экспериментов, в каждом из которых повторность была не менее чем 3-х кратной. Рассчитаны средние арифметические значения и их стандартные отклонения.
RESULTS AND DISCUSSION
Выживаемость контрольных и закаленных растений арабидопсиса с измененной экспрессией AOX1a после действия отрицательных температур
Ранее в работе A.L. Umbach с соавт. (2005) были охарактеризованы линии арабидопсиса с измененной экспрессией гена AOX1a . В нашей работе использовали растения арабидопсиса поколения F 4 линий AS-12 (со сниженной экспрессией AOX1a ) и XX-2 (с повышенной экспрессией AOX1a ). Cохранение факта трансформации у растений поколения F 4 было проверено в работе (Tarasenko et al. , 2012).
Как видно из Fig. 1 растения арабидопсиса дикого типа и растения с измененной экспрессией AOX1a не имели никаких фенотипических отличий. На отсутствие фенотипических отличий при нормальных условиях роста у растений с измененной экспрессией AOX1a указывали и другие авторы (Vanlerberghe et al. , 1994; Fiorani et al. , 2005; Umbach et al. , 2005; Watanabe et al. , 2008).
При изучении влияния отрицательных температур на выживаемость растений арабидопсиса, выращенных в контрольных условиях, нами показано, что растения с повышенной экспрессией АOX1a (сенсовая линия XX-2) имеют большую морозоустойчивость, по сравнению с диким типом (Fig. 2). Однако обнаружено, что морозоустойчивость растений со сниженной экспрессией АOX1a (антисенсовая линия AS-12) также выше по сравнению с диким типом. Если при температуре -6 °С выживало всего 20% контрольных растений дикого типа, то с измененной экспрессией AOX1a – около 70% растений. Независимо от экспрессии AOX1a все растения арабидопсиса погибали при температуре -8 °С. Следовательно, нам удалось выявить тот факт, что изменение экспрессии гена AOX1a, кодирующего альтернативную оксидазу митохондрий, может приводить к существенным перестройкам в метаболизме клетки, направленным на повышение устойчивости растений к низкой температуре.
Далее была проанализирована морозоустойчивость растений арабидопсиса предварительно закаленных при 5 ºС в течение 7 суток. Ранее на озимой пшенице было показано (Borovik, 2015), что обработка растений температурой 5 ºС в течение 7 суток при непрерывном освещении наиболее эффективна для формирования закаленного состояния и повышения морозоустойчивости, поскольку приводит к значительному увеличению содержания в тканях водорастворимых углеводов. Как следует из полученных данных, закаливание значительно повышало морозоустойчивость растений арабидопсиса (Fig. 2). Закаленные растения дикого типа и линий с измененной экспрессией AOX1a выдерживали 2-х часовую экспозицию при температуре -8 °С. При этом морозоустойчивость после холодового закаливания повышалась независимо от экспрессии гена АOX1а .
На основе полученных данных можно заключить, что изменение экспрессии АOX1а оказывает влияние на развитие морозоустойчивости растений, однако процессы, происходящие в клеточном метаболизме растений при действии низких температур, направлены на компенсацию снижения активности АО и, вероятно, связаны с активацией других защитных механизмов. Такой факт отмечали ранее на растениях арабидопсиса с выключенной экспрессией АOX1а (Watanabe et al. , 2008), когда в ответ на снижение температуры у растений с отсутствием АО возрастало цианид-чувствительное дыхание и экспрессия генов таких белков как внешняя НАДН-ДГ ( NDB2) и разобщающий белок ( UCP1 ), а также ряд генов, кодирующих антиоксидантные ферменты. Альтернативные НАД(Ф)Н-ДГ и разобщающие белки, как известно, так же как и АО, вносят вклад в развитие морозоустойчивости растений (Grabelnych et al. ,
Некоторые физиолого-биохимические параметры, определяющие устойчивость растений арабидопсиса с измененной экспрессией AOX1a к отрицательным температурам
В механизмах повышения устойчивости растений к низкой температуре важную роль играет поддержание процесса дыхания и регуляция образования АФК. Как видно из Fig. 3 интенсивность дыхания листьев контрольных растений арабидопсиса достоверно не отличалась между линиями, но в зависимости от изменения экспрессии AOX1a изменялось участие АО в дыхании. Так, если вклад АП в дыхание листьев дикого типа составлял около 26%, то в листьях AS-12 он понижался до 8%, а в листьях XX-2 повышался до 50% (Fig. 3). Холодовое закаливание вызывало активацию дыхания в листьях арабидопсиса независимо от экспрессии AOX1a , при этом усиление интенсивности дыхания было наибольшим у дикого типа и по сравнению с дыханием в контрольных условиях было в 2 раза выше (Fig. 3). Наряду с изменением интенсивности дыхания при действии низкой температуры на растения изменялся и вклад альтернативного и цитохромного путей в дыхание. Так, у дикого типа (Col-0) усиление интенсивности дыхания в равной мере обеспечивалось увеличением вклада в дыхание и ЦП, и АП, у линии со сниженной экспрессией AOX1a (AS-12) в некоторой степени происходило увеличение вклада в дыхание цитохромного и альтернативного путей, а у линии с повышенной экспрессией AOX1a (ХХ-2), наоборот, снижался вклад в дыхание ЦП и еще больше увеличивался вклад АП.
Поскольку существуют данные о связи дыхания и активности АО с содержанием сахаров в тканях растений (Wang et al., 2011), был проведен анализ содержания сахаров в листьях растений арабидопсиса, различающихся по экспрессии АOX1а. Показано, что в оптимальных условиях роста различие в активности АО не влияло на содержание сахаров, которое у 40-суточных растений составляло 2,8-3,0% от суховоздушного веса (Fig. 4). Низкотемпературное закаливание приводило к значительному увеличению содержания сахаров в листьях арабидопсиса (Fig. 4). Сахара выполняют осморегуляторную и криопротекторную функции, а также участвуют в поддержании про/антиоксидантного баланса в клетке (Couée et al., 2006), поэтому их накопление при действии на растения арабидопсиса низкой положительной температуры еще раз подтверждает эффективность выбранной в работе температурной обработки. В случае растений дикого типа увеличение содержания сахаров под действием низкой температуры происходило в 4,8 раза, у линии с пониженной экспрессией АOX1а – в 5,9 раз, а у линии с повышенной экспрессией АOX1а – в 5,3 раза. Более значительное увеличение содержания сахаров в тканях растений арабидопсиса линии AS-12 может быть одним из механизмов, благоприятствующих повышению морозоустойчивости.
Низкая температура вызывает развитие окислительного стресса у растений, связанного с увеличением содержания АФК и продуктов ПОЛ (Suzuki, Mittler, 2006; Xu et al., 2013). Активация АО в митохондриях холодоустойчивых растений при низких температурах, по-видимому, является защитным механизмом, предотвращающим генерацию АФК при последующем действии отрицательных температур (Sugie et al., 2006; Grabel'nyh et al., 2011). Анализ содержания ряда форм АФК (супероксид анион-радикала и пероксида водорода) и общей активности СОД и гваяколовых пероксидаз проводили в листьях растений арабидопсиса, различающихся по активности АО, в контрольных условиях и подвергнутых холодовому закаливанию. Оказалось, в контрольных условиях растения дикого типа и растения с измененной экспрессией АOX1а по содержанию АФК в листьях достоверно не различались (Fig. 5), хотя наблюдалась тенденция к снижению содержания пероксида водорода у растений с измененной экспрессией АOX1а. Нами установлено, что изменение экспрессии гена AOX1a оказывает влияние на активность таких антиоксидантных ферментов как СОД и растворимые гваяколовые пероксидазы. При этом в контрольных условиях роста у линии ХХ-2 со сверхэкспрессией AOX1a активность СОД была ниже (на 24%), а активность гваяколовых пероксидаз выше (на 51%) по сравнению с диким типом и линией AS-12 (Fig. 6). Полученные нами данные о различиях в активности антиоксидантных ферментов у линии со сверхэкспрессией АOX1а лишний раз доказывают, что изменение экспрессии одного гена может существенно изменять клеточный метаболизм, подстраивая его под нужды клетки.
Низкая закаливающая температура приводила к повышению общей активности СОД и гваяколовых пероксидаз в листьях арабидопсиса всех линий (Fig. 6). Наибольшее увеличение активности СОД наблюдали в листьях растений арабидопсиса линии AS-12, в этих условиях активность фермента была в 2,5 раза выше по сравнению с контрольными растениями арабидопсиса. Такое значительное увеличение активности общей СОД под действием низкой температуры обусловило резкое снижение содержания САР в листьях арабидопсиса этой линии (на 78%). В листьях растений дикого типа также наблюдали активацию СОД (в 1,9 раза) и снижение содержания САР (на 50%) после действия закаливающей температуры. В листьях арабидопсиса линии XX-2 активность СОД была менее выражена по сравнению с диким типом и линией AS-12, а снижение САР было недостоверным. В отличие от активности СОД, активность гваяколовых пероксидаз возрастала в большей степени у линии XX-2 (в 2,3 раза), в этих же условиях наблюдали снижение содержания пероксида водорода (на 36%) (Fig. 6). У линии AS-12 (со сниженной экспрессией AOX1a ) увеличение активности гваяколовых пероксидаз (в 1,8 раза) также сопровождалось достоверным снижением содержания пероксида водорода в листьях (на 39%). Как можно видеть из полученных данных, изменение экспрессии AOX1a , кодирующего альтернативную оксидазу митохондрий, приводит к изменению активности антиоксидантных ферментов. При этом увеличение экспрессии AOX1a у линии XX-2 сопровождается активацией гваяколовых пероксидаз и снижением активности СОД.
Как известно, одной из функций АО является использование электронов для предотвращения сверхвосстановленного состояния дыхательной цепи митохондрий (Purvis and Shewfelt, 1993; Maxwell et al., 1999; Popov, 2003). В норме содержание АФК в митохондриях поддерживается на низком уровне благодаря наличию антиоксидантных систем, призванных проводить постоянную ликвидацию АФК (Blokhina and Fagerstedt, 2010). Однако в стрессовых для клетки условиях, например при действии на растения низкой температуры, содержание АФК начинает увеличиваться, и развивается окислительный стресс (Suzuki and Mittler, 2006; Xu et al., 2013). Активация альтернативной оксидазы увеличивает скорость электронного потока и предотвращает сверхвосстановление дыхательной цепи и генерацию САР, сходную с АО антиоксидантную функцию в митохондриях растений могут выполнять разобщающие белки (Blokhina and Fagerstedt, 2010). Благодаря разобщающим белкам протоны обратно транспортируются в матрикс без образования АТФ, что снижает образование АФК. Можно предположить, что снижение экспрессии АОХ1а у линии AS-12 запускает экспрессию разобщающих белков, функционирование которых препятствует образованию АФК и способствует повышению устойчивости незакаленных растений к низкой температуре. Повышение экспресcии UCP1 у арабидопсиса с выключенной экспрессией АОХ1а было показано в работе (Watanabe et al., 2008).
В нейтрализации АФК у растений принимают участие антиоксидантные ферменты. Так, в матриксе митохондрий образующийся в дыхательной цепи
САР быстро нейтрализуется до пероксида водорода с помощью СОД, а пероксид водорода удаляется каталазой и пероксидазами, использующими различные субстраты в качестве доноров электронов. Как показано выше, в процессе закаливания растений арабидопсиса в листьях возрастает общая активность СОД и гваяколовых пероксидаз (Fig. 6) и снижается генерация САР и пероксида водорода (Fig. 5). При этом в тканях закаленных растений значительно увеличивается содержание сахаров (Fig. 4), интенсивность дыхания и вклад АО в дыхание (Fig. 3), что сопровождается повышением морозоустойчивости растений (Fig. 2). Отличием закаленных растений с измененной экспрессией АОХ1а от закаленных растений дикого типа является изменение антиоксидантного статуса за счет снижения и/или повышения активности антиоксидантных ферментов и повышения и/или снижения образования отдельных форм АФК. Снижение активности СОД у линии с повышенной активностью АО (линия ХХ-2) (Fig. 6) может свидетельствовать о том, что АО защищает митохондрии от образования САР. Следует заметить, что изменение дыхательного метаболизма и антиоксидантного статуса у линий с измененной экспрессией АОХ1а повышает устойчивость незакаленных растений арабидопсиса к низкой температуре, а происходящие во время закаливания физиолого-биохимические изменения позволяют выживать растениям дикого типа и с измененной экспрессией АОХ1а .

Col-0 AS-12 XX-2
Figure 1. Внешний вид растений арабидопсиса дикого типа и линий с измененной экспрессией AOX1a в возрасте 34 суток.
Обозначения : Col-0 – дикий тип, AS-12 – растения со сниженной экспрессией гена AOX1a, XX-2 – растения с повышенной экспрессией гена AOX1a.
Контрольные растения

Figure 2. Морозоустойчивость контрольных и закаленных в течение 7 суток при 5 ºС растений арабидопсиса дикого типа и линий с измененной экспрессией AOX1a . Растения подвергали действию отрицательных температур в течение 2 часов и анализировали их выживаемость через 9 суток.
Обозначения : как на Fig. 1.
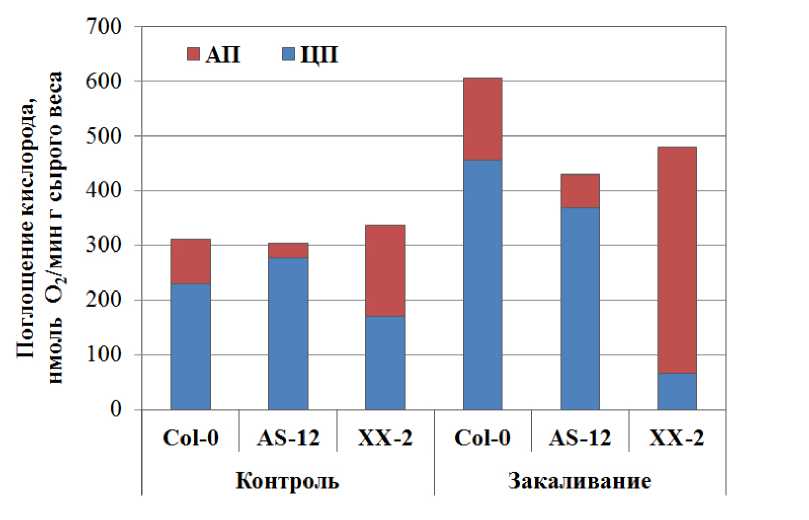
Figure 3. Интенсивность дыхания и вклад альтернативной оксидазы в дыхание листьев растений арабидопсиса дикого типа и линий с измененной экспрессией AOX1a в контрольных условиях и после закаливания в течение 7 суток при 5 ºС.
Обозначения : Col-0, AS-12, XX-2 как на Fig. 1; АП – альтернативный функционированием альтернативной оксидазы, ЦП – цитохромный функционированием цитохромоксидазы.
путь дыхания, связанный путь дыхания, связанный
с с
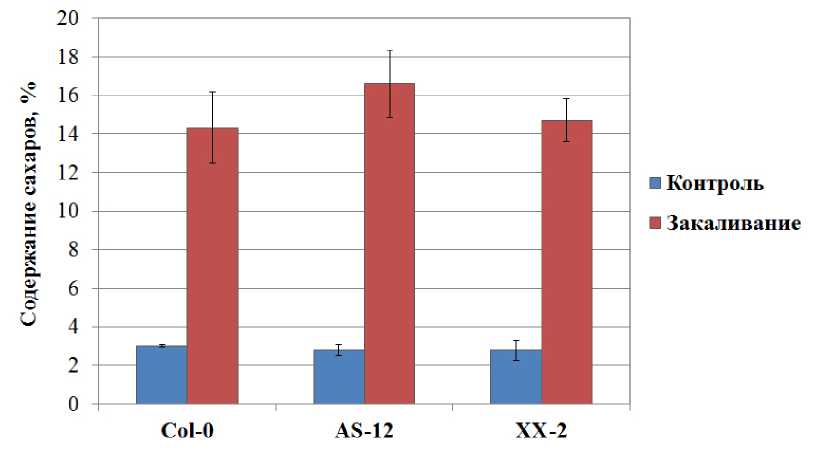
Figure 4. Содержание водорастворимых углеводов в листьях растений арабидопсиса дикого типа и линий с измененной экспрессией AOX1a в контрольных условиях и после закаливания в течение 7 суток при 5 ºС.
Обозначения : как на Fig. 1.
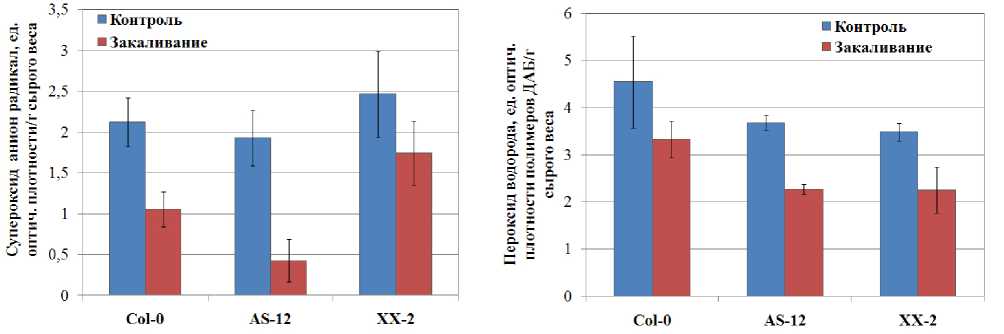
Figure 5. Содержание супероксид анион-радикала и пероксида водорода в листьях растений арабидопсиса дикого типа и линий с измененной экспрессией AOX1a в контрольных условиях и после закаливания в течение 7 суток при 5 ºС.
Обозначения : как на Fig. 1.
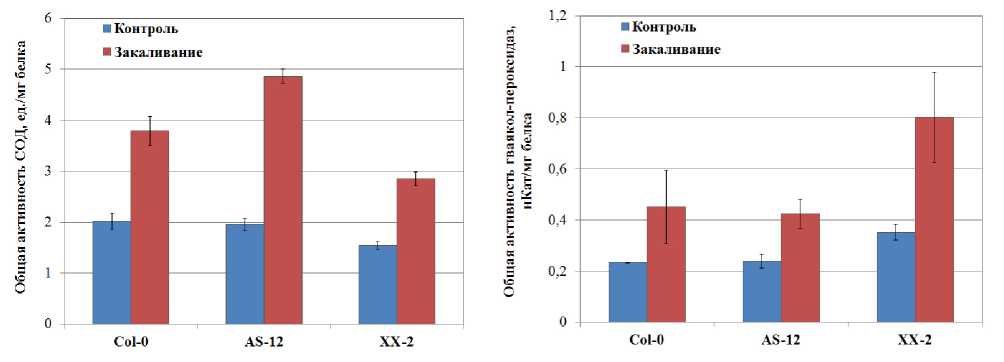
Figure 6. Общая активность супероксиддисмутазы и гваяколовых пероксидаз в листьях растений арабидопсиса дикого типа и линий с измененной экспрессией AOX1a в контрольных условиях и после закаливания в течение 7 суток при 5 ºС.
Обозначения : как на Fig. 1.
Таким образом, нами обнаружены различия в базовой морозоустойчивости растений арабидопсиса с измененной экспрессией гена АOX1a, однако не выявлено существенных различий в морозоустойчивости закаленных растений дикого типа и линий с измененной экспрессией АOX1a. Можно заключить, что функционирование альтернативной оксидазы играет важную роль в формировании морозоустойчивого состояния растений, однако снижение активности данного фермента, связанное со снижением экспрессии кодирующих его генов (в частности AOX1a), может приводить к активации других механизмов, которые вносят вклад в защиту растений при низкотемпературном стрессе.
ACKNOWLEDGEMENTS
Авторы признательны Тарасенко В.И. за предоставленные семена арабидопсиса линий AS-12 и XX-2. В работе использовалось оборудование ЦКП ИНЦ СО РАН «Байкальский аналитический центр» и ЦПК СИФИБР СО РАН
«Фитотрон». Работа выполнена при поддержке грантов РФФИ №15-04-06533-а и №16-34-00105-мол_а.
Список литературы Изменение экспрессии aox1a, кодирование митохондриальной альтернативной оксидазы, влияние на морозоустойчивость растений Arabidopsis
- Aleksandrov V.Ja. (1954) Uproshhennyj sposob infil'tracii rastitel'nyh tkanej. Botanicheskij zhurnal , 39, 421-422
- Beauchamp C. and Fridovich I. (1971) Superoxide dismutase: Improved assays and an assay applicable to acrylamide gels. Anal. Biochem., 44, 276-287
- Bergmeyer H.U. (1983) Methods of enzymatic analysis. Volume 1: Fundamentals, VCH Publishers, Weinheim, 571 p
- Blokhina O.B. and Fagerstedt K.V. (2010) Reactive oxygen species and nitric oxide in plant mitochondria: origin and redundant regulatory systems. Plant Physiol., 138, 447-462
- Borecky J., Nogueira F.T.S., de Oliveira K.A.P., Maia I.G., Vercesi A.E. and Arruda P. (2006) The plant energy-dissipating mitochondrial systems: depicting the genomic structure and the expression profiles of the gene families of uncoupling protein and alternative oxidase in monocots and dicots. J. Exp. Bot., 57, 849-864
- Borovik O.A. (2015) Funkcionirovanie al'ternativnoj oksidazy i NAD(F)∙N-degidrogenaz II tipa v mitohondriyah iz ehtiolirovannyh i zelenyh pobegov ozimoj pshenicy pri holodovom zakalivanii: avtoref. dis… kand. biol. nauk: 03.01.05, Irkutsk, 22 s
- Borovik O.A., Grabelnych O.I., Koroleva N.A., Pobezhimova T.P. and Voinikov V.K. (2013) The relationships among an activity of the alternative pathway respiratory flux, a content of carbohydrates and a frost-resistance of winter wheat. J. Stress Physiol. Biochem., 9, 241-250
- Clifton R., Millar A.H. and Whelan J. (2006) Alternative oxidases in Arabidopsis: a comparative analysis of differential expression in the gene family provides new insights into function of non-phosphorylating bypasses. Biochim. Biophys. Acta, 1757, 730-741
- Considine M.J., Holtzapffel R.C. and Day D.A., Whelan J. and Millar A.H. (2002) Molecular distinction between alternative oxidase from monocots and dicots. Plant Physiol., 129, 949-953
- Couée I., Sulmon C., Gouesbet G. and Amrani A.E. (2006) Involvement of soluble sugars in reactive oxygen species balance and responses to oxidative stress in plants. J. Exp. Bot., 57, 449-459
- Dishe Z. (1967) Obshhie cvetnye reakcii. pod red. Kochetkova N.K. Metodi himii uglevodov. M: Mir , 21-24
- Fiorani F., Umbach A.L. and Siedow J.N. (2005) The alternative oxidase of plant mitochondria is involved in the acclimation of shoot growth at low temperature. A study of Arabidopsis AOX1a transgenic plants. Plant Physiol., 139, 1795-1805
- Grabelnych O.I., Kolesnichenko A.V., Pobezhimova T.P., Tourchaninova V.V., Korzun A.M., Koroleva N.A., Zykova V.V. and Voinikov V.K. (2003) The role of different plant seedling shoots mitochondrial uncoupling systems in thermogenesis during low-temperature stress. J. Thermal Biol., 28, 571-580
- Grabel'nyh O.I., Pobezhimova T.P., Pavlovskaja N.S., Koroleva N.A., Borovik O.A., Ljubushkina I.V., Vojnikov V.K. (2011) Antioksidantnaja funkcija al'ternativnoj oksidazy v mitohondrijah ozimoj pshenicy pri holodovom zakalivanii. Biologicheskie membrany , 28, 274-283
- Grabelnych O.I., Borovik O.A., Tauson E.L., Pobezhimova T.P., Katyshev A.I., Pavlovskaya N.S.,Koroleva N.A., Lyubushkina I.V., Bashmakov V.Yu., Popov V.N., Borovskii G.B. and Voinikov V.K. (2014) Mitochondrial energy dissipating systems (alternative oxidase, uncoupling proteins, and external NADH dehydrogenase) are involved in development of frost-resistance of winter wheat seedlings. Biochem. (Moscow), 79, 506-519
- Lambers H., Robinson A. and Ribas-Carbo M. (2005) Regulation of respiration in vivo. Plant Respiration: From Cell to Ecosystem. Lambers H. and Ribas-Carbo M. (eds.), Springer, Hamburg, pp.1-15
- Maxwell D.P., Wang Y. and McIntosh L. (1999) The alternative oxidase lowers mitochondrial reactive oxygen production in plant cells. Proc. Natl. Acad. Sci., 96, 8271-8276
- Meeuse B.J.D. (1975) Thermogenic respiration in aroids. Ann. Rev. Plant Physiol., 26, 117-126
- Michalecka A.M., Svensson A.S., Johansson F.I., Agius S.C., Johanson U., Brennicke A., Binder S. and Rasmusson A.G. (2003) Arabidopsis genes encoding mitochondrial type II NAD(P)H dehydrogenases have different evolutionary origin and show distinct responses to light. Plant Physiol., 133, 642-652
- Nagy K.A., Odell D.K. and Seymour R.S. (1972) Temperature regulation by the inflorescence of Philodendron. Science, 178, 1195-1197
- Popov V.N. (2003) Possible role of free oxidation processes in regulation of reactive oxygen species production in plant mitochondria (review). Biochem. Soc. Transactions, 31, 1316-1317
- Purvis A.C. and Shewfelt R.L. (1993) Does the alternative pathway ameliorates chilling injury in sensitive plant tissue? Physiol. Plant., 88, 712-718
- Seymour R.A. and Schultze-Motel P. (1999) Respiration, temperature regulation and energetics of thermogenic inflorescences of the dragon lily Dracunculus vulgaris (Araceae). Proc. Roy. Soc. Lond. Ser. B. Biol. Sci., 266, 1975-1983
- Sugie A., Naydenov N., Mizuno N., Nakamura C. and Takumi S. (2006) Overexpression of wheat alternative oxidase gene Waox1a alters respiration capacity and response to reactive oxygen species under low temperature in transgenic Arabidopsis. Gen. Genet. Syst., 81, 349-354
- Tarasenko V.I., Garnik E.Y., Shmakov V.N. and Konstantinov Y.M. (2012) Modified alternative oxidase expression results in different reactive oxygen species content in Arabidopsis cell culture but not in whole plants. Biologia Plant., 56, 635-640
- Trunova T.I. (2007) Rastenie i nizkotemperaturnyj stress. М.: Nauka , 54 s
- Umbach A.L., Fiorani F. and Siedow J.N. (2005) Characterization of transformed Arabidopsis with altered alternative oxidase levels and analysis of effects on reactive oxygen species in tissue. Plant Physiol., 139, 1806-1820
- Vanlerberghe G.C. (2013) Alternative oxidase: a mitochondrial respiratory pathway to maintain metabolic and signaling homeostasis during abiotic and biotic stress in plants. Int. Mol. Sci., 14, 6805-6847
- Vanlerberghe G.C., Vanlerberghe A.E. and McIntosh L. (1994) Molecular genetic alteration of plant respiration: silencing and overexpression of alternative oxidase in transgenic tobacco. Plant Physiol., 106, 1503-1510
- Wagner A.M., Krab K., Wagner M.J. and Moore A.L. (2008) Regulation of thermogenesis in flowering Araceae: The role of the alternative oxidase. Biochim. Biophys. Acta, 1777, 993-1000
- Wang J., Rajakulendran N., Amirsadeghi S. and Vanlerberghe C. (2011) Impact of mitochondrial alternative oxidase expression on the response of Nicotiana tabacum to cold temperature. Physiol. Plant., 142, 339-351
- Watanabe C.K., Hachiya T., Terashima I. and Noguchi K. (2008) The lack of alternative oxidase at low temperature leads to a disruption of the balance in carbon and nitrogen metabolism, and to an up-regulation of antioxidant defence systems in Arabidopsis thaliana leaves. Plant Cell Environ., 31, 1190-1202
- Zhang D.-W., Xu F., Zhang Z.-W., Chen Y.-E., Du J.-B., Jia S.-D., Yuan S. and Lin H.-H. (2010) Effects of light on cyanide-resistant respiration and alternative oxidase function in Arabidopsis seedlings. Plant Cell Environ., 33, 2121-2131
- Zhu Y., Lu J., Wang J., Chen F., Leng F. and Li H. (2011) Regulation of thermogenesis in plants: The interaction of alternative oxidase and plant uncoupling mitochondrial protein. J. Integr. Plant Biol., 53, 7-13
- Suzuki N. and Mittler R. (2006) Reactive oxygen species and temperature stresses: A delicate balance between signaling and destruction. Physiol. Plant., 126, 45-51
- Xu J., Li Y., Sun J., Du L., Zhang Y., Yu Q. and Liu X. (2013) Comparative physiological and proteomic response to abrupt low temperature stress between two winter wheat cultivars differing in low temperature tolerance. Plant Biol., 15, 292-303


