Изменение концентраций неорганических соединений азота в сточных водах горнодобывающего предприятия микроводорослью Chlorella vulgaris
Автор: Щеглов Г. А.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Науки о земле
Статья в выпуске: 2 т.26, 2023 года.
Бесплатный доступ
Загрязнение сточных вод соединениями неорганического азота является серьезной проблемой для горнодобывающей отрасли, промышленных и коммунальных предприятий. Азот может попадать в сточные воды карьеров, когда для взрывных работ используются взрывчатые вещества, содержащие нитрат аммония. Такое загрязнение воды азотом приводит к экологическому ущербу и заболеваниям людей, компании, превышающие установленные законом пределы загрязнения азотом, облагаются штрафами. Утилизация азота из сточных вод осуществляется биологическими методами, однако эффективность биологических методов в северных регионах России низка в силу климатических факторов, затрудняющих жизнедеятельность организмов. Поэтому важно разработать технологии очистки сточных вод для удаления соединений азота. В работе анализируется способность микроводоросли Chlorella vulgaris поглощать и использовать разные формы неорганических соединений азота в сточных водах горнодобывающей промышленности на примере сточных вод отстойника карьера и хвостохранилища предприятия "Карельский окатыш" (Костомукша, Республика Карелия). Изучены концентрации аммония, нитратов, нитритов в воде и биомасса микроводорослей в образцах воды. Новизной исследования является оценка концентраций загрязняющих веществ в параллельно идущих опытах с различными условиями культивирования. Установлено, что при культивировании Chlorella vulgaris при температуре 26 °C, аэрации и искусственном освещении концентрация аммония снижалась. Эти результаты свидетельствуют о перспективности биореакторных технологий очистки сточных вод от аммония.
Карьерные воды, соединения неорганического азота, нитрат аммония, поллютанты, очистка, микроводоросли, биотехнологии, quarry waters, inorganic nitrogen compounds, ammonium nitrate, pollutants, purification, microalgae, biotechnologies
Короткий адрес: https://sciup.org/142237552
IDR: 142237552 | УДК: 504.054 | DOI: 10.21443/1560-9278-2023-26-2-191-199
Текст статьи Изменение концентраций неорганических соединений азота в сточных водах горнодобывающего предприятия микроводорослью Chlorella vulgaris
Щеглов Г. А. Изменение концентраций неорганических соединений азота в сточных водах горнодобывающего предприятия микроводорослью Chlorella vulgaris. Вестник МГТУ. 2023. Т. 26, № 2. С. 191–199. DOI:
Institute of Industrial Ecology Problems in the North KSC RAS, Apatity, Murmansk region, Russia; e-mail: , ORCID:
В процессе добычи полезных ископаемых, а также при ведении коммунального хозяйства образуются сточные воды, загрязненные соединениями азота.
В воду коммунальных хозяйств азот попадает с отходами жизнедеятельности человека. Помимо загрязнения азотом также воды загрязняются фосфором и различными взвесями.
В сточные воды горнодобывающих предприятий азот попадает из нитрата аммония, используемого в качестве взрывчатки при буровзрывных работах ( Рыбникова и др., 2020 ). В процессе взрыва нитрат аммония разлагается с выделением энергии и тепла на кислород, воду и азот по формуле
2NH 4 NO 3 → 2N 2 + O 2 + 4H 2 O. (1)
Азот в воде встречается в аммонийной, нитратной и нитритной форме в растворенном состоянии. Не выпадает в осадок и увеличивает растворимость с ростом температуры. В сточные воды азот попадает с карьерными и шахтными водами, а также с атмосферными осадками, проходящими через взорванную породу. Порядка 4 % общей массы азота из взрывчатых веществ попадает в воду после взрывных работ ( Хохряков и др., 2016; Jermakka et al., 2015 ).
В результате сброса сточных вод в открытые водоемы происходит загрязнение почвы и воды, что приводит к загрязнению экосистем и ущербу здоровью человека ( Babatunde et al., 2011 ). В документации СанПиН 2.1.3684-211 установлены нормы предельно допустимых концентраций (ПДК) для различных веществ.
Для разных форм азота в воде установлены свои нормы ПДК:
-
• аммоний – 1,5 мг/л;
-
• нитраты – 45 мг/л;
-
• нитриты – 3,3 мг/л.
Превышение этих показателей приводит к выплате штрафных санкций предприятиями, превышающими ПДК. Таким образом, загрязнение азотом и другими веществами наносит не только экологический ущерб, но и снижает показатели экономической эффективности предприятий.
Так, в регионах с развитым горным производством наблюдаются загрязнения окружающей среды. Например, в Мурманской области вклад горной промышленности в общий объем отходов составляет 90 % и ежегодно образуется 225,78 млн м3/год сточных вод, загрязненных соединениями неорганического азота ( Солнышкова, 2020 ).
Для борьбы с загрязнением вод азотом эффективно работают биологические методы. Наиболее распространенными из них являются:
-
1) создание искусственных болот с использованием сообществ сосудистых растений и микроорганизмов, интенсивно поглощающих соединения азота в процессе своей жизнедеятельности ( Савичев, 2008; Иванова и др., 2021; Солнышкова и др., 2018 ). При этом у метода имеются свои недостатки:
-
• индивидуальный подбор растительных сообществ для каждого конкретного производства;
-
• низкая эффективность в условиях северных регионов России, особенно в условиях Крайнего Севера;
-
• вторичное загрязнение воды азотом после отмирания части растений в процессе жизнедеятельности;
-
2) применение сообществ микроорганизмов "активного ила". Сущность метода заключается в преобразовании микроорганизмами азота из одной формы в другую с последующим удалением из воды в процессе нитрификации и денитрификации ( Мешенгиссер и др., 2006; Зубов и др., 2013; Дубовик и др., 2016 ). Недостатками метода являются:
-
• затраты на сооружение для проведения очистки, а также затраты на электроэнергию и нагрев воды;
-
• метод эффективно работает при температурах выше 10 °С;
-
• необходимость утилизации избыточного активного ила, образующегося в процессе нитрификации;
-
3) применение микроводорослей, поглощающих азот в процессе жизнедеятельности. Очистка микроводорослями может проходить как в формате прудов, так и в биореакторе, заменяя или дополняя предыдущие методы очистки. Так, в работе ( Кирилина и др., 2013 ) установлена высокая эффективность удаления азота при совместном использовании микроводорослей и активного ила.
Микроводоросли рода Chlorella применяются для очистки воды, в том числе от соединений азота ( Кирилина и др., 2013; Солнышкова, 2020 ).
Особенностями применения хлореллы для очистки являются:
-
• невысокая эффективность очистки при низких температурах, хотя существуют штаммы хлореллы, способные выживать и поглощать азот даже при температуре воды 3 °С ( Солнышкова, 2020 );
-
• необходимость утилизации избыточной биомассы микроводоросли, образующейся в процессе очистки. При этом хлорелла широко применяется в качестве БАД, корма для скота, из водоросли получают добавки Омега-3, в связи с чем избыточную биомассу можно рассматривать не как отход производства, а как ценное сырье для животноводства и фармакологии;
-
• главной проблемой использования хлореллы для очистки вод и последующей утилизации биомассы является недостаточное развитие подобных технологий. Помимо лабораторных работ, исследующих принципиальную возможность применения водоросли для разработки технологий очистки в условиях Крайнего Севера, необходимы и натурные исследования, рассматривающие практические аспекты использования различных штаммов водоросли для очистки сточных вод.
Представляется актуальным разработка современных методов очистки сточных вод от азота на горнодобывающих предприятиях и в коммунальных хозяйствах, в условиях постоянно возрастающих объемов загрязненных сточных вод и размеров штрафных санкций для предприятий. Проблема очистки сточных вод от азота особенно актуальна в условиях Крайнего Севера, где в силу суровых климатических условий сложнее внедрить любые биологические методы.
В горной промышленности постоянно образуются большие объемы загрязненных сточных вод. Некоторые предприятия пытаются снизить количество выбросов, пуская сточные воды в оборот. Но при внедрении подобного подхода зачастую страдает технологический процесс, например, снижение эффективности флотации из-за повышения pH оборотной воды.
В коммунальном хозяйстве объемы сбросов воды ниже, чем на предприятиях горной промышлености, но при этом штрафы за превышение ПДК по азоту и фосфору оказывают существенное влияние на экономическую эффективность предприятий. Это приводит к удорожанию ведения коммунального хозяйства и отражается на тарифах за водоснабжение для жителей населенных пунктов как конечных потребителей услуг.
Цель исследования – изучить, насколько эффективно штамм водоросли Chlorella vulgaris Beyerinck [Beijerinck], 1890 обеспечивает в ходе жизнедеятельности снижение концентрации аммония, нитратов и нитритов в воде при различной исходной концентрации азотсодержащих загрязняющих веществ и различных условиях проведения очистки.
Материалы и методы
Источник загрязненных проб воды
Работа проводилась на образцах сточных вод, поступающих с предприятия АО "Карельский окатыш", расположенного в г. Костомукша (Республика Карелия, Россия). Предприятие занимается добычей и переработкой железной руды и производит 20 % всех железорудных окатышей в России. Всего было отобрано два образца воды из отстойника карьера и один образец из отстойника хвостохранилища.
Характеристика микроводоросли
Способность микроводорослей снижать концентрацию азота в воде изучалась на примере одноклеточной зеленой водоросли Chlorella vulgaris Beyerinck [Beijerinck], 1890.
Подготовка маточной культуры микроводоросли проходила в течение 7 дней. Водоросль выращивалась на среде Тамия. Во все исследуемые пробы на 200 мл исследуемой воды добавлялось 10 мл маточной культуры микроводоросли. Все пробы находились в колбах с узким горлышком, закрытым алюминиевой фольгой в ходе экспериментов.
Для контроля количества биомассы водоросли измерялась оптическая плотность проб воды с добавленной суспензией перед началом эксперимента. Среднее значение оптической плотности для всех проб составило 0,022 ± 0,003.
Определение концентрации водоросли
Концентрация биомассы микроводоросли проводилась колориметрическим методом. Измерения оптической плотности проводились на колориметре модели КФК-2 с кюветой на 10 мм. Предварительно спектрофотометрическим методом по ГОСТ 17.1.4.02-902 определялась концентрация биомассы водоросли. На основе показателей концентрации и оптической плотности проб на длине волны 540 нм строился калибровочный график на основе линейного уравнения (формула 2), с помощью которого в дальнейшем определялась концентрация биомассы микроводоросли y = 0,4628x + 0,001; R² = 0,9999, (2)
где у – оптическая плотность пробы в кювете 10 мм при длине волны 540 нм, х – концентрация биомассы водоросли в пробе, R2 – коэффициент детерминации.
Ход эксперимента и условия проведения
В ходе экспериментов пробы воды разделялись на три группы, различающиеся по условиям культивирования водоросли в процессе эксперимента:
-
• условия, приближенные к неблагоприятным в зимний период: температура 7 °С в холодильнике без аэрации и освещения;
-
• промежуточные условия, имитирующие летний период в естественных условиях: 17 °С, без аэрации с естественным освещением;
-
• оптимальный для вида условия культивирования: 26 °С, с аэрацией и освещением.
-
3.7 – вода с отстойника карьера № 1;
Контроль температуры осуществлялся ртутным градусником с точностью шкалы ±1 °С.
Для обеспечения оптимальных условий для освещения и подогрева проб использована лампа LED-1088 Aquarium light. Аэрацию обеспечивал компрессор М-102 со скоростью прокачки 2,5 л/мин.
Образцы воды, отобранные на производстве, разделялись на описанные выше группы, часть проб разбавлялась дистиллированной водой для наблюдения изменения концентрации азота при различных исходных степенях загрязнения воды. Внесение суспензии микроводоросли производилось непосредственно перед началом эксперимента, после разбавления и подготовки проб воды.
Так, в 1-й группе рассматривали 2 пробы воды:
3/2.7 – вода с отстойника карьера № 1, разбавленная дистиллированной водой в 2 раза.
Во 2-й группе рассматривалось 5 проб воды:
-
1 – вода с отстойника хвостохранилища;
-
3 – вода с отстойника карьера № 1;
3/2 – вода с отстойника карьера № 1, разбавленная дистиллированной водой в 2 раза;
3/4 – вода с отстойника карьера № 1, разбавленная дистиллированной водой в 4 раза;
-
4 – вода с отстойника карьера № 2.
-
3 .26 – вода с отстойника карьера № 1;
В 3-й группе рассматривалось 2 пробы воды:
3/2.26 – вода с отстойника карьера № 1, разбавленная дистиллированной водой в 2 раза.
Продолжительность экспериментов составила 9 суток. В ходе всего периода ежедневно измерялась концентрация аммония, нитратов и биомассы водоросли. Измерение нитритов проводилось на старте экспериментов и после 4 и 8 суток. Все эксперименты были запущены в одно время и шли параллельно.
Для экспериментов отбирались пробы в объеме 200 мл с добавлением 10 мл суспензии микроводоросли.
Метод определение концентрации азота
Для оценки концентрации аммония и нитратов в воде использовались ионселективные методы с применением иономера Мультитест ИПЛ-112 и электрода сравнения ЭСр-10103/3.0.
Концентрация аммония определялась по методике РД 52.24.394-953 с помощью электрода ЭЛИТ-051, концентрация нитратов – по методике РД 52.24.367-954 с помощью электрода ЭЛИТ-021. Перед началом серии экспериментов электрод был откалиброван.
Концентрацию нитритов в воде рассчитывали колориметрическим методом ПНД Ф 14.1:2.3-955 на колориметре модели КФК-2 с кюветой на 20 мм. Перед началом экспериментов был построен калибровочный график для определения концентрации нитритов y = 1,9517x; R² = 0,998. (3)
Статистическая обработка данных
Для статистической обработки результатов экспериментов применены стандартные алгоритмы вариационного и регрессионного анализа, включенные в пакет MS Excell.
Результаты и обсуждение
Концентрация биомассы водоросли
Результаты изменения концентрации биомассы водоросли Chlorella vulgaris представлены на двух графиках (рис. 1 и 2) в связи с различным диапазоном значений биомассы в разных пробах. На рис. 1 представлены данные для проб 1; 3.7; 3/2.7; 3/4; 3/2; 4; 3. В данных пробах концентрация изменялась от 0,041 г/м3 до 0,11 г/м3, т. е. отмечено увеличение биомассы после 9 суток в 2,7 раза.
На рис. 1 видно, что культивирование при температуре 17 °С, за исключением пробы 1, к концу эксперимента позволило накопить больше биомассы в пробах, чем в ходе культивирования при температуре 7 °С.
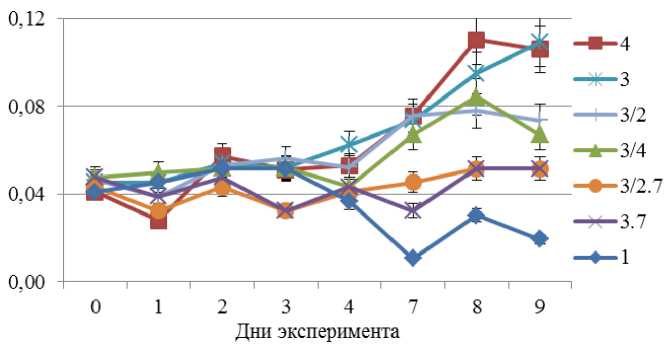
Рис. 1. Концентрация биомассы культуры водоросли, тестируемой для проб воды с разной температурой. Пробы культуры хлореллы в эксперименте при постоянной температуре 17 °С, без аэрации и переменном освещении: 1 – пробы воды из отстойника хвостохранилища; 3 – пробы из отстойника карьера № 1; 3/2 – пробы воды из отстойника карьера № 1, разбавленные в 2 раза; ¾ – пробы из отстойника карьера № 1, разбавленные в 4 раза; 4 – пробы из отстойника карьера № 2. Пробы культуры хлореллы в эксперименте при постоянной температуре 7 °С, без аэрации и освещения: 3.7 – пробы воды из отстойника карьера № 1;
3/2.7 – пробы из отстойника карьера № 1, разбавленные в 2 раза
Fig. 1. Biomass concentration of the algae culture testing for water samples at different temperature ranges. Samples cultured at constant temperature 17 °С, without aeration and variable illumination: 1 – tailings pond lagoon; 3 – pit № 1 lagoon; 3/2 – pit № 1 lagoon diluted by 2 times; ¾ – pit № 1 lagoon diluted by 4 times; 4 – pit № 2 lagoon. Samples cultured at a constant temperature of 7 °C, without aeration and lighting: 3.7 – pit № 1 lagoon; 3/2.7 – pit № 1 lagoon diluted by a factor of 2
По сравнению с пробами хлореллы, культивируемой в "идеальных" условиях, пробы, культивируемые при температурах 7 и 17 °С, не показали существенного прироста биомассы, что объясняется низкой температурой для данного вида микроводоросли. Однако прирост биомассы все же был зафиксирован.
На графике ниже представлены гистограммы, отражающие изменения концентрации биомассы микроводоросли в пробах воды при температуре культивирования 26 °С. В пробах 3.26 и 3/2.26 исходная концентрация 0,04 г/м3 увеличилась к концу экспериментов до 2,4 г/м3, что составляет 60-кратный рост биомассы за 9 суток (рис. 2).
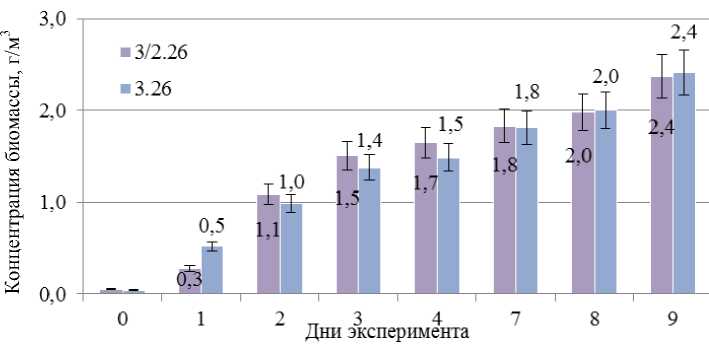
Рис. 2. Изменение концентрации биомассы микроводоросли Chlorella vulgaris в оптимальных условиях: при постоянной температуре 26 °С, с аэрацией и освещением: 3.26 – проба воды из отстойника карьера № 1; 3/2.26 – проба из отстойника карьера № 1, разбавленная в 2 раза
Fig. 2. Concentration of the biomass of the microalgae Chlorella vulgaris under optimum conditions.
Samples cultured at the constant temperature 26 °C, with aeration and lighting:
3.26 – pit 1 lagoon; 3/2.26 – pit 1 lagoon diluted by a factor of 2
При анализе зависимости изменения концентрации биомассы от концентрации форм азота можно отметить, что концентрация биомассы возрастала не только при более высокой температуре, но и при больших исходных концентрациях азота в воде. Однако при температуре 26 °С концентрация биомассы уже не зависела от исходной концентрации азота (рис. 2).
Концентрация аммония
На рис. 3 представлена графическая интерпретация результатов измерений содержания аммония в воде для двух групп проб воды: 3 и 3/2 в разных условиях.
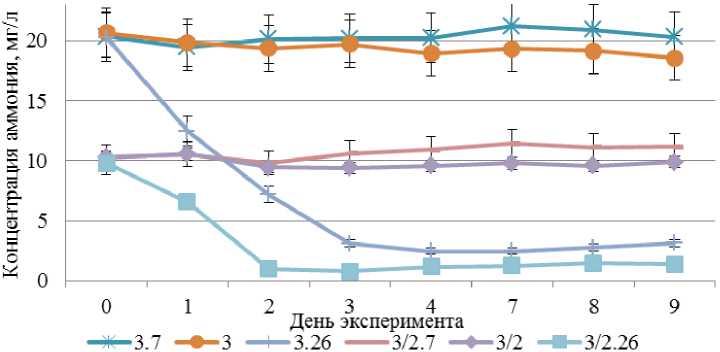
Рис. 3. Концентрация аммония (мг/л) в пробах воды.
Расшифровка обозначения проб соответствует индексации на предыдущих рисунках Fig. 3. Ammonium concentration (mg/l) in water samples.
The designation of the sample labels corresponds to the indexing in the previous figures
На рис. 3 видно, что при температуре культивирования 7 °С концентрация аммония в пробах за 9 суток осталась неизменной, тогда как при температуре культивирования 17 °С концентрация аммония в пробах снизилась относительно исходной концентрации на 10,2 % для пробы 3 и на 3,5 % для пробы 3/2.
В пробах, культивируемых при температуре 26 °C с аэрацией и освещением, наблюдалось равномерное снижение концентрации аммония в воде. Для пробы 3.26 с большей исходной концентрацией аммония снижение соответствующих значений продолжалось в течение 3 суток и составило 84,6 % от исходного уровня. Для пробы 3/2.26 с меньшей исходной концентрацией аммония снижение продолжалось в течение 2 суток и составило 89,7 %. Далее концентрация аммония вышла на плато и колебалась в пределах 0,65 мг/л. Для проб 3.26 и 3/2.26 наблюдался максимальный прирост биомассы водоросли и снижение ее концентрации. Это позволяет сделать вывод, что снижение концентрации аммония обусловлено его поглощением водорослью в процессе питания для поддержания процессов жизнедеятельности и последующего деления клеток.
Концентрация нитратов и нитритов
Графическая интерпретация концентрации нитритов в пробах воды представлена на рис. 4.
Концентрация нитритов замерялась трижды: перед началом серии экспериментов, через 4 и 8 суток. Продолжительный перерыв между измерениями обусловлен необходимостью отбирать большой объем пробы воды по сравнению с общим объемом пробы.
В большинстве проб концентрация нитритов оставалась неизменной в ходе экспериментов. Рост значений наблюдался для проб 3.26, 3/2.26, 4. Рост концентрации объясняется переходом из одной формы неорганического азота в другую. Конечная концентрация не превышала уровень ПДК во всех пробах.
Графическая интерпретация концентрации нитратов в пробах воды представлена на рис. 5.
В ходе экспериментов было отмечено незначительное снижение концентрации нитратов в воде по прошествии 3 суток и последующий рост концентрации к начальному уровню (рис. 5, пробы 3.20; 3.25 и 4).
Наиболее близкой к нашим исследованиям является работа (Солнышкова, 2020), согласно которой при температуре воды 3 °С наблюдалось понижение концентрации нитратов с 200 мг/л до 45 мг/л за 8 дней, а при температуре 19 °С – за 7 дней. По нашим результатам статистически значимого снижения концентрации нитратов не зафиксировано даже при оптимальной для объекта температуре 26 °С. Результаты работы (Солнышкова, 2020) показывают, что высокая эффективность очистки вод от азотсодержащих компонентов обусловлена выбором холодоустойчивого вида водоросли, а также специальной методикой подготовки культуры на среде без источников азота – "азотном голодании". Автором не приводятся данные по изменению концентрации аммонийной формы азота, которая существенно снижалась при культивировании при 26 °С согласно оригинальным результатам. Необходимо повторить проведенные эксперименты с культурой, выращенной в условиях "азотного голодания", для более объективного сопоставления результатов и изучения способа культивирования водорослей на их способность утилизировать нитраты и аммоний.
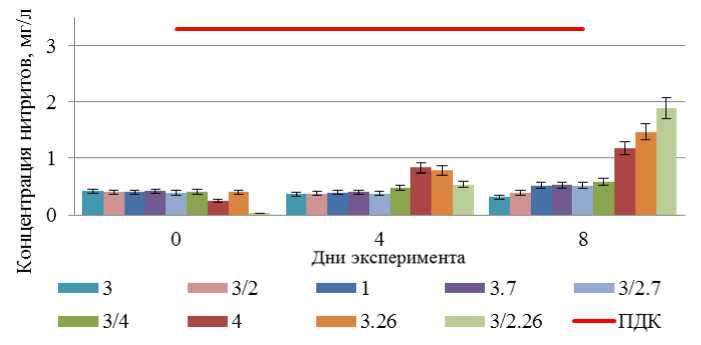
Рис. 4. Концентрация нитритов (мг/л) в пробах воды.
Расшифровка обозначения проб соответствует индексации на предыдущих рисунках Fig. 4. Nitrite concentration (mg/l) in water samples.
The designation of the sample labels corresponds to the indexing in the previous figures
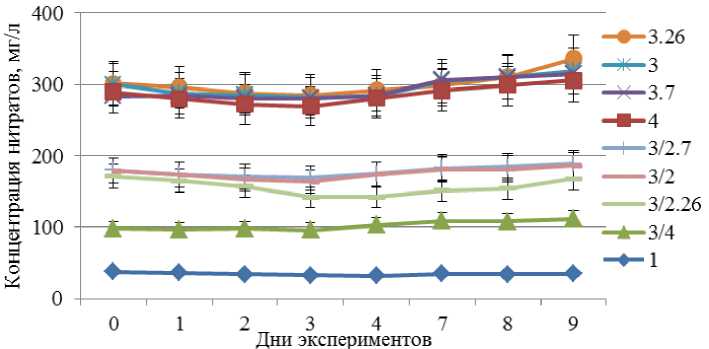
Рис. 5. Концентрация нитратов (мг/л) в пробах воды.
Расшифровка обозначения проб соответствует индексации на предыдущих рисунках Fig. 5. Nitrate concentration (mg/l) in water samples.
The designation of the sample labels corresponds to the indexing in the previous figures
В работе ( Кирилина и др., 2013 ) изучены особенности применения элодеи и сообществ активного ила для изменения концентрации аммония в сточных водах. Было показано, что культивирование элодеи совместно с активным илом позволило удалить весь аммоний из воды при исходной концентрации 6,5 мг/л и температуре 20 °С. Концентрация нитратов снижалась за 7 дней с 8,1 до 2,9 мг/л в аналогичных условиях. Данный метод превосходит эффективность утилизации азота, показанный в наших опытах, однако стоит отметить, что в полученных нами результатах скорость утилизации аммония была выше, а снижение концентрации на 85–90 % наступало уже через 2–3 дня (в зависимости от исходной концентрации аммония). При этом исходная концентрация азотсодержащих веществ в нашем исследовании была на порядки выше и составляла для аммония 10 и 20 мг/л, а для нитратов доходила до 300 мг/л, тогда как в работе ( Кирилина и др., 2013 ) исходные концентрации аммония и нитратов не превышали 9 мг/л. Вместе с тем неизвестно, как рассмотренные автором организмы отреагируют на столь высокие концентрации азота в воде.
На основе сопоставления полученных результатов с работами других авторов (Кирилина и др., 2013; Солнышкова, 2020) можно сделать вывод о том, что различные организмы в совокупности с учетом методов их подготовки демонстрируют различную способность утилизации соединений азота. В зависимости от условий, в том числе климатических, и от характеристик предприятий (концентрации загрязнителей, объемы водосброса), на которых необходимо проводить очистку, эффективными могут оказаться различные методы очистки. Из полученных данных можно сделать вывод о том, что применение хлореллы возможно при малых объемах водосброса, когда очистку можно проводить в биореакторах с оптимальными для водоросли условиями роста. Вместе с тем адекватный подбор вида водоросли и оптимизация условий подготовки культуры может способствовать расширению диапазона условий, в которых хлорелла будет наиболее эффективно справляться с загрязнениями.
Заключение
В условиях 9-суточных экспериментов изучена способность культуры микроводоросли Chlorella vulgaris наращивать биомассу, поглощая азот из сточных вод горнодобывающих производств в различных температурных условиях. Установлено, что хлорелла, выращенная на среде Тамия, успешно наращивает биомассу при постоянных температуре 26 °С, аэрации и освещении, а также снижает концентрацию аммония в воде в 10 раз уже через 2–3 суток. При температуре 7 и 17 °С без аэрации и с естественным освещением отмечены незначительные изменения в воде концентрации аммония и нитратов, не превышающие уровень ПДК. Успешное поглощение аммония достигалось в идеальных для водоросли условиях с температурой 26 °С, аэрацией и освещением. Данный факт свидетельствует о возможности применения хлореллы для очистки сточных вод в регионах с благоприятным для водоросли климатом. При неблагоприятных климатических условиях может быть перспективна разработка биореакторов, искусственно поддерживающих необходимые для культивирования условия. Перспективным является также изучение способности микроводоросли Chlorella vulgaris , выращенной при азотном голодании, утилизировать азот, а также поглощать фосфор и тяжелые металлы из сточных вод.
Важно отметить, что по итогам экспериментов концентрация аммония в сосудах хотя и существенно снижалась, но все равно превышала уровень ПДК, что требует проведения дальнейших экспериментов и подбора таких условий культивирования (состав среды, сроки экспозиции, плотность культуры, температурный режим опытов, вторичный посев культуры), при которых итоговая концентрация соединений азота в очищаемой воде станет ниже значений ПДК.
Полученные результаты свидетельствуют о перспективности широкого использования микроводоросли Chlorella vulgaris для снижения содержания аммонийного азота в сточных водах предприятий горнопромышленного комплекса.
Исследование выполнено в рамках темы НИР FMEZ-2022-0010 122022400112-7 "Процессы трансформации природных и техногенных систем в условиях изменения климата в Арктической зоне Российской Федерации (на примере Мурманской области) ".


