Изменение популяции стволовых клеток рака молочной железы линии MCF-7 при одиночном и комбинированном действии ионизирующего излучения и конъюгатов дендритных полимеров с доксорубицином
Автор: Матчук О.Н., Чурюкина К.А., Яббаров Н.Г., Никольская Е.Д., Жунина О.А., Кондрашева И.Г., Северин Е.С., Замулаева И.А.
Рубрика: Научные статьи
Статья в выпуске: 4 т.26, 2017 года.
Бесплатный доступ
Известно, что опухолевые стволовые клетки (ОСК) представляют собой наиболее радио- и химиорезистентную популяцию в составе широкого ряда злокачественных новообразований, включая рак молочной железы. В связи с этим усилия многих специалистов в области экспериментальной онкологии и радиобиологии направлены в последнее время на разработку средств/способов элиминации ОСК и (или) повышения их чувствительности к известным противоопухолевым воздействиям. В частности, создаются новые препараты на основе использования наночастиц. В данной работе были использованы полиамидоаминовые (РАМАМ) дендримеры второго поколения (G2), ковалентно конъюгированные с доксорубицином (Докс) и векторным белком (рекомбинантным фрагментом третьего домена альфа-фетопротеина - 3D). Сравнивали внутриклеточное содержание Докс и изменение количества стволовых и нестволовых клеток рака молочной железы линии MCF-7 при одиночном и комбинированном действии ионизирующего излучения, свободного Докс, дендримеров второго поколения, нагруженных Докс (G2-Докс), и конъюгатов тех же дендримеров с векторным белком и Докс (3D-G2-Докс). ОСК идентифицировали с помощью проточной цитометрии по способности этих клеток откачивать во внеклеточную среду флуоресцентный краситель Хёхст33342 и формировать популяцию, слабо окрашенную этим красителем (side population - SP). Результаты исследования свидетельствуют об относительно низком внутриклеточном содержании Докс в ОСК (SP) по сравнению с остальными клетками (NSP) при использовании всех изученных соединений, что в значительной мере объясняет различие цитотоксического действия этих соединений на разные популяции клеток. Под влиянием использованных соединений Докс абсолютное количество клеток NSP уменьшалось, в то время как количество клеток SP имело тенденцию к увеличению. В итоге, средняя доля клеток SP возрастала до 13,1%, 4,2% и 3,4% после инкубации со свободным Докс, G2-Докс и 3D-G2-Докс соответственно, составляя в контроле 1,8% (р
Опухолевые стволовые клетки, доксорубицин, дендримеры, альфа-фетопротеин, ионизирующее излучение, цитотоксическое действие, радиорезистентность, химиорезистентность, рак молочной железы, проточная цитометрия
Короткий адрес: https://sciup.org/170170322
IDR: 170170322 | DOI: 10.21870/0131-3878-2017-26-4-52-62
Текст научной статьи Изменение популяции стволовых клеток рака молочной железы линии MCF-7 при одиночном и комбинированном действии ионизирующего излучения и конъюгатов дендритных полимеров с доксорубицином
Как свидетельствуют многочисленные данные литературы и результаты собственных исследований, опухолевые стволовые клетки (ОСК), обнаруженные в злокачественных новообразованиях различных локализаций, первичных и стабильных культурах опухолевых клеток, обладают более высокой резистентностью к редкоионизирующему излучению и многим противоопухолевым препаратам по сравнению с остальной массой клеток [1-6]. Поэтому в последние годы высказывается предположение, что именно эта фракция клеток может определять неблагопри-
Матчук О.Н.* – научн. сотр., к.б.н.; Чурюкина К.А. – мл. научн. сотр.; Яббаров Н.Г. – ст. научн. сотр., к.б.н.; Никольская Е.Д. – лаб.-исслед.; Замулаева И.А. – зав. отделом, д.б.н., проф. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России. Жунина О.А. – ст. научн. сотр., к.б.н.; Кондрашева И.Г. – дир. по инновационному развитию, к.б.н.; Северин Е.С . – ген. директор, д.х.н., чл.-корр. РАН. АНО «ИМОДИ».
ятные результаты лучевого и комбинированного лечения онкологических больных, включая возникновение рецидивов заболевания и метастазирование. В настоящее время выясняются молекулярные механизмы резистентности ОСК к различным факторам физической или химической природы, и на этой основе разрабатываются новые способы/средства элиминации ОСК или повышения чувствительности этих клеток к известным противоопухолевым воздействиям
(рис. 1) [7-10].
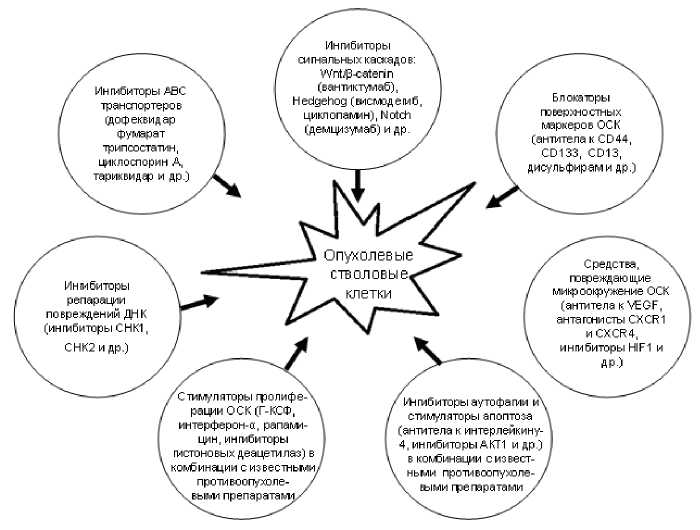
Рис. 1. Средства элиминации ОСК и/или повышения их чувствительности к противоопухолевым воздействиям, сгруппированные по механизмам действия (часть из них успешно прошла клинические испытания, часть находится на стадии доклинических исследований).
Одним из важнейших механизмов химиорезистентности ОСК является быстрое удаление из этих клеток многих противоопухолевых препаратов вследствие высокой экспрессии на клеточной мембране АТФ-связывающих кассетных (ABC) транспортёров, осуществляющих обратное откачивание токсичных соединений во внеклеточную среду [8, 10]. Действительно, ингибирование таких транспортёров приводит к повышению чувствительности ОСК к ряду противоопухолевых препаратов. Можно также предположить, что форма внутриклеточной доставки противоопухолевых препаратов может влиять на эффективность работы АВС-транспортёров, нарушая, например, их связывание с препаратами, что может привести к большему накоплению последних в ОСК и, соответственно, к более эффективной элиминации этой фракции клеток как при одиночном применении препаратов, так и в комбинации с облучением. В данной работе проведена проверка этого предположения на примере стабильной культуры рака молочной железы линии MCF-7.
Материалы и методы
ОСК выявляли с помощью проточной цитометрии известным методом SP (side population), основанном на способности ОСК откачивать флуоресцентный краситель Хёхст33342 и формировать популяцию, слабо окрашенную этим красителем. В качестве проти- воопухолевого препарата выбран доксорубицин (Докс), который входит в традиционные схемы лечения рака молочной железы и, как известно, обладает радиосенсибилизирующим действием за счёт своей способности снижать эффективность репарации сублетальных и потенциально летальных радиационно-индуцированных повреждений ДНК [11]. В работе использовали Докс: свободный и в форме конъюгатов с дендритными полимерами второго поколения (G2), которые являются перспективными наноконтейнерами для направленной доставки противоопухолевых препаратов в клетки-мишени. В качестве векторной молекулы использован фрагмент (третий домен – 3D) онкофетального белка альфа-фетопротеина (АФП). Рецепторы к АФП были обнаружены в клетках злокачественных новообразований различной локализации, но не в нормальных клетках [12], поэтому лиганд АФП рецептора – полноразмерный белок АФП или его фрагмент могут быть использованы в качестве векторов для адресной доставки в опухолевые клетки химиопрепаратов, повышая, таким образом, селективность и эффективность действия последних.
В работе сравнивали внутриклеточное содержание Докс в SP и остальных клетках (non SP – NSP) через 24 ч после инкубации со свободным Докс, G2-Докс и 3D-G2-Докс, а также оценивали цитотоксическое действие этих соединений на клетки SP в сравнении с NSP в случае их одиночного применения или в комбинации с облучением.
Синтез конъюгата G2 дендримера с Докс (G2-Докс). В работе использованы полиамидоаминовые дендримеры 2-го поколения с 16 терминальными NH 2 -группами и ядром на основе этилендиамина («Dendritech», США). Ковалентные конъюгаты G2-Докс («Sigma-Aldrich», США) синтезировали с использованием кислотолабильного линкера цис-аконитового ангидрида в соответствии с ранее описанной методикой [13]. Чистоту полученного продукта анализировали с помощью высокоэффективной жидкостной хроматографии. Содержание Докс в конъюгате определяли путём фотоколориметрического измерения поглощения Докс при 481 нм.
Получение рекомбинантного 3D АФП и его конъюгата с дендримером G2 и Докс. 3D АФП получали посредством бактериальной системы экспрессии, а именно с помощью штамма E. coli BL21DE3, трансформированного конструктом на основе плазмиды pET28a+, которая содержала нуклеотидную последовательность, кодирующую целевой белок и полиглутаминовую вставку (21 аминокислотный остаток) по С-концу. Оптимизация нуклеотидной последовательности за счёт введения указанной вставки позволила получить рекомбинантный белок в растворимом виде. Получение конъюгата 3D-G2-Докс осуществляли с помощью Cu1+-катализи-руемой реакции циклоконденсации в несколько стадий, как подробно описано в статье [14]. Количество доксорубицина в конъюгате определяли путём фотоколориметрического измерения поглощения Докс при 481 нм. Гомогенность конъюгата, чистоту и молекулярную массу конечного конъюгата определяли с помощью аналитической гель-эксклюзионной хроматографии на колонке TSK gel G2000SWxl на хроматографической системе Shimadzu LC-20 Promience (Япония).
Инкубация клеток с препаратами и облучение. Клетки линии MCF-7 культивировали по стандартной методике в полной питательной среде DMEM (ПанЭко, РФ) с добавлением 10% фетальной сыворотки крупного рогатого скота (Biosera, Франция). Клеточные культуры в логарифмической стадии роста инкубировали с препаратами Докс (свободным Докс, G2-Докс и 3D-G2-Докс) в концентрации 2,5 мкМ по Докс в среде DMEM без сыворотки в течение 2 ч. Затем клетки подвергали воздействию γ-излучения (60Со) на установке «Луч-1» (Россия) в дозе 4 Гр (MCF-7). Мощность дозы составляла 0,9 Гр/мин. Часть клеток облучали без препаратов или ин- кубировали с препаратами, но не облучали. Контролем служили необлучённые и не обработанные препаратами клетки. Далее среду с препаратами удаляли, к клеткам приливали полную питательную среду с сывороткой и культивировали ещё 24 ч, после чего клетки снимали с подложки в среду DMEM, определяли их концентрацию с помощью камеры Горяева и вычисляли общее количество клеток во флаконах. Затем полученную клеточную суспензию инкубировали с красителем Хёхст33342 (Sigma, США) для выявления и сравнительного исследования клеток SP и NSP, как описано ниже.
Выявление и количественный анализ клеток SP и NSP. Концентрацию клеток доводили до 1 x 10 6 кл./мл. К 1 мл суспензии клеток добавляли Хёхст33342 в конечной концентрации 5 мкг/мл и инкубировали 90 мин при +37 оС и периодическом перемешивании. К части проб за 15 мин до внесения красителя добавляли верапамил в конечной концентрации 12,5 мкг/мл. Как известно, верапамил препятствует обратному транспорту ряда веществ, в том числе Хёх-ста33342, из клетки. Поэтому при введении верапамила доля SP значительно уменьшается, что может быть использовано для подтверждения способности этих клеток эффективно откачивать краситель. После окончания инкубации клетки собирали с помощью центрифугирования в течение 5 мин при 200 x g, к осадку добавляли 1 мл холодного раствора Хэнкса (ПанЭко, Россия), содержащего 2% эмбриональной сыворотки (Gibco, США) и 10 мМ Hepes (Sigma, США), и ре-суспендировали. Далее образцы анализировали с помощью проточного цитофлуориметра-сортировщика FACS Vantage (Becton Dickinson, США), оборудованного двумя лазерами с длинами волн 364 нм (177-G1202, Spectra Physics Lasers, США) и 488 нм (Enterprise ENT 621, Coherent, США). Флуоресценцию Хёхст33342 измеряли в синей (424 ± 20 нм) и красной (675 ± 20 нм) областях спектра (при Х возб=364 нм), а также регистрировали флуоресценцию Докс при длине волны 585 ± 20 нм ( Х возб=488 нм). Также фиксировались данные об интенсивности прямого и бокового светорассеяния клеток. В каждой пробе анализировали не менее 100 тысяч клеток, данные об измеряемых параметрах флуоресценции и светорассеяния записывали в файл, который затем обрабатывали с помощью программы CellQuestPro (Becton Dickinson, США), как подробно описано ранее [15]. Коротко: строили графики распределения клеток по интенсивности флуоресценции Хёхст33342 в красной и синей областях спектра. Для определения SP графически выделяли регион клеток с низкой интенсивностью флуоресценции этого красителя. SP выделяли таким образом, чтобы в контрольных образцах с верапамилом в этот регион попадало минимальное количество клеток. Вычисляли относительное и абсолютное количество клеток SP после применения изучаемых препаратов Докс и/или облучения.
Статистическая обработка. Для описательной статистики использовали среднее значение и стандартную ошибку (SE), вычисленные с помощью программы «Statistica 6.0» (StatSoft., Inc.). Групповое сравнение полученных данных проводили по критерию Манна-Уитни в той же программе. Различия считали статистически значимыми при р<0,05. Построение графиков выполняли с помощью программы «Origin 6.0» (Microcal Software, Inc.).
Результаты и обсуждение
В данной работе изучалось внутриклеточное содержание Докс, поступившего в опухолевые клетки в форме различных конъюгатов или в свободном виде, после частичного удаления во время инкубации в чистой среде без препаратов. Следовательно, измеряемый параметр является результатом нескольких последовательных процессов – накопления путём эндоцитоза
(неспецифического в случае G2-Докс и специфического в случае 3D-G2-Докс) или диффузии через липидный бислой (в случае свободного Докс), высвобождения Докс из конъюгатов при низких значениях рН во вторичных лизосомах и удаления Докс из клеток соответствующими обратными транспортёрами. Все указанные процессы могут влиять на цитотоксическое действие изучаемых препаратов Докс, поэтому представляло интерес изучить результат их совместного действия, причём отдельно в ОСК (SP) и остальной массе не стволовых клеток (NSP).
На рис. 2 представлены полученные данные об интенсивности флуоресценции Докс, по которой судили о содержании этого соединения в разных клеточных популяциях. Прежде всего, обращает на себя внимание факт значительно менее интенсивной флуоресценции Докс в клетках SP по сравнению с NSP (p<0,01) при использовании всех препаратов. Причём клетки SP содержали одинаковое количество Докс во всех случаях, судя по одинаковой флуоресценции после инкубации со свободным Докс, G2-Докс и 3D-G2-Докс. Можно полагать, что основной причиной наблюдаемых различий по содержанию Докс в клетках SP и NSP является более высокая экспрессия АВС-транспортёров на поверхности первых, хотя нельзя исключать наличие различий в интенсивности накопления изучаемых соединений в клетках SP и NSP, а также различий в высвобождении Докс из конъюгатов в этих клеточных популяциях. Однако, выяснение точного вклада каждого из этих процессов требует отдельного изучения.
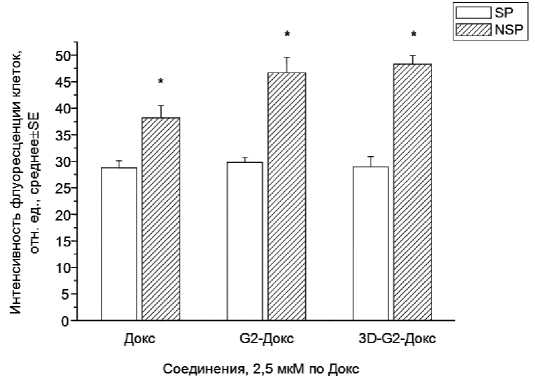
Рис. 2. Интенсивность флуоресценции Dox в клетках SP и NSP линии MCF-7 после инкубации со свободным Докс, конъюгатами G2-Докс или 3D-G2-Докс (*р<0,01 по сравнению с SP).
Относительно низкое содержание изучаемых соединений в клетках SP, по-видимому, является одной из основных причин более высокой резистентности этих клеток по сравнению с NSP, о чём свидетельствует увеличение доли SP при применении всех соединений (рис. 3). Интересно, что после инкубации со свободным Докс доля SP возрастает в среднем до 13,1%, после инкубации с G2-Докс – до 4,2%, после инкубации с 3D-G2-Докс – до 3,4%, составляя в контроле 1,8% (р<0,05 по сравнению с контролем во всех случаях). Следует отметить, что общее количество клеток MCF-7 уменьшается сильнее всего при использовании свободного Докс; конъюгаты G2-Докс и 3D-G2-Докс снижали общее количество клеток в меньшей степени (рис. 4). Эти различия, по крайней мере отчасти, объясняют тот факт, что именно использование свободного Докс приводило к максимальному повышению доли клеток SP. При этом важно отметить, что снижение общего числа клеток после инкубации со свободным Докс, конъюгатами
G2-Докс и 3D-G2-Докс составляло соответственно 50,5, 8,2 и 12,0% от контрольного уровня, а доля SP увеличивалась значительно: в 7,7, 2,3 и 1,9 по сравнению с контролем. Поэтому можно заключить, что сохранение жизнеспособности клеток SP является не единственным фактором, обеспечивающим увеличение этой популяции под влиянием препаратов Докс, важную роль могут играть такие процессы как дедифференцировка клеток NSP с переходом в пул SP и пролиферация клеток SP. Точный вклад этих процессов в формирование SP после действия препаратов Докс (поодиночке или в комбинации с облучением) требует дальнейших исследований.
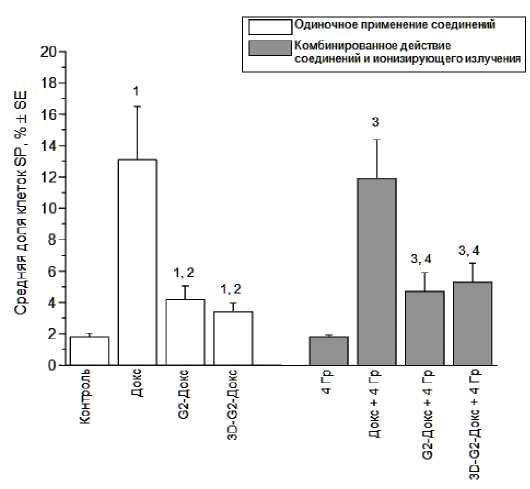
Рис. 3. Доля клеток SP в культуре линии MCF-7 через 24 часа после одиночного и комбинированного применения изучаемых соединений (свободного Докс, G2-Докс, 3D-G2-Докс) и ионизирующего излучения.
1 р<0,05 по сравнению с контролем; 2 р<0,05 по сравнению с группой «Dox»; 3 р<0,05 по сравнению с группой «4 Гр»; 4 р<0,05 по сравнению с группой «4 Гр+Dox».
р-ЗО'
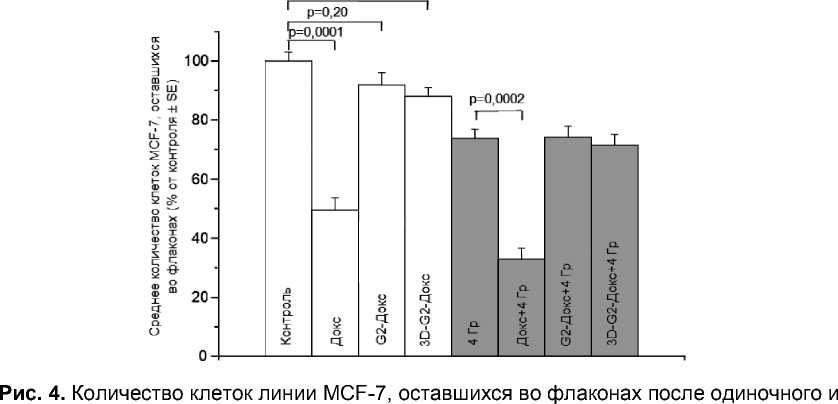
комбинированного действия препаратов Докс (2,5 мкМ) и ионизирующего излучения в дозе 4 Гр. Представлены данные в процентах от количества клеток в контроле, принятого за 100%. Указана величина р – вероятность отсутствия различий между сравниваемыми группами.
Результаты определения абсолютного количества клеток SP, представленные на рис. 5, свидетельствуют о тенденции к повышению этого показателя при использовании всех соединений по сравнению с контролем (р=0,08-0,10 в различных случаях), в то время как популяция клеток NSP уменьшается, хотя и в различной степени, при использовании разных соединений (рис. 6). Интересно, что по изменению абсолютного количества клеток SP изучаемые соединения статистически значимо не отличаются между собой, что также отражает факт одинакового внутриклеточного содержания Докс в SP при использовании всех этих соединений (рис. 2).
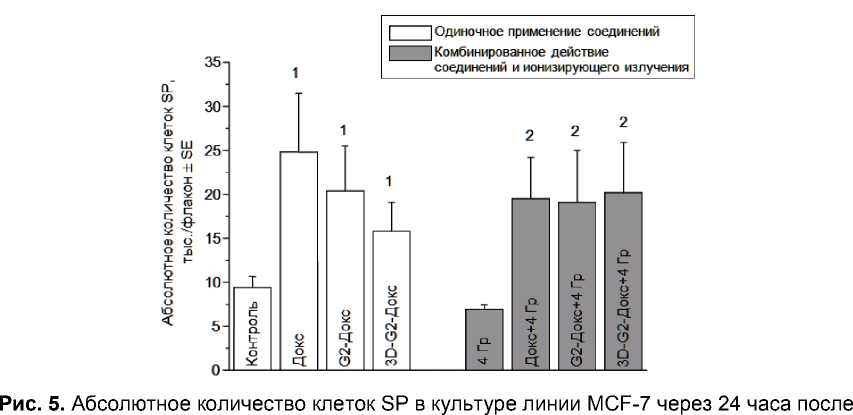
одиночного и комбинированного применения изучаемых соединений (свободного Докс, G2-Докс, 3D-G2-Докс) и ионизирующего излучения.
1 p=0,08-0,10 по сравнению с контролем; 2 p<0,05 по сравнению с группой «4 Гр».
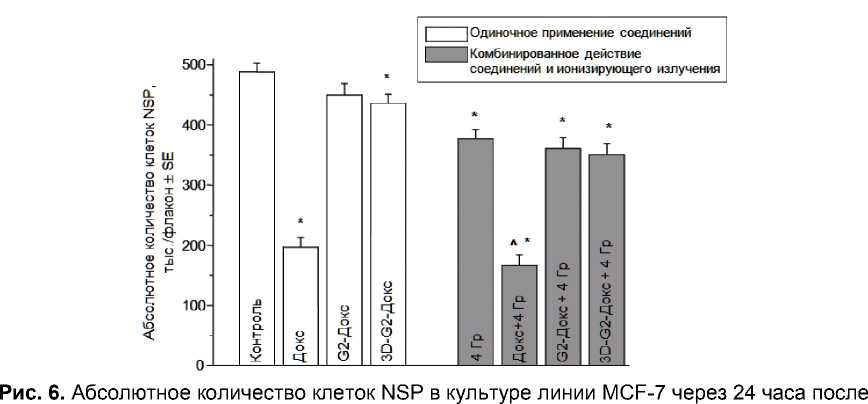
одиночного и комбинированного применения изучаемых соединений (свободного Докс, G2-Докс, 3D-G2-Докс) и ионизирующего излучения.
* p<0,05 по сравнению с контролем; ^ p<0,05 по сравнению с группой «4 Гр».
При комбинированном действии изучаемых соединений и ионизирующего излучения отмечаются те же закономерности, что и при одиночном применении этих соединений.
Ранее нами были получены данные, свидетельствующие о более интенсивном накоплении и более медленном удалении конъюгатов G2-Докс и 3D-G2-Докс из клеток химиорезистент-ной линии MCF-7/MDR1 по сравнению со свободным Докс [16]. Клетки этой линии имеют при- знаки множественной лекарственной устойчивости (МЛУ) вследствие высокой экспрессии Р-гли-копротеина (первый член подсемейства В суперсемейства АВС-транспортёров, кодируемый у человека геном АВСВ1), который обеспечивает обратный транспорт многих противоопухолевых препаратов (в том числе свободного Докс) во внеклеточную среду. Однако высокая экспрессия Р-гликопротеина в значительно меньшей степени влияла на удаление Докс, поступившего в клетки в составе дендримеров, что в итоге приводило к существенно более высокому содержанию Докс в случае использования конъюгатов по сравнению со свободным Докс (более чем в 2 раза через 24 ч культивирования в чистой среде после двухчасовой инкубации с препаратами, т.е. в условиях, использованных и в данном исследовании). Результаты, полученные нами на культуре MCF-7/MDR1, подтверждают данные других авторов о перспективности использования наночастиц для преодоления МЛУ [17] и лежат в основе предположения о возможной эффективности такого подхода для снижения химиорезистентности ОСК. Однако, как показано в данной статье на примере линии MCF-7, использование G2-Докс или 3D-G2-Докс не приводит к более высокому или хотя бы одинаковому накоплению Докс в клетках SP по сравнению NSP. Важ-но также, что размер популяции ОСК (SP) не только не уменьшается (в отличие от NSP), но даже имеет тенденцию к увеличению. В целом, использованные нами клеточные модели и транспортные системы демонстрируют наличие существенных различий между феноменами высокой химиорезистентности ОСК и МЛУ, несмотря на наличие и общих характеристик (например, высокой экспрессии АВС-транспортёров). По-видимому, для снижения химиорезистентности ОСК недостаточно использовать средства адресной доставки химиопрепаратов в общую популяцию опухолевых клеток (в нашем случае 3D-G2-Докс); в этом случае необходимы средства направленного транспорта химиопрепаратов именно в ОСК, например, наночастицы, покрытые антителами к поверхностным маркерам ОСК (CD44, CD133) или соответствующими лигандами (гиалуроновой кислотой и др.) [10]. Кроме того, использование наночастиц с разной химической структурой (дендримеров, липосом, углеродных нанотрубок, полимерных и металлических наночастиц), нагруженных новыми препаратами с различным механизмами действия на ОСК, также является очень перспективным, как показывают результаты доклинических и клинических исследований [18, 19]. Наконец, особенно привлекательной является разработка новых транспортных систем на основе наночастиц, селективно доставляющих в ОСК сразу несколько противоопухолевых препаратов, в том числе, индуцирующих дифференцировку ОСК [20].
Заключение
Результаты исследования свидетельствуют об относительно низком внутриклеточном содержании Докс в ОСК (SP) по сравнению с остальными клетками при использовании всех изученных соединений, что в значительной мере объясняет различие цитотоксического действия этих соединений на разные популяции клеток. Так, под влиянием использованных соединений Докс абсолютное количество клеток NSP уменьшалось, в то время как количество клеток SP имело тенденцию к увеличению. Таким образом, с помощью данного подхода не удалось достичь гибели ОСК. По-видимому, более эффективным подходом к элиминации ОСК стало бы использование транспортных систем на основе наночастиц, обеспечивающих направленную доставку в ОСК химиопрепаратов с селективным действием именно на эту популяцию клеток, включая средства дифференцировки ОСК и ингибиторы дедифференцировки остальных клеток.
Исследование выполнено за счёт гранта Российского научного фонда (проект № 1515-10013).
Список литературы Изменение популяции стволовых клеток рака молочной железы линии MCF-7 при одиночном и комбинированном действии ионизирующего излучения и конъюгатов дендритных полимеров с доксорубицином
- Dubrovska A. Report on the International Workshop «Cancer stem cells: The mechanisms of radioresistance and biomarker discovery»//Int. J. Radiat. Biol. 2014. V. 90, N 8. P. 607-614.
- Rycaj K.,Tang D.G. Cancer stem cells and radioresistance//Int. J. Radiat. Biol. 2014. V. 90, N 8. P. 615-621.
- Pavlopoulou A., Oktay Y., Vougas K., Louka M., Vorgias C.E., Georgakilas A.G. Determinants of resistance to chemotherapy and ionizing radiation in breast cancer stem cells//Cancer Lett. 2016. V. 380, N 2. P. 485-493.
- Yang F., Xu J., Tang L., Guan X. Breast cancer stem cell: the roles and therapeutic implications//Cell. Mol. Life Sci. 2017. V. 74, N 6. P. 951-966.
- Матчук О.Н., Саенко А.С. Влияние редкоионизирующего излучения и химиопрепаратов на опухолевые стволовые клетки (SP) меланомы B16 и аденокарциномы молочной железы MCF-7//Радиация и риск. 2013. Т. 22, № 2. С. 67-76.
- Замулаева И.А., Матчук О.Н., Селиванова Е.И., Андреев В.Г., Липунов Н.М., Макаренко С.А., Жаворонков Л.П., Саенко А.С. Увеличение количества опухолевых стволовых клеток под воздействием редкоионизирующего излучения//Радиационная биология. Радиоэкология. 2014. Т. 54, № 3. С. 256-264.
- Takebe N., Miele L., Harris P.J., Jeong W., Bando H., Kahn M., Yang S.X., Ivy S.P. Targeting Notch, Hedgehog, and Wnt pathways in cancer stem cells: clinical update//Rev. Clin. Oncol. 2015. V. 12, N 8. P. 445-464.
- Ahmed M., Chaudhari K., Babaei-Jadidi R., Dekker L.V., Shams Nateri A. Concise review: emerging drugs targeting epithelial cancer stem-like cells//Stem Cells. 2017. V. 35, N 4. P. 839-850.
- Kuhlmann J.D., Hein L., Kurth I., Wimberger P., Dubrovska A. Targeting cancer stem cells: promises and challenges//Anticancer Agents Med. Chem. 2016. V. 16, N 1. P. 38-58.
- Shen S., Xia J.X., Wang J. Nanomedicine-mediated cancer stem cell therapy//Biomaterials. 2016. V. 74. P. 1-18.
- Bonner J.A., Lawrence T.S. Doxorubicin decreases the repair of radiation-induced DNA damage//Int. J. Radiat. Biol. 1990. V. 57, N 1. P. 55-64.
- Ницветов М.Б., Москалева Е.Ю., Посыпанова Г.А., Макарова О.В., Степанов В.А., Рогов К.А., Коромыслова И.А., Караулов А.В., Северин С.Е., Северин Е.С. Изучение экспрессии рецептора АФП в опухолевых и нормальных тканях человека с помощью иммуногистохимического метода//Иммунология. 2005. Т. 26, № 2. С. 122-125.
- Яббаров Н.Г., Посыпанова Г.А., Воронцов Е.А., Попова О.Н., Северин Е.С. Направленный транспорт доксорубицина: система доставки на основе РАМАМ дендримеров//Биохимия. 2013. Т. 78, № 8. С. 1128-1140.
- Ahmad Fuaad A.A., Azmi F., Skwarczynski M., Toth I. Peptide conjugation via CuAAC ‘click’ chemistry//Molecules. 2013. V. 18, N 11. P. 13148-13174.
- Матчук О.Н., Замулаева И.А., Ковалев О.А., Саенко А.С. Механизмы радиорезистентности клеток SP культуры мышиной меланомы В16//Цитология. 2013. Т. 55, № 8. С. 553-559.
- Замулаева И.А., Чурюкина К.А., Матчук О.Н., Яббаров Н.Г., Никольская Е.Д., Макаренко С.А., Жунина О.А., Кондрашева И.Г., Северин Е.С. Цитотоксические эффекты комбинированного действия ионизирующего излучения и конъюгатов доксорубицина с дендритным полимером и векторным белком на опухолевые клетки in vitro//Радиация и риск. 2016. Т. 25, № 3. С. 46-56.
- Kapse-Mistry S., Govender T., Srivastava R., Yergeri M. Nanodrug delivery in reversing multidrug resistance in cancer cells//Front. Pharmacol. V. 5. Article 159. P. 1-22.
- Zhao Y., Alakhova D.Y., Kabanov A.V. Can nanomedicines kill cancer stem cells?//Adv. Drug Deliv. Rev. 2013. V. 65, N 13-14. P. 1763-1783.
- Malhi S., Gu X. Nanocarrier-mediated drugs targeting cancer stem cells: an emerging delivery approach//Expert Opin. Drug. Deliv. 2015. V. 12, N 7. P. 1177-1201.
- Sun R., Liu Y., Li S.Y., Shen S., Du X.J., Xu C.F., Cao Z.T., Bao Y., Zhu Y.H., Li Y.P., Yang X.Z., Wang J. Co-delivery of all-trans-retinoic acid and doxorubicin for cancer therapy with synergistic inhibition of cancer stem cells//Biomaterials. 2015. V. 37. P. 405-414.


