Изменение "портрета" пациентов с впервые установленной идиопатической легочной гипертензией за последние два десятилетия
Автор: Шария А.М., Мартынюк Т.В.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2024 года.
Бесплатный доступ
Цель: провести комплексный анализ клинико-функционального и гемодинамического статуса пациентов с идиопатической легочной гипертензией (ИЛГ) для сравнения «портрета» исторической и современной подгрупп.
Легочная артериальная гипертензия, идиопатическая легочная гипертензия, оценка риска, прогноз, риск смерти, орфанные заболевания
Короткий адрес: https://sciup.org/143183519
IDR: 143183519 | УДК: 616.12-008.331.1 | DOI: 10.38109/2225-1685-2024-3-42-49
Текст научной статьи Изменение "портрета" пациентов с впервые установленной идиопатической легочной гипертензией за последние два десятилетия
Данная статья распространяется на условиях «открытого доступа», в соответствии с лицензией CC BY-NC-SA 4.0 («Attribution-NonCommercial-ShareAlike»/ «Атрибуция-Не-коммерчески-СохранениеУсловий» 4.0), которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Чтобы ознакомиться с полными условиями данной лицензии на русском языке, посетите сайт: by-nc-sa/4.0/
This is an open access article distributed under the terms of the Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0) License , which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
Идиопатическая легочная гипертензия (ИЛГ) является редкой сердечно-сосудистой патологией неизвестной этиологии, при которой повышение сопротивления легочных сосудов вследствие ремоделирования прекапиллярного русла легких приводит к существенному повышению давления в легочной артерии, правожелудочковой сердечной недостаточности и смерти. Среди пациентов c легочной артериальной гипертензией (ЛАГ), по данным современных регистров, доля пациентов с ИЛГ составляет 40–45% [1].
Впервые данные, описывающие естественное течение идиопатической и наследуемой ЛАГ, были получены в 80-х годах при поддержке Национальных институтов здравоохранения в США. Проводилось наблюдение в течение 5 лет за 187 пациентами, у которых наблюдался крайне неблагоприятный прогноз с медианой выживаемости 2,8 лет. Показатели 1, 3 и 5-летней выживаемости составили соответственно 68%, 48% и 34% соответственно. Медиана выживаемости – 2,8 лет. Средний возраст составил 36±15 лет, медиана периода от появления симптомов до постановки диагноза – 2 года [2].
За четверть века разработка патогенетической терапии ЛАГ с внедрением в клиническую практику комбинированных схем лечения способствовали существенному улучшению прогноза больных. Проведены многочисленные регистры пациентов с ЛАГ в США и Европейских странах, которые показывают, что ИЛГ часто возникает у пациентов с сопутствующими заболеваниями, которые могут влиять на прогноз данной группы пациентов [3]. Так, в американском регистре REVEAL [The Registry to Evaluate Early and Long-term Pulmonary Arterial Hypertension Disease Management] наиболее распространенными сопутствующими заболеваниями были гипертоническая болезнь (ГБ) (40%), ожирение (33%), обструктивное заболевание дыхательных путей, не считающееся причиной ЛАГ (22%), сахарный диабет (CД) (12%) и депрессия (25%). Большая часть пациентов с обструктивным заболеванием легких и ожирением были III-IV функционального класса (ФК) на момент включения. Риск летального исхода был повышен у пациентов с диабетом (ОР – 1,73; 95% ДИ, 1,40-2,13; р<0,001) и пациентов с обструктивным заболеванием дыхательных путей (ОР-1.59; 95% ДИ 1,34–1.90; р<0,001), а 3-летняя выживаемость составила 62,2%±2,8% и 64,7%±2,3% [5]. В то время как показатели 1,3 и 5-летней выживаемости у пациентов с так называемой классической ИЛГ без коморбидности составили – 91%±2%, 74%±2% и 65%±3% соответственно. Средняя выживаемость пациентов в группе составила 7 лет, а медиана от начала симптомов до постановки диагноза составила 1 год [4].
Острая фармакологическая проба (ОФП) проводится во время катетеризации правых отделов сердца (КПОС) у всех пациентов с впервые установленным диагнозом ИЛГ для выявления больных с сохранной вазореактивностью и благоприятным долгосрочным эффектом при применении высоких доз блокаторов кальциевых каналов [1]. У ряда больных ввиду гипотонии не удается осуществить титрацию дозы или отмечается «ускользание» клинического ответа, что требует эскалации специфической терапии [6]
На основании полученных за последние годы данных разработано множество шкал для оценки риска пациентов с ЛАГ, которые успешно применяются в клинической практике. В Евразийских рекомендациях 2019 года и российских клинических рекомендациях «Лёгочная гипертензия, в том числе хроническая трмбоэмболи-ческая легочная гипертензия» от 2020 года применяется модель стратификации риска из Европейского документа по диагностике и лечению ЛАГ 2015 года рекомендуют проводить оценку риска у всех пациентов с использованием многомерной стратификации по клиническим параметрам, данным визуализации, физическим и гемодинамическим переменным с известной прогностической значимость [1,6,8]. Эта шкала стратификации риска предназначена для применения в момент постановки диагноза и последующей оценки, а критерии низкого риска используются в качестве целей лечения.
Таким образом, сравнение «портрета» пациентов с впервые установленным диагнозом ИЛГ в двух исторических когортах – начала 2000 гг. до широкого применения ЛАГ-специфической терапии и в последнее 10-летие представляется актуальной задачей.
МАТЕРИАЛЫ И МЕТОДЫ
На базе отдела легочной гипертензии и заболеваний сердца НИИ клинической кардиологии им. А.Л. Мясникова ФГБУ «НМИЦ кардиологии им. ак. Е. И. Чазова» Минздрава России за период 2003-2022 гг. отобрано 120 пациентов с впервые установленным диагнозом ИЛГ старше 18 лет. Критериями исключения были легочная гипертензия (ЛГ) другой этиологии, включая ассоциированные формы ЛАГ, противопоказания к назначению ЛАГ-специфической терапии (доказанная ишемия миокарда у больных с гемодинамически значимыми поражениями коронарных артерий, наличие посткапиллярной ЛГ, выраженная дыхательная недостаточность, тяжелые нарушения функции печени (более 9 баллов по шкале Чайлд-Пью, класс С); тяжелые нарушения функции почек (СКФ менее 15 мл/мин), потребность в гемодиализе). Проведен анализ историй болезни, в результате которого пациенты разделены на две подгруппы – историческую и современную, в зависимости от даты установленного диагноза (период 2003-2012 гг. и 2013-2022 гг). Диагноз ИЛГ у всех больных верифицирован на основании комплексного клиникоинструментального обследования, включавшего данные анамнеза и физикального осмотра, рентгенографию органов грудной клетки, электрокардиографию, эхокардиографию, функцию внешнего дыхания, перфузионную сцинтиграфию легких, МСКТ легких с ангиопульмонографией, катетеризацию правых отделов сердца (КПОС) с проведением ОФП. Разные исторические когорты были сопоставимы по соотношению в подгруппах пациентов с различным ФК на момент включения. Проводилось изучение демографических, лабораторных, клинических, функциональных, гемодинамических характеристик пациентов, а также коморбид-ных состояний и схем начальной ЛАГ-специфической и поддерживающей терапии с целью сравнительного анализа.
Оценка риска летальности в течение одного года проводилась согласно шкалам стратификации риска, предложенным в Европейских рекомендациях ESC 2015 [6], а также упрощенного калькулятора оценки риска (без параметров инвазивного измерения гемодинамики) – REVEAL Lite 2.
Статистическая обработка данных проводилась с использованием компьютерной программы Statistica v. 10.0 for Windows (StatSoftlnc, USA), предусматривающей возможность параметрического и непараметрического анализа. Результаты исследований представлены в виде медианы и межквартильного размаха (25-й и 75-й процентиль). Оценка различий между группами и подгруппами проводилась с использованием знакового критерия (G-критерий). Статистически значимые различия считались при достигнутом уровне р<0,05.
РЕЗУЛЬТАТЫ
По результатам оценки данных медиана времени от начала симптомов до постановки диагноза ИЛГ в исторической когорте была больше и составила 24 (7,25-50,25) месяцев, а среди пациентов, диагноз которым установлен в последние годы 13,5 (636,25) месяцев, но достоверно не отличалась. Пациенты исторической когорты на момент установки диагноза имели достоверно более молодой возраст 32 (25,75-44,25) года, против 38,5 (3253,5) года. Соотношение мужчин и женщин между подгруппами было одинаковое (табл. 1).
При анализе симптомов пациентов на старте болезни выявлено что у большинства больных в обеих группах самыми частыми сим- птомами были одышка при умеренной и минимальной физической нагрузке, учащенное сердцебиение, слабость, головокружение, отеки нижних конечностей и боль в грудной клетке (рис. 1).
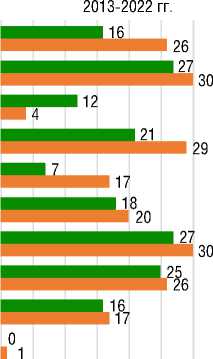
У пациентов из новой когорты чаще встречались сопутствующие заболевания (рис. 2), среди которых преобладали гипертоническая болезнь – 32,7% (n=19) и ожирение – 25,0% (n=15). Во
Одышка при минимальной физической нагрузке
Одышка при умеренной физической нагрузке
Одышка при интенсивной
Боль в груди
Отеки
Головокружение
Сердцебиение
Слабость
Синкопе
Осиплость голоса
Потеря массы тела
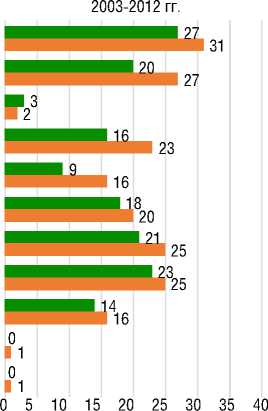
0 5 10 15 20 25 30 35 40
в дебюте болезни на момент диагноза
Рисунок 1. Распространённость симптомов [составлено авторами]
Picture 1. Prevalence of symptoms [compiled by the authors]
Рисунок 2. Сопутствующая патология [составлено авторами]
Picture 2. Associated pathology [compiled by the authors]
Примечание/Note: ХВН – хроническая венозная недостаточность (CVI – chronic venous insufficiency); ХБП – хроническая болезнь почек (CKD – chronic kidney disease); ЩЖ – щитовидная железа (TG – thyroid gland); ФП – фибрилляция предсердий (AF – atrial fibrillation); ТП – трепетание предсердий (AFL – atrial flutter)
2013-2022 гг.
2003-2012 гг.
Таблица 1. Клинико-демографические показатели [составлено авторами]
Table 1. Clinical and demographic parameters [compiled by the authors]
При оценке функционального статуса пациентов медиана дистанции в тесте 6-минутной ходьбы (Т6МХ) составила 370,0 м (302,75-434,25 м) с медианой индекса одышки по Боргу – 4 в группе 1 и 396 м (289,5-449,5 м) с медианой индекса одышки по Боргу – 4,5 в группе 2. В обеих группах основная масса пациентов на момент установки диагноза находилась во II-III ФК (табл. 2).
Для оценки прогноза ИЛГ и стратификации риска по шкалам ESC 2015 и REVEAL Lite 2 проводились лабораторные и инстру- ментальные исследования. Медиана уровня мозгового натрийуретического пептида (NT-proBNP) составила 369 пг/мл (35,42347,5 пг/мл) у исторических пациентов и 342 пг/мл (187-1088,5 пг/мл) у пациентов, диагноз которым установлен в последнее десятилетие, и существенно не отличалась между группами. Остальные ключевые биохимические показатели были в пределах нормы в обеих подгруппах и не отличались (табл. 2).
По данным инструментальных методов исследования отмечается более выраженное ремоделирование правых камер сердца, которое достоверно не отличалось, кроме рентгенометрических показателей (индекс Люпи и КТИ) (табл. 2).
Таблица 2. Инструментальные и лабораторные методы обследования [составлено авторами] Table 2. Instrumental and laboratory parameters [compiled by the authors]
|
Группа пациентов с диагнозом, установленным в 2003-2012 гг. |
Группа пациентов с диагнозом, установленным в 2013-2022 гг. |
Значение р |
|
|
Рентгенография органов грудной клетки |
|||
|
Ширина правого корня, мм |
17 (15,25-19,75) |
20 (17,25-26) |
p=0,14 |
|
Индекс Мура,% |
34 (31-39) |
33 (30-39) |
p=0,92 |
|
Индекс Люпи,% |
37,1 (34-40) |
34 (31-36) |
p=0,02 |
|
Кардиоторакальный индекс,% |
54 (49,25-58) |
50 (47,7-55) |
p=0,01 |
|
Эхокардиография |
|||
|
КДР ЛЖ, см |
4,0 (3,5-4,3) |
3,9 (3,4-4,5) |
p=0,75 |
|
S ПП, см 2 |
24,0 (20,05-30) |
21,0(17,75-26,25) |
p=0,27 |
|
ПЗР ПЖ, см |
3,9 (3,4-3,9) |
3,7 (3,3-4,7) |
p=0,1 |
|
БР ПЖ, см |
4,4 (3,7-5,1) |
4,4 (4,0-5,0) |
p=0,83 |
|
ТПС ПЖ, см |
0,8 (0,68-1) |
0,67 (0,6-0,8) |
p=0,27 |
|
Ствол ЛА, см |
3,4 (3,1-3,7) |
3,2 (2,9-3,3) |
p=0,11 |
|
СДЛА, мм рт. ст. |
100 (85–120) |
86,5 (86–100) |
р=0,32 |
|
Степень ТР |
2 (2–3) |
2 (2–2,5) |
|
|
Выпот в полости перикарда |
36,6% (n=22) |
26,6% (n=16) |
|
|
Катетеризация правых отделов сердца |
|||
|
КПОС |
100% (n=60) |
100% (n=60) |
|
|
ОФП+ |
35% (n=21) |
23,3% (n=14) |
|
|
срДЛА, мм рт. ст. |
61 (50,0-68,0) |
57 (50,0-63,0) |
p=0,81 |
|
срДПП, мм рт. ст. |
9,0 (5-13) |
7,5 (4-11) |
p=0,43 |
|
СИ л/мин/м 2 |
2,1 (1,6-2,4) |
1,9(1,6-2,2) |
p=0,38 |
|
SvO 2 ,% |
62,0 (52,0-68,9) |
61,0 (56,5-67,5) |
p=0,68 |
|
ЛСС, дин сек/см ' |
1125 (704,25-653,5) |
1142 (876,2642,75) |
р=0,67 |
|
Тест 6 минутной ходьбы |
|||
|
Д6МХ, м |
370,5 (302,75-434,25) |
396 (289,5-449,5) |
p=0,89 |
|
ФК (ВОЗ) I II III IV |
6,6% (n=4) 36,6% (n=22) 30,0% (n=18) 10,0% (n=6) |
10,0% (n=6) 43,3% (n=26) 38,3% (n=23) 16,6% (n=10) |
|
|
Одышка по Боргу |
4,0 (2,0–5,0) |
4,5 (2,0-5,25) |
p=0,31 |
|
Лабораторная диагностика |
|||
|
NT-proBNP, пг/мл |
369 (35,4-2347,5) |
342 (187–1088,5) |
р=0,08 |
|
СКФ мл/мин/1,72 м 2 |
80,0 (60,0–93,75) |
88,5 (78–101) |
р=0,78 |
|
Гемоглобин, г/дл |
14,9 (13,4–16,4) |
14,85 (13,44–,39) |
р=0,79 |
|
Общий холестерин, ммоль/л |
4,3 (3,5–5,5) |
4,61 (3,89–5,6) |
р=0,73 |
Примечание/Note: ПЖ – правый желудочек (RV – right ventricule); ЛЖ – левый желудочек (LV – left ventricule); ЛА – легочная артерия (PA – pulmonary artery); КДР – конечно-диастолический размер (EDS – end-diastolic size); S ПП – площадь правого предсердия (S RA – right atrium area); ПЗР – переднезадний размер (RVOT – right venticule outflow tract); БР – базальный размер (4AC – four apical chamber); ТПС – толщина передней стенки (RWT – right ventricular wall thickness); СДЛА – систолической давление легочной артерии (SPAP – systolic pulmonary arterial pressure); срДЛА – среднее давление в легочной артерии (mPAP – mean pulmonary arterial pressure); СИ – сердечный индекс (CI – cardiac index); ДПП-давление в правом предсердии (RAP – right atrial pressure); ЛСС – легочной сосудистое сопротивление (PVR – pulmonary vascular resistance); СКФ – скорость клубочковой фильтрации (GFR – glomerular filtrarion rate); SvO 2 - сатурация венозной крови (SvO 2 - venous blood saturation)
При проведении катетеризации правых отделов сердца (КПОС) получены следующие данные: медиана срДЛА была несколько больше среди исторических пациентов – 61 (50,0-68,0) мм рт. ст., против 57 (50,0-63,0); выше был также СИ и давление в ПП, однако, выявленные различия не достоверны. (табл. 2). Количество пациентов с сохранной вазореактивностью среди исторической когорты больных было больше – 35%, против 23,3% в новой когорте. Известно, что у ряда больных с возрастом отмечается «ускользание» клинического ответа, что требует эскалации специфической терапии, поэтому вероятнее всего это различие связано с тем, что пациенты из группы 2 на момент установки диагноза были достоверно старше.
После получения результатов обследования была проведена оценка риска летальности и прогрессирования болезни с помо- щью шкал ESC/ERS 2015 и упрощенному калькулятору REVEAL Lite 2, который не включает данные КПОС. По результатам оценки риска большинство пациентов в обеих подгруппах имели промежуточный риск неблагоприятных событий с большим количеством пациентов высокого риска у пациентов из новой когорты. Однако, при исключении данных инвазивного измерения гемодинамики (оценка по шкале REVEAL Lite 2) результат модифицировался – наблюдается равномерное распределение пациентов между разными категориями риска (табл. 3).
В результате комплексного анализа результатов обследования была назначена ЛАГ-специфическая терапия (рис. 3), а также, учитывая наличие у ряда пациентов коморбидности, сопутствующая терапия (табл. 4). Среди пациентов исторической когорты постоянная ЛАГ-специфическая терапия была назначена лишь у 8
Таблица 3. Стратификация риска пациентов с ИЛГ [составлено авторами]
Table 3. Risk stratification of patients with IPАH [compiled by the authors]
|
Стратификация риска |
Группа пациентов с диагнозом, установленным в 2003-2012 гг. |
Группа пациентов с диагнозом, установленным в 2013-2022 гг. |
|
ESC/ERS 2015 |
1,9 (1,5-2,2) |
1,9 (1,6-2,3) |
|
Низкий риск |
23,3% (n=14) |
25% (n=15) |
|
Промежуточный риск |
68,3% (n=41) |
55% (n=33) |
|
Высокий риск |
8,3% (n=5) |
20,0% (n=12) |
|
Число параметров низкого риска ESC/ERS 2015 |
4 (2–5) |
4 (1,5–5) |
|
REVEAL Lite 2 |
||
|
Низкий риск |
30,0% (n=18) |
33,3% (n=20) |
|
Промежуточный риск |
41,6% (n=25) |
28,3% (n=17) |
|
Высокий риск |
28,3% (n=17) |
38,3% (n=23) |
ЛАГ специфическая терапия 2013-2022 гг.
■ Моно
Монотерапия
Комби
Не назначено
Комбинированная терапия
3,3%6,6%
-
■ Силденафил
-
■ Амбризентан
-
■ Риоцигуат
-
■ Илопрост
-
■ Бозентан
-
■ Мацитентан
-
■ Селексипаг
21,6%
36,6%
14,7%
9,9%
18,2%
15,0%
15,0%
27,2%
-
■ Силд+Боз
-
■ Силд+Мац
-
■ Риоцигуат+Боз
-
■ Риоцигуат+Мац
-
■ Риоцигуат+Илопрост
-
■ Мац+Селексипаг
1,5%
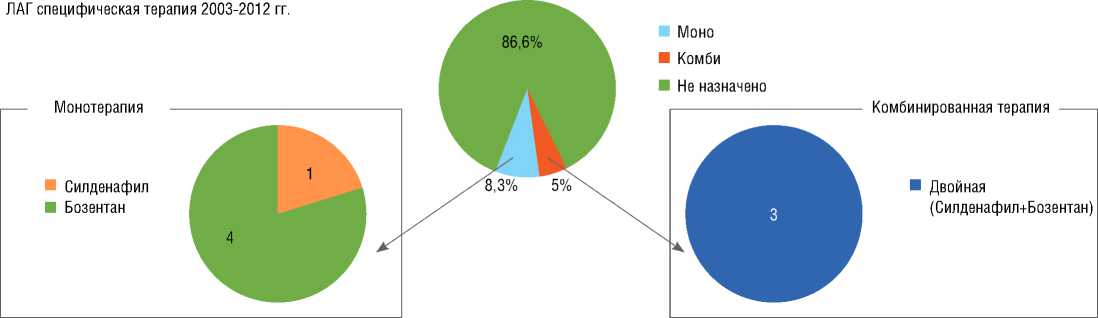
Рисунок 3. Режимы или схемы ЛАГ-специфическая терапия [составлено авторами]
Picture 3. Regimes or schemes of PAH-specific therapy [compiled by the authors]
больных что связано с тем фактом что первый препарат – антагонист эндотелина Бозентан стал доступен в нашей стране с 2008 г. С целью снижения давления в легочной артерии в этой подгруппе проводились курсы ингаляций оксидом азота и простагландином Е1 в течение госпитализации у 73,3% (44 человека).
ОБСУЖДЕНИЕ
Целью настоящего исследования явился сравнительный анализ ключевых параметров, характеризующих «портрет» пациентов с впервые установленным диагнозом ИЛГ в двух исторических когортах – начала 2000 гг. до широкого применения ЛАГ-специфической терапии и в последнее 10-летие.
Несмотря на улучшение выявляемости и уменьшение сроков от начала симптомов до постановки диагноза с 24 месяцев до 13,5 месяцев, ИЛГ остается поздно диагностируемым заболеванием. Этому также способствует, по-прежнему сохраняющийся, большой интервал времени между началом клинических проявлений и обращению к врачу. Полученные данные соответствуют показателям из американского регистра REVEAL, где аналогичный показатель составил 12,8 месяцев [5,11].
Средний возраст пациентов, включенных в регистр, проведенный в США в период с 1981 по 1985 год на момент постановки диагноза, составлял 36 лет; только 9% пациентов были старше 60 лет [2]. С тех пор средний возраст пациентов с ИЛГ на момент постановки диагноза значительно увеличился, по крайней мере, в западных странах. В Германии средний возраст пациентов, у которых впервые диагностирована ИЛГ в 2014 г., составил 65 лет, в Шведском регистре средний возраст пациентов на момент постановки диагноза составил 69 лет [10], а в американской популяции пациентов – 49,9 лет [5]. Медиана возраста пациентов в исследовании COMPERA, входящих в младшую подгруппу (1865лет) составила 54 года. Соотношение женщин и мужчин составило 2,3:1. В нашем исследовании отмечается достоверное увеличение возраста пациентов (с 31 до 40,5 лет, p<0,01), хотя пациенты оказались существенно моложе чем в западных регистрах.
Одной из демографических особенностей пациентов с ИЛГ является отчетливое преобладание женщин среди числа пациентов. Однако, данные несколько разнятся, вероятно, ввиду раз- ных популяций. В Шведском регистре процент женщин с ИЛГ, включенных в исследование, был 55% [10], а в REVEAL – 80,3% [11]. По данным нашего исследования за прошедшие десятилетия процент пациентов женского пола с ИЛГ существенно не изменился (85% и 86,6%).
Неудивительно, что увеличение возраста сопровождается более высокой распространенностью сопутствующих заболеваний. В 2016 году для отражения этих изменений эксперты Кёльнской консенсусной конференции ввели два новых термина: «типичная ИЛГ» и «атипичная ИЛГ».
По данным шведских исследователей [10,12], среди пациентов с ИЛГ моложе 65 лет в 34% встречается гипертоническая болезнь, у 9% – диабет, у 9% – ишемическая болезнь сердца и у 5% – фибрилляция предсердий. Еще более часто сердечно-сосудистая коморбидность встречается у американских пациентов (регистр REVEAL): гипертоническая болезнь – 41,2%; ожирение – 28,6%; диабет – 14,2% [11], а в регистре COMPERA 81% пациентов с ИЛГ имел по крайней мере одну значимую сопутствующую патологию. В структуре сопутствующей патологии в нашем исследовании наиболее часто встречается коморбидность по сердечно-сосудистой патологии, в частности: гипертоническая болезнь – 31,6%, ожирение – 25% и сахарный диабет – 5%. Это различие находит отражение и в большем проценте среди исторической когорты пациентов с положительной ОФП. Известно, что сохранный резерв вазодилатации и долгосрочный ответ на терапию антагонистами кальция чаще встречается у пациентов более молодого возраста [12].
При сравнении клинико-лабораторных и инструментальных данных между подгруппами в нашем исследовании отмечено некоторое отличие в виде более тяжелых изменений в ремоделировании сердца и гемодинамике у пациентов исторической когорты. Однако эти отличия критериев достоверности не достигали (табл. 2).
При стратификации риска пациентов с помощью шкалы ESC/ ERS 2015 выяснено что среди тех, кому диагноз установлен после 2012 года большее число пациентов находилось в высоком риске на момент постановки диагноза. Полученные данные можно объяснить более часто встречающейся коморбидностью среди пациентов этой группы и более старшим возрастом на момент установки диагноза.
Таблица 4. Сопутствующая терапия [составлено авторами]
Table 4. Additional therapy [compiled by the authors]
|
Сопутствующая терапия |
Группа пациентов с диагнозом, установленным в 2003-2012гг |
Группа пациентов с диагнозом, установленным в 2013-2022гг |
|
Антагонисты кальция |
86,6% (n=52) |
30% (n=26) |
|
Дилтиазем |
53,3% (n=32) |
25% (n=15) |
|
Дигидропиридиновые блокаторы кальциевых каналов |
33,3% (n=20) |
15% (n=9) |
|
Ацетилсалициловая кислота |
23,3% (n=14) |
20% (n=12) |
|
Варфарин |
56,6% (n=34) |
53,3% (n=32) |
|
Эноксапарин натрия |
1,6% (n=1) |
0 (n=0%) |
|
Невитамин-К оральные антикоагулянты |
0,00% (n=0) |
3,3% (n=2) |
|
Петлевые диуретики |
43,3% (n=26) |
43,3% (n=26) |
|
Антагонисты альдостерона |
40,0% (n=24) |
43,3% (n=26) |
|
Статины |
0,0% (n=0) |
8,3% (n=5) |
|
Ивабрадин |
0,0% (n=0) |
13,3% (n=8) |
|
Бета-адреноблокаторы |
23,3% (n=14) |
6,6% (n=4) |
|
Эутирокс |
3,3% (n=2) |
5% (n=3) |
|
Терапия сахарного диабета |
0% (n=0) |
3,3% (n=2) |
|
Гипотензивная терапия |
11,6% (n=7) |
13,3% (n=8) |
Оценка риска с помощью калькулятора REVEAL Lite 2, не включающего данные КПОС, уравнивает различие в количестве пациентов с высоким риском между группами, а также уменьшает количество пациентов с высоким риском в целом, в связи с чем можно сделать вывод, что данные инвазивной диагностики в дополнение к другим методам обследования являются важной составляющей с точки зрения как постановки диагноза, так и решения вопроса о назначения ЛАГ- специфической терапии, что отражено в клинических рекомендациях [1,6].
Существенное различие в частоте назначения антагонистов кальция и ЛАГ-специфической терапии объясняется тем, что надежная реализация лекарственного обеспечения в российской практике после первого появления ЛАГ-специфической терапии в нашей стране датировано лишь 2008-2009 гг., в связи с чем у ряда пациентов из исторической когорты она не могла быть назначена на момент установки диагноза по причине ее недоступности [13].
ЗАКЛЮЧЕНИЕ
В наши дни ИЛГ остается поздно диагностируемым заболеванием, что способствует отсрочке в назначении лечения. Клинический «портрет» пациентов с ИЛГ изменился с годами в сторону появления устойчивой когорты более возрастных и коморбидных, особенно по сердечно-сосудистым заболеваниям пациентов, с зачастую уже отсутствующим резервом вазодилатации. Учитывая такую тенденцию, возможно, в будущем будет обосновано добавление возраста и сопутствующих состояний в качестве самостоятельных прогностических факторов. Своевременное выявление и лечение сопутствующей патологии, оценка риска использованием параметром инвазивного измерения гемодинамики в момент постановки диагноза остаются ключом к назначению наиболее эффективной схемы лечения, улучшению качества жизни и прогноза пациентов с ИЛГ.
Список литературы Изменение "портрета" пациентов с впервые установленной идиопатической легочной гипертензией за последние два десятилетия
- Galie N., Humbert M., Vachiery J.L., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur Heart J. 2016;37(1):67-119. https://doi.org/10.1093/eurheartj/ehv317
- Rich S, Dantzker DR, Ayres SM, et al. Primary pulmonary hypertension: a national prospective study. Ann Intern Med 1987;107:216-223. https://doi.org/10.7326/0003-4819-107-2-216
- McEvoy, C.A., Sardana, M., Moll, M., Farber, H., & Chakinala, M. (2016). Patient Registries in Pulmonary Arterial Hypertension: The Role of Survival Equations and Risk Calculators. Pulmonary Hypertension. Springer, Cham. https://doi.org/10.1007/978-3-319-23594-3_20
- Badesch DB, Raskob GE, Elliott CG, et al. Pulmonary arterial hypertension: baseline characteristics from the REVEAL registry. Chest 2010;137:376-387. https://doi.org/10.1378/chest.09-1140
- Benza, Raymond L., Miller, Dave P., Barst, Robyn J., Badesch, David B., Frost, Adaani E., McGoon, Michael D. An evaluation of long-term survival from time of diagnosis in pulmonary arterial hypertension from the REVEAL registry. Chest. 2012 Aug;142(2):448-456. https://doi.org/10.1378/chest.11-1460
- Чазова И.Е., Мартынюк Т.В., Валиева З.С., Азизов В.А., Барбараш О.Л., Веселова Т.Н., Галявич А.С., Горбачевский С.В., Зелвеян П.А., Лазарева И.В., Мукаров М.А., Наконечников С.Н., Саидова М.А., Сарыбаев А.Ш., Стукалова О.В., Шалаев С.В., Шмальц А.А. Евразийские клинические рекомендации по диагностике и лечению легочной гипертензии. Евразийский Кардиологический Журнал. 2020;(1):78-122. https://doi.org/10.38109/2225-1685-2020-1-78-122
- Чазова И.Е., Мартынюк Т.В., Валиева З.С., Азизов В.А., Барбараш О.Л., Веселова Т.Н., Галявич А.С., Горбачевский С.В., Зелвеян П.А., Лазарева И.В., Мукаров М.А., Наконечников С.Н., Саидова М.А., Сарыбаев А.Ш., Стукалова О.В., Шалаев С.В., Шмальц А.А. Евразийские клинические рекомендации по диагностике и лечению легочной гипертензии. Евразийский кардиологический журнал. 2020, Февраль 25;1:78-122. https://doi.org/10.24411/2076-4766-2020-10002
- Легочная гипертензия, в том числе хроническая тромбоэмболическая легочная гипертензия 2020 г. Российское общество кардиологов. Клинические рекомендации. https://scardio.ru/content/Guidelines/2020/Clinic_rekom_LG.pdf
- Hoeper MM, Pausch C, Olsson KM, et al. COMPERA 2.0: a refined four-stratum risk assessment model for pulmonary arterial hypertension. Eur Respir J 2022;60:2102311 https://doi.org/10.1183/13993003.02311-2021
- Hoeper MM, Boucly A, Sitbon O. Age, risk and outcomes in idiopathic pulmonary arterial hypertension. Eur Respir J 2018;51:1800629 https://doi.org/10.1183/13993003.00629-2018
- Badesch, D. B., Raskob, G. E., Elliott, C. G., Krichman, A. M., Farber, H. W., Frost, A. E., McGoon, M. D. (2010). Baseline Characteristics from the REVEAL Registry Pulmonary Arterial Hypertension. Chest, 137(2):376-387. https://doi.org/10.1378/chest.09-1140
- Erika B. Rosenzweig, Jane H. Morse, James A. Knowles, Kiran K. Chada, Amar M. Khan, Kari E. et al. Clinical Implications of Determining BMPR2 Mutation Status in a Large Cohort of Children and Adults with Pulmonary Arterial Hypertension, The Journal of Heart and Lung Transplantation. 2008;27(6):668-674. ISSN 1053-2498, https://doi.org/10.1016/j.healun.2008.02.009
- Мартынюк Т.В. Легочная гипертензия: диагностика и лечение. Москва, 2018. Серия Библиотека ФГБУ «НМИЦ кардиологии» Минздрава России. - Москва: МИА, 2018. - 304 с. ISBN 978-5-6040008-0-9.


