Изменение содержания HSP70 в байкальских эндемических губках Lubomirskiidae в условиях гипертермии
Автор: Ицкович В.Б., Шигарова А.М., Глызина О.Ю., Калужная О.В., Купчинский А.Б., Боровский Г.Б.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.11, 2015 года.
Бесплатный доступ
Байкальские эндемичные губки (Lubomirskiidae) составляют основную часть биомассы бентоса озера. Впервые изменения содержания HSP70 в ответ на повышенную температуру окружающей среды были проанализированы в трех эндемичных видах байкальских губок: Baikalospongia bacillifera (Dybowski, 1880), B. intermedia (Dybowski, 1880) и Swartschewskia papyracea (Dybowski, 1880 ). Для представителей трех проанализированных видов Lubomirskiidae выявлена межвидовая изменчивость конститутивного уровня HSP70. После экспозиции при 13 ° С в течение 3 и 7 дней наблюдались противоположные изменения в количестве HSP70. В условиях гипертермии уровень белка снижается у видов Байкалосонги, а у S. papyracea содержание HSP70 несколько увеличилось. Различия в механизмах адаптации стресса, вероятно, влияют на тепловое сопротивление видов, а также подтверждают их специфический статус.
Короткий адрес: https://sciup.org/14323973
IDR: 14323973
Текст научной статьи Изменение содержания HSP70 в байкальских эндемических губках Lubomirskiidae в условиях гипертермии
У губок экспрессия БТШ70 может быть вызвана тепловым или осмотическим шоком, рН стрессом, тяжелыми металлами и фенолами (Schröder et al., 1999, 2006). Динамика БТШ70 у морских губок изучалась в связи с проблемами теплового стресса вызванного глобальным потеплением (Lopez-Legentil et al., 2008; Webster et al., 2013). Была показана связь нескольких случаев массовой гибели губок с повышением температуры, что определяется узкими границами их температурного оптимума (Vicente, 1989; Cerrano et al., 2000; Cebrian et al., 2011; Webster et al., 2013). В геммулах пресноводной губки Spongilla lacustris было обнаружено повышенное содержание БТШ70, что позволяет клеткам стабилизировать белки и мембраны при изменениях температуры среды (Shill et al., 2006). В первом мониторинговом исследовании биомаркеров стресса было показано, что БТШ70 экспрессируется у эндемичных байкальских губок при тепловом и химическом стрессе (Efremova et al., 2002; Schröder et al., 2006). Проведенные ранее исследования показали также, что сточные воды Байкальского целлюлозно-бумажного комбината вызывают у байкальских губок повышенную экспрессию БТШ70 (Efremova et al., 2002; Schröder et al., 2006), однако данные о температурном оптимуме Lubomirskiidae отсутствуют. В свете последних экологических изменений экосистемы озера Байкал, количественная оценка стресс-индуцируемых белков необходима, чтобы идентифицировать ранние биомаркеры стресса.
Целью работы являлось изучение особенностей изменения содержания белков теплового шока семейства БТШ70 у трех эндемичных видов байкальских губок: Baikalospongia bacillifera (Dybowski, 1880), B. intermedia (Dybowski, 1880) и Swartschewskia papyracea (Dybowski, 1880) в условиях гипертермии.
MATERIALS AND METHODS
Губки были собраны в Южном Байкале (п. Листвянка) на глубине 15 метров в июле 2014 года (рис.1). Сразу после доставки в лабораторию образцы были помещены в аквариумы с байкальской водой (10 л) и содержались при температуре 4 °С и 12 часовом световом режиме, постоянной аэрации и ежедневной замене одной трети воды. Видовая идентификация образцов была проведена на основе микроскопического анализа спикул и скелета согласно ранее описанным методикам (Efremova, 2001). Температура стрессирования была выбрана на основе данных об изменении жирнокислотного состава у Lubomirskia baicalensis после культивирования в аквариуме при повышенных температурах (Glyzina, Glyzin, 2014). После периода адаптации губки были помещены в аквариумы с температурой 13 °С на 3 и 7 суток. Для S. papyracea пробы после трех суток экспозиции не фиксировали из-за мелких размеров губок. По окончании времени экспозиции образцы были помещены в кельвинатор (-70 °С).
Общий белок выделяли по ранее описанному методу (Voinikov et al., 1986). Концентрацию белка в пробах определяли с помощью Quant-iT™ Protein Assay Kit (Thermo Fisher Scientific, USA). По 30 мкг белка каждой пробы разделяли электрофоретически в 12% SDS-PAGE (Laemmli, 1970), далее белок переносили на нитроцеллюлозную мембрану в системе mini– Protean III (Bio–Rad, USA) по прилагаемой инструкции. БТШ70 детектировали с помощью антител, как было описано ранее (Timmons, Dunbar, 1990). Использовали первичные антитела против Hsp70 (Cat. No H5147 Sigma, USA). Антитела визуализировали с помощью вторичных антител, конъюгированных с щелочной фосфатазой (Sigma, USA). Интенсивность окрашивания пятен определяли с помощью программы Gel Analysis (Россия) (усл. ед) и выражали как процент от интенсивности окрашивания пятна данного белка в контроле (или в первом образце на рисунках). Для сравнения интенсивности окрашивания пятен использовали не менее трех типичных мембран для каждого варианта опыта. Приведены средние значения суммарной интенсивности пятна и их стандартные отклонения.
RESULTS AND DISCUSSION
При анализе уровня конститутивного синтеза БТШ70 в пробах трех видов губок при 4 °С выявлены значимые различия между видами (рис.1). Наибольший уровень БТШ70 выявлен у B. intermedia, более низкий у B. bacillifera (68% по сравнению с B. intermedia), самый низкий уровень синтеза белка выявлен у S. papyracea (39% по сравнению с B. intermedia) (рис.2). Межвидовая вариабельность по содержанию конститутивного БТШ70 описана для многих морских и пресноводных организмов (Henkel et al., 2009; Garbuz et al., 2011), в частности для организмов Байкала (Timofeyev et al., 2009; Bedulina et al., 2013). Уровень конститутивного синтеза БТШ70 связан с резистентными способностями вида. Так, у термочувствительных видов амфипод уровни конститутивного синтеза БТШ70 в несколько раз снижены по сравнению с термоустойчивыми видами (Timofeyev et al., 2009; Bedulina et al., 2013). Уровень конститутивного синтеза БТШ70 определяет различия в механизмах стрессового ответа, что и было выявлено нами при анализе динамики изменений количества белка у губок после стрессового воздействия повышенной температурой 13 °С.
После экспозиции при температуре 13 °С в течение 3 и 7 суток были отмечены разнонаправленные изменения в количестве БТШ70 у трех проанализированных видов Lubomirskiidae. После трех суток экспозиции при 13 °С уровень белка у B. intermedia остался практически на прежнем уровне (97% по сравнению с контролем при 4 °С), в то время как у B. bacillifera количество БТШ70 уменьшилось в два раза по сравнению с количеством белка при 4 °С. Через семь суток экспозиции при гипертермии уровень БТШ70 у B. intermedia незначительно снизился (до 91% от контроля), тогда как у B. bacillifera остался почти на том же уровне, как и после трех суток экспозиции (37% по сравнению с контролем при 4 °С) (рис.2). Выявленное значимое снижение содержания БТШ70 у B. bacillifera при повышении температуры до 13 °С, сохраняющееся на протяжении 7 суток, может указывать на угнетение метаболизма, деградацию стрессовых белков, а также переключение с аэробного на менее эффективный анаэробный метаболизм (Geret et al., 2002 ; Sokolova, Pörtner, 2003; Axenov-Gribanov et al., 2012). В отличие от представителей рода Baikalospongia у S. papyracea выявлена тенденция к повышению уровня синтезируемого БТШ70 (на 15% по сравнению с контролем). Функциональной причиной увеличения количества БТШ70 у S. papyracea, вероятно, является необходимость компенсации стрессового воздействия, вызванного повышением температуры выше оптимальных для данного вида значений. Ефремовой с соавторами было показано, что повышение температуры окружающей среды до 20 °С вызывает увеличение количества БТШ70 у трех видов байкальских губок включая B. intermedia (Efremova et al., 2002), однако данные о температурном оптимуме Lubomirskiidae отсутствуют. Согласно нашим данным, повышение температуры окружающей среды до 13 °С может вызывать изменения в содержании БТШ70 и возможно влияет на стабильность других показателей клеточного метаболизма у Lubomirskiidae. Этот факт указывает на возможную связь зафиксированного явления обесцвечивания (Kaluzhnaya, Itskovich, 2015) и массовой гибели байкальских губок в последние годы с повышением среднегодовых температур. Известно, что морские губки имеют узкий температурный оптимум, при этом была показана связь нескольких случаев массовой гибели губок с климатическими синдромом обесцвечивания представителей различных видов Lubomirskiidae (Itskovich et al., изменениями (Vicente, 1989; Cerrano et al., 2000;
unpubl.), возможно, также связана с межвидовыми
Cebrian et al ., 2011; Webster et al. , 2013).
различиями в их терморезистентности.
Выявленная избирательная поражаемость
Figure 1. Губки Baikalospongia intermedia и papyracea .
Lubomirskiidae. a- bacillifera , b-B. c- Swartschewskia

Особенности механизмов стресс-регуляции у разных видов, как правило, коррелируют с температурными условиями существования вида. Однако исследованные нами виды обитают в сходном температурном, но различном световом режимах. Виды B. bacillifera, B. intermedia и S. papyracea населяют литоральную и сублиторальную зоны на глубинах от 1,5 до 400 метров (Efremova, 2001). Температура глубинных вод Байкала постоянна и составляет около 4 °С, в то время как в зоне верхней литорали (до 20 м глубины) возможны сезонные и суточные повышения температуры до 14-20 °С (Kozhova, Izmest’eva, 1998). S. papyracea имеет отличие в световом режиме среды обитания от B. bacillifera и B. intermedia, поскольку населяет отрицательные склоны скал и камней. Вследствие недостатка света S. papyracea всегда имеет светлую окраску из-за отсутствия симбиоза с фотосинтезирующими микроорганизмами, в то время как виды Baikalospongia на глубинах, доступных свету, имеют зеленую окраску. Влияние симбиотического состава на стресс-устойчивость губок требует дополнительных исследований.
Figure 2. Изменение уровня белка БТШ70 у байкальских губок после экспозиции при повышенной
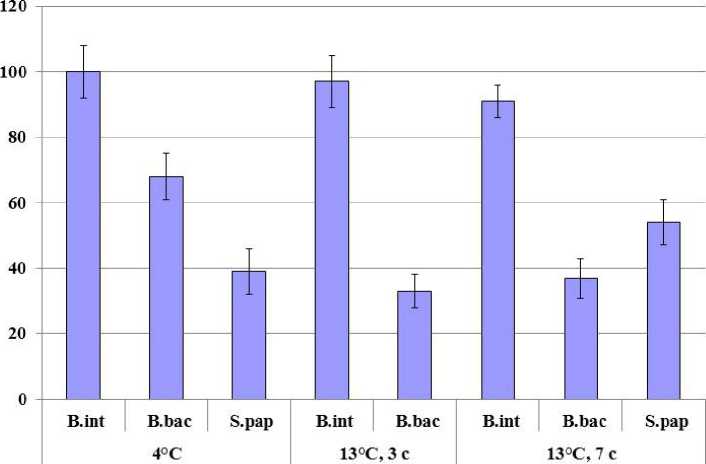
температуре среды (13 °С) в течение 3 и 7 суток. B.bac.- Baikalospongia bacillifera , B.int .-B. intermedia , S.pap.- Swartschewskia papyracea .
Выявленное несоответствие морфологических и молекулярных данных делает актуальной проблему определения границ видов внутри Lubomirskiidae (Itskovich et al., 2008). Наиболее перспективным подходом на сегодня является интегративная таксономия, использующая все имеющиеся наборы морфологических, молекулярных, биохимических и экологических данных. Молекулярный анализ на сегодня не поддерживает монофилетичность B.bacillifera и B. intermedia (Itskovich et al., 2015). Однако выявленные нами различия в механизмах стресс-адаптации, вероятно, свидетельствуют в поддержку их видового статуса.
ACKNOWLEDGMENT
Работа выполнена в рамках госбюджетной темы № VI.50.1.4. «Молекулярная экология и эволюция живых систем Центральной Азии на примере рыб, губок и ассоциированной с ними микрофлоры» при частичной поддержке грантов РФФИ № 14-04-00838А, 14-44-04165р_сибирь_а (совместного с правительством Иркутской области).
Список литературы Изменение содержания HSP70 в байкальских эндемических губках Lubomirskiidae в условиях гипертермии
- Axenov-Gribanov D.V., Lubyaga J.А., Shakhtanova N.S., Gurkov А.N., Bedulina D.S., Shatilina Zh. М., Kondratyeva Е.М., Vereshchagina K.P., Timofeyev М.А. (2012) Determination of Lake Baikal endemic amphipod Eulimnogammarus verrucosus (Gerstf., 1858) thermal optima limits by changes in its metaboliс markers. JSPB, 8(4), 289-301
- Bedulina D.S., Evgen'ev M.B., Timofeyev M.A., Protopopova M.V., Garbuz D.G., Pavlichenko V.V., Luckenbach T., Shatilina Z.M., Axenov-Gribanov D.V., Gurkov A.N., Sokolova I.M., Zatsepina O.G. (2013) Expression patterns and organization of the hsp70 genes correlate with thermotolerance in two congener endemic amphipod species (Eulimnogammarus cyaneus and E. verrucosus) from Lake Baikal. Mol. Ecol., 22(5) DOI: 10.1111/mec.12136
- Cebrian E., Uriz M.J., Garrabou J., Ballesteros E. (2011) Sponge mass mortalities in a warming Mediterranean Sea: are cyanobacteria-harboring species worse off? PLoS One, 6, e20211
- Cerrano C., Bavestrello G., Bianchi C.N., Cattaneovietti R., Bava S., Morganti C., Morri C., Picco P., Sara G., Schiaparelli S., Siccardi A., Sponga F. (2000) A catastrofic mass-mortality episode of gorgonians and other organisms in the Ligurian Sea (North-Western Mediterranean), summer 1999. Ecol. Lett., 3, 284-293
- Efremova S.M. (2001) Sponges (Porifera). In Timoshkin, O.A. (ed.), Index of animal species inhabiting lake Baikal and its catchment area, vol. 1. Lake Baikal, Book 1. Nauka, Novosibirsk, pp. 182-192.
- Efremova S., Margulis B., Guzhova I., Itskovich V., Lauenroth S., Müller W., Schröder H. (2002) Heat shock protein Hsp70 expression and DNA damage in Baikalian sponges exposed to model pollutants and wastewater from Baikalsk Pulp and Paper Plant. Aquat. Toxicol., 57, 267-280
- Efremova S.M. (2004) New genus and new species of sponges from family Lubomirskiidae Rezvoj, 1936. In Timoshkin, O.A. (ed.), Index of animal species inhabiting lake Baikal and its catchment area, vol. 1. Lake Baikal, Book 2. Nauka, Novosibirsk, pp. 1261-1278.
- Feder M.E., Hofmann G.E. (1999) Heat-shock proteins, molecular chaperones and the stress response: evolutionary and ecological physiology. Annu. Rev. Physiol., 61, 243-282
- Garbuz D.G., Yushenova I.A., Zatsepina O.G. Przhiboro A.A, Bettencourt B.R, Evgen’ev M.B. (2011) Organization and evolution of hsp70 clusters strikingly differ in two species of Stratiomyidae (Diptera) inhabiting thermally contrasting environments. BMC Evol. Biol., 11(74) DOI: 10.1186/1471-2148-11-74
- Geret F., Serafim A., Barreira L., Bebianno M.J. (2002) Effect of cadmium on antioxidant enzyme activities and lipid peroxidation in the gills of the clam Ruditapes decussates. Biomarkers, 7(3), 242-256
- Glyzina O.Yu., Glyzin A.V. (2014) Biochemical adaptation of Lubomirskia baicalensis Baikal sponge to changes in temperature conditions of the environment. Water: chemistry and ecology, 1, 71-79
- Henkel S. K., Kawai H. and Hofmann G. E. (2009) Interspecific and interhabitat variation in hsp70 gene expression in native and invasive kelp populations. MEPS, 386, 1-13
- Kaluzhnaya O.V., Itskovich V. B. (2015) Bleaching of Baikalian sponge affects the taxonomic composition of symbiotic microorganisms. Rus. J. Genetics, 51(11), 1153-1157
- Kolesnichenko A.V., Voinikov V.K. (2003) Belki nizkotemperaturnogo stressa rastenij, Art-press, Irkutsk, 196 p.
- Kozhova O.M., Izmest’eva L.R. (1998) Lake Baikal -Evolution and Biodiversity. Backhuys, Leiden
- Kültz D. (2005) Molecular and evolutionary basis of the cellular stress response. Annu. Rev. Physiol., 67, 225-257
- Laemmli U.K. (1970) Cleavage of Structural Proteins During the Assembly of Head Bacteriophage T4. Nature, 227, 680-685
- Lopez-Legentil S., Song B., McMurray S. E., Pawlik J. R. (2008) Bleaching and stress in coral reef ecosystems: hsp70 expression by the giant barrel sponge Xestospongia muta. Mol. Ecol., 155(17), 159-171
- Parsell D.A., Lindquist S. (1993) The function of heat-shock proteins in stress tolerance: degradation and reactivation of damaged proteins. Annu. Rev. Genet. 27, 437-496
- Schill R.O., Pfannkuchen M., Fritz G., Köhler H-R., Brümmer F. (2006) Quiescent gemmules of the freshwater sponge, Spongilla lacustris (Linnaeus, 1759), contain remarkably high levels of Hsp70 stress protein and hsp70 stress gene mRNA. J. Exp. Zool. A Comp. Ex.p Biol., 305(5), 449-57
- Schröder H.C., Hassanein H.M., Lauenroth S., Koziol C., Mohamed T.A., Lacorn M., Steinhart H., Batel R., Müller W.E.G. (1999) Induction of DNA strand breaks and expression of HSP70 and GRP78 homolog by cadmium in the marine sponge Suberites domuncula. Arch. Environ. Contam. Toxicol., 36(1), 47-55
- Schröder H.C., Efremova S., Margulis B., Guzhova I.V., Itskovich V.B., Müller W.E.G. (2006) Stress response in Baikalian sponges exposed to pollutants. Hydrobiologia, 568(1), 277-287
- Sokolova I.M., Pörtner H.O. (2003) Metabolic plasticity and critical temperatures for aerobic scope in a eurythermal marine invertebrate (Littorina saxatilis, Gastropoda: Littorinidae) from different latitudes. J. Exp. Biol., 206(1), 195-207
- Timmons T.M., Dunbar B.S. (1990) Protein Blotting and Immunodetection. Meth. in Enzymol., 182, 679-688
- Timofeyev M.A., Shatilina Z.M., Protopopova M.V., Bedulina D.S., Pavlichenko V.V., Kolesnichenko A.V., Steinberg C.E.W. (2009) Thermal stress defense in freshwater amphipods from contrasting habitats with emphasis on small heat shock proteins (sHSPs). J. Therm. Biol., 3(4), 281-285
- Vicente V.P. (1989) Regional commercial sponge extinction in the West Indies: are recent climatic changes responsible? Mar. Ecol. Prog. Ser., 10, 179-191
- Webster N.S., Taylor M.W. (2012) Marine sponges and their microbial symbionts: love and other relationships. Environ. Microbiol., 14, 335-346
- Voinikov V.K., Ivanova G.G., Korytov M.V. (1986) Sintez belkov v rasteniyah pri dejstvii nizkoj temperatury. Fiziol. i bioh. kul't. Rastenij.,18(3), 211-222


