Изменение содержания оксида азота в корнях проростков пшеницы под влиянием лектинов азоспирилл
Автор: Аленькина С.А., Никитина В.Е.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.6, 2010 года.
Бесплатный доступ
Показано, что лектин Azospirillum brasilense Sp7 в концентрации 40 мкг/мл вызывает два пика индукции синтеза оксида азота в корнях проростков пшеницы, происходящей через 3 и 26 ч совместной инкубации. Лектин мутантного по лектиновой активности штамма Azospirillum brasilense Sp7.2.3 проявлял аналогичный эффект, но в случае 26 - часовой инкубации в меньшей степени активировал продукцию оксида азота в корнях. Было показано, что лектины в одинаковой степени усиливают синтез цитруллина в растительной клетке после 3-х часов воздействия, что свидетельствует о том, что лектины азоспирилл активируют продукцию оксида азота посредством NO-сигнальной системы растений, и тем самым выступают в качестве индукторов адаптационных процессов корней проростков пшеницы.
Лектины, корни проростков пшеницы, оксид азота, цитруллин
Короткий адрес: https://sciup.org/14323497
IDR: 14323497
Текст научной статьи Изменение содержания оксида азота в корнях проростков пшеницы под влиянием лектинов азоспирилл
Известно, что при взаимодействии растений с микроорганизмами происходит изменение уровня активных форм азота в растении (Глянько и др., 2009). Особую роль при этом играет оксид азота (NO). Установлено, что NO вовлечен во многие метаболические процессы в растениях: в формирование корней (Molina-Favero et all, 2007), адаптацию и ответ на стрессовые воздействия (Valderrama et all, 2007), в защитные реакции (Hong et all, 2008) и другие физиологические процессы (Beligni et all, 2000).
Исследователями молекулярных механизмов функционирования микробно-растительных ассоциаций ведется активный поиск рецепторных структур микро- и макропартнеров и изучение ответных реакций, возникающих при установлении ассоциативных взаимодействий. В ассоциации «пшеница- Azospirillum » большой интерес представляют бактериальные лектины в связи с их известными информационными функциями в различных биологических системах (Hebert, 2000). Было показано, что лектины азоспирилл за счет способности связывать углеводы, участвуют не только в адгезии бактерий на корнях растений, но стимулируют прорастание семян, проявляют по отношению к растительной клетке митотическую и ферментмодифицирующую активности (Никитина и др., 1996; Никитина и др., 2004; Alen’kina et all , 2006). Лектины способны участвовать в сигнальных процессах растений, оказывая влияние на синтез цАМФ, перекиси водорода (Аленькина и др., 2010). Данные же о влиянии лектинов азоспирилл на синтез оксида азота полностью отсутствуют.
Исследование биохимических механизмов на начальных этапах взаимодействия пшеницы с почвенными микроорганизмами имеет не только теоретическое, но и практическое значение. Изучение активных форм азота на начальных стадиях формирования ассоциации между азоспириллами и пшеницей позволит углубить знания о физиолого-биохимических механизмах этого взаимодействия и повысить его эффективность в практическом аспекте.
В связи с этим, целью изучения явилась оценка изменения содержания оксида азота в корнях проростков пшеницы под влиянием лектинов двух штаммов азоспирилл - A. brasilense Sp7 и Sp7.2.3.
МАТЕРИАЛЫ И МЕТОДЫ
В работе были использованы лектины двух штаммов Azospirillum brasilense Sp7, полученного из Института микробиологии РАН (г. Москва) и его мутанта, дефектного по лектиновой активности - Azospirillum brasilense Sp7.2.3. (Аленькина и др. , 1998).
Культуры азоспирилл выращивали на жидкой синтетической среде для флоккуляции при 37°С в течение 18 ч (Sadasivan et all, 1985).
Выделение лектинов с поверхности клеток проводили методом Eshdat и Sharon (Echdat et all, 1978).
В экспериментах использовали кристаллические препараты лектинов, полученные после двукратного осаждения сульфатом аммония и спирто-ацетоновой смесью.
Белок определяли по методу Бредфорд (Bradford, 1976).
В работе использовали 3-суточные проростки пшеницы ( Triticum aestivum) сорта Саратовская 29. Семена стерилизовали 1 мин 60%-ным этанолом и проращивали на дистиллированной воде при 22°С. Корни выдерживали в растворах лектинов дикого и мутантного штаммов; в отдельной серии экспериментов – растворах лектинов, содержащих 1мМ СаСl 2 . Корни проростков фиксировали в жидком азоте и гомогенизировали. К гомогенату добавляли по
129 Azospirillum lectin –
100 мкл реактива Гриесса, состоящего из равных объемов 0,3% сульфаниловой кислоты и 0,5% α-нафтиламина (Чибисова, 1999).
После 10 мин контакта определялась оптическая плотность при 540 нм. В качестве контроля использовали образцы корней, не обработанных лектинами.
Количество цитруллина определяли с помощью тонкослойной хроматографии. Экстракт подвергали ТСХ на силикагеле 60А (“Merck”, Germany) в системе растворителей, содержащей н-бутанол, уксусную кислоту и воду (4:1:1 по объему). Хроматограммы окрашивали раствором нингидрина (Дарбре 1989). Пятна вырезали, элюировали и проводили количественное определение цитруллина при 570 нм.
Полученные результаты подвергали статистической обработке (Рокицкий, 1973). Результаты представлены как средние значения трех повторностей ± стандартное отклонение. Доверительные интервалы определяли для 95% уровня значимости.
■лектин A. brasilense Sp7йлектин A. brasilense Sp7.2.3
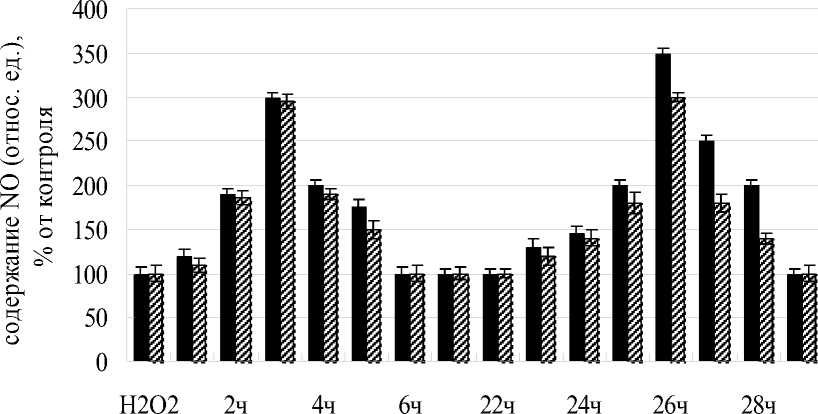
Рисунок 1. Содержание оксида азота (NO) в корнях проростков пшеницы после инкубации с лектинами A. brasilense Sp7 и A. brasilense Sp7.2.3.
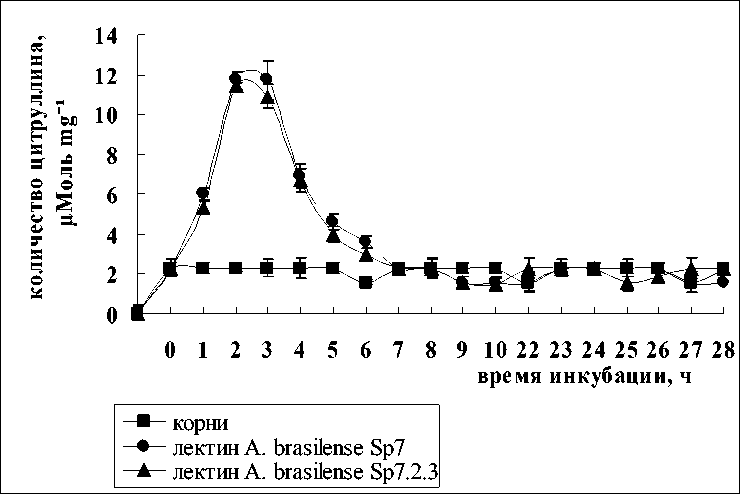
Рисунок 2. Содержание цитруллина в корнях проростков пшеницы после инкубации с лектинами A. brasilense Sp7 и A. brasilense Sp7.2.3.
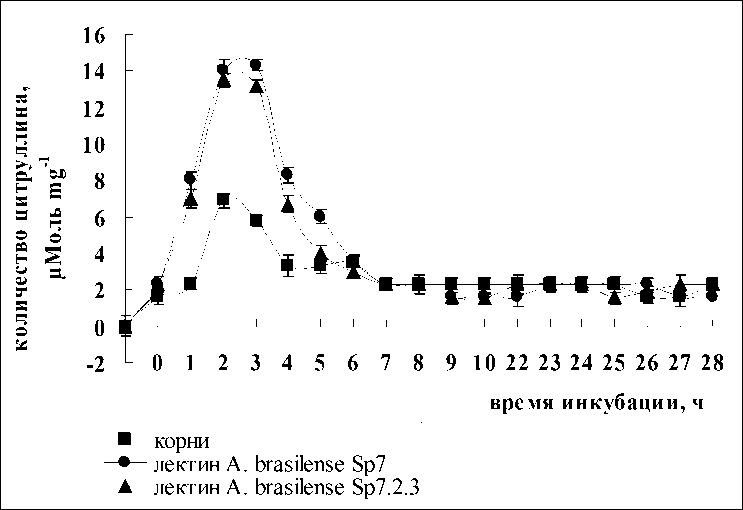
Рисунок 3. Содержание цитруллина в корнях проростков пшеницы после инкубации с лектинами A. brasilense Sp7 и A. brasilense Sp7.2.3 и СаСl 2 .
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характер изменения уровня оксида азота в результате инкубации корней проростков пшеницы с препаратами лектинов родительского и мутантного штаммов в концентрации 40 мкг/мл был неодинаков и зависел от времени воздействия. Для обоих лектинов первое увеличение уровня оксида азота (NO) в корнях происходило уже после 1 ч воздействия лектинов и достигало максимума через 3 ч. Оба лектина проявляли одинаковую активность. Для лектина родительского штамма наблюдалось увеличение в 2 раза по сравнению с контролем, для лектина мутантного штамма - в 1,9 раза. Второе повышение начиналось в результате более длительного воздействия - через 23 ч и достигало максимума через 26 ч. Для лектина родительского штамма уровень оксида азота превосходил контроль в 2,5 раза, для лектина мутантного штамма - в 2 раза. Таким образом, различия между двумя лектинами наблюдались лишь в случае 26-часовой инкубации - лектин родительского штамма в большей степени активировал продукцию оксида азота в корнях (рис. 1).
Различия, проявляемые лектинами в данном случае, вероятно связаны с конформационными различиями молекул лектинов и как следствие, различным взаимодействием с поверхностью растительной клетки, что является определяющим фактором для включения последующих этапов.
По мнению многих авторов, в растениях может быть несколько источников образования NO и некоторые из них могут регулироваться через сигнальные пути (Glyan'ko et all, 2009; Flores et all, 2008) .Одним из таких путей является реакция, катализируемая синтазой оксида азота (NOS) по следующей схеме: α-аргинин + О2 + НАДФН → α-цитруллин + оксид азота. С целью доказательства того, что лектины способны индуцировать образование оксида азота таким способом, нами были предприняты попытки определения количества цитруллина в корнях после экспозиции в растворах лектинов. В результате было показано, что лектины родительского и мутантного штаммов в одинаковой степени вызывали постепенное увеличение количества цитруллина в растительной клетке лишь в первые часы их совместной инкубации с корнями. Максимальное количество цитруллина синтезировалось через 3 ч (рис. 2). Так как известно, что NO-синтаза растений является Са-зависимым ферментом (Corpas et all, 2009), было исследовано влияние кальция на синтез цитруллина. Добавление в среду инкубации корней проростков с лектинами ионов кальция в виде СаСl2 (1 мМ) активировало синтез аминокислоты в корнях, причем разницы между лектинами родительского и мутантного штаммов не наблюдалось (рис. 3), как и в случае без кальция.
Тот факт, что инкубация лектинов с корнями приводила к единовременному увеличению оксида азота и цитруллина в корнях, позволяет сделать вывод о том, что лектины способны активировать NO-сигнальную систему растений. Идентичность эффектов, вызываемых лектинами двух штаммов свидетельствует о том, что в данном случае эффект определялся специфическими взаимодействиями лектинов, учитывая, что они имеют одинаковую углеводную специфичность. Увеличение синтеза монооксида азота и отсутствие эффекта в отношении цитруллина при более длительном воздействии лектинов свидетельствует о том, что лектины способны регулировать уровень NO и через другие физиологические механизмы отличные от NO-синтазной сигнальной системы. По мнению Дьякова с соавт. (Дьяков и др., 2001) повышение концентрации NO приводит к активации гуанилатциклазы, катализирующей превращение ГТФ в цГМФ. цГМФ активирует протеинкиназу, которая открывает Са-каналы внутриклеточных Са-депо, в результате чего повышается концентрация кальция в цитозоле, активируются Са-зависимые протеинкиназы, фосфорилируется белковый фактор регуляции транскрипции и начинается синтез специфических белков.
Таким образом, полученные данные свидетельствуют о том, что лектины азоспирилл способны увеличивать синтез оксида азота в корнях пшеницы. и тем самым, регулировать взаимодействие микро- и макросимбионта при формировании ассоциации на начальных ее этапах.
Список литературы Изменение содержания оксида азота в корнях проростков пшеницы под влиянием лектинов азоспирилл
- Аленькина С.А., Никитина В.Е. (2010) Роль лектинов азоспирилл в регуляции активности пероксидазы и оксалатоксидазы корней пшеницы. Известия РАН. Серия биологическая. 1, 1-4.
- Аленькина С.А., Матора Л.Ю., Никитина В.Е. (2010) Оценка влияния лектинов азоспирилл на уровень ц-АМФ в растительной клетке. Микробиология. 79, 1-3.
- Глянько А.К., Васильева Г.Г., Митанова Н.Б., Ищенко А.А. (2009) Влияние минерального азота на бобово-ризобиальный симбиоз. Известия РАН. Серия биол. 36, 302-312.
- Аленькина С.А., Петрова Л.П., Никитина В.Е. (1998) Получение и характеристика мутанта Azospirillum brasilense Sp7 по лектиновой активности. Микробиология. 67, 782-787.
- Дарбре А. (1989). Практическая химия белка. Москва. Мир.
- Дьяков Ю.Т., Озерецковская О.Л., Джавахия В.Г., Багирова С.Ф. (2001) Общая и молекулярная фитопатология. Учеб. пособие.М. Изд-во Общество фитопатологов.
- Никитина В.Е., Аленькина С.А. Пономарева Е.Г., Савенкова Н.Н. (1996) Изучение роли клеточной поверхности азоспирилл во взаимодействии с корнями пшеницы. Микробиология. 65, 165-170.
- Никитина В.Е., Богомолова Н.В., Пономарева Е.Г., Соколов О.И. (2004) Влияние лектинов азоспирилл на способность семян к прорастанию. Известия АН. Серия биологическая. 4, 431-435.
- Рокицкий П.Ф. (1973) Биологическая статистика. Минск.
- Чибисова Н.В. (1999) Практикум по экологической химии. Учебное пособие. Калининград. Калининградский ун-т.
- Alenkina S.A., Payusova O.A., Nikitina V.E. (2006) Effect of Azospirillum lectins on the activities of wheat-root hydrolytic enzymes. Plant and Soil. 283, 147-151.
- Beligni M.W., Lamattina L. (2000) Nitric oxide stimulates seed germination and de-etiolation, and inhibits hypocotyls elongation, there light-inducible responses in plants. Planta. 210, 215-221.
- Bradford M. M. (1976) A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem.. 72, 248-254.
- Corpas F.J., Palma J.M., del Rio L.A., Barroso J.B. (2009) Evidence supporting the existence of larginine-dependent nitric oxide syntase activity in plants. New Physiol. 184, 9-14.
- Echdat Y., Ofek I., Yachow-Yan Y., Sharon N., Mirelman D. (1978) Isolation of mannose-specific lectin from E.coli and its role in the adherence of the bacterial to epithelial cells. Biochem. Biophis. Res. Commun. 85, 1551-1559.
- Flores T., Todd C.D.,Tovar-Mendez A., Dhanoa P.K., Corra-Aragunde N., Hoyos M.E., Brownfield D.M., Mullen R.T., Lamattina L., Polacco J.C. (2008) Arginase-negative mutant of Arabidopsis exhibit increased nitric oxide signalling in root development. Plant Physiol. 147, 1936-1946.
- Glyan'ko A.K., Mitanova N.B., Stepanov A.V. (2009) Physiological role of nitric oxide (NO) at vegetative organisms. J of Stress Physiol.and Biochem. 5, 33-52.
- Hong J.K., Yun B-W., Kang J-G., Raja M.U., Know E., Sorhagen K.,Chu C., Wang Y., Loake G.J.(2008) Nitric oxide function and signaling in plant disease resistanse. J. Exp. Bot. 59, 147-154.
- Hebert E. (2000) Endogenous lectins as cell surface transducer. Bioscience Reports. 20, 213-237.
- Molina-Favero С., Creus C. M., Lanteri M. L., Correa-Aragunde N., Lombardo M. C., Barassi C. A., Lamattina L. (2007) Nitric oxide and plant growth promoting rhizobacteria: common features influencing root growth and development. Advances in Botanical Research. 46, 1-33.
- Sadasivan L., Neyra C.A. (1985) Flocculation in Azospirillum brasilense and Azospirillum lipoferum. J. Bacteriol. 163, 716-723.
- Valderrama R., Corpas F.J., Carreras A., Fernandez-Ocana A., Chaki M., Luque L., Gomes-Rodriguez M.V., Colmenero-Varea P., del Rio L.A., Barroso J.B. (2007) Nitrosative stress in plants. FEBS Lett. 581, 453-461.


