Изменение соотношения адениловых нуклеотидов в клетках Escherichia coli как интегральный показатель стресса
Автор: Ахова А.В., Ткаченко А.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2025 года.
Бесплатный доступ
Исследовано изменение концентрации АТФ и АДФ в клетках Escherichia coli, подвергнутых сублетальному стрессу. Сублетальный стресс – воздействие стрессоров, не приводящее к снижению количества колониеобразующих единиц относительно момента их внесения в культуру, но ингибирующее рост. Бактерии культивировали в минимальной среде М9 с добавкой 0.4% глюкозы при 37ºС и перемешивании со скоростью 120 об/мин. Стрессоры (50 г/л хлорида натрия, 1 г/л уксусной кислоты, 7% этанол) вносили в экспоненциальной фазе роста (ОП600=0.3). Нуклеотиды экстрагировали 0.4 N HClO4 на ледяной бане из предварительно отмытых от среды бактериальных клеток с последующей нейтрализацией 2М К2СО3. Количественный анализ нуклеотидов проводили методом обращеннофазной высокоэффективной жидкостной хроматографии с тетрабутиламмония гидрогенсульфатом в качестве ионпарного реагента. Воздействие хлорида натрия вызывало повышение [АТФ] и [АДФ], воздействие этанола – повышение [АТФ] и повышение с последующим снижением [АДФ], уксусной кислоты – снижение с последующим повышением [АТФ] и снижение [АДФ] относительно уровня нестрессированной культуры. Несмотря на разнонаправленное изменение концентрации АТФ и АДФ в клетках, подвергнутых разным типам стресса, все они характеризовались повышенным уровнем показателя [АТФ]/[АДФ] по сравнению с контрольной культурой.
АТФ/АДФ, адениловые нуклеотиды, энергетический заряд, осмотический стресс, этанол, кислотный стресс
Короткий адрес: https://sciup.org/147250952
IDR: 147250952 | УДК: 579.22 | DOI: 10.17072/1994-9952-2025-2-178-184
Текст научной статьи Изменение соотношения адениловых нуклеотидов в клетках Escherichia coli как интегральный показатель стресса
Направленная регуляция внутриклеточной концентрации важных кофакторов, например адениловых нуклеотидов, рассматривается как один из способов повышения эффективности синтеза целевых соединений в биотехнологических процессах [Sun et al., 2023]. Однако для успешного воплощения такого подхода должны быть подробно изучены регуляторные механизмы и физиологическая роль данных соединений.
Более 50 лет назад Аткинсон с коллегами предложили концепцию аденилатного энергетического заряда (ЕС) как меры энергии, доступной для метаболических процессов, которая может быть использована в метаболических реакциях [Chapman, Fall, Atkinson, 1971]. Энергетический заряд клетки определяется концентрацией в ней АТФ, АДФ и АМФ и рассчитывается по следующей формуле:
ЕС=([АТФ]+1/2[АДФ])/([АТФ]+[АДФ]+[АМФ]).
У бактерий концентрация АМФ – величина относительно постоянная и находится на низком уровне, поэтому их энергетический заряд в значительной мере определяется соотношением [АТФ]/[АДФ]. Энергетический заряд растущих клеток находится в интервале 0.8-0.95, у бактерий, рост которых замедляется, например, вследствие голодания по источнику углерода, ЕС снижается до 0.1-0.6 [Jiang, Ninfa, 2007].
Многие ферменты и регуляторные белки имеют сайты связывания АТФ/АДФ, и если активность такого белка зависит от характера лиганда, то возможность протекания процесса, осуществляемого таким белком, будет зависеть от уровня энергетического заряда (или [АТФ]/[АДФ]). Изменение соотношения адениловых нуклеотидов является также сигналом, регулирующим топологическое состояние ДНК и посредством этого экспрессию генов [Maldonado, Lemasters, 2014; Dorman, 2023]. Поэтому набор метаболических процессов, протекающих в клетке в определенный момент времени, во многом определяется ее энергетическим статусом.
Отклонение ЕС и [АТФ]/[АДФ] от нормального значения наблюдается в бактериальных клетках, подвергнутых воздействию различных стрессовых условий, в частности гиперосмотического стресса, повышения температуры, голодания, исчерпания кислорода, воздействия антибиотиков [Ткаченко, 1990; Hsieh, Burger, Drlica, 1991; Hsieh, Rouviore-Yaniv, Drlica, 1991; Camacho-Carranza et al., 1995; Ткаченко и др., 1998, 1999; Akhova, Tkachenko, 2014]. Таким образом, изменения энергетических показателей клетки могут рассматриваться в качестве признаков развития стресса и сигнала к запуску адаптивных механизмов. Кроме того, они могут быть использованы для тестирования оптимальности условий культивирования на разных этапах биотехнологических процессов [Demling et al., 2021].
Состав свободных нуклеотидов клетки (как вторичных мессенджеров, так и энергетических резервов – [АТФ]/[АДФ]/[АМФ]) играет решающую роль в выборе пути развития отдельной клетки с целью максимального приспособления к конкретным условиям. От энергетического статуса клетки зависит будет ли продолжено размножение с последующим ростом численности популяции, или ресурсы будут перенаправлены на защиту и сохранение жизнеспособности, или найден оптимальный баланс между этими процессами [Abram et al., 2021].
Цель настоящей работы – исследовать изменение внутриклеточной концентрации АТФ и АДФ в клетках Escherichia coli , подвергнутых одинаковому по интенсивности стрессу, вызванному воздействием факторов разной физико-химической природы (этанола, хлорида натрия и уксусной кислоты). Это позволит оценить универсальность изменения энергетических параметров бактериальных клеток в ответ на стресс.
Материалы и методы исследования
Объекты и условия культивирования
Объектом исследования является штамм Escherichia coli RO91, любезно предоставленный профессором R. Hengge [Lange, Hengge-Aronis, 1994]. Бактериальные клетки со скошенного агара LB переносили в 5 мл бульона LB с добавкой 25 мкг/мл стрептомицина и культивировали в течение 5-6 ч. при температуре 37ºС без перемешивания. Полученную культуру в соотношении 1:500 переносили в 50 мл среды М9 с добавкой 0.4% глюкозы и 25 мкг/мл стрептомицина и выращивали при температуре 37˚С и перемешивании со скоростью 120 об/мин в течение 16-18 ч. Ночную культуру разводили в 50 мл среды М9 с добавкой 0.4% глюкозы до оптической плотности ОП600=0.1 и выращивали при температуре 37ºС и перемешивании со скоростью 120 об/мин. По достижении ОП600=0.3 вносили стрессирующие факторы.
Определение оптической плотности культуры и концентрации абсолютно сухой биомассы
Оптическую плотность измеряли на длине волны λ=600 нм (ОП 600 ) в кювете с длиной оптического пути, равной 1 см, с использованием спектрофотометра UV1280 (Shimadzu, Япония). Абсолютно сухую биомассу рассчитывали на основе измерений оптической плотности культуры по предварительно построенной калибровочной кривой.
Определение количества колониеобразующих единиц (КОЕ)
Готовили последовательные десятикратные разведения культуры в физиологическом растворе и 10 мкл каждой суспензии наносили на поверхность агара LB в чашках Петри. Чашки инкубировали при температуре 37ºС и через 18-20 ч. производили подсчет сформировавшихся колоний.
Измерение внутриклеточной концентрации адениловых нуклеотидов
2 мл бактериальной культуры центрифугировали (16 000 g, 0ºС, 1 мин.) с применением центрифуги 5415R (Eppendorf, Германия), надосадочную жидкость удаляли, а осадок ресуспендировали в 200 мкл охлажденной 0.4 N HClO 4 . Микропробирки с суспензией клеток помещали на ледяную баню на 25 мин. для экстракции. Затем пробы центрифугировали (16 000 g, 0ºС, 2 мин.), и надосадок переносили в микропробирки, содержащие 2М К 2 СО 3 . Соотношение надосадка и карбоната калия подбиралось таким образом, чтобы рН смеси был нейтральным. На этом этапе пробы могли быть заморожены. Количественный анализ адениловых нуклеотидов проводили методом обращенно-фазной высокоэффективной жидкостной хроматографии с тетрабутиламмония гидрогенсульфатом в качестве ион-парного реагента [Akhova, Tkachenko, 2014].
Результаты и их обсуждение
Гиперосмотический стресс моделировали добавкой в среду культивирования 50 г/л хлорида натрия, кислотный шок – внесением 1 г/л уксусной кислоты. Также бактериальные клетки подвергали воздействию 7% этанола, что моделировало условия теплового шока и стресса повреждения клеточной оболочки (envelope stress) [Mitchell, Silhavy, 2019]. Изменение внутриклеточной концентрации адениловых нуклеотидов изучали в клетках периодической культуры, а стрессирующие факторы вносили на стадии экспоненциального роста бактерий. Концентрации стрессоров подобраны таким образом, что их воздействие в течение четырех часов не приводило к снижению количества КОЕ по сравнению с моментом их внесения в культуру (таблица), но ингибировало рост (рис., d).
Количество колониеобразующих единиц в культуре E. coli через четыре часа после начала стрессового воздействия
[The number of colony-forming units in E. coli culture four hours after the onset of stress exposure]
|
Условия |
КОЕ/мл |
|
Контроль, без воздействия |
14.2±0.3 |
|
7% этанол |
9.0±0.3 |
|
1 г/л уксусная кислота |
8.8±0.2 |
|
50 г/л NaCl |
9.1±0.2 |
Примечание: в момент начала стрессового воздействия КОЕ/мл равнялось 8.7±0.3. Данные представлены как среднее±стандартное отклонение, рассчитанные на основе результатов не менее трех отдельных экспериментов.
Изменение количества КОЕ и скорости роста культуры были выбраны в качестве меры интенсивности стресса. Стресс, формирующийся в бактериальных клетках в выбранных условиях, был обозначен как сублетальный. Подбор условий, вызывающих одинаковый по силе стресс, позволил сравнить стрессирующие факторы разной природы между собой.
В условиях кислотного стресса, вызванного добавкой уксусной кислоты, на начальном этапе происходило снижение внутриклеточной концентрации АТФ, которое сменялось небольшим повышением уровня трифосфата в сравнении с контрольной культурой. Концентрация АДФ в стрессированных клетках была ниже по сравнению с клетками, не подвергнутыми воздействию кислоты (рис., b, c).
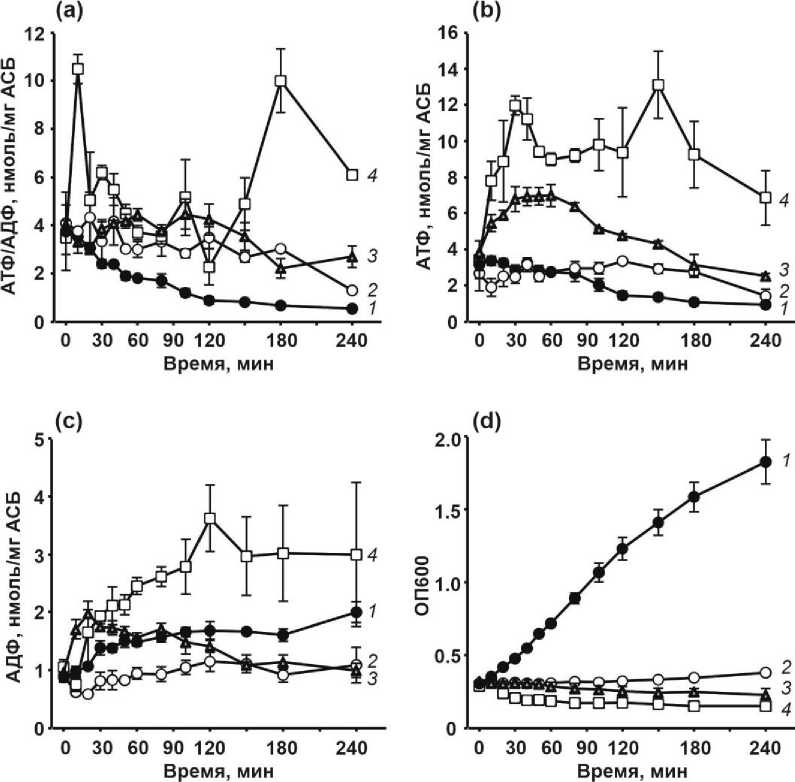
Влияние стрессовых условий на соотношение АТФ/АДФ (a), концентрацию АТФ (b), концентрацию АДФ (c) в клетках E. coli , а также оптическую плотность бактериальной культуры (d):
1 – культура, не подвергнутая воздействию (темные круги); 2 – воздействие 1 г/л уксусной кислоты (светлые круги); 3 – воздействие 7% этанола (серые треугольники); 4 – воздействие 50 г/л хлорида натрия (светлые квадраты). АСБ – абсолютно сухая биомасса. Символы отображают средние значения, отрезки (вискерсы) – стандартную ошибку среднего, рассчитанные на основе результатов не менее трех отдельных экспериментов
[The effect of stress conditions on the ATP/ADP (a), ATP (b), and ADP (c) in E. coli cells (in nmol/mg dry weight), and the optical density of bacterial culture (OD 600 ) (d):
1 – control, untreated culture (dark circules); 2 – 1 g/L acetic acid (light circules); 3 – 7% ethanol (grey triangles); 4 – 50 g/L sodium chloride (light squares). ACБ – absolutely dry biomass in mg. Symbols represent mean values and whiskers represent standard errors of the mean (SE), calculated based on the results of at least three independent experiments]
Добавка в среду этанола вызывала повышение концентрации АТФ на протяжении первого часа наблюдения, после чего следовало снижение концентрации трифосфата, уровень которого при этом оставался выше контрольного. Параллельно сразу после начала стрессового воздействия резко повышалась концентрация АДФ, после чего она снижалась ниже уровня контрольной культуры (рис., b, c).
В клетках, подвергнутых гиперосмотическому стрессу, уровень АТФ был повышен по сравнению с контрольной культурой практически в течение всего периода наблюдения. На кривой изменения концентрации АТФ в стрессированных клетках можно выделить два пика, первый из которых наблюдался через 30 мин после начала стрессового воздействия, а второй – спустя два часа. Концентрация АДФ в этих условиях плавно возрастала на протяжении первых двух часов наблюдения и далее стабилизировалась на уровне более высоком, чем в контрольной культуре (рис., b, c).
Одним из важных показателей, характеризующих энергетический статус клетки, является соотношение [АТФ]/[АДФ]. В контрольных условиях наблюдалось плавное снижение значения данного показате- ля по мере развития периодической культуры. С приближением к стационарной фазе роста показатель [АТФ]/[АДФ] стабилизировался на минимальном уровне (рис., a). В стрессированных клетках значения [АТФ]/[АДФ] было выше по сравнению с клетками, не подвергнутыми воздействию. Профиль изменения показателя [АТФ]/[АДФ] зависел от природы стрессора. Например, изменение [АТФ]/[АДФ] в условиях осмотического стресса, как и концентрация АТФ, характеризовалось наличием двух пиков. В клетках, подвергнутых действию этанола, повышение показателя [АТФ]/[АДФ] происходило позже, чем в условиях кислотного и осмотического стрессов. Тем не менее, микроорганизмы в состоянии сублетального стресса, вне зависимости от его природы, характеризовались повышенным уровнем показателя [АТФ]/[АДФ] по сравнению с микроорганизмами в контрольных условиях.
Полученные нами данные совпадают с описанными ранее результатами, демонстрирующими резкое повышение соотношения [АТФ]/[АДФ] сразу после внесения в культуру хлорида натрия (29 г/л) и быстрое падение этого показателя через 10 мин после начала стресса [Hsieh, Rouviore-Yaniv, Drlica, 1991]. Сходная картина наблюдалась в условиях голодания по источнику азота (аммонию): снижение содержания в клетках АДФ и АМФ на фоне стабильной концентрации АТФ, что в итоге приводило к повышению соотношения [АТФ]/[АДФ] [Ткаченко, 1990]. Голодание по источнику углерода и энергии (глюкоза) приводило к резкому снижению АТФ и повышению АДФ и АМФ в первые минуты, после чего следовало плавное снижение концентрации дифосфата и монофосфата и увеличение концентрации АТФ, а вместе с этим и возрастание [АТФ]/[АДФ] [Ткаченко, 1990]. Повышение температуры с 37˚С до 47-52˚С (тепловой шок) вызывало возрастание ЕС и [АТФ]/[АДФ], главным образом за счет возрастания пула АТФ [Camacho-Carranza et al., 1995; Ткаченко и др., 1998]. Подъем уровня [АТФ]/[АДФ] наблюдался при переносе бактериальной культуры из аэробных в анаэробные условия [Hsieh, Burger, Drlica, 1991]. Непродолжительное резкое повышение [АТФ]/[АДФ] наблюдалось в клетках, подвергнутых действию фторхинолоновых, бета-лактамных и аминогликозидных антибиотиков [Akhova, Tkachenko, 2014]. Однако подобные закономерности не обнаружены в условиях окислительного стресса, вызванного воздействием пероксида водорода, приводящего к снижению энергетических показателей [Ткаченко и др., 1999].
Однонаправленное изменение интегрального показателя [АТФ]/[АДФ] в условиях разнообразных стрессов тем более интересно, что разные стрессоры вызывали различные, иногда прямо противоположные по характеру изменения внутриклеточной концентрации АТФ и АДФ.
Заключение
Таким образом, профиль изменения внутриклеточной концентрации отдельных адениловых нуклеотидов зависит от типа физико-химического стресса, в то время как повышение интегрального показателя [АТФ]/[АДФ] характерно для бактериальных клеток, подвергнутых всем исследованным в данной работе типам стрессирующих воздействий (гиперосмотический стресс, кислотный стресс, воздействие этанола).


