Изменение уровня экспрессии гена MGMT у пациентов с первичной глиобластомой после рецидива. Влияние клинических характеристик и экспрессии гена MGMT на продолжительность жизни больных
Автор: Мацко Марина Витальевна, Скляр Софья Сергеевна, Улитин Алексей Юрьевич, Мацко Дмитрий Евгеньевич, Имянитов Евгений Наумович, Иевлева Аглая Геннадиевна, Ни Валерия Игоревна, Волков Никита Михайлович, Зрелов Андрей Андреевич, Бакшеева Анастасия Олеговна, Галкина Дарья Владимировна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 3 т.20, 2021 года.
Бесплатный доступ
Актуальность. За последние 10-15 лет сложилось представление о биологических процессах, происходящих в клетках первичной глиобластомы. В настоящее время остаются неизученными изменение экспрессии гена MGMT и его роль после рецидива заболевания. Цель исследования - изучить изменение экспрессии гена MGMT при рецидивировании первичной глиобластомы после стандартной терапии и определить влияние клинических факторов и экспрессии гена MGMT на безрецидивную выживаемость больных. Материал и методы. Проведен проспективный анализ клинических и молекулярно-генетических характеристик 21 пациента в возрасте от 28 до 63 лет с глиобластомой до и после рецидива. Экспрессия мРНК гена MGMT и мутации в генах IDH1 и IDH2 определялись при помощи ПЦР-методик в материалах от первой и второй операций. Все пациенты после первой операции получали лучевую терапию (60 Гр) и химиотерапию темозоломидом (2-18 циклов). Вторая линия химиотерапии проведена 17 (80,9 %) пациентам и в 8 (47 %, 8/17) случаях - темозоломидом. Результаты. Установлена зависимость первого безрецидивного периода от экспрессии мРНК гена MGMT (73,5 нед vs 33 нед, р=0,013) и от наличия объективного ответа на терапию (88 нед vs 36 нед, р=0,046). Число циклов химиотерапии темозоломидом в 1-й линии повлияло на длительность первого безрецидивного периода с тенденцией к достоверности (65 нед vs 21,5 нед, р=0,07). Не отмечено влияния возраста (р=0,64), пола (р=0,17), функционального статуса по шкале Карновского (р=0,43), объема поражения (р=0,41) и степени циторедукции (р=0,27). При рецидивах экспрессия мРНК гена MGMT осталась прежней в 66,7 % (14/21), повышение экспрессии наблюдалось в 23,8 % (5/21), снижение - в 9,5 % (2/21). На второй безрецидивный период оказала влияние степень циторедукции, хотя статистически значимых различий получено не было (р=0,52). Влияния экспрессии мРНК гена MGMT на медиану второго безрецидивного периода не выявлено (p=0,39). Ни у одного больного с низкой экспрессией гена MGMT не был зарегистрирован объективный ответ на терапию. Заключение. Глиобластома при рецидивировании становится все более устойчивой к дальнейшей терапии. С развитием рецидива опухоли ген MGMT теряет свое предиктивное значение, и на фоне этого возрастает роль степени циторедукции.
Первичная глиобластома, рецидив глиобластомы, мутации в генах IDH1 и IDH2, ген MGMT, темозоломид, первый безрецидивный период, степень циторедукции
Короткий адрес: https://sciup.org/140254508
IDR: 140254508 | УДК: 616-006.484.04-036.65:575.113 | DOI: 10.21294/1814-4861-2021-20-3-5-17
Текст научной статьи Изменение уровня экспрессии гена MGMT у пациентов с первичной глиобластомой после рецидива. Влияние клинических характеристик и экспрессии гена MGMT на продолжительность жизни больных
Background. Over the past 10–15 years, there has been a clearer understanding of the processes occurring in cells of the primary glioblastoma. However, the change in MGMT gene expression and its role after disease relapse remain understudied. Purpose: to study changes in MGMT gene expression in case of recurrent primary glioblastoma after the standard therapy; to determine influence of clinical factors and MGMT gene expression on relapse-free survival of patients. Materials and Methods. We carried out a prospective analysis of clinical and molecular genetic characteristics of 21 patients aged from 28 to 63 with primary glioblastoma before and after recurrence. Relative mRNA expression of MGMT gene and mutations in IDH1/IDH2 genes were determined in surgical biopsies using PCR techniques. After the first surgery, all patients received radiation therapy (60 Gy) and chemotherapy with adjuvant temozolomide (2–18 cycles). The second-line chemotherapy was performed in 17 (80.9 %) patients, and 8 patients received (47 %, 8/17) temozolomide. Results. The relationship between the progression-free survival (PFS) and mRNA expression of MGMT gene (73.5 vs 33 weeks, p=0.013) and objective response to therapy (88 vs 36 weeks, p=0.046) was found. The number of cycles of first-line chemotherapy with temozolomide influenced the duration of the first PFS (65 weeks vs 21.5 weeks, p=0,07). The first PFS was not affected by patients’ age (p=0.64), sex (p=0.17), Karnofsky performance scale index (p=0.43), extent of brain damage (p=0.41) and extent of the resection (p=0.27). After onset of relapse, mRNA expression of MGMT gene remained the same, being 66.7 % (14/21). The increased expression was observed in 23.8 % (5/21) of cases, and decreased gene expression was observed in 9.5 % (2/21) of cases. The second PFS was affected by the extent of tumor resection, although there were no statistically significant differences (p=0.52). The effect of mRNA expression of MGMT gene on the median second PFS was not revealed (p=0.39). No objective response to therapy was found in patients with a low mRNA expression of MGMT gene. Conclusion. Recurrent glioblastoma becomes more resistant to further therapy. With the development of tumor recurrence, the predictive value of MGMT gene is lost and the role of the extent of cytoreductive surgery increases.
Согласно данным Регистра Опухолей Мозга США (Central Brain Tumor Registry of the United States CBTRUS), среди всех опухолей ЦНС первичная глиобластома (ГБ) составляет 14,9 %, среди злокачественных новообразований нервной системы – 47,1 %, в структуре глиальных опухолях – 56,1 % [1]. Пациенты с ГБ даже при комплексном лечении живут от 9,5 до 16 мес [2, 3], и лишь у небольшого числа заболевших удается достичь 3-летней выживаемости [4, 5]. Обязательными в лечении пациентов с глиобластомой являются максимальная циторедукция, лучевая и лекарственная терапия [6]. Учитывая инфильтративный рост ГБ, удалить ее радикально не представляется возможным, поэтому наиболее перспективными остаются лучевая терапия и лекарственные методы лечения [7]. Появление препарата темозоломид в нейро-онкологической практике позволило существенно увеличить медиану безрецидивной и общей выживаемости больных [8, 9].
Выявленные за последние два десятилетия предиктивные и прогностические биомаркеры в лечении пациентов с глиобластомой [8, 10] повлияли на формирование новой классификации ВОЗ 2016 [11]. Впервые в основу диагноза положено не только гистологическое строение новообразования, но и наиболее значимая молекулярногенетическая характеристика, или хромосомная аберрация (наличие или отсутствие мутации в генах IDH1 и IDH2, коделеция 1p19q и др.). Особую нишу в лечении больных с ГБ занимает ген репарации ДНК MGMT (О6-метилгуанин-ДНК- метилтрансфераза), изучение роли которого началось в 1970-х гг. [12]. Однако только с 2005 г. стало понятно, что назначение темозоломида при высокой экспрессии гена MGMT малооправдано [8, 10, 13]. Данное обстоятельство способствовало формированию индивидуализированного подхода в лечении больных. К сожалению, пока не во всех клиниках учитывают статус гена MGMT при назначении темозоломида в первой линии. Более того, многим больным «вслепую» рекомендуется этот препарат и после рецидивирования опухоли. Видимо, в данном случае ориентируются на логичную гипотезу «суицид энзима» [14]. Согласно этой гипотезе, под воздействием темозоломида в опухоли запасы белка MGMT истощаются, и чувствительность к данному препарату теоретически должна увеличиваться. Однако данное предположение не учитывает приспособительные механизмы ГБ к различным воздействиям, в том числе и к химиотерапии [15–17].
Следует признать, что лечение пациентов с рецидивирующей ГБ является существенным пробелом в современной нейроонкологии. Четких стандартов нет, а рекомендуемая комбинация бевацизумаб + иринотекан из-за стоимости препаратов доступна не всем пациентам. Выбор вновь остается за цитостатиками. Принимая решение о повторном назначении темозоломида во 2-й линии, необходимо ответить на следующие вопросы: как изменяется активность гена MGMT с рецидивом и сохраняется ли его предиктивная значимость при низкой экспрессии гена?
Цель исследования – изучить изменение экспрессии гена MGMT при рецидивировании первичной глиобластомы после стандартной терапии и определить влияние клинических факторов и экспрессии гена MGMT на безрецидивную выживаемость больных.
Материал и методы
В проспективное исследование был включен 21 пациент старше 18 лет с первичной глиобластомой с супратенториальной локализацией (табл. 1). В каждом случае изучены особенности клинической картины и молекулярных характеристик опухоли до и после ее рецидива. Все пациенты подписывали информированное согласие на участие в данном исследовании.
При анализе первичной МРТ головного мозга с контрастным усилением было установлено, что почти в половине случаев поражалась только одна доля (52,3 %) и преимущественно левое полушарие
Таблица 1/table 1
Характеристика пациентов с первичной ГБ GiV перед первой и второй операцией Characteristics of patients with primary GB (grade iV) before the first and second surgeries
|
Клинические характеристики/ Clinical characteristics |
1-я операция/ 1-я линия терапи First surgery/First-line 1 |
иh/erapy S |
2-я операция/ -я линия терапии/ Second surgery/ econd-line therapy |
|
Пол/Gender |
|||
|
Мужчины/Males |
7 (33,4 %) |
||
|
Женщины/Females |
14 (66,6 %) |
||
|
Mедиана возраста (лет)/Median age (years) |
47 (45,8–49,5) |
||
|
Объем поражения/Extent of injury |
|||
|
1 доля/One lobe |
11 (52,3 %) |
9 (42,8 %) |
|
|
2 доли/2 lobes |
6 (28,6 %) |
7 (33,4 %) |
|
|
3 доли/3 lobes |
1 (4,8 %) |
0 (0 %) |
|
|
1 доля и базальные отделы/ One lobe and basal structures |
1 (4,8 %) |
3 (14,3 %) |
|
|
2 доли и базальные отделы/ 2 lobes and basal structures |
2 (9,5 %) |
2 (9,5 %) |
|
|
Локализация/Location |
|||
|
Правое полушарие/Right hemisphere |
7 (33,4 %) |
6 (28,6 %) |
|
|
Левое полушарие/Left hemisphere |
10 (47,5 %) |
10 (47,5 %) |
|
|
Оба полушария/ Both hemispheres |
1 (4,8 %) |
0 (0 %) |
|
|
Полушария + базальные структуры/ Hemispheres + basal structures |
3 (14,3 %) |
5 (23,7 %) |
|
|
Функциональный статус по шкале Карновского (баллы)/Functional status on the Karnofsky scale (points) |
|||
|
90–100 |
3 (14,3 %) |
0 (0 %) |
|
|
60–80 |
17 (80,9 %) |
20 (95,2 %) |
|
|
Меньше 60/less than 60 |
1 (4,8 %) |
1 (4,8 %) |
|
|
Объем циторедукции/Extent of cytoreductive surgery |
|||
|
Близко к тотальному/Close to total |
6 (28,6 %) |
4 (19,1 %) |
|
|
Субтотально/Subtotally |
8 (38,0 %) |
10 (47,5 %) |
|
|
Частично/Partially |
7 (33,4 %) |
7 (33,4 %) |
|
|
Лучевая терапия/радиохирургия/Radiation therapy/radiosurgery |
|||
|
Без темозоломида/ Лучевая терапия/ Without temozolomide |
6 (28,6 %) |
4 (19,1 %) |
|
|
Radiation therapy С темозоломидом/ With temozolomide |
15 (71,4 %) |
0 (0 %) |
|
|
Гамма нож/Кибер нож/ Gamma Knife/Cyber Knife |
- |
3 (14,3 %) |
|
|
Не получали ЛТ/Received no radiation therapy |
- |
14 (66,6 %) |
|
|
Лекарственная терапия/Сhemotherapy |
|||
|
Темозоломид/Temozolomide |
|||
|
2–5 циклов/2–5cycles |
2 (9,5 %) |
8 (38 %) |
|
|
6–15 циклов/cycles |
18 (85,7 %) |
– |
|
|
Более 15 циклов/More than 15 cycles |
1 (4,8 %) |
– |
|
|
Другая терапия/Other therapy |
– |
9 (42,9 %) |
|
|
Не получали терапию/Received no therapy |
– |
4 (19,1 %) |
|
(47,5 %). Всем больным выполнялось оперативное вмешательство с разным объемом циторедукции: макроскопически тотальное удаление, субтотальное и частичное. Под макроскопически тотальным удалением понималась резекция 95 % опухоли и более, под субтотальным – 80–94 % и частичным – 79–50 % и открытой биопсией – <50 % [18]. У всех больных объем циторедукции во время первой и второй операции был более 50 %. Оценка степени резекции опухоли проводилась по данным послеоперационных МРТ с контрастным усилением на 2–3-е сут после операции.
После первой операции лучевая терапия (ЛТ) проводилась в 100 %, из них в 71,4 % (15/21) случаев – на фоне ежедневного приема темозоломида. Все пациенты в адъювантном режиме получали химиотерапию (ХТ) темозоломидом от 2 до 18 циклов. Число циклов зависело от эффективности лечения, переносимости ХТ и степени гематологической токсичности. При рецидиве заболевания больные повторно оперировались с последующей ЛТ или радиохирургией в 33,4 %, а также 2-й линии терапии у большинства больных (80,9 %).
Гистологический диагноз ставился в соответствии с классификацией ВОЗ опухолей ЦНС (2016). Иммуногистохимическое исследование (ИГХ) выполнялось c использованием антител GFAP (poly, DakoCytomation), Ki67 (MIB-1, DakoCytomation), при необходимости – Syn (27G12, DakoCytomation), NB (NB84A, Leica). При оценке цитоплазматического окрашивания антителами (GFAP, Syn, NB) пользовались полуколичествен-ным методом: 0 – окрашивание отсутствует, 1+ – слабое окрашивание, 2+ – умеренное окрашивание, 3+ – интенсивное окрашивание. При ядерном окрашивании (антитело Ki67) определялся процент окрашенных клеток.
У всех пациентов в материалах от первой и второй операций определялась относительная экспрессия мРНК гена MGMT при помощи ПЦР в режиме реального времени на оборудовании CFX96 RealTime PCR Detection System (BioRad Laboratories, США). Выделение мРНК и обратная транскрипция проводились по изложенной ранее методике [19]. Источником мРНК служили патоморфологические образцы опухолевой ткани, залитые в парафин (замороженный материал не включался в работу) с содержанием опухолевых клеток более 85 %. Пороговые уровни для разграничения низкой, средней и высокой экспрессии гена (выраженные в ∆ Ct относительно гена-нормализатора SDHA) определялись как 20 и 80 перцентили значений относительной экспрессии соответствующих генов в группе из 50 солидных опухолей, отобранных случайным образом. Мутации в генах IDH1 (экзон 4) и IDH2 (экзон 4) в опухолевой ткани детектировали при помощи анализа кривых плавления ПЦР-продуктов с высоким разрешением (HRMA – High Resolution Melting Analysis) с последуюшим секвенированием ДНК.
В процессе анализа эффективности проводимой терапии и длительности выживаемости все больные были разделены на два биологических подтипа по уровню экспрессии мРНК гена MGMT : 1-й подтип – с низкой экспрессией гена ( ∆ Ct, равной 2 и выше) и 2-й подтип – с высокой экспрессией гена ( ∆ Ct, равной 1,9 и ниже).
Оценка эффективности терапии осуществлялась по данным МРТ с контрастным усилением каждые два цикла химиотерапии и каждые 2–4 мес после ее окончания по критериям RANO (Response Assessment in Neuro-Oncology Working Group) [20]. Части пациентов проводилось ПЭТ с метионином для оценки эффективности лечения и исключения псевдопрогрессии опухоли.
Клинические результаты анализировались с помощью программы STATISTICA for Windows (версия 10 Лиц. BXXR310F964808FA-V). Для определения влияния на безрецидивный период (БРП) степени резекции опухоли, экспрессии мРНК гена MGMT (до и после рецидива), а также проводимой терапии использовался модуль «анализ выживаемости» (Cox’s F-test и Gehan’s Wilcoxon test). В соответствии с руководством к модулю выживаемости в разделе статистика выбиралось большее значение «р» из результатов этих двух тестов. Оценка функции выживания проводилась с помощью метода Каплана–Мейера на основе исследования цензурированных данных с определением ее медианы. Все различия считались достоверными при доверительной вероятности не менее 95 % (уровень значимости р<0,05).
Результаты
Аберрации в генах IDH1 и IDH2 определялись в 20 образцах опухолевой ткани, полученных во время первой операции. В 10 % (2/20) случаев выявлена мутация в гене IDH1(R132H) . При повторном хирургическом вмешательстве после ЛТ и ХТ обнаружены мутации в обоих генах (IDH1 и IDH2) . В 2 случаях повреждение сохранилось в гене IDH1(R132H) , и у одного пациента появилась мутация в гене IDH2(R159G) , которой в материале от первой операции не было (материал перепроверен).
При анализе влияния разных факторов на продолжительность первого БРП были получены следующие результаты. В нашем исследовании мы не получили зависимость длительности первого БРП от пола (p=0,17), возраста (больше 50 и меньше 50 лет, p=0,64), функционального статуса по шкале Карновского (p=0,43), объема поражения (1 доля vs 2 доли и более) (р=0,41) и степени циторедукции (р=0,27). На первый БРП оказало влияние число циклов адъювантной ХТ темозоломидом с тенденцией к достоверности (р=0,07) (рис. 1а). Медиана БРП при проведении 6 циклов ХТ темозоломидом и более составила 65 нед, при терапии 5 циклами и менее - всего 21,5 нед.
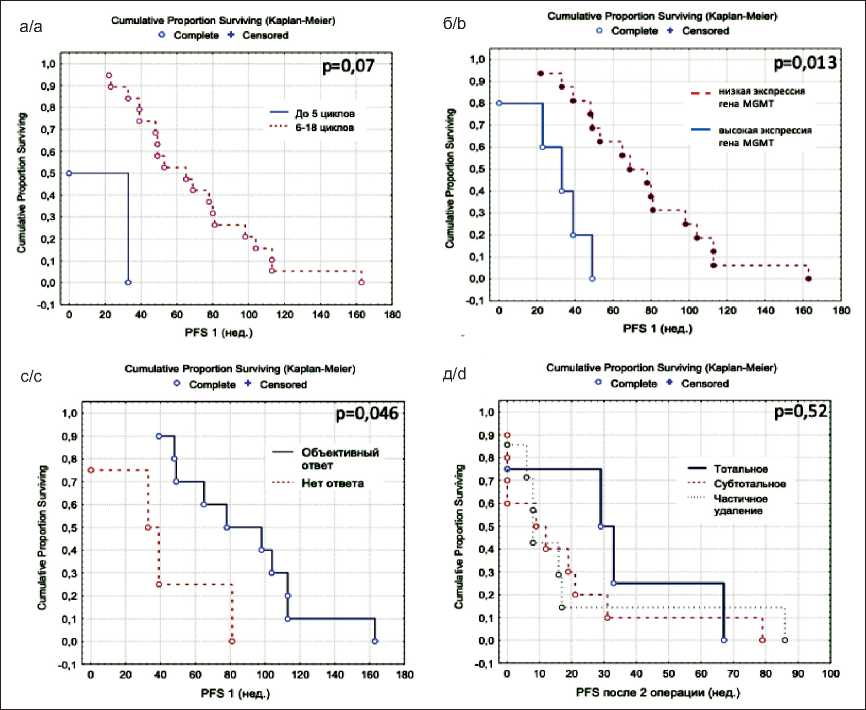
Рис. 1. а. Первый БРП в зависимости от числа циклов ХТ темозоломидом. Прерывистая линия – от 6 до 18 циклов, сплошная линия – 5 циклов и менее (p=0,07); б. Первый БРП в зависимости от уровня экспрессия мРНК гена MGMT. Прерывистая линия – низкая экспрессия ( ∆ Ct равной 2 и выше), сплошная линия – высокая экспрессия ( ∆ Ct равной 1,9 и ниже) (p=0,013); в. Первый БРП в зависимости от ответа опухоли на терапию первой линии. Сплошная линия – полный и частичный ответ, прерывистая линия – отсутствие объективного ответа (р=0,046); г. Второй БРП в зависимости от степени циторедукции (р=0,52)
Fig. 1. a. The first PFS according to the number of cycles of chemotherapy with temozolomide. Broken line – from 6 to 18 cycles, solid line – 5 cycles or less (p=0,07). b. The first PFS according to the level of mRNA expression of the MGMT gene. Broken line – low expression ( ∆ Ct equal to 2 and higher), solid line – high expression ( ∆ Ct equal to 1.9 and lower) (p=0.013). c. The first PFS according to the response of the tumor to first-line therapy. Solid line – a complete and partial response, broken line – the absence of an objective response (р=0,046). d. The second PFS according to the extent of resection (р=0,52)
Длительность первого БРП при терапии темозоломидом со статистической достоверностью зависела от экспрессии мРНК гена MGMT . Все пациенты по уровню экспрессии были разделены на два биологических подтипа: 1-й подтип – с низкой экспрессией мРНК гена MGMT (16 больных) и 2-й подтип – с высокой экспрессией (5 больных). Безрецидивная выживаемость оказалась выше на 40,5 нед в группе с низкой экспрессией мРНК гена MGMT (73,5 нед vs 33 нед, р=0,013) (рис. 1б).
Развитие полного и частичного ответа опухоли на терапию темозоломидом было связано с низкой экспрессией гена MGMT на уровне тенденции, увеличивая продолжительность жизни на 9,3 мес (по χ2 Пирсона – р=0,02, по F-критерияю Фишера – р=0,08). При высокой экспрессии гена полный ответ на терапию не наблюдался ни в одном случае, частичный ответ был только у 1 пациента. В конечном итоге была выявлена статистическая зависимость первого БРП от наличия объективного ответа (полный + частичный vs стабилизация + продолженный рост) на терапию первой линии (88 нед vs 36 нед, р=0,046) (рис. 1в).
При рецидиве заболевания пациенты снова оперировались с пересмотром гистологических препаратов и дальнейшим анализом влияния некоторых параметров на выживаемость. У всех пациентов при повторном хирургическом вмешательстве объем циторедукции составил более 50 %. При этом тотальное удаление рецидивной опухоли выполнено 4 (19,1%), субтотальное – 10 (47,5 %), частичное – 7 (33,4 %) больным (табл. 1). Медиана второго БРП при тотальном удалении составила 31 нед, при субтотальном удалении – 10,5 нед, при частичном – 7,8 нед, однако значимых различий не получено (р=0,52) (рис. 1г) .
Уровень экспрессии мРНК гена MGMT повторно определялся в материале от второй операции. С наступлением рецидива (после проведенной ЛТ и ХТ в первой линии) экспрессия гена MGMT оста-
Таблица 2/table 2
|
W SO m m _ ^ ^ ^ m СО /(№н) go 2^^2222 2 (S>|ggx\) JBAIAmS gg.IJ-gSBgSip pUOOgg /(toH) nag и-ё ° ° 2 2 2 6 НЭ gug-puoogs oj gsuodsg.i S S Й 1 Й § й « 2« |
|
|
го ОО 5 * $ °- го о. £ ф Е ф о О ГО с -О X с о ” d ф > £ О ® ш > >S Т О Ф х -о £ 2 и ® ф CD Е О ° ^ * го 5 I 5 - о £ ю — га > X -н 1- С О Ф S 15 о. га Ф о. В О о. to ГО о X = К * 3 Ф о о Т 2 X го Ф о 5 £ О с X ф а m = ф о Е ® 5 £ 5 тз к с га га о га Ф о £ = х О 5 |
/(киник ё) IX EH igaxo 1 К К К К я ^ ° 8 ° Q о О О од ,—! 1—1 sapXo jo isquinu НЭ auippuooas CL CL s CL ^ /(аоклиП 01ГОИР1) HHUBdai киник к-£ н н 2 н н u Н н и 6 5 .ms р„ё 1ЭЦВ 1У я S й I Й Й /ПО ё дГООП Ilf 1 1 §" о Н ^ о н 1 н (.ms рп-ё) ою?ч^?ч° 2? лила IPVOPV J° noissg.idxg уЫНш/(ио 2- 2 2 2 f^ 5/ ° 2 с) (ЮУ) 1ИОИ вил । ЯНДИ KH999dn93G щ 'й 'й ^ ^ "^ ^ (ins I) ^^оооооо о Z/ШШ uoiwm Q Lh 5 о о o о /(цо с) c/IHQI Enlreilpv ■ ~ ^ К К к к к к X (.ms рп-ё) иоцээбэу Й Рч Й Й Рч [-1 Й Н /(по з) КИНЭГТВУХ W9SL90 15^ии^ни н (5>|ЛЛЛ\) ]BAIA.inS ЛЛ.||-Л5ЕЛ5|р IS.Iig оо m rr> ^ оо m го /(ton) падн-1 m ^ ° m НЭ ong-js.ig од gsuodsgy ° « /(КИНИ1Г l) J^X BH 1991Q 1 у Рч Д U (J о о о g с К К К к я soplo jo .igqinnn ‘НЭ auq-is.iig mo c-i /Я01ШИ11 огонь ‘(пл [ ) КИНИН [ ix rt rt вл ^ rt n-i а а § 5 2 5 2 5 2 5 2 5 2 ® 5 2 1 | 0 S 0 S 0 S 0 S 0 s S | 0 S эиэЗ IPVQPV jo noissg.idxg ухцш/(по 2. ОД ОД ° Ч I) (ЮУ) 1ИОИ вид । ЯНДИ Knoggdnoxe 2 2 q q q а я 2 2 2 2 2 2 И / „ . х . , о о о о о о о (ins 1ST) г/ТНШ иоцщпр\[/(по 1) ё/1НШ киПмЛрм Q м о о S о о о о (.ins jsj) uoipgsg.i jo jug/xg ( ПО I I 'рч_»^Рч^^РнРч f—1 1 й а а а киндтЖА идядо v о о поцгоод/киНвЕигаюц щ н щ н m m m Ч S и u ” ^" SdX хи ° ° ° ° ° ° К § igpugi )1'0| | gSy/xoBdsog 5 S § S S S 5 оу ,—। о, еп хГ иод чо о со |
9 35 ж/f 70 В/P Т/T Нет/no н/l (3,8) без Тем/ 6 нет РО/ 69 Т/T Нет/no в/h (1,5) – Тем (4ц) нет РО/ 33 157
without Tem no RT Tem (4 c) no RT
Повторная ЛТ/радиохирургия проведена 7 пациентам (33,4 %, 7/21). Вторую линию ХТ получали 17 больных, из них 8 – темозоломид. Влияния уровня экспрессии мРНК гена MGMT на медиану второго БРП на всем массиве больных, которые получали ХТ во 2-й линии, не выявлено (p=0,39). Отдельно проанализирована группа больных, которая во второй линии получала темозоломид (табл. 2, выделено цветом). Только у 1 пациента наблюдался частичный ответ на терапию, при этом уровнь экспрессии мРНК гена MGMT в этом случае был высоким. У 5 больных с низкой экспрессией гена вместо ожидаемого положительного ответа на терапию наблюдался продолженный рост опухоли при первом же МРТ-контроле.
Обсуждение
С появлением темозоломида и бевацизумаба в практической деятельности нейроонколога и с применением персонифицированного подхода стало понятно, что на продолжительность жизни больных в большой степени оказывают влияние молекулярные особенности самой опухоли и проведенное лечение, чем степень поражения головного мозга и объем циторедукции при условии удовлетворительного состояния пациента (оценка функционального статуса по шкале Карновского и шкале ECOG) [21, 22].
На данный момент основным и пока единственным предиктивным маркером в лечении пациентов с ГБ остается ген MGMT [8, 11]. Исследователи пришли к заключению, что у пациентов с низкой активностью гена MGMT в опухоли (наличие метилирования промотора гена или низкий уровень экспрессии) при стандартном комплексном лечении показатели выживаемости были выше, чем у больных с высокой его активностью [8, 13]. Безрецидивная продолжительность жизни у оперированных больных с первичной ГБ при комплексной терапии (лучевая и химиотерапия) при высокой активности гена MGMT , по данным разных источников, составляет от 2,7 до 10,5 мес [23, 24], а при низкой активности гена – от 8,2 до 24 мес [13, 23, 24]. В настоящем исследовании мы получили схожие результаты: медиана первого БРП у пациентов с низкой экспрессией мРНК гена MGMT при комплексной терапии была выше на 9,6 месяцев, чем у пациентов с высокой экспрессией мРНК данного гена (73,5 нед vs 33 нед, р=0,013).
С наступлением рецидива, когда опухоль претерпела множество преобразований в геноме, перед нейроонкологами возникает целый ряд вопросов. Для определения лекарственной тактики во 2-й линии и целесообразности повторного назначения темозоломида при рецидиве ГБ необходимо учитывать не только клинические аспекты течения заболевания, но и данные повторного молекулярногенетического исследования. По данным литературы, при рецидивировании глиобластомы после стандартного лечения, включающего ЛТ и ХТ темозоломидом, экспрессия мРНК гена MGMT может меняться. Крайне редко она снижается, чаще всего остается на прежнем уровне или повышается (табл. 3). При анализе собственных данных мы пришли к похожим результатам: в 66,7 % экспрессия мРНК гена MGMT осталась прежней, при этом не было выявлено зависимости уровня экспрессии от числа циклов химиотерапии, проведенных в первой линии. Остается неясным, сохраняет ли свои предиктивные свойства ген MGMT после рецидива в случае, когда его экспрессия остается или становится низкой? Исследований по этой проблеме очень мало, и единого мнения нет. В одних исследованиях подтверждается предиктивная роль гена MGMT после рецидивирования ГБ [35, 36], в других работах – нет [37, 38]. По результатам нашего исследования эффективность 2-й линии терапии не зависела от уровня экспрессии гена MGMT. В современной литературе описываются возможные причины, объясняющие потерю предиктивной значимости гена MGMT после рецидива ГБ даже в случае низкого уровня его экспрессии. Во-первых, под воздействием различных факторов, в том числе химиотерапии, в ГБ происходят перестройки молекулярно-генетического статуса с появлением новых альтераций (амплификация в гене EGFR; мутации в генах TP53, PTEN и PDGFRA; делеции в генах RB1, NF1, CDKN2A и CDKN2B, и др.); в том числе могут возникнуть мутации в генах системы репарации неспаренных нуклеотидов ДНК (в первую очередь в системе MMR гены MSH2, MSH6, MLH1, MLH3 и PMS2), что приводит к нарушению их работы и сопровождается появлением еще большего количества мутаций [16, 17]. Во-вторых, в процессе лечения все доминантные клоны первичной опухоли, чувствительные к проводимой терапии, гибнут, а сохранившиеся клетки-предшественники, имея повышенный потенциал к самообновлению с неизвестной дифференцировкой, образуют опухолевую массу, резистентную к цитостатикам, которые назначались в первой линии [17].
Благодаря уже имеющимся немногочисленным исследованиям стало понятно, что опухолевые клетки, избегая собственной гибели под воздействием лучевой и лекарственной терапии, эволюционируют и приобретают генотип, устойчивый к дальнейшему лечению. Положение усугубляется еще и тем, что единственный на сегодняшний день предиктивный маркер (ген MGMT ) при рециди-
Таблица 3/table 3
Сравнительная характеристика изменения активности гена MGMt у больных с первичной ГБ GiV до и после рецидива. Обзор литературы и результаты собственного исследования
Comparative characteristics of changes in the activity of the MGMt gene in patients with primary GB GiV before and after relapse. literature review and results of our own research
|
Исследование/ Authors |
ii is vo ° ° ,0 |
Io 8 m g s -g и |
К |
Метод исследования/ Study method |
Лечение первичной опухоли/ Treatment of the primary tumor |
Активность гена MGMT / Activity of MGMT gene Без изме- Повыше- Сниже-нений/ ние/ ние/ Without Increase Decrease changes |
||
|
Parkinson J.F. et al., 2008 [25] |
8 |
56,5 |
7/1 |
МС-ПЦР/ MS-PCR |
ЛТ с Тем (2 случая + Прокарбазин, 1 случай + Целекоксиб)/ RT with Tem (2 cases + Procarbazine, 1 case + Celecoxib) |
6 (75 %) |
– |
2 (25 %) |
|
7 |
55,2 |
6/1 |
ИГХ/IHC |
ЛТ, МХТ Тем/ RT, MCT Tem |
1 (14,4 %) |
3 (42,8 %) |
3 (42,8 %) |
|
|
Metellus P. et al., 2009 [26] |
18 |
59 |
м>ж |
МС-ПЦР/ MS-PCR |
ЛТ с Тем (75 мг/м2/сут) + МХТ Тем/ RT with Tem (75 mg/m2/ day) + MCT Tem |
18 (100 %) |
– |
– |
|
Christmann M. et al., 2010 [27] |
9 |
– |
– |
МС-ПЦР/ MS-PCR |
ЛТ + МХТ Тем/RT/RT with Tem |
1 (11,1 %) |
6 (66,7 %) |
2 (22,2 %) |
|
Jung Tae-Young et al., 2010 [28] |
16 |
52,06 |
7/9 |
МС-ПЦР/ MS-PCR ИГХ/IHC |
ЛТ/ЛТ с Тем (75 мг/м2/ сут) + МХТ Тем (150 RT/ RT with Tem 200 мг/м2, 5/28)/ RT/RT with Tem (75 mg/ m2/day) + MCT Tem (150 RT/RT with Tem 200 мг/ м2, 5/28) |
12 (75 %) 2 (12,5 %) |
3 (18,75 %) 14 (87,5 %) |
1 (6,25 %) – |
|
Felsberg J. et al., 2011 [29] |
64 48 |
57,4 |
м>ж |
МС-ПЦР/ MS-PCR Пиросеквенирование/ Pyrosequencing |
ЛТ с Тем + МХТ Тем/ЛТ с Тем/ RT with Tem + MCH Tem/ RT with Tem |
57 (89 %) 43 (89,6 %) |
5 (7,9%) 5 (10,4 %) |
2 (3,1 %) -– |
|
29 |
ИГХ/IHC |
8 (27,6 %) |
12 (41,4 %) |
9 (31 %) |
||||
|
Park Chul-Kee et al., 2012 [30] |
24 |
60,1 |
15/9 |
МС-ПЦР/ MS-PCR ИГХ/IHC |
Протокол Stupp/ЛТ с Тем/ ЛТ+МХТ Тем/ protocol Stupp/RT with Tem / RT + MCT Tem |
22 (91,6 %) 19 (79,2 %) |
1 (4,2 %) 4 (16,7 %) |
1 (4,2 %) 1 (4,1 %) |
|
Brandes A.A. et al., 2010 [31] |
38 |
49 |
28/10 |
МС-ПЦР/ MS-PCR |
Протокол Stupp/ Protocol Stupp |
24 (63,2 %) |
8 (21 %) |
6 (15,8 %) |
|
Brandes A.A. et al., 2017 [32] |
108 |
50,8 |
69/39 |
МС-ПЦР/ MS-PCR |
Протокол Stupp/ Protocol Stupp |
81 (75 %) |
16 (14,9 %) |
11 (10,1 %) |
|
O’Regan C.J. et al., 2017 [33] |
22 |
49,5 |
12/10 |
Пиросеквенирование/ Pyrosequencing |
Протокол Stupp/ Protocol Stupp |
14 (63 %) |
5 (23 %) |
3 (14 %) |
|
Hudson A.M. et al., 2018 [34] |
19 |
60 |
12/7 |
МС-ПЦР/ MS-PCR |
Протокол Stupp/ ЛТ + МХТ Тем/ protocol Stupp/RT + MCH Tem |
17 (89,5 %) |
2 (10,5 %) |
– |
|
Настоящее исследование/ Present study |
21 |
47 |
7/14 |
ПЦР в режиме реального времени/ Real-time PCR |
Протокол Stupp/ ЛТ + МХТ Тем/ protocol Stupp/RT + MCH Tem |
14 (66,7 %) |
5 (23,8 %) |
2 (9,5 %) |
Примечание: МС-ПЦР – метилспецифическая полимеразная цепная реакция; ИГХ – иммуногистохимия; Тем – темозоломид;
МХТ – монохимиотерапия; протокол Stupp – ЛТ c Тем (75 мг/м2/сут) + МХТ Тем (150–200 мг/м2, 6 циклов, 5/28)
Note: MS-PCR – methyl-specific polymerase chain reaction; IHC – immunohistochemistry; RT – radiation therapy; Tem – temozolomide;
MCT – monochemotherapy; Stupp protocol – RT with Tem (75 mg/m2/day) + MCT Tem (150–200 mg/m2, 6 cycles, 5/28)
вировании может терять свою функцию. В этой ситуации стоит больше ориентироваться на уровень экспрессии других генов: VEGF (сосудистоэндотелиальный фактор роста) и ERCC1 (ген эксцизионной репарации ДНК) с целью назначения
Список литературы Изменение уровня экспрессии гена MGMT у пациентов с первичной глиобластомой после рецидива. Влияние клинических характеристик и экспрессии гена MGMT на продолжительность жизни больных
- Ostrom Q.T., Gittleman H., Truitt G., Boscia A., Kruchko C., Barnholtz-Sloan J.S. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2011-2015. Neuro Oncol. 2018 Oct 1; 20(suppl_4): iv1-iv86. https://doi.org/10.1093/neuonc/noy131.
- Noroxe D.S., Poulsen H.S., Lassen U. Hallmarks of glioblastoma: a systematic review. ESMO Open. 2017 Feb 22; 1(6): e000144. https://doi.org/10.1136/esmoopen-2016-000144.
- Gilbert M.R., Dignam J.J., Armstrong T.S., Wefel J.S., Blumenthal D.T., Vogelbaum M.A., Colman H., Chakravarti A., Pugh S., Won M., Jeraj R., Brown P.D., Jaeckle K.A., Schiff D., Stieber V.W., Brachman D.G., WernerWasik M., Tremont-Lukats I.W., Sulman E.P., Aldape K.D., Curran W.J.Jr., Mehta M.P. A randomized trial of bevacizumab for newly diagnosed glioblastoma. N Engl J Med. 2014 Feb 20; 370(8): 699-708. https://doi.org/10.1056/NEJMoa1308573.
- Amelot A., De Cremoux P., Quillien V., Polivka M., Adle-Biassette H., Lehmann-Che J., Françoise L., Carpentier A.F., George B., Mandonnet E., Froelich S. IDH-Mutation Is a Weak Predictor of Long-Term Survival in Glioblastoma Patients. PLoS One. 2015 Jul 9; 10(7): e0130596. https://doi.org/10.1371/journal.pone.0130596.
- Matsko M.V., Matsko D.E., Volkov N.M., Ulitin A.Yu., Moiseenko V.M., Imyanitov E.N., Ievleva A.G. Morfologicheskie i molekulyarno-geneticheskie osobennosti pervichnykh glioblastom u patsientov s neobychno vysokoi prodolzhitel'nost'yu zhizni. Sibirskii onkologicheskii zhurnal. 2019; 18(3): 34-44. https://doi.org/10.21294/1814-4861-2019-18-3-34-44.
- Stupp R., Hegi M.E., Mason W.P., van den Bent M.J., Taphoorn M.J., Janzer R.C., Ludwin S.K., Allgeier A., Fisher B., Belanger K., Hau P., Brandes A.A., Gijtenbeek J., Marosi C., Vecht C.J., Mokhtari K., Wesseling P., Villa S., Eisenhauer E., Gorlia T., Weller M., Lacombe D., Cairncross J.G., Mirimanoff R.O.; European Organisation for Research and Treatment of Cancer Brain Tumour and Radiation Oncology Groups; National Cancer Institute of Canada Clinical Trials Group. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial. Lancet Oncol. 2009 May; 10(5): 459-66. https://doi.org/10.1016/S1470-2045(09)70025-7.
- Zagzag D., Esencay M., Mendez O., Yee H., Smirnova I., Huang Y., Chiriboga L., Lukyanov E., Liu M., Newcomb E.W. Hypoxia- and vascular endothelial growth factor-induced stromal cell-derived factor-1alpha/CXCR4 expression in glioblastomas: one plausible explanation of Scherer’s structures. Am J Pathol. 2008 Aug; 173(2): 545-60. https://doi.org/10.2353/ajpath.2008.071197.
- Hegi M.E., Diserens A.C., Gorlia T., Hamou M.F., de Tribolet N., Weller M., Kros J.M., Hainfellner J.A., Mason W., Mariani L., Bromberg J.E., Hau P., Mirimanoff R.O., Cairncross J.G., Janzer R.C., Stupp R. MGMT gene silencing and benefit from temozolomide in glioblastoma. N Engl J Med. 2005 Mar 10; 352(10): 997-1003. https://doi.org/10.1056/NEJMoa043331.
- Perry J.R., Laperriere N., O'Callaghan C.J., Brandes A.A., Menten J., Phillips C., Fay M., Nishikawa R., Cairncross J.G., Roa W., Osoba D., Rossiter J.P., Sahgal A., Hirte H., Laigle-Donadey F., Franceschi E., Chinot O., Golfinopoulos V., Fariselli L., Wick A., Feuvret L., Back M., Tills M., Winch C., Baumert B.G., Wick W., Ding K., Mason W.P.; Trial Investigators. Short-Course Radiation plus Temozolomide in Elderly Patients with Glioblastoma. N Engl J Med. 2017; 376(11): 1027-1037. https://doi.org/10.1056/NEJMoa1611977.
- Matsko M.V., Imaynitov E.N. Predictive role of O6-methylguanine DNA methyltransferase status for the treatment of brain tumors. Epigen Terr Cancer. 2015. 251-279. https://doi.org/10.1007/978-94-017-9639-2_9.
- Louis D.N., Perry A., Reifenberger G., von Deimling A., FigarellaBranger D., Cavenee W.K., Ohgaki H., Wiestler O.D., Kleihues P., Ellison D.W. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol. 2016 Jun; 131(6): 803-20. https://doi.org/10.1007/s00401-016-1545-1.
- Samson L., Cairns J.A new pathway for DNA repair in Escherichia coli. Nature. 1977; 267: 281-283.
- Park C.K., Lee S.H., Kim T.M., Choi S.H., Park S.H., Heo D.S., Kim I.H., Jung H.W. The value of temozolomide in combination with radiotherapy during standard treatment for newly diagnosed glioblastoma. J Neurooncol. 2013 Apr; 112(2): 277-83. https://doi.org/10.1007/s11060-013-1060-3.
- Chen C., Xu T., Lu Y., Chen J., Wu S. The efficacy of temozolomide for recurrent glioblastoma multiforme. Eur J Neurol. 2013 Feb; 20(2): 223-30. https://doi.org/10.1111/j.1468-1331.2012.03778.x.
- Campos B., Olsen L.R., Urup T., Poulsen H.S. A comprehensive profile of recurrent glioblastoma. Oncogene. 2016 Nov 10; 35(45): 5819-5825. https://doi.org/10.1038/onc.2016.85.
- Kim J., Lee I.H., Cho H.J., Park C.K., Jung Y.S., Kim Y., Nam S.H., Kim B.S., Johnson M.D., Kong D.S., Seol H.J., Lee J.I., Joo K.M., Yoon Y., Park W.Y., Lee J., Park P.J., Nam D.H. Spatiotemporal Evolution of the Primary Glioblastoma Genome. Cancer Cell. 2015 Sep 14; 28(3): 318-28. https://doi.org/10.1016/j.ccell.2015.07.013.
- Kim H., Zheng S., Amini S.S., Virk S.M., Mikkelsen T., Brat D.J., Grimsby J., Sougnez C., Muller F., Hu J., Sloan A.E., Cohen M.L., Van Meir E.G., Scarpace L., Laird P.W., Weinstein J.N., Lander E.S., Gabriel S., Getz G, Meyerson M., Chin L., Barnholtz-Sloan J.S., Verhaak R.G. Whole-genome and multisector exome sequencing of primary and posttreatment glioblastoma reveals patterns of tumor evolution. Genome Res. 2015 Mar; 25(3): 316-27. https://doi.org/10.1101/gr.180612.114.
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Central Nervous System Cancers. Version 2.2019.
- Mitiushkina N.V., Iyevleva A.G., Poltoratskiy A.N., Ivantsov A.O., Togo A.V., Polyakov I.S., Orlov S.V., Matsko D.E., Novik V.I., Imyanitov E.N. Detection of EGFR mutations and EML4-ALK rearrangements in lung adenocarcinomas using archived cytological slides. Cancer Cytopathol. 2013 Jul; 121(7): 370-6. https://doi.org/10.1002/cncy.21281.
- Wen P.Y., Macdonald D.R, Reardon D.A., Cloughesy T.F., Sorensen A.G., Galanis E., Degroot J., Wick W., Gilbert M.R., Lassman A.B., Tsien C., Mikkelsen T., Wong E.T., Chamberlain M.C., Stupp R., Lamborn K.R., Vogelbaum M.A., van den Bent M.J., Chang S.M. Updated response assessment criteria for high-grade gliomas: response assessment in neurooncology working group. J Clin Oncol. 2010 Apr 10; 28(11): 1963-72. https://doi.org/10.1200/JCO.2009.26.3541.
- Zhang C., Yao Y., Wang Y., Chen Z., Wu J., Mao Y., Zhou L. Temozolomide for adult brain stem glioblastoma: case report of a long-term survivor. Int J Neurosci. 2010 Dec; 120(12): 787-91. https://doi.org/10.3109/00207454.2010.520377.
- Marchi F., Sahnane N., Cerutti R., Cipriani D., Barizzi J., Stefanini F.M., Pistolio S., Cerati M., Balbi S., Mazzucchelli L., Sessa F., Pesce G.A., Reinert M., Frattini M. The Impact of Surgery in IDH 1 Wild Type Glioblastoma in Relation With the MGMT Deregulation. Front Oncol. 2020 Jan 24; 9: 1569. https://doi.org/10.3389/fonc.2019.01569.
- Felsberg J., Rapp M., Loeser S., Fimmers R., Stummer W., Goeppert M., Steiger H.J., Friedensdorf B., Reifenberger G., Sabel M.C. Prognostic significance of molecular markers and extent of resection in primary glioblastoma patients. Clin Cancer Res. 2009 Nov 1; 15(21): 6683-93. https://doi.org/10.1158/1078-0432.CCR-08-2801.
- Quillien V., Lavenu A., Sanson M., Legrain M., Dubus P., KarayanTapon L., Mosser J., Ichimura K., Figarella-Branger D. Outcome-based determination of optimal pyrosequencing assay for MGMT methylation detection in glioblastoma patients. J Neurooncol. 2014 Feb; 116(3): 487-96. https://doi.org/10.1007/s11060-013-1332-y.
- Parkinson J.F., Wheeler H.R., Clarkson A., McKenzie C.A., Biggs M.T., Little N.S., Cook R.J., Messina M., Robinson B.G., McDonald K.L. Variation of O(6)-methylguanine-DNA methyltransferase (MGMT) promoter methylation in serial samples in glioblastoma. J Neurooncol. 2008 Mar; 87(1): 71-8. https://doi.org/10.1007/s11060-007-9486-0.
- Metellus P., Coulibaly B., Nanni I., Fina F., Eudes N., Giorgi R., Barrie M., Chinot O., Fuentes S., Dufour H., Ouafik L., Figarella-Branger D. Prognostic impact of O6-methylguanine-DNA methyltransferase silencing in patients with recurrent glioblastoma multiforme who undergo surgery and carmustine wafer implantation: a prospective patient cohort. Cancer. 2009 Oct 15; 115(20): 4783-94. https://doi.org/10.1002/cncr.24546.
- Christmann M., Nagel G., Horn S., Krahn U., Wiewrodt D., Sommer C., Kaina B. MGMT activity, promoter methylation and immunohistochemistry of pretreatment and recurrent malignant gliomas: a comparative study on astrocytoma and glioblastoma. Int J Cancer. 2010 Nov 1; 127(9): 2106-18. https://doi.org/10.1002/ijc.25229.
- Jung T.Y., Jung S., Moon K.S., Kim I.Y., Kang S.S., Kim Y.H., Park C.S., Lee K.H. Changes of the O6-methylguanine-DNA methyltransferase promoter methylation and MGMT protein expression after adjuvant treatment in glioblastoma. Oncol Rep. 2010; 23(5): 1269-76. https://doi.org/10.3892/or_00000760.
- Felsberg J., Thon N., Eigenbrod S., Hentschel B., Sabel M.C., Westphal M., Schackert G., Kreth F.W., Pietsch T., Löffler M., Weller M., Reifenberger G., Tonn J.C.; German Glioma Network. Promoter methylation and expression of MGMT and the DNA mismatch repair genes MLH1, MSH2, MSH6 and PMS2 in paired primary and recurrent glioblastomas. Int J Cancer. 2011 Aug 1; 129(3): 659-70. https://doi.org/10.1002/ijc.26083.
- Felsberg J., Thon N., Eigenbrod S., Hentschel B., Sabel M.C., Westphal M., Schackert G., Kreth F.W., Pietsch T., Löffler M., Weller M., Reifenberger G., Tonn J.C.; German Glioma Network. Promoter methylation and expression of MGMT and the DNA mismatch repair genes MLH1, MSH2, MSH6 and PMS2 in paired primary and recurrent glioblastomas. Int J Cancer. 2011 Aug 1; 129(3): 659-70. https://doi.org/10.1002/ijc.26083.
- Brandes A.A., Franceschi E., Tosoni A., Bartolini S., Bacci A., Agati R., Ghimenton C., Turazzi S., Talacchi A., Skrap M., Marucci G., Volpin L., Morandi L., Pizzolitto S., Gardiman M., Andreoli A., Calbucci F., Ermani M. O(6)-methylguanine DNA-methyltransferase methylation status can change between first surgery for newly diagnosed glioblastoma and second surgery for recurrence: clinical implications. Neuro Oncol. 2010 Mar; 12(3): 283-8. https://doi.org/10.1093/neuonc/nop050.
- Brandes A.A., Franceschi E., Paccapelo A., Tallini G., De Biase D., Ghimenton C., Danieli D., Zunarelli E., Lanza G., Silini E.M., Sturiale C., Volpin L., Servadei F., Talacchi A., Fioravanti A, Pia Foschini M., Bartolini S., Pession A., Ermani M. Role of MGMT Methylation Status at Time of Diagnosis and Recurrence for Patients with Glioblastoma: Clinical Implications. Oncologist. 2017 Apr; 22(4): 432-437. https://doi.org/10.1634/theoncologist.2016-0254.
- O'Regan C.J., Kearney H., Beausang A., Farrell M.A., Brett F.M., Cryan J.B., Loftus T.E., Buckley P.G. Temporal stability of MGMT promoter methylation in glioblastoma patients undergoing STUPP protocol. J Neurooncol. 2018 Apr; 137(2): 233-240. https://doi.org/10.1007/s11060-017-2722-3.
- Hudson A.L., Parker N.R., Khong P., Parkinson J.F., Dwight T., Ikin R.J., Zhu Y., Chen J., Wheeler H.R., Howell V.M. Glioblastoma Recurrence Correlates With Increased APE1 and Polarization Toward an Immuno-Suppressive Microenvironment. Front Oncol. 2018; 8: 314. https://doi.org/10.3389/fonc.2018.00314.
- Gutenberg A., Bock H.C., Brück W., Doerner L., Mehdorn H.M., Roggendorf W., Westphal M., Felsberg J., Reifenberger G., Giese A. MGMT promoter methylation status and prognosis of patients with primary or recurrent glioblastoma treated with carmustine wafers. Br J Neurosurg. 2013 Dec; 27(6): 772-8. https://doi.org/10.3109/02688697.2013.791664.
- Weller M., Tabatabai G., Kästner B., Felsberg J., Steinbach J.P., Wick A., Schnell O., Hau P., Herrlinger U., Sabel M.C., Wirsching H.G., Ketter R., Bähr O., Platten M., Tonn J.C., Schlegel U., Marosi C., Goldbrunner R., Stupp R., Homicsko K., Pichler J., Nikkhah G., Meixensberger J., Vajkoczy P., Kollias S., Hüsing J., Reifenberger G., Wick W.; DIRECTOR Study Group. MGMT Promoter Methylation Is a Strong Prognostic Biomarker for Benefit from Dose- Intensified Temozolomide Rechallenge in Progressive Glioblastoma: The DIRECTOR Trial. Clin Cancer Res. 2015 May 1; 21(9): 2057-64. https://doi.org/10.1158/1078-0432.CCR-14-2737.
- Sadones J., Michotte A., Veld P., Chaskis C., Sciot R., Menten J., Joossens E.J., Strauven T., D'Hondt L.A., Sartenaer D., Califice S.F., Bierau K., Svensson C., De Grève J., Neyns B. MGMT promoter hypermethylation correlates with a survival benefit from temozolomide in patients with recurrent anaplastic astrocytoma but not glioblastoma. Eur J Cancer. 2009 Jan; 45(1): 146-53. https://doi.org/10.1016/j.ejca.2008.09.002.
- Quick J., Gessler F., Dützmann S., Hattingen E., Harter P.N., Weise L.M., Franz K., Seifert V., Senft C. Benefit of tumor resection for recurrent glioblastoma. J Neurooncol. 2014 Apr; 117(2): 365-72. https://doi.org/10.1007/s11060-014-1397-2.


