Изменение вентиляторного ответа на гиперкапнию при экзогенном повышении уровня интерлейкина-1 бета в крови и цереброспинальной жидкости
Автор: Данилова Г.А., Александрова Н.П., Александров В.Г.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Нормальная и патологическая физиология
Статья в выпуске: 2, 2015 года.
Бесплатный доступ
В экспериментах на наркотизированных трахеостомированных крысах исследовалось влияние основного провоспалительного цитокина интерлейкина-1β (ИЛ-1β) на вентиляторный ответ при действии гиперкапнического стимула. Установлено, что повышение содержания ИЛ-1β в цереброспинальной жидкости вызывает снижение вентиляторной чувствительности к гиперкапнической стимуляции: наблюдается снижение прироста минутного объема дыхания, дыхательного объема и средней скорости инспираторного потока, отражающей уровень центральной инспираторной активности. Также установлено, что в отличие от церебровентрикулярного введения ИЛ-1β его внутривенное введение не вызывает ослабления вентиляторной чувствительности к гиперкапнии. Полученные данные позволяют сделать вывод о том, что повышение церебрального уровня провоспалительных цитокинов может оказывать влияние на механизмы центральной хеморецепции.
Центральная, периферическая хеморецепция, цитокины, внешнее дыхание, гиперкапния
Короткий адрес: https://sciup.org/14113067
IDR: 14113067 | УДК: 612.217
Текст научной статьи Изменение вентиляторного ответа на гиперкапнию при экзогенном повышении уровня интерлейкина-1 бета в крови и цереброспинальной жидкости
Введение.2Как известно, в основе регуляции дыхания лежат реакции дыхательной системы на изменение газового состава артериальной крови. Общий уровень легочной вентиляции определяется интенсивностью афферентной импульсации, поступающей в дыхательный центр от центральных и периферических хеморецепторов. При этом важнейшая роль отводится центральным хеморецепторам, так как их активация при повышении содержания углекислого газа в артериальной крови вызывает увеличение вентиляции легких, необходимое для удаления избытка СО2 из организма и поддержания газо- вого гомеостаза. Поэтому при исследовании участия того или иного фактора в регуляции функции дыхания важно знать, как он влияет на центральную хеморецепцию и вентиляторную чувствительность к гиперкапническому стимулу.
В настоящее время известно, что цитокины играют важную роль в нейроиммунных взаимодействиях, участвуя в межклеточной коммуникации в качестве нейромодуляторов, оказывающих прямое или опосредованное действие на клетки центральной нервной системы [4–6, 9]. Это дает основание предполагать участие цитокинов в центральной регуляции различных физиологических функций, в т.ч. и функции дыхания [3].
Участие цитокинов в контроле дыхания подтверждается и результатами иммуногистохимических исследований, которые показали наличие экспрессии цитокинов и их рецепторов в ядре солитарного тракта и вентролатеральном отделе продолговатого мозга, т.е. в тех областях ствола, которые принимают непосредственное участие в управлении дыханием [7, 8, 13]. Кроме того, в последние годы были установлены некоторые экспериментальные факты, которые дают основание для предположений об участии про-воспалительных цитокинов в хеморефлек-торных механизмах регуляции дыхательной функции.
Значительный подъем церебрального и системного уровней провоспалительных цитокинов происходит при различных видах стресса, увеличении нагрузки на дыхательную систему, травмах головного мозга, инсультах и ишемии [5, 6, 11, 16]. С другой стороны, при таких условиях часто наблюдаются изменение паттерна дыхания, снижение вентиляторной чувствительности к гиперкапнии, развитие патологических типов дыхания (ап-нейзисы, гаспинги).
В связи с вышеперечисленными фактами актуальным становится исследование возможных последствий увеличенной продукции провоспалительных цитокинов и механизмов их влияния на функцию дыхания. При этом приоритетным направлением является изучение роли цитокинов в механизмах гиперкапнической хеморецепции, так как они лежат в основе регуляции функции дыхания и формирования адаптивных реакций дыхательной системы [2]. К тому же до сих пор нет ясности в вопросе о том, как реализуются респираторные влияния провоспалительных цитокинов, могут ли они участвовать в рефлекторных механизмах регуляции дыхания, оказывать активирующее или угнетающее действие на вентиляционную функцию легких, модифицировать чувствительность дыхательной системы к изменению газового состава крови.
Цель исследования. Анализ изменений вентиляторного ответа и его составляющих на гиперкапническую стимуляцию центральных хеморецепторов возвратным дыханием гиперкапнически-гипероксической газовой смесью до и после повышения церебрального и системного уровня ИЛ-1βВ с целью определения участия иммунных механизмов в регуляции центральной хеморецепции.
Материалы и методы. Эксперименты проводились на 16 трахеостомированных спонтанно дышащих крысах-самцах линии Wistar, весом 250–300 г, наркотизированных внутрибрюшинным введением уретана из расчета 1400 мг/кг. Все эксперименты на животных были проведены с соблюдением основных норм и правил биомедицинской этики (European Community Council Directives 86/609/EEC).
В экспериментах применялась пневмота-хографическая методика для регистрации объемно-временных параметров внешнего дыхания. При помощи миниатюрной пнев-мометрической трубки MLT-1L (ADInsru-ments), обеспечивающей ламинарность воздушного потока, регистрировалась объемная скорость воздушного потока (пневмотахограмма).
По пневмотахограмме измерялась максимальная скорость вдоха, длительность вдоха и выдоха, рассчитывалась частота дыхания (ЧД). Для определения дыхательного объема (ДО) производилось интегрирование пневмо-тахографической кривой. Минутный объем дыхания (МОД) рассчитывался как произведение величины дыхательного объема на количество дыхательных движений за одну минуту. Средняя скорость инспираторного потока (Vинс), являющаяся косвенным показателем центральной инспираторной активности, рассчитывалась как частное от деления величины дыхательного объема на продолжительность вдоха.
Известно, что полипептиды, которыми являются и цитокины, не проходят через гематоэнцефалический барьер, так как это крупные молекулы. Поэтому эффекты при системном и центральном введении ИЛ могут быть разными. Для того чтобы выяснить, влияет ли наличие барьерных структур на респираторные эффекты интерлейкина, было проведено две серии экспериментов. В одной серии экспериментов вещество вводилось в кровь через бедренную вену, в другой – в це- реброспинальную жидкость в обход гематоэнцефалического барьера.
В первой серии экспериментов микроинъекции ИЛ-1β производились в правый боковой желудочек головного мозга при помощи шприца Гамильтона. Координаты для введения канюли определялись по стереотаксическому атласу мозга крысы [14] и составляли 0,8 мм каудальнее уровня bregma, 1,5 мм ла-теральнее средней линии и 3,5–4,0 мм в глубину от поверхности черепа. Введение канюли по данным координатам неоднократно использовалось нами в экспериментах и показало хорошую точность попадания в боковой желудочек мозга [1]. С помощью бормашины рассверливалось трепанационное отверстие, в которое вводилась направляющая канюля, укрепленная на стереотаксической головке. В ходе эксперимента в канюлю погружался микроинъектор, через который в боковой желудочек мозга вводилось 10 мкл раствора, содержащего 500 нг ИЛ-1β, со скоростью 1 мкл/мин.
Во второй серии экспериментов в кровеносную систему через бедренную вену вводилось 500 нг ИЛ-1β, разведенного в 0,1 мл раствора.
Для оценки вентиляторной чувствительности к гиперкапническому стимулу использовался метод возвратного дыхания [15]. Вентиляторная чувствительность определялась с помощью построения кривых роста вентиляции и ее составляющих при увеличении содержания СО 2 в альвеолярном воздухе. Изменение состава альвеолярного воздуха достигалось дыханием гиперкапнически-гипероксической газовой смесью. Парциальное давление углекислого газа в альвеолярном воздухе (Р ЕТ СО 2 ) измерялось при помощи квадрупольного масс-спектрометра МС 7-100 (ИАП РАН, Санкт-Петербург).
При регистрации вентиляторного ответа на гиперкапническую стимуляцию использовалась азотно-гиперкапнически-гиперокси-ческая смесь (60 % О 2 и 7 % СО 2 в азоте). Продолжительность проведения пробы с возвратным дыханием составляла 4 мин.
Статистическая обработка данных про- водилась с помощью однофакторного дисперсионного анализа программными средствами Microsoft Excel. Вычислялась средняя величина регистрируемых параметров и ошибка средней. Различия считались достоверными при уровне вероятности p<0,05.
Результаты и обсуждение. Интравентрикулярное введение ИЛ-1β в цереброспинальную жидкость вызывало увеличение дыхательного объема, минутного объема дыхания, средней скорости инспираторного потока. Достоверные изменения в параметрах дыхания наблюдались через 15–20 мин после введения препарата, достигая максимальных значений на 40-й мин после введения ИЛ-1β.
Увеличение частоты дыхания через 40 мин после интравентрикулярного введения интерлейкина не было статистически значимым. Величина дыхательного объема достоверно возрастала на 13 % через 40 мин действия ИЛ-1β и на 17 % через 60 мин. Вследствие роста глубины дыхания и небольшого увеличения частоты происходило достоверное увеличение минутной вентиляции легких в среднем на 40 %. Средняя скорость инспираторного потока, отражающая величину центральной инспираторной активности, возрастала на 20 % (табл. 1).
Введение интерлейкина в бедренную вену приводило к повышению уровня ИЛ-1β в циркуляторном русле, что вызывало такие же изменения в величине респираторных параметров, как и повышение его церебрального уровня (табл. 1). Увеличение дыхательного объема начиналось через 20 мин после введения ИЛ-1β, становясь статистически значимым через 35–40 мин и превышая фоновый уровень на 36 %, а через 60 мин – уже на 40 %. При этом частота дыхания не возрастала. Достоверное увеличение минутного объема дыхания начиналось через 25 мин после начала введения ИЛ-1β и через 40 мин превышало фоновый уровень в среднем на 23 %. Средняя скорость инспираторного потока в этот период увеличивалась на 20 %. Интравентрикулярное и внутривенное введение физиологического раствора не оказывало влияния на паттерн дыхания.
Объемно-временные параметры дыхания до и после церебрального и внутривенного введения ИЛ-1β
Таблица 1
|
Параметр |
Церебральное введение ИЛ-1β (n=8) |
Внутривенное введение ИЛ-1β (n=8) |
||||
|
фон |
40 мин |
60 мин |
фон |
40 мин |
60 мин |
|
|
МОД, мл/мин |
104,0±9,0 |
126,0±3,7** |
131,0±5,4** |
117,0±10,6 |
143,0±12,8** |
146,0±12,0** |
|
ДО, мл |
1,00±0,05 |
1,13±0,06* |
1,17±0,04* |
1,00±0,08 |
1,36±0,07** |
1,40±0,07** |
|
ЧД, цикл/мин |
109,0±6,0 |
117,0±6,8 |
118,0±6,4 |
113,0±7,0 |
106,0±9,0 |
105,0±8,0 |
|
Vинс, мл/с |
3,70±0,27 |
4,40±0,12* |
4,50±0,19* |
3,80±0,55 |
4,20±0,36 |
4,30±0,40* |
Примечание. Различия по сравнению с исходными данными достоверны при: * – p<0,05; ** – p<0,01.
При возвратном дыхании по мере постепенного усиления гиперкапнической стимуляции наблюдалось увеличение дыхательного объема, минутного объема дыхания и средней скорости инспираторного потока (показателя центральной инспираторной активности) как до введения вещества, так и после его церебрального введения. Однако под действием ИЛ-1β угол наклона к оси абсцисс линий тренда, характеризующий зависимость между величиной регистрируемых параметров и степенью хеморецепторной стимуляции дыхания, изменялся.
На рис. 1 показаны линии тренда, отражающие зависимость между увеличением парциального давления СО2 в альвеолярном газе и увеличением минутного объема дыхания до и после интравентрикулярного и системного введения ИЛ-1β. После введения ИЛ-1β в цереброспинальную жидкость угол наклона вентиляторной кривой к оси абсцисс снижается, что свидетельствует об уменьшении вентиляторной чувствительности к гиперкапнии. Эти изменения наблюдаются через 20 мин, максимально выражены через 40 мин и исчезают к 90-й мин, линии тренда становятся параллельными (рис. 1а). Такие же изменения наблюдались при регистрации ДО и средней скорости инспираторного потока: наклон линий тренда, характеризующих зависимость ДО и скорости инспираторного потока от напряжения углекислого газа в артериальной крови, снижался после действия ИЛ-1β.
Внутривенное введение ИЛ-1β в кровеносное русло не оказывало достоверного влияния на компоненты вентиляторного гиперкапнического ответа, в отличие от повышения церебрального уровня цитокина. Угол наклона линий тренда, характеризующий зависимость МОД от интенсивности гиперкапнического стимула, практически не изменялся (рис. 1б).
Проведение количественных расчетов показало достоверное снижение величины прироста респираторных параметров в ответ на гиперкапническую стимуляцию на фоне действия ИЛ-1β при его центральном введении и отсутствие достоверных изменений этой величины при системном введении ИЛ-1β. Расчет величины прироста регистрируемых параметров при увеличении Р ЕТ CО 2 на 1 мм рт. ст. показал, что через 40 мин после интравентрикулярного введения интерлейкина прирост МОД уменьшался на 47 %, ДО и скорости инспираторного потока – на 40 % по сравнению с фоновыми величинами. При внутривенном введении статистически значимых различий в приростах вентиляторных параметров до и после действия ИЛ-1β обнаружено не было (рис. 2).
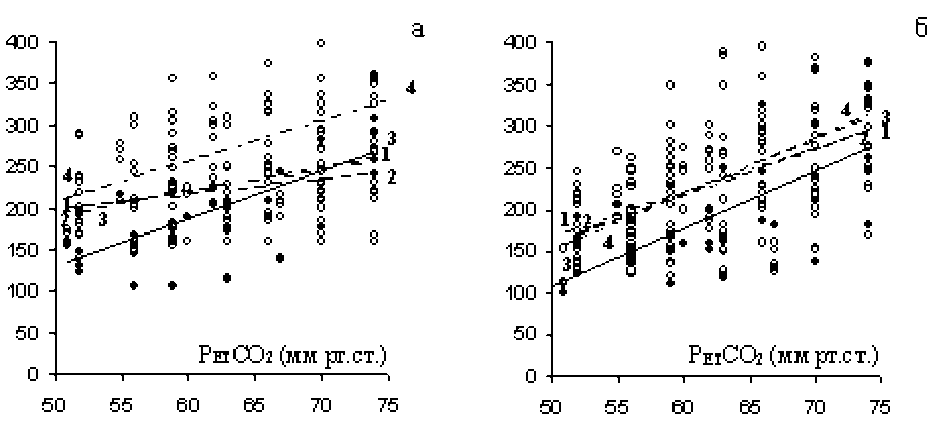
Рис. 1. Изменение МОД при возвратном дыхании гиперкапнической газовой смесью: а) при интравентрикулярном введении; б) при системном введении.
По оси ординат – минутный объем дыхания, мл/мин;
по оси абсцисс – парциальное давление СО2 в альвеолярном газе.
Сплошная линия – до введения ИЛ-1β, линии 1–1, 2–2, 3–3, 4–4 – через 20, 40, 60, 90 мин после введения ИЛ-1β соответственно
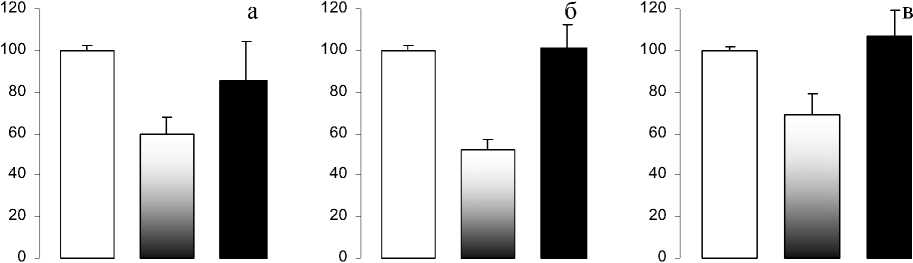
Рис. 2. Влияние ИЛ-1β на прирост респираторных параметров при увеличении РETCО2
в альвеолярном газе на 1 мм рт. ст.:
а) средней скорости инспираторного потока; б) минутной вентиляции; в) дыхательного объема.
Cветлые столбцы – до введения ИЛ-1β (фон), черно-белые столбцы – после церебрального введения ИЛ-1β, черные столбцы – после системного введения ИЛ-1β.
По оси ординат – изменение регистрируемых параметров в процентах по отношению к фону
Полученные данные свидетельствуют о снижении вентиляторной чувствительности к гиперкапнии при повышении содержания ИЛ-1β в цереброспинальной жидкости, что определяется влиянием этого цитокина на механизмы центральной хеморецепции, так как периферические хеморецепторы при дыхании использованной нами гиперкап-нически-гипероксической газовой смесью (7 % СО2, 60 % О2) не участвуют в формиро- вании вентиляторных ответов. Это вызвано тем, что большое содержание кислорода в данной дыхательной смеси резко снижает активность периферических хеморецепторов. Известно, что фоновая активность периферических хеморецепторов исчезает при напряжении кислорода в артериальной крови, равном уже 200 мм рт. ст. [12], тогда как в наших экспериментах напряжение кислорода превышало 400 мм рт. ст.
Обнаруженное снижение прироста средней скорости инспираторного потока при гиперкапнической стимуляции на фоне повышенного церебрального уровня ИЛ-1β указывает на ослабление реакции центральной инспираторной активности, что в свою очередь и вызывает снижение прироста ДО и МОД. Это еще раз подтверждает, что ослабление вентиляторной чувствительности к гиперкапнии было связано с влиянием ИЛ-1β на центральные механизмы, участвующие в хемо-рецепторной регуляции дыхания. Известно, что для формирования центральной инспираторной активности и ее динамики большое значение имеет интенсивность афферентного потока, поступающего от центральных хеморецепторов, локализованных в хемочувстви-тельных зонах вентральной поверхности ствола мозга, к нейронам дорсальной респираторной группы, расположенной в вентролатеральной области ядра одиночного тракта. Импульсы от хеморецепторов активируют расположенный здесь пул α-инспираторных нейронов.
Логично предположить, что обнаруженный нами респираторный эффект интерлейкина мог проявляться либо через его влияние непосредственно на центральные хеморецепторы, снижая их чувствительность к гиперкапническому стимулу, либо через модуляцию синаптического взаимодействия между инспираторными нейронами дыхательного центра. В результате и в том, и в другом случае гиперкапническая стимуляция вызывала меньшую, чем в обычных условиях, активацию α-инспираторных нейронов. Ослабление α-инспираторной активности в свою очередь снижало сократительную активность дыхательных мышц, что и уменьшало прирост дыхательного объема и вентиляции легких в ответ на увеличение гиперкапнической стимуляции.
Полученные нами данные об ингибирующем влиянии провоспалительного цитокина на вентиляторный гиперкапнический ответ косвенно подтверждаются исследованием, проведенным на мышах с мышечной дистрофией, которые имеют ослабленную вентиляторную реакцию на гиперкапнию по сравнению с нормальными мышами. У таких животных конкурентное устранение провос-палительного цитокина TNF-α (посредством удаления гена для TNF-α) значительно улучшает вентиляторный ответ на гиперкапнию, что указывает на угнетение этого ответа эндогенно продуцируемым TNF-α [18]. Авторы этой статьи связывают угнетение вентиляторного ответа с ухудшением сократимости мышечных волокон диафрагмы, вызванным повреждающим действием провоспалитель-ного цитокина. Наши данные позволяют предположить, что такой эффект мог быть вызван и центральным действием данного цитокина. Оно выражается в том, что эндогенно продуцируемый TNF-α, который является провоспалительным цитокином, очень близким к IL-1β, может угнетать ту часть центрального дыхательного механизма, которая ответственна за хеморецепторную регуляцию дыхания.
Заключение. Результаты данного исследования позволяют сделать выводы об участии основного провоспалительного цитокина ИЛ-1β в хеморецепторных механизмах регуляции дыхания. Ослабление вентиляторной чувствительности к гиперкапнии при повышении церебрального уровня ИЛ-1β свидетельствует о его ингибирующем влиянии либо на центральные хеморецепторы, либо на синаптические взаимодействия между нейронами дыхательного центра. Повышение уровня ИЛ-1β в кровеносном русле не оказывает влияния на гиперкапнический вентиляторный ответ, указывая на то, что гематоэнцефалический барьер препятствует проявлению центрального действия циркулирующих провоспалительных цитокинов.
-
1. Александрова Н. П. Влияние гамма-аминомасляной кислоты на инспираторно-тормозящий рефлекс Геринга–Брейера / Н. П. Александрова, В. Г. Александров, Т. Г. Иванова // Российский физиологический журн. им. И. М. Сеченова. – 2008. – Т. 94, № 12. – С. 1356–1364.
-
2. Александрова Н. П. Дыхательные мышцы человека: три уровня управления / Н. П. Александрова, И. С . Бреслав // Физиология человека. – 2009. – Т. 35, № 2. – С. 103–111.
-
3. Александрова Н. П. Цитокины и резистивное дыхание / Н. П. Александрова // Физиология человека. – 2012. – Т. 38, № 2. – С. 119.
-
4. Мюльберг А. А. Цитокины как медиаторы нейроиммунных взаимодействий / А. А. Мюль-берг, Е. В. Гришина // Успехи физиологических наук. – 2006. – Т. 37, № 1. – C. 18.
-
5. Филиппова Л. В. Интерорецепция и ней-роиммунные взаимодействия / Л. В. Филиппова, А. Д. Ноздрачев. – СПб. : Наука, 2007. – 295 с.
-
6. Brain cytokines and chemokines: roles in ischemic injury and pain / M. Minami [et al.] // J. Phar-
- maco7l. ScBir. a–in200d6is.t–ribVuotli.on100o. f– Pc.y4to6k1i.ne m RNA induced by systemic administration of interleukin-1beta or tumor necrosis factor alpha / L. Сhurchill [et al.]
-
// Bran Res. – 2006. – Vol. 1120, № 1. – P. 64.
-
8. Cafeteria feeding induces interleukin-1beta mRNA expression in rat liver and brain / M. K. Hansen [et al.] // Am. J. Physiol. – 1998. – Vol. 274, № 6 (pt. 2). – P. 1734–1739.
-
9. Characterization of chemokines and their receptors in the central nervous system: physiopathological impli-cations / A. Bajetto [et al.] // J. Neur-chem1.0–. 2C0y0t2o.k–inVesola.n8d2.d–iePt.ar1y31e1n.ergy restriction in stable chronic obstructive pulmonary disease patients / I. Godoy [et al.] // Eur. Respir. J. – 2003. – Vol. 22. – P. 920.
-
11. Does systemic inflammation trigger local exercise-induced oxidative stress in COPD? / C. Koech-lin [et al.] // Eur. Respir. J. – 2004. – Vol. 23. – P. 538.
-
12. Hayashi F. The ventilatory response to hypoxia in the anesthetized rat / F. Hayashi // Pflu-gers Arch. – 1983. – Vol. 396, № 2. – P. 121–127.
-
13. Nadeau S. Effect of circulation tumor necrosis factor on the neu-ronal activity and expression of the genes encoding the tumor necrosis factor (p55 and p75) in the rat brain: a view from the bloodbrain barrier / S. Nadeau, S. Rivest // Neuroscience. – 1999. – Vol. 93, № 4. – P. 1449.
-
14. Paxinos G. The rat brain in stereotaxic coordinates / G. Paxinos, C. Watson. – London : Academic Press, 1982.
-
15. Rebuck A. S. Measurement of ventilatory response to CO2 by rebreathing / A. S. Rebuck // Chest. – 1976. – Vol. 70 (suppl.). – P. 118–121.
-
16. Sleep apnoea and daytime sleepiness and fatigue: relation to visceral obesity, insulin resistance, and hyper-cytokinemia / A. N. Vgontzas [et al.] / J. Clin. Endocrinol. Metab. – 2000. – Vol. 85. – P. 1151.
-
17. Vassilakopoulos T. Ventilatory muscle activation and in-flammation: cytokines, reactive oxygen species, and nitric oxide / T. Vassilakopoulos, S. N. Husain // J. Appl. Physiol. – 2007. – Vol. 102. – P. 161887.–V16e9n5ti.latory dysfunction in mdx mice: impact of tumor necrosis factor-alpha deletion / L. E. Gosselin [et al.] // Muscle Nerve. – 2003. – Vol. 28. – P. 336–343.
THE CHANGE IN VENTILATORY RESPONSEON THE HYPERCAPNIA DURING EXOGENOUS INCREASEIN THE CEREBRAL LEVEL OF PRO-INFLAMMATORY CYTOKIN IL-1β
G.A. Danilova 1 , N.P. Aleksandrova 1 , V.G. Aleksandrov 2
-
1Pavlov Institute of Physiology RAS, St. Petersburg, 2Herzen State Pedagogical University of Russia, St. Petersburg
Список литературы Изменение вентиляторного ответа на гиперкапнию при экзогенном повышении уровня интерлейкина-1 бета в крови и цереброспинальной жидкости
- Александрова Н. П. Влияние гамма-аминомасляной кислоты на инспираторно-тормозящий рефлекс Геринга-Брейера/Н. П. Александрова, В. Г. Александров, Т. Г. Иванова//Российский физиологический журн. им. И. М. Сеченова. -2008. -Т. 94, № 12. -С. 1356-1364.
- Александрова Н. П. Дыхательные мышцы человека: три уровня управления/Н. П. Александрова, И. С. Бреслав//Физиология человека. -2009. -Т. 35, № 2. -С. 103-111.
- Александрова Н. П. Цитокины и резистивное дыхание/Н. П. Александрова//Физиология человека. -2012. -Т. 38, № 2. -С. 119.
- Мюльберг А. А. Цитокины как медиаторы нейроиммунных взаимодействий/А. А. Мюльберг, Е. В. Гришина//Успехи физиологических наук. -2006. -Т. 37, № 1. -C. 18.
- Филиппова Л. В. Интерорецепция и нейроиммунные взаимодействия/Л. В. Филиппова, А. Д. Ноздрачев. -СПб.: Наука, 2007. -295 с.
- Brain cytokines and chemokines: roles in ischemic injury and pain/M. Minami //J. Pharmacol. Sci. -2006. -Vol. 100. -P. 461.
- Brain distribution of cytokine m RNA induced by systemic administration of interleukin-1beta or tumor necrosis factor alpha/L. Сhurchill //Bran Res. -2006. -Vol. 1120, № 1. -P. 64.
- Cafeteria feeding induces interleukin-1beta mRNA expression in rat liver and brain/M. K. Hansen //Am. J. Physiol. -1998. -Vol. 274, № 6 (pt. 2). -P. 1734-1739.
- Characterization of chemokines and their receptors in the central nervous system: physiopathological impli-cations/A. Bajetto //J. Neurchem. -2002. -Vol. 82. -P. 1311.
- Cytokines and dietary energy restriction in stable chronic obstructive pulmonary disease patients/I. Godoy //Eur. Respir. J. -2003. -Vol. 22. -P. 920.
- Does systemic inflammation trigger local exercise-induced oxidative stress in COPD?/C. Koechlin //Eur. Respir. J. -2004. -Vol. 23. -P. 538.
- Hayashi F. The ventilatory response to hypoxia in the anesthetized rat/F. Hayashi//Pflugers Arch. -1983. -Vol. 396, № 2. -P. 121-127.
- Nadeau S. Effect of circulation tumor necrosis factor on the neu-ronal activity and expression of the genes encoding the tumor necrosis factor (p55 and p75) in the rat brain: a view from the blood-brain barrier/S. Nadeau, S. Rivest//Neuroscience. -1999. -Vol. 93, № 4. -P. 1449.
- Paxinos G. The rat brain in stereotaxic coordinates/G. Paxinos, C. Watson. -London: Academic Press, 1982.
- Rebuck A. S. Measurement of ventilatory response to CO2 by rebreathing/A. S. Rebuck//Chest. -1976. -Vol. 70 (suppl.). -P. 118-121.
- Sleep apnoea and daytime sleepiness and fatigue: relation to visceral obesity, insulin resistance, and hyper-cytokinemia/A. N. Vgontzas /J. Clin. Endocrinol. Metab. -2000. -Vol. 85. -P. 1151.
- Vassilakopoulos T. Ventilatory muscle activation and in-flammation: cytokines, reactive oxygen species, and nitric oxide/T. Vassilakopoulos, S. N. Husain//J. Appl. Physiol. -2007. -Vol. 102. -P. 1687-1695.
- Ventilatory dysfunction in mdx mice: impact of tumor necrosis factor-alpha deletion/L. E. Gosselin //Muscle Nerve. -2003. -Vol. 28. -P. 336-343.


