Изменение вентиляторного ответа на гиперкапнию в условиях липополисахаридной модели системного воспаления
Автор: Клинникова Анна Андреевна, Данилова Галина Анатольевна, Александрова Нина Павловна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Медико-биологические науки
Статья в выпуске: 4, 2016 года.
Бесплатный доступ
При системном воспалении возникают нарушения дыхания, такие как гипервентиляция, тахип-ноэ, апноэ, развитие гипоксических состояний, но хеморецепторные механизмы регуляции дыхания при системном воспалении и участие эндогенного увеличения уровня цитокинов в этих процессах практически не изучены. Цель. Исследовать влияние липополисахарида (ЛПС), вызывающего системную воспалительную реакцию, на динамику вентиляторного гиперкапнического ответа. Материалы и методы. Эксперименты проведены на 16 наркотизированных трахеостомирован-ных спонтанно дышащих гиперкапнически-гипероксической газовой смесью крысах-самцах линии Wistar. Липополисахарид вводили в бедренную вену в количестве 200 мкг. Проводили 4-минутные пробы с возвратным дыханием до введения ЛПС и каждые 20 мин после введения ЛПС на протяжении 1,5 ч. PECO2 регистрировали с помощью квадрупольного масс-спектрометра МС 7-100. Регистрировали пневмотахограмму, по которой измеряли объемно-временные параметры дыхания (максимальную скорость вдоха, длительность вдоха и выдоха, частоту дыхания, среднюю скорость инспираторного потока). Результаты. Установлено, что моделируемое липополисахаридом системное воспаление вызывает уменьшение хеморефлекторной чувствительности к гиперкапнической стимуляции: на фоне развития системной воспалительной реакции наблюдается снижение прироста минутного объема дыхания, дыхательного объема и средней скорости инспираторного потока в ответ на усиление гиперкапнического стимула. Респираторный эффект системного воспаления был наиболее выражен через 40 мин после введения ЛПС. Заключение. Полученные данные позволяют сделать вывод о том, что системное воспаление оказывает ингибирующее влияние на центральный хеморецепторный контроль дыхания.
Центральная хеморецепция, липополисахарид, гиперкапния
Короткий адрес: https://sciup.org/14113238
IDR: 14113238 | УДК: 612.217+612.285.1
Текст научной статьи Изменение вентиляторного ответа на гиперкапнию в условиях липополисахаридной модели системного воспаления
Введение.1Как известно, для системного воспаления среди прочих неспецифических симптомов общего тяжелого заболевания характерны серьезные нарушения функции дыхания. Они выражаются в эпизодах апноэ (остановка дыхания), тахипноэ, гипервентиляции, развитии гипоксических состояний. При этом практически не изучены рефлекторные механизмы регуляции дыхания в условиях системного воспаления. Лишь в последние годы стали появляться экспериментальные данные, подтверждающие гипотезу о негативном влиянии воспаления на кардиореспираторные ответы и, в частности, на гипоксический вентиляторный ответ [1, 2]. В наших предыдущих исследованиях было показано, что экзогенное увеличение системного или церебрального уровня основного провоспалительного цитокина ИЛ-1β ослабляет реакцию системы внешнего дыхания на изменение газового состава крови: наблюдается снижение вентиляторных ответов на гипоксию и гиперкапнию [3].
Цель исследования. Изучение влияния на хеморефлекторные механизмы регуляции дыхания бактериального липополисахарида (ЛПС), вызывающего мощную эндогенную индукцию провоспалительных цитокинов из клеток иммунной системы организма и инициирующего системную воспалительную реакцию [1, 4].
Для этого в экспериментах на наркотизированных крысах при помощи метода возвратного дыхания гиперкапнически-гиперо-ксической газовой смесью исследовалась динамика изменения вентиляторного ответа на гиперкапнию в условиях развития системной воспалительной реакции, вызванной внутривенным введением бактериального ЛПС.
Материалы и методы . Эксперименты проводились на 16 трахеостомированных спонтанно дышащих крысах-самцах линии Wistar, весом 250–300 г, наркотизированных внутрибрюшинным введением уретана из расчета 1400 мг/кг. Все эксперименты на животных были проведены с соблюдением основных норм и правил биомедицинской этики (European Community Council Directives 86/609/EEC).
В экспериментах применялась пневмота-хографическая методика для регистрации объемно-временных параметров внешнего дыхания. При помощи миниатюрной пнев-мометрической трубки MLT-1L (ADInsru-ments), обеспечивающей ламинарность воздушного потока, регистрировалась объемная скорость воздушного потока (пневмотахограмма). По пневмотахограмме измерялась максимальная скорость вдоха, длительность вдоха и выдоха, рассчитывалась частота дыхания. Для определения дыхательного объема производилось интегрирование пневмота-хографической кривой. Минутный объем дыхания рассчитывался как произведение величины дыхательного объема на количество дыхательных движений за одну минуту. Средняя скорость инспираторного потока (косвенный показатель центральной инспираторной активности) рассчитывалась как частное от деления величины дыхательного объема на продолжительность вдоха.
Системное воспаление моделировалось введением ЛПС, выделенного из микробных клеток сальмонеллы брюшного тифа (Sigma, ФНИЦЭМ им. Н.Ф. Гамалеи), в бедренную вену в количестве 200 мкг, растворенных в 2 мл физиологического раствора.
Вентиляторный ответ на гиперкапнию исследовался с помощью метода возвратного дыхания гиперкапнически-гипероксической (СО2 – 7 %, О2 – 60 %) газовой смесью. Вен- тиляторная чувствительность к гиперкапническому стимулу определялась с помощью построения кривых роста вентиляции при увеличении парциального давления углекислого газа в конечной порции выдыхаемого воздуха (PЕCO2). PЕCO2 измерялось при помощи квадрупольного масс-спектрометра МС 7-100 (ИАП РАН, Санкт-Петербург).
Продолжительность проведения пробы с возвратным дыханием составляла 4 мин. Пробы проводились до введения ЛПС и через каждые 20 мин после введения ЛПС в течение 1,5 ч. На протяжении всего эксперимента велась непрерывная регистрация ректальной температуры.
Статистическая обработка данных проводилась программными средствами с использованием Microsoft Excel. Вычислялась средняя величина регистрируемых параметров и стандартная ошибка. Достоверность результатов определялась посредством однофакторного дисперсионного анализа и непараметрического критерия Уайта. Вероятность различий при р<0,01 и p<0,05 считалась достоверной.
Результаты и обсуждение. Установлено, что при спокойном дыхании воздухом внутривенное введение указанного количества липополисахарида (200 мкг на животное) не вызывает достоверных изменений дыхательного объема (ДО), частоты дыхания (ЧД), минутного объема дыхания (МОД) и средней скорости инспираторного потока (Vинс) (табл. 1). Однако наблюдается хорошо выраженная тенденция к их увеличению на фоне действия ЛПС.
Анализ вентиляторного ответа на гиперкапнию показал существенное изменение чувствительности дыхательной системы к гиперкапнической стимуляции после введения ЛПС. Как и следовало ожидать, при возвратном дыхании гиперкапнически-гиперо-ксической газовой смесью (7 % СО2, 60 % О2) по мере роста парциального давления СО2 в крови наблюдалось увеличение средней скорости инспираторного потока, дыхательного объема и минутного объема дыхания как до введения липополисахарида, так и после его введения. Однако после введения ЛПС угол наклона линии тренда, усредняющей венти- ляторные кривые, зарегистрированные в нескольких экспериментах, достоверно уменьшался. Линии тренда становились более пологими, что свидетельствует о снижении вентиляторной чувствительности к гиперкапни- ческой стимуляции. Отмеченный респираторный эффект липополисахарида отчетливо проявлялся уже через 20 мин действия вещества и был выражен максимально через 40 мин после введения препарата (рис. 1)
Объемно-временные параметры до и после введения липополисахарида
Таблица 1
|
Параметр |
Системное введение липополисахарида (n=16) |
||
|
фон |
40 мин |
90 мин |
|
|
ДО, мл |
1,43±0,09 |
1,57±0,09 |
1,55±0,09 |
|
ЧДД, цикл/мин |
118,0±5,0 |
117,0±5,0 |
127,0±7,0 |
|
МОД, мл/мин |
166,4±10,5 |
185,2±16,4 |
192,1±10,6 |
|
Vинс, мл/с |
5,89±0,38 |
6,62±0,61 |
6,85±0,39 |
ДО,% по всем опытам
Y
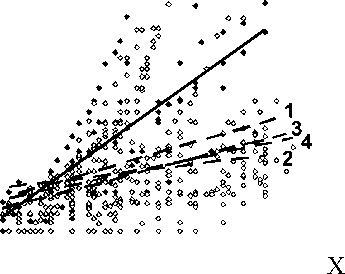
40 60 80 100
Рис. 1. Изменение ДО при возвратном дыхании гиперкапнически-гипероксической газовой смесью при системном введении липополисахарида.
По оси ординат: дыхательный объем, % от фонового значения.
По оси абсцисс: парциальное давление СО 2 в альвеолярном газе.
Сплошная линия – до введения ЛПС (фон), линии 1, 2, 3, 4 – 20, 40, 60, 90 мин после введения ЛПС соответственно
Проведение количественных расчетов показало достоверное снижение величины прироста МОД, ДО и среднего инспираторного потока в ответ на гиперкапническую стимуляцию на фоне действия ЛПС. После инъекции липополисахарида величина при- роста МОД при увеличении РЕСО2 на 1 мм рт. ст. снижалась на 32 %, дыхательного объема – на 46 % и средней скорости инспираторного потока на – 50 % по сравнению с фоновыми величинами (р<0,01) (рис. 2).
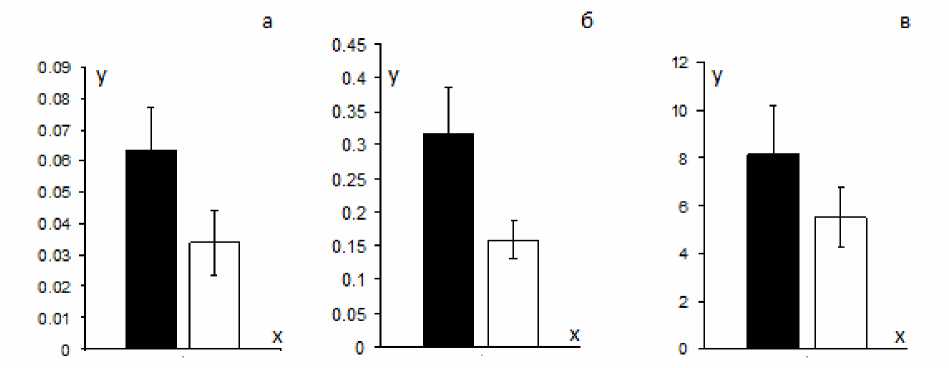
Рис. 2. Изменение прироста респираторных параметров при увеличении Р Е СО 2 в альвеолярном газе на 1 мм рт. ст. (slope):
а – дыхательного объема, б – средней скорости инспираторного потока, в – минутной вентиляции. Темные столбцы – до введения ЛПС (фон), светлые столбцы – после введения ЛПС.
По оси ординат: а – прирост ДО, мл/мм рт. ст., б – прирост среднего инспираторного потока, мл/с/мм рт. ст., в – прирост МОД, мл/мин/мм рт. ст.
Анализируя механизмы действия бактериального липополисахарида на систему внешнего дыхания, прежде всего следует иметь в виду, что ЛПС клеточной стенки грамотрицательных бактерий при попадании в системный кровоток вызывает усиленную продукцию многочисленных медиаторов воспаления (ИЛ-1β, ИЛ-6, фактор некроза опухоли (ФНО-α) и др.), каждый из которых может оказывать специфическое воздействие на изучаемые рефлекторные механизмы [1, 5]. Попадая в системный кровоток, ЛПС связывает липополисахарид-связывающий белок, переносящий ЛПС на рецепторы макрофагов, взаимодействие с которыми через ряд посредников вызывает активацию синтеза ядерного фактора каппа В (NFKB), который усиливает транскрипцию генов, отвечающих за синтез провоспалительных цитокинов – ФНО-α и ИЛ-1β. Однако, как известно, ЛПС одновременно увеличивает и серозный уровень ИЛ-10 – противовоспалительного цитокина, ингибирующего экспрессию перечисленных провоспалительных цитокинов [6]. Поэтому интенсивность и продолжительность действия ЛПС-индуцированного воспаления зависит от баланса между про- и противовоспалительными цитокинами. Таким образом, в данной работе исследуется действие на систему внешнего дыхания не какой-то определенной группы цитокинов, а общего, глобального воспалительного ответа.
Необходимо отметить и тот факт, что в нашем исследовании введение ЛПС, обладающего, как известно, пирогенным эффектом, не вызывало значительного подъема температуры тела. Ректальная температура не поднималась выше 38 °С. Отсутствие пирогенного эффекта, возможно, было связано с действием общей анестезии. В наших предыдущих исследованиях на наркотизированных крысах как с внутривенным, так и с церебральным введением ИЛ-1β также не наблюдалось существенного подъема ректальной температуры. Кроме того, известно, что у новорожденных в ответ на инфекционное заражение часто наблюдается не гипертермия, а гипотермия [7]. Отсутствие гипертермии позволяет нам при интерпретации полученных данных не принимать во внимание участие терморегуляторных механизмов в респираторных эффектах ЛПС.
В наших предыдущих работах было показано, что экзогенное увеличение церебрального уровня основного провоспалитель-ного цитокина ИЛ-1β оказывает такое же влияние на паттерн дыхания и вентиляторный ответ на гиперканию, как и введение
ЛПС в данном исследовании. ИЛ-1β оказывал небольшое активирующее действие на паттерн дыхания и значительно ослаблял вентиляторный ответ на гиперкапнию [8, 9]. Совпадает и динамика развития ответа на ИЛ-1β и ЛПС: максимальное ослабление вентиляторного ответа на гиперкапнию наблюдается через 40 мин после введения препаратов. Это позволяет предполагать, что респираторные эффекты воспаления определяются прежде всего действием эндогенно образующихся провоспалительных цитокинов.
Мы предполагаем, что обнаруженные нами респираторные эффекты воспаления, индуцированного действием ЛПС, связаны с его влиянием на центральные механизмы регуляции дыхания. Это предположение основано на способности цитокинов выполнять функцию медиаторов нейроиммунных взаимодействий в ЦНС. Участвуя в несинаптическом межклеточном взаимодействии, цитокины могут влиять на функциональное состояние нервных клеток и изменять работу различных нейронных сетей, в т.ч. и тех, которые контролируют функцию дыхания. Несмотря на то что цитокины являются крупными полипептидными молекулами, гематоэнцефалический барьер (ГЭБ) не препятствует проявлению центральных эффектов циркулирующих цитокинов. Это объясняется, во-первых, наличием в головном мозге цир-кумвентрикулярных областей, лишенных ГЭБ. В этих областях цитокины могут свободно проникать в ЦНС и оказывать свое действие на нервные клетки. Тем более что ГЭБ, как было недавно показано, практически отсутствует в каудально-медиальной области ядра одиночного тракта (NTS), т.е. там, где оканчиваются терминали афферентных волокон от каротидных хеморецепторов, механорецепторов легких и дыхательных путей [10]. Капилляры этой локальной области хорошо фенестрированы, что предоставляет цитокинам крови возможность прямого выхода в периваскулярное пространство и взаимодействия с нейронами NTS.
Кроме того, известно, что увеличение уровня циркулирующих периферических цитокинов усиливает синтез церебральных ци- токинов. Поэтому циркулирующие воспалительные медиаторы могут влиять на нейроны NTS непосредственно через локальный синтез соответствующих цитокинов в клетках головного мозга [11–13]. Так, например, установлено, что интраперитонеальное введение ИЛ-1β увеличивает уровень матричной РНК ИЛ-1β, ФНО-α и ИЛ-6 в ядре одиночного тракта, в гипоталамусе, гиппокампе, в соматосенсорной и инсулярной коре. К тому же при повышении уровня циркулирующих про-воспалительных цитокинов (ИЛ-6, ФНО-α и ИЛ-1β) происходит увеличение проницаемости ГЭБ, что делает возможным проникновение в ЦНС не только цитокинов, но и клеток, которые их продуцируют (макрофаги, моноциты, лимфоциты, нейтрофилы).
В основе центральных эффектов ИЛ-1β могут лежать и механизмы, связанные с индукцией посредников – вторичных мессенджеров, образование которых является результатом цитокин-рецепторного взаимодействия на клетках сосудистого эндотелия [14]. Роль таких посредников могут выполнять оксид азота (NO) и простагландины (РG). Они в большом количестве экспрессируются периваскулярными клетками и клетками церебрального эндотелия при активации имеющихся здесь цитокиновых рецепторов [15, 16]. Являясь небольшими растворимыми молекулами, РG и NO легко проникают через плазмолемму и гематоэнцефалический барьер. С их помощью цитокины могут влиять на функцию даже тех нейронов, которые не имеют цитокиновых рецепторов. Респираторные эффекты ИЛ-1β, опосредованные активацией циклооксигеназных и NO-зависимых путей, показаны нами в предыдущих исследованиях [9, 17, 18].
Заключение. Результаты проведенного исследования свидетельствуют о том, что внутривенное введение бактериального ЛПС оказывает влияние на систему внешнего дыхания. Наблюдается тенденция к изменению паттерна дыхания и значимое ослабление вентиляторного ответа на гиперкапническую стимуляцию. Полученные данные свидетельствуют о влиянии системного воспаления на рефлекторные механизмы регуляции дыхания.
Список литературы Изменение вентиляторного ответа на гиперкапнию в условиях липополисахаридной модели системного воспаления
- Fernandez R., Nardocci G., Simon F., Martin A., Becerra A., Rodriguez-Tirado C., Maisey K.R., Acuna-Castillo C., Cortes P.P. Lipopolysaccharide signaling in the carotid chemoreceptor pathway of rats with sepsis syndrome. Respiratory Physiology and Neurobiology. 2011; 175: 336-348.
- McDonald F.D., Chandrasekharan R., Wilson R.J.A., Hasan S.U. Cardiorespiratory control and cytokine profile in response to head stress, hypoxia, and lipopolysaccharid (LPS) exposure during early neonatal period. Physiological Reports. 2016; 4 (iss. 2), e12688: 1-13.
- Данилова Г.А., Александрова Н.П., Александров В.Г. Изменение вентиляторного ответа на гипер-капнию при экзогенном повышении уровня интерлейкина-1 бета в крови и цереброспинальной жидкости. Ульяновский медико-биологический журнал. 2015; 2: 118-124.
- Nardocci G., Martin A., Abarzua S., Rodriguez J., Simon F., Reyes E.P., Acuna-Castillo C., Navarro C., Cortes P.P., Fernandez R. Sepsis progression to multiple organ dysfunction in carotid chemo/barodenervated rats treated with lipopolysaccharide. J. Neuroimmunol. 2015; 278: 44-52.
- Yang Yi-Xin, Li Gui-Yuan. Progression of lipopolysaccharide signal pathway. J. Cent. South Univ. (Med Sci.). 2006; 31 (1): 141-145.
- Hedi H., Norbert G. 5-Lipoxygenase Pathway, Dendritic Cells, and Adaptive Immunity. J. Biomed. Biotechnol. 2004; 2004 (2): 99-105.
- Nofer J.R., van der Giet M., Tolle M., Wolinska I., von Wnuck Lipinski K., Baba H.A., Tietge U.J., Godecke A., Ishii I., Kleuser B., Schafers M., Fobker M., Zidek W., Assmann G., Chun J., Levkau B. HDL induces NO-dependent vasorelaxation via the lysophospholipid receptor S1P3. J. Clin. Invest. 2004; 113 (4): 569-581.
- Aleksandrova N.P., Danilova G.A. Effect of intracerebroventricular injection of interleukin-1-beta on the ventilatory response to hyperoxic hypercapnia. Eur. J. Med. Res. 2010; 15 (II): 1-4.
- Aleksandrova N.P., Danilova G.A., Aleksandrov V.G. Cyclooxygenase pathway in modulation of the ventilatory response to hypercapnia by interleukin-1p in rats. Respir. Physiol. Neurobiol. 2015; 209: 85-90.
- Gross P.M., Wall K.M., Pang J.J. et al. Microvascular specializations promoting rapid interstitial solute dispersion in nucleus tractus solitaries. Am. J. Physiol. Regul. Integr. Comp. Physiol. 1990; 259: 1131.
- Dantzer R., Konsman J.P., Bluthe R.M., Kelley K. W. Neural and humoral pathways of communication from the immune system to the brain: parallel or convergent? Auton. Neurosci. 2000; 85: 60.
- Gordon F.J. Effect of nucleus tractus solitarius lesions on fever produced by interleukin-1beta. Auton. Neurosci. 2000; 85: 102.
- Maier S.F., Goehler L.E., Fleshner M., Watkins L.R. The role of the vagus 142 nerve in cytokine-to-brain communication. Ann. NY Acad. Sci. 1998; 840: 289.
- Ericsson A., Liu C., Hart R.P., Sawchenko P.E. Type 1 interleukin-1 receptor in the rat brain: distribution, regulation, and relationship to sites of IL-1-induced cellular activation. J. Comp. Neurol. 1995; 361: 681-698.
- Nadeau S., Rivest S. Effect of circulation tumor necrosis factor on the neuronal activity and expression of the genes encoding the tumor necrosis factor (p55 and p75) in the rat brain: a view from the blood-brain barrier. Neuroscience. 1999; 93 (4): 1449.
- Wong M.L., Bongiorno P.B., Gold P. W., Licinio J. Localization of interleukin-1 beta converting enzyme mRNA in rat vasculature: evidence that the genes encoding the interleukin-1 system are constitutively expressed in brain blood vessels. Pathophisiological implications. Neuroimmunomodulation. 1995; 2 (3): 141.
- Александрова Н.П., Меркурьев В.А., Туманова Т.С., Александров В.Г. Механизмы модуляции рефлекторного контроля дыхания при повышении системного уровня провоспалительного цитокина интерлейкина-1р. Рос. физиол. журн. им. И.М. Сеченова. 2015; 101 (10): 1158-1168.
- Александров В.Г., Александрова Н.П., Туманова Т.С., Евсеева А.Д., Меркурьев В.А. Участие NO-ергических механизмов в реализации респираторных эффектов провоспалительного цитоки-на интерлейкина-1бета. Рос. физиол. журн. им. И.М. Сеченова. 2015; 101 (10): 1190-1198.


