Изменения активности процессов липопброксидации под влиянием экстракта очитка большого (Sedum maximum (L.) Hoffm.)
Автор: Пластун В.О., Комарова Е.Э., Дурнова Н.А., Афанасьева Г.А., Курчатова М.Н., Андреева Н.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Медико-биологические науки
Статья в выпуске: 2, 2015 года.
Бесплатный доступ
Изучено изменение активности процессов липопероксидации (ПОЛ) в сыворотке крови белых крыс под влиянием водного раствора спиртового экстракта очитка большого (Sedum maximum (L.) Hoffm., Crassulaceae) в концентрациях 100, 200 и 300 мг/кг на модели индуцированного окислительного стресса. Интенсивность процессов ПОЛ оценивали по содержанию в сыворотке крови животных МДА и ГПЛ, интенсивность аутоинтоксикации - по содержанию МСМ. Установлено, что экстракт в концентрации 200 мг/кг и выше обладает способностью снижать содержание промежуточных продуктов ПОЛ в сыворотке крови крыс, подвергшихся прооксидантному действию диоксидина.
Пол, растительные экстракты
Короткий адрес: https://sciup.org/147204722
IDR: 147204722 | УДК: 577.164.39+352.38
Текст научной статьи Изменения активности процессов липопброксидации под влиянием экстракта очитка большого (Sedum maximum (L.) Hoffm.)
Проблема оксидативного стресса и состояния активности процессов липопероксидации в норме и при различных формах патологии привлекает внимание многих специалистов [Бобырев, 1989; Заггщуллина. 2005; Гнусина, 2007]. В настоящее время нс вызывает сомнения тот факт, что активация процессов перекисного окисления липидов (ПОЛ) является типовым патологическим процессом, сопровождающим развитие различных патологических состояний, в частности, в этиологии и клинических проявлениях бактериальных инфекций и интоксикаций, неоплазий, эндокринных, сердечно-сосудистых, желудочно-кишечных и др. заболеваний [Афанасьева, Чеснокова, 2009].
В большинстве случаев исход развития патологии определяется не только особенностями происхождения, механизмами воздействия этиологических факторов, но и интенсивностью вторичных неспсцифичсских функциональных и метаболических сдвигов, развивающихся, зачастую, по сте-
(С Пластун В. О., Комарова Е. Э Урнова Н А.. Афанасьева Г. А., Курчатова М. Н.; Андреева Н. В., 2015
реотипным механизмам и в значительной мере потенцирующих действие патогенного агента. Поэтому актуальное значение приобретает проблема фармакологической коррекции свободно-радикальных процессов с использованием препаратов, оказывающих антиоксидантное и антигипоксант-ное действие.
Одним из перспективных направлений поиска новых средств патогенетической и симптоматической терапии заболеваний и патологических процессов является исследование возможностей эффективной регуляции процессов ПОЛ с помощью биологически активных соединений растительного происхождения. Преимуществами этих веществ ЯВЛЯЮТСЯ отсутствие токсических, побочных эффектов. «мягкое» воздействие на организм, что позволяет использовать их не только для коррекции патологических СДВИГОВ, НО и в целях профилактики развития заболеваний и осложнений.
Очиток большой VSedum maximum (L.) НоЛпт. Crassuiaceae) широко применяется в народной медицине. в том числе как тонизирующее и адапто-генное средство [Шнякина. Краснов, 1974: Барна) лов и др., 2001]. однако спектр действия его БАВ пока мало изучен. Имеются сведения о способности отвара близкородственного вида о. пурпурного (S. lelephium L.) ингибировать окислительные процессы in vitro [Барнаулов и др., 2001]. До настоящего момента в отечественной и зарубежной литературе отсутствуют сведения о влиянии биологически активных компонентов травы о.
большого на состояние активности процессов ли-попероксидации в условиях нормы и патологии.
Целью работы явилось установление возможностей влияния водного раствора спиртового экстракта травы очитка большого на активность свободнорадикального окисления липидов в экспериментальных условиях.
Материалы и методы исследования
Материалом для исследований являлась трава о. большого, собранная на территории Саратовской области в августе 2013 г. Спиртовые извлечения были получены методом двукратной экстракции 95%-ным этанолом, после чего упарены насухо. Спиртовые экстракты упаривали насухо, после чего растворяли сухой остаток в воде.
Исследования проводили в экспериментах in vivo на 54 беспородных белых крысах-самцах массой 180.0 ± 20.0 г, которые содержались в одинаковых условиях на стандартном пищевом рационе. Оксидативный стресс моделировали путем внутрибрюшинного введения экспериментальным животным 1%-ного раствора диоксидина (ДО) в дозе 100 мг/мл. ДО часто используется в экспериментах в качестве прооксиданта, поскольку индуцирует образование в организме свободных форм кислорода (Н2О2. Он-радикалов) [Дурнев и др,, 1989; Абдуллин и др., 2002; Празднова. 2013].
В эксперименте были использованы 9 групп но 6 крыс в каждой (таблица). Все животные содержались в стандартных условиях вивария.
Группы животных» использованных в эксперименте
|
№ группы |
Название группы |
Вводимые вещества и их концентрации, мг/кг |
|
1 |
Интактная |
|
|
2 |
Контроль 1 (позитивный) |
ДО 100 |
|
3 |
Контроль 2 (негативный) |
Вода юо |
|
4 |
Опытная 1 |
ДО 100; экстракт 100 |
|
5 |
Опытная 2 |
Экстракт 100 |
|
6 |
Опытная 3 |
ДО 100; экстракт 200 |
|
7 |
Опытная 4 |
Экстракт 200 |
|
8 |
Опытная 5 |
ДО 100; экстракт 300 |
|
9 |
Опытная 6 |
Экстракт 300 |
Все препараты вводились внутрибрюшинно один раз в день на протяжении 4 сут. На четвертые сутки через 1 ч. после введения растворов животных дскапитировали и отбирали кровь для анализа. Состояние активности процессов свободнорадикального окисления липидов оценивали по содержанию в сыворотке крови экспериментальных крыс промежуточных продуктов ПОЛ - гидроперекисей липидов (ГПЛ) и малонового диальдегида (МДА). Уровень ГПЛ и МДА определяли общепринятыми епскрофотометрическими методами на спектрофотометре «Shimadzu» СФ-UV 1800. Уро вень аутоинтоксикации определяли по содержанию в сыворотке крови молекул средней массы (МСМ) [Медицинские .... 2002].
Статистическую обработку проводили при помощи пакета программного обеспечения StatSoft Статистика 10.0. Достоверность полученных результатов оценивалась с использованием критерия Манна - Уитни, различия групп считались достоверными при уровне значимости р<0.05.
Результаты и их обсуждение
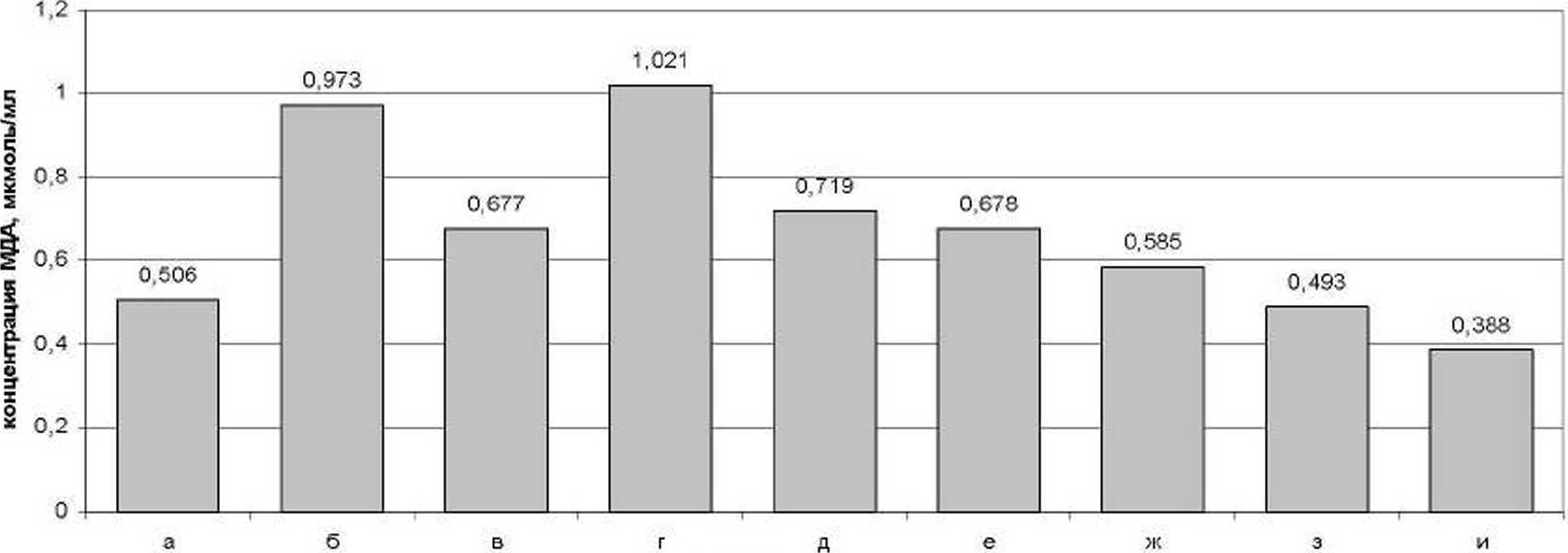
Как показали результаты проведенных иссле- дований, после внутрибрюшинного введения белым крысам 1%-ного раствора ДО на протяжении 4 сут. в дозе 100 мг/кг происходило повышение уровня МДА (рис. 1. б) в сыворотке крови на 90%.
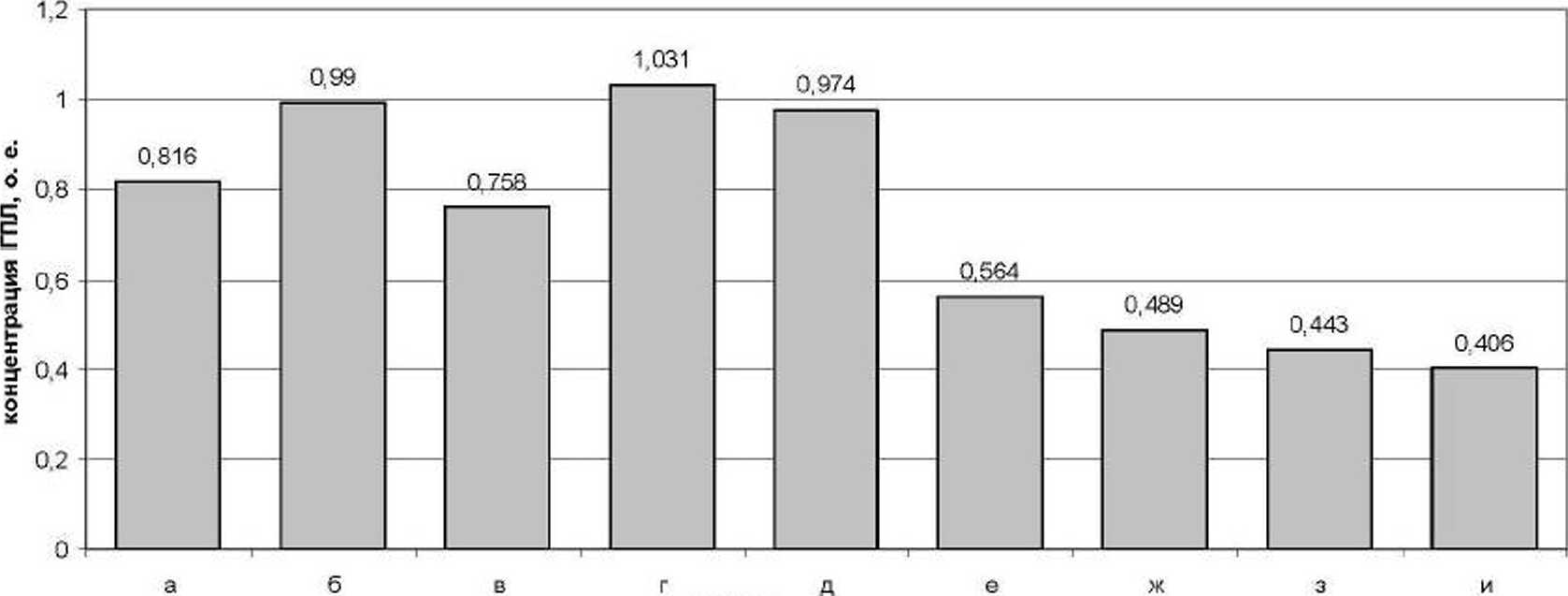
ГПЛ (рис. 2. б) на 20% раза (р<0.05) по сравнению с аналогичными показателями интактной группы животных (рис. 1. а: рис. 2. а) и группой негативного контроля (рис.1, в. рис.2, в).
группы
Рис. 1. Концентрация МДА в сыворотке крови экспериментальных белых крыс: а - интактная группа; б - контроль 1; в - контроль 2; г - опытная 1; д - опытная 2; е - опытная 3; ж -опытная 4; з - опытная 5; и - опытная 6
группы
Рис. 2. Концентрация ГПЛ в сыворотке крови экспериментальных белых крыс.
Обозначения такие же, как на рис. 1
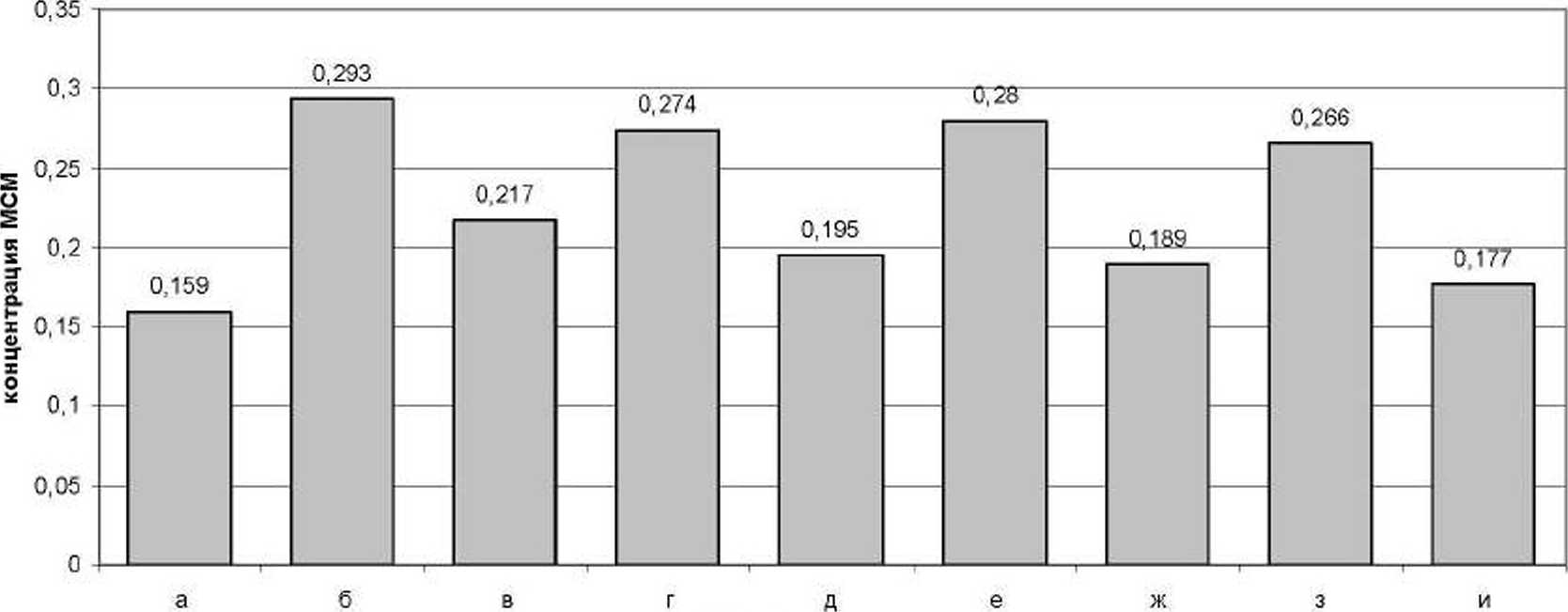
Накопление промежуточных продуктов липо-пероксидации на фоне введения диоксидина сочеталось с развитием выраженной эндогенной интоксикации белых крыс, что подтверждалось увеличением содержания в сыворотке крови МСМ (рис. 3. б) на 40% по сравнению с показателями животных, которым вводили эквивалентный объем воды (р<0.01) (рис. 3, в). Полученные результаты свидетельствовали об активации процессов липопсрок-сидации под влиянием ДО.
В последующих сериях экспериментов исследовали возможности биологически активных веществ водного раствора спиртового экстракта травы о. большого коррегировать прооксидантные эффекты ДО. Как оказалось, при сочетании введе ния на протяжении 4 сут. 1%-ного раствора ДО в дозе 100 мг/кг и последующего внутрибрюшинного введения водного раствора спиртового экстракта о. большого в дозе 200 мг/кг происходило значительное снижение уровня продуктов липоперок-сидации в сыворотке крови белых крыс: МДА на 40% (рис. 1, е). ГПЛ на 75% (р<0.01) (рис. 2, е). Фоновое введение экстракта о. большого в дозе 200 мг/кг вызывало незначительное повышение уровня этих веществ в сыворотке экспериментальных животных (рис. 1. ж; рис. 2, ж) в сравнении с интактной группой и было сопоставимо с их уровнем у группы негативного контроля.
Уровень эндогенной интоксикации у экспериментальных животных, оиенивемый по содержа- нию МСМ в сыворотке крови, при использовании этой концентрации экстракта о. большого сохранялся на том же уровне, что и у животных контрольных групп. Отличие количества МСМ как в о. большого в сочетании с ДО. от позитивного контроля. так и у группы животных, получавших только экстракт от негативного контроля, было не значимо (р>0.05: рис. 3, е. ж).
сыворотке крови животных, получавших экстракт
группы
Рис. 3. Концентрация МСМ в сыворотке крови экспериментальных белых крыс.
Обозначения такие же, как на рис. 1
Далее была изучена зависимость протекторных эффектов водного раствора спиртового экстракта травы о. большого от величины используемой дозы растительного препарата. Для этого провели сравнительную оценку содержания промежуточных продуктов липопероксидации (ГПЛ, МДА) и интегративного показателя аутоинтоксикации -МСМ в крови белых крыс при использовании экстракта о. большого в дозах 100 мг/кг и 300 мг/ кг.
Полученные результаты свидетельствовали об отсутствии протекторного эффекта препарата при использовании его в дозе 100 мг/кг. что подтверждалось сохранением высокого содержания МДА (рис. 1, г, д) и ГПЛ (рис.2, г, д) в сыворотке крови животных, сопоставимого с таковым в группе позитивного контроля.
В серии экспериментов с сочетанным введением ДО с экстрактом о. большого в дозе 300 мг/кг отмечалось снижение уровня обоих продуктов липопероксидации не только по сравнению с соответствующими показателями группы животных, которым вводился только ДО. но и с показателями белых крыс, получавших ДО в сочетании с экстрактом травы о. большого в дозе 200 мг/кг.
Уровень эндогенной интоксикации в сыворотке крови экспериментальных животных одинаков во всех группах, которым вводили ДО в сочетании с экстрактом, независимо от его концентрации, и значимо не отличается от группы позитивного контроля (р<0.05). В группах, получавших только экстракт о. большого в различных концентрациях, эндогенная интоксикация сохраняется на уровне негативного контроля дтя концентраций 100 и 200
мг/мл (р<0.05). При введении исследуемого экстракта в концентрации 300 мг/мл количество МСМ в сыворотке крови экспериментальных животных снижается относительно позитивного контроля на 20% (р<0.05) и становится сопоставимо с количеством МСМ у интактной группы. В целом, уровень эндогенной интоксикации, оцениваемый по концентрации МСМ в сыворотке крови экспериментальных животных, слабо коррелирует с концентрацией вводимых веществ и интенсивностью протекающих процессов ПОЛ.
Заключение
Установлено, что водный раствор спиртового экстракта о. большого обладает способностью снижать содержание промежуточных продуктов ПОЛ (МДА и ГПЛ) в сыворотке крови крыс, подвергшихся прооксидантному действию ДО. Способность компонентов экстракта подавлять интенсивность процессов липопероксидации в условиях патологии носит дозозависимый характер и проявляется при использовании экстракта о. большого в дозе 200 мг/кг и более. В связи с этим является перспективным более детальное изучение его антиоксидантных свойств по другим маркерам окси-дативного стресса.
Список литературы Изменения активности процессов липопброксидации под влиянием экстракта очитка большого (Sedum maximum (L.) Hoffm.)
- Абдуллин И.Ф. и др. Экспрессная оценка антиоксидантной активности растительного сырья//Тез. докл. II Всерос. конф. «Химия и технология растительных веществ». Казань, 2002. С. 77-78.
- Азнабаева Ю.Г., Каспранский Р.Р., Фархутдинов Р.Р. Антиоксидантные свойства чайных напитков фирмы «Травы Башкирии»//Эфферентная терапия. 2001. Т. 7, № 2. С. 52-56
- Афанасьева Г.А., Чеснокова Н.П. О патогенетической значимости активации процессов липопероксидации в механизмах нарушения реологических свойств крови при экспериментальной чумной интоксикации, индуцируемой фракцией FII вакцинного штамма EV Y.pestis//Вестник Российской академии медицинских наук. 2009. № 2. С. 14-18
- Барнаулов О.Д. и др. Сравнительная оценка антиоксидантной активности (АОА) водных извлечений из растений.//Материалы Х конф. «Нейроиммунология». СПб, 2001. Т. 2. С. 223297
- Бобырев В.Н. Антиоксиданты в клинической практике//Терапевтический архив. 1989. № 3. С. 122-125
- Гнусина С.В. Перекисное окисление липидов и антиоксидантная система у больных сахарным диабетом I типа разного возраста: автореф. дис.... канд. мед. наук. Иркутск, 2007. 21 с
- Дурнев А.Д. и др. Роль свободных радикалов кислорода в механизме мутагенного действия фотрина и диоксидина//Химико-фармацевтический журнал. 1989. Т. 23, № 11. С. 1289-1291
- Загидуллина А.И. Патогенетическое значение процессов перекисного окисления липидов, антиоксидантной защиты и системы гемостаза, коррекция их нарушений методом озонотерапии при роже: автореф. дис.... канд. мед. наук. СПб., 2005. 24 с
- Колесова В.Г. и др. Антиоксидантная терапия растениями//Эфферентная терапия. 1996. Т. 2, № 1. С. 67-70
- Медицинские лабораторные технологии: справочник/под ред проф. А.И. Карпищенко. СПб.: Интермедика, 2002. 600 с
- Празднова Е.В. Оценка биологической активности антиоксидантов на основе анализа экспрессии стресс-индуцибельных бактериальных оперонов: автореф. дис.. канд. биол. наук. Ростов н/Д, 2013. 24 с
- Шнякина Г.П., Краснов Е.А. О фитохимической и медико-биологической изученности видов рода Sedum L.//Растительные ресурсы. 1974. Т. 10, вып. 1. С. 130-135


