Изменения клеточного состава крови у необлучённых и облучённых мышей при их контакте на межорганизменном уровне
Автор: Когарко И.Н., Петушкова В.В., Когарко Б.С., Нейфах Е.А., Ктиторова О.В., Ганеев И.И., Кузьмина Н.С., Селиванова Е.И.
Рубрика: Научные статьи
Статья в выпуске: 4 т.32, 2023 года.
Бесплатный доступ
В последнее время увеличился интерес к результатам воздействия ионизирующего излучения на процессы в организме необлучённых животных, контактирующих с облучёнными («эффект свидетеля» и «эффект спасения»). В исследовании, проведённом на беспородных мышах-самках, получены данные, свидетельствующие о присутствии этих эффектов на межорганизменном уровне. В эксперименте облучённые (3 Гр) и необлучённые животные помещались в клетках совместно. Эффект регистрировали в субпопуляции кроветворных клеток периферической крови по сравнению с контрольными животными как облучёнными, так и необлучёнными, размещёнными в отдельных клетках. «Эффект свидетеля» наблюдался на субпопуляции моноцитов на 3, 7 и 60 сут, а также нейтрофилов на 7 и 90 сут. «Эффект спасения» отмечался у облучённых животных: на 30 сут регистрировалось повышение числа эозинофилов в 5,8 раза (t=2,85; p=0,01), на 60 сут - в 1,6 раза и на 90 сут - в 3 раза (t=2,28; p=0,04). В популяции нейтрофилов данный эффект менее выражен и присутствует в большей мере как тенденция к повышению их числа на 14 и 30 сут. При изучении «эффекта спасения» на субпопуляции моноцитов у облучённых мышей замечено повышение показателя в 5,7 раза (t=2,94; p=0,01) на 30 сут и на 90 сут в 7,3 раза (t=2,41; p=0,03). Полученные в исследовании данные показывают, что «эффект свидетеля» и «эффект спасения» наблюдается во всех названных субпопуляциях клеток крови, но каждая из популяций реагирует индивидуально. Эти результаты подтверждают существование «эффекта свидетеля» и «эффекта спасения» на межорганизменном уровне. Однако следует отметить, что их выраженность и направленность существенно зависят от временного интервала после облучения, вида контакта животных (тактильный или обонятельный), а также анализируемой клеточной субпопуляции.
Ионизирующее излучение, «немишенные эффекты», структурно- функциональные нарушения генома, радиационно-индуцированный «эффект свидетеля», радиационно-индуцированный «эффект спасения», нейтрофилы, эозинофилы, моноциты
Короткий адрес: https://sciup.org/170201864
IDR: 170201864 | УДК: 591.111.1:577.346:599.323.4 | DOI: 10.21870/0131-3878-2023-32-4-147-161
Текст научной статьи Изменения клеточного состава крови у необлучённых и облучённых мышей при их контакте на межорганизменном уровне
В настоящее время показано, что повреждение клеток при непосредственном воздействии ионизирующего излучения, в первую очередь, выражается индукцией двунитевых разрывов ДНК, а также структурно-функциональными нарушениями макромолекул и мембран за счёт действия свободных радикалов [1]. В облучённых клетках активируется транскрипция ряда генов, большинство из которых участвуют в восстановлении ДНК и регуляции апоптоза [2]. Так называемые «немишенные эффекты» ионизирующего излучения (ИИ), включая «эффекты свидетеля» изучались in vitro и in vivo [3, 4]. Основные пути, участвующие в реализации «немишенных эффектов» радиации («эффект свидетеля», «нестабильность генома», «адаптивные реакции»), сопряжены с передачей сигналов апоптоза, опосредованной TLR (toll-like receptor) и NLR (nucleotide-binding oligomerization domain-like receptor) рецепторами [1].
Когарко И.Н. – зав. гр., вед. науч. сотр., д.м.н.; Петушкова В.В .* – вед. спец., к.э.н.; Когарко Б.С. – ст. науч. сотр., к.ф.-м.н.; Нейфах Е.А. – науч. сотр., к.б.н.; Ктиторова О.В. – науч. сотр., к.б.н.; Ганеев И.И. – инж.-исслед. ФГБУН ФИЦ ХФ РАН. Кузьмина Н.С. – вед. науч. сотр., д.б.н. ФГБУН ФИЦ ХФ РАН, ФГБУН ИОГен РАН. Селиванова Е.И. – ст. науч. сотр., к.б.н. ФГБУН ФИЦ ХФ РАН, МРНЦ им. А.Ф. Цыба – филиал «НМИЦ радиологии» Минздрава России.
Ранее считалось, что «эффект свидетеля» может быть реализован в пределах одной системы или органа. Однако, недавно было показано, что «эффект свидетеля» имеет место не только в клеточных культурах или in vivo в одном организме, но и индуцируется при межорганизменном взаимодействии. Организм, подвергшийся радиационному воздействию, может индуцировать изменения у необлучённого организма. Эффект был выявлен у беспозвоночных - Daphnia magna [4], у высших позвоночных животных: у рыб [5, 6] и крыс [7]. Это явление получило название «межорганизменные радиационные эффекты свидетеля» [4]. Кроме того, наблюдения за «эффектом свидетеля» показали, что клетки, непосредственно не подвергавшиеся воздействию ИИ, могут иметь повреждения, аналогичные возникающим в облучённых клетках. Одним из проявлений таких негативных последствий может являться нестабильность генома, которая проявляется генными мутациями, хромосомными аберрациями, потерей генетического контроля, что приводит к структурно-функциональному дисбалансу клеток, тканей, органов.
Цель настоящего исследования заключалась в изучении «немишенных эффектов» радиации, проявляющихся в изменениях клеточного состава крови и индуцирующихся у облучённых и необлу-чённых животных при их тактильном и обонятельном контакте (межорганизменный уровень).
Материалы и методы
Исследование проводили на 60 белых беспородных мышах, сток CD1. Животные были получены из ЦКП «Центр генетических ресурсов лабораторных животных», сформированный на базе ЦКП SPF-виварий ИЦиГ СО РАН (г. Новосибирск). В экспериментах использовали половозрелых самок в возрасте 2,5 мес., массой 23-26 г к началу эксперимента. Животные проходили карантин в виварии экспериментального отдела ФГБУН УНПЦ РМ ФМБА России в течение 2-х недель. Мышей содержали в стандартных условиях вивария конвенционального типа при искусственном освещении. Животные получали полнорационный гранулированный корм и питьевую воду ad libitum. В качестве подстила для животных использовали таковой для разведения и содержания лабораторных животных (производитель – ИП Филонич, г. Новосибирск), представляющий из себя кубические гранулы или круглые частицы из обработанной древесины (лиственные породы) размером не менее 2 мм и не более 4 мм (фракция № 3). Подстил изготавливался по ТУ 5313-001-0084157135-2015. Замену подстила проводили 1 раз в неделю.
Группы формировали методом сплошной выборки. Мышей после формирования экспериментальных групп и проведения процедуры индивидуального мечения до начала эксперимента содержали в отдельных клетках по 10 животных в 1 клетке в течение 7 сут до эксперимента. При проведении экспериментальных процедур соблюдались соответствующие международные правила работы с животными [8, 9]. Животные (n=20) были облучены в дозе 3 Гр на исследовательской гамма-установке радиобиологической ИГУР-1М с 4 источниками 137Cs, мощность дозы 0,79 Гр/мин, неравномерность γ-поля в рабочем пространстве не более 5%. Поглощённая доза для мышей составила 3,0 Гр.
Непосредственно после облучения (в течение 3-5 мин) интактных мышей посадили в клетки с облучёнными мышами (со свежим подстилом). Мыши были рассажены в четыре клетки, в каждой из которых находилось по 5 облучённых мышей и по 5 необлучённых (мыши-«свиде-тели», n=20). В двух из четырёх клеток облучённые и необлучённые мыши могли свободно контактировать друг с другом. В двух других клетках мыши облучённой и необлучённой групп были разделены металлической сеткой, что исключало их тактильный контакт. Были использованы также группа биологического контроля (необлучённые животные, n=10) и группа облучённого контроля (облучённые животные, n=10), каждая из которых содержалась в отдельной клетке. Клетки были расположены на одном стеллаже на расстоянии 0,5 м друг от друга. Представлены данные трёхмесячного эксперимента с 6 группами животных.
Для решения поставленных задач был проведён анализ клеточного состава периферической крови. Кровь из хвостовой вены отбирали на 3, 7, 14, 30, 60, 90 сут после начала эксперимента. Готовили мазки крови для определения состава периферической крови, их фиксировали метанолом в течение 3 мин, высушивали, окрашивали по Романовскому-Гимзе. Препараты для анализа кодировали. Кодированные препараты анализировали с помощью микроскопов Axio Scop. A1 и Axio Image. M2 (Ziess): оценивали процентное содержание моноцитов, нейтрофилов, эозинофилов среди всех ядросодержащих клеток крови – лейкоцитов.
Для расчёта средних значений и сравнения средних значений в каждой группе принимали количество животных, равное 10, без учёта содержания их в двух разных клетках. Статистический анализ проводили с помощью t-критерия Стьюдента. Различия принимали статистически значимыми при вероятности 0-гипотезы р<0,05. Для сравнительного анализа полученных данных выделили следующие воздействующие факторы: гамма-облучение; срок после начала эксперимента; «фактор контакта» – вид контакта между облучёнными и необлучёнными животным. Для статистического анализа использовали пакет R (The R Project for Statistical Computing, .
Результаты
В результате проведённых исследований по оценке относительного количества эозинофилов в периферической крови были получены следующие результаты (рис. 1, 2; табл. 1). У необ-лучённых мышей-«свидетелей», содержавшихся с облучёнными мышами как в клетках с перегородкой, так и без перегородки, отмечается повышение процентного содержания эозинофилов на 3, 14, 30, 60 и 90 сут. При этом наиболее выраженные (статистически значимые) эффекты были следующие. У неэкспонированных животных-«свидетелей» рассматриваемый показатель зарегистрирован повышенным на 3, 14 и 30 сут (соответственно 1,8, 2,5, 3,8% против 0,4, 0,5, 0,8% в необлучённом контроле, р=0,00005, р=0,004, р=0,00002; клетка без перегородки), на 14 и 90 сут (соответственно 2,2 и 3,1% против 0,5 и 1,4% в необлучённом контроле, р=0,0008 и р=0,02; клетка с перегородкой) (рис. 1, табл. 1).
У облучённых мышей наблюдалось значимое повышение относительного количества эозинофилов периферической крови лишь на 14 сут после экспонирования (1,4% против 0,5% в контроле, р=0,02) (табл. 1). В то же время у облучённых мышей-«свидетелей» (клетка с перегородкой) на 30 и 90 сут отмечается существенное повышение этого показателя (в 5,8 и 3 раза относительно облучённого контроля, р=0,01 и р=0,04 соответственно). В группе облучённых животных, содержавшихся без перегородки, на 60 сут отмечается тенденция к повышению уровня эозинофилов (2,2% против 1,0% в облучённом контроле, р=0,07) (рис. 2, табл. 1). Таким образом, у облучённых мышей, находящихся в контакте с необлучёнными животными (клетки как без перегородки, так и с перегородкой), в определённое время отмечается повышение числа эозинофилов. Полученные данные позволяют полагать, что фактор контакта приводит к повышению выработки числа эозинофилов в организме этих особей по сравнению с облучённым контролем. Предполагается, что данный эффект можно охарактеризовать как «эффект спасения».
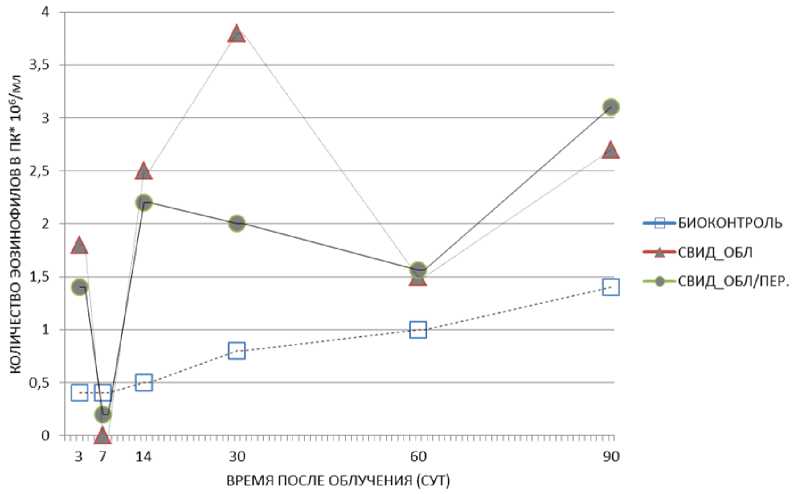
Рис. 1. Изменение относительного количества эозинофилов в периферической крови животных необлучённых групп: биологический контроль, необлучённые мыши-«свидетели», содержавшиеся с облучёнными мышами в клетках без перегородки, необлучённые мыши-«свидетели», содержавшиеся с облучёнными мышами в клетках с перегородкой в различные сроки после радиационного воздействия. Представлены средние значения показателя в группе.
Таблица 1
Относительное количество эозинофилов в периферической крови животных в различных экспериментальных группах через разное время после начала эксперимента, %
|
Время после начала экспери-мента, сут |
Биологический контроль |
Необлучённые свидетели |
Необлучённые свидетели (перегородка) |
Гамма-контроль |
Облучённые в одной клетке с необлучёнными свидетелями |
Облучённые в одной клетке с необлучёнными свидетелями (перегородка) |
|
3 |
0,4±0,22 |
1,8±0,14 t1=5,33; p=0,00005 |
1,4±0,43 t1=2,08; p=0,05 |
0,9±0,23 t1=1,56; p=0,14 |
1,3±0,52 t1=1,6; p=0,13 t2=0,7; p=0,49 |
0,4±0,22 t1=0; p=1 t2=1,56; p=0,14 |
|
7 |
0,4±0,22 |
0 t1=1,81; p=0,09 |
0,2±0,2 t1=0,67; p=0,51 |
0 t1=1,81; p=0,09 |
0 t1=1,81; p=0,09 - |
0 t1=1,81; p=0,09 - |
|
14 |
0,5±0,22 |
2,5±0,56 t1=3,3; p=0,004 |
2,2±0,36 t1=4,02; p=0,0008 |
1,4±0,27 t1=2,59; p=0,02 |
1,4±0,22 t1=2,86; p=0,01 t2=0; p=1 |
0,9±0,35 t1=0,97; p=0,34 t2=1,14; p=0,27 |
|
30 |
0,8±0,2 |
3,8±0,49 t1=5,67; p=0,00002 |
2±0,61 t1=1,88; p=0,08 |
1,3±0,21 t1=1,71; p=0,1 |
1,7±0,47 t1=1,75; p=0,1 t2=0,77; p=0,45 |
7,6±2,2 t1=3,08; p=0,01 t2=2,85; p=0,01 |
|
60 |
1±0,26 |
1,5±0,22 t1=1,46; p=0,16 |
1,56±0,32 t1=1,35; p=0,19 |
1,4±0,22 t1=1,18; p=0,25 |
2,2±0,36 t1=2,71; p=0,01 t2=1,9; p=0,07 |
1,3±0,37 t1=0,67; p=0,51 t2=0,23; p=0,82 |
|
90 |
1,4±0,22 |
2,7±0,83 t1=1,51; p=0,15 |
3,1±0,66 t1=2,45; p=0,02 |
1,2±0,25 t1=0,6; p=0,56 |
0,5±0,22 t1=2,86; p=0,01 t2=2,09; p=0,05 |
3,6±1,02 t1=2,1; p=0,05 t2=2,28; p=0,04 |
Примечание: t1 – значение t-критерия Стьюдента при сравнении с показателем в группе биологического контроля; t2 – значение t-критерия Стьюдента при сравнении со значением показателя в группе гамма-контроля; р – уровень значимости.
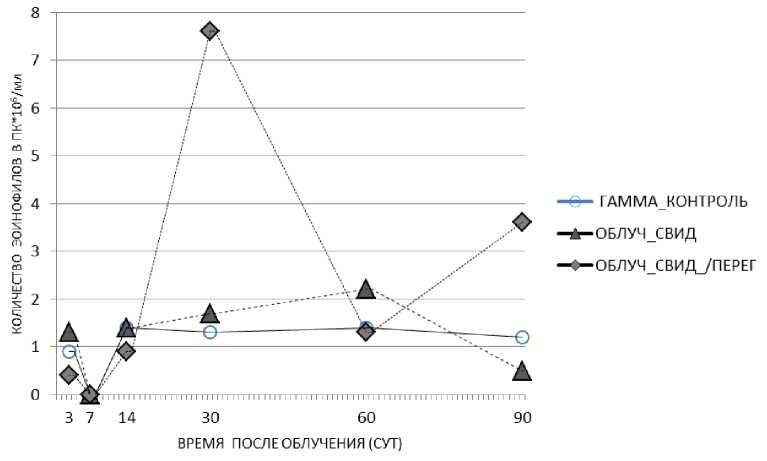
Рис. 2. Изменение относительного количества эозинофилов в периферической крови животных облучённых групп: облучённый контроль, облучённые мыши, содержавшиеся с необлучёнными мышами в клетках без перегородки, облучённые мыши, содержавшиеся с необлучёнными мышами в клетках с перегородкой в различные сроки после радиационного воздействия. Представлены средние значения показателя в группе.
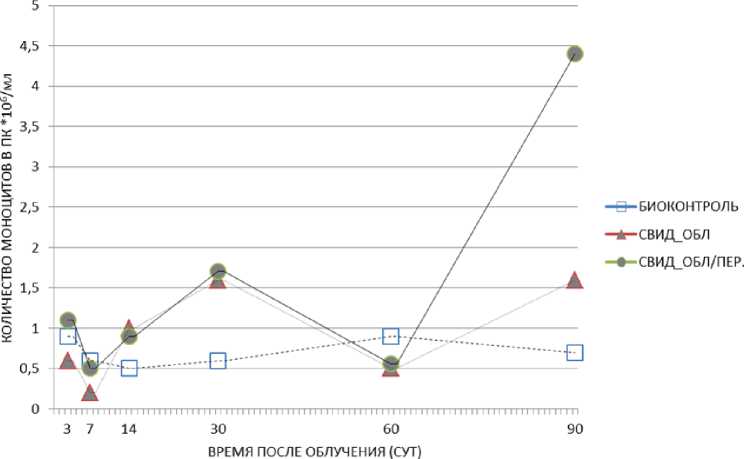
Рис. 3. Изменение относительного количества моноцитов в периферической крови животных необлучённых групп: биоконтроль, необлучённые мыши-«свидетели», содержавшиеся с облучёнными мышами без перегородки, необлучённые мыши-«свидетели», содержавшиеся с облучёнными мышами в клетках с перегородкой в различные сроки после радиационного воздействия. Представлены средние значения показателя в группе.
В результате проведённых исследований по оценке относительного количества моноцитов в периферической крови были получены следующие результаты (рис. 3, 4; табл. 2). У необлучён-ных мышей-«свидетелей» наблюдалась явная тенденция к повышению рассматриваемого показателя на 90 сут (1,6% против 0,7% в необлучённом контроле, р=0,05; клетка без перегородки) и на 30 и 90 сут (соответственно 1,7 и 4,4% против 0,6 и 0,7% в необлучённом контроле, р=0,04 и р=0,05; клетка с перегородкой) (рис. 3; табл. 2). Этот результат предполагает наличие «эффекта свидетеля».
Таблица 2
Относительное количество моноцитов в периферической крови животных в различных экспериментальных группах через разное время после начала эксперимента, %
|
Время после начала экспери-мента, сут |
Биологический контроль |
Необлучённые свидетели |
Необлучённые свидетели (перегородка) |
Гамма-контроль |
Облучённые в одной клетке с необлучёнными свидетелями |
Облучённые в одной клетке с необлучёнными свидетелями (перегородка) |
|
3 |
0,9±0,28 |
0,6±0,28 t1=0,76; p=0,46 |
1,1±0,23 t1=0,55; p=0,59 |
0,4±0,22 t1=1,41; p=0,18 |
1,8±0,55 t1=1,45; p=0,16 t2=2,35; p=0,03 |
0,3±0,21 t1=1,72; p=0,1 t2=0,33; p=0,75 |
|
7 |
0,6±0,27 |
0,2±0,13 t1=1,34; p=0,2 |
0,5±0,22 t1=0,29; p=0,78 |
0,3±0,21 t1=0,88; p=0,39 |
0,8±0,29 t1=0,51; p=0,62 t2=1,39; p=0,18 |
0,7±0,26 t1=0,27; p=0,79 t2=1,19; p=0,25 |
|
14 |
0,5±0,22 |
1±0,3 t1=1,34; p=0,2 |
0,9±0,23 t1=1,24; p=0,23 |
0,3±0,15 t1=0,74; p=0,47 |
1,2±0,36 t1=1,66; p=0,11 t2=2,31; p=0,03 |
0,3±0,15 t1=0,74; p=0,47 t2=0; p=1 |
|
30 |
0,6±0,22 |
1,6±0,54 t1=1,71; p=0,1 |
1,71±0,44 t1=2,28; p=0,04 |
0,9±0,23 t1=0,93; p=0,36 |
0,8±0,25 t1=0,6; p=0,56 t2=0,29; p=0,78 |
5,2±1,44 t1=3,15; p=0,01 t2=2,94; p=0,01 |
|
60 |
0,9±0,28 |
0,5±0,22 t1=1,12; p=0,28 |
0,56±0,23 t1=0,96; p=0,35 |
0,7±0,15 t1=0,63; p=0,54 |
0,5±0,22 t1=1,12; p=0,28 t2=0,74; p=0,47 |
0,5±0,17 t1=1,24; p=0,23 t2=0,88; p=0,39 |
|
90 |
0,7±0,21 |
1,6±0,37 t1=2,1; p=0,05 |
4,4±1,77 t1=2,08; p=0,05 |
0,7±0,21 t1=0; p=1 |
0,8±0,25 t1=0,3; p=0,77 t2=0,3; p=0,77 |
5,1±1,81 t1=2,41; p=0,03 t2=2,41; p=0,03 |
Примечание: t1 – значение t-критерия Стьюдента при сравнении с показателем в группе биологического контроля; t2 – значение t-критерия Стьюдента при сравнении со значением показателя в группе гамма-контроля; р – уровень значимости.
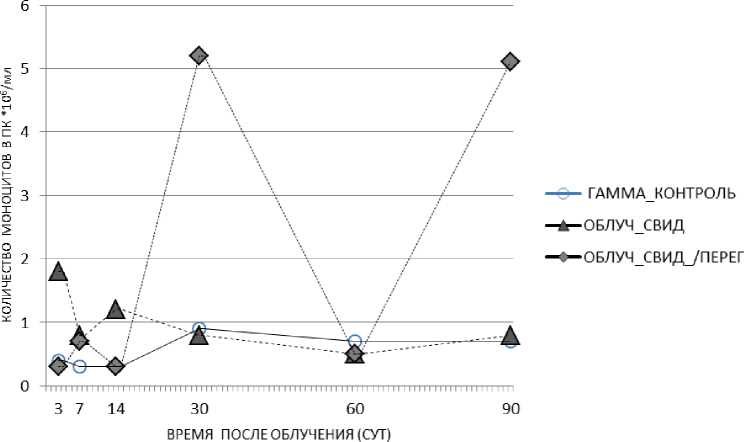
Рис. 4. Изменение относительного количества моноцитов в периферической крови животных облучённых групп: облучённый контроль, облучённые мыши, содержавшиеся с необлучёнными мышами в клетках без перегородки, облучённые мыши, содержавшиеся с необлучёнными в клетках с перегородкой в различные сроки после радиационного воздействия. Представлены средние значения показателя в группе.
Результат исследования относительного количества моноцитов в крови мышей при совместном содержании облучённых и необлучённых животных заключался в следующем (табл. 2). У облучённых животных, содержавшихся совместно с необлучёнными мышами, процентное содержание моноцитов в крови характеризовалось повышением по сравнению с группой экспонированного контроля на 3 и 14 сут (соответственно 1,8 и 1,2% против 0,4 и 0,3%, р=0,03 и р=0,03; клетка без перегородки). На 30 и 90 сут отмечался наиболее выраженный эффект возрастания рассматриваемого показателя – почти в 6 раз (соответственно 5,2 и 5,1% против 0,9 и 0,7% в облучённом контроле, р=0,01 и р=0,03; клетка с перегородкой) (рис. 4). Этот эффект может рассматриваться как «эффект спасения».
Также показано, что относительное количество моноцитов в группе биологического контроля за весь период анализа находилось в пределах от 0,5 до 0,9% в периферической крови. При проведении многофакторного анализа было выявлено значимое влияние «фактора времени» после начала эксперимента (F=16,59; p=0,000058) и «Фактора контакта» (F=10,09; p=0,000055). Доля моноцитов увеличивалась на 0,01% в день. При содержании облучённых и необлучённых мышей-«свидетелей» в одной клетке с перегородкой вызывало в среднем повышение доли моноцитов в периферической крови на 1,2%.
В результате проведённых исследований по оценке относительного количества нейтрофилов в периферической крови были получены следующие результаты (рис. 5, 6; табл. 3). У мышей-«свидетелей», находящихся совместно с облучёнными животными (клетка с перегородкой), на 3 сут наблюдается тенденция к повышению числа нейтрофилов (при сравнении с необлучённым контролем р=0,11) (рис. 5; табл. 3). Совместное содержание экспонированных и неэкспонированных мышей приводило к значимому возрастанию относительного количества нейтрофилов в крови необлучённых животных: на 30 сут (25,7% против 19% в необлучённом контроле, р=0,04; клетка с перегородкой) и 60 сут (22% против 17,2% в необлучённом контроле, р=0,02; клетка без перегородки) (рис. 5, табл. 3). Предполагается, что это может быть «эффект свидетеля».
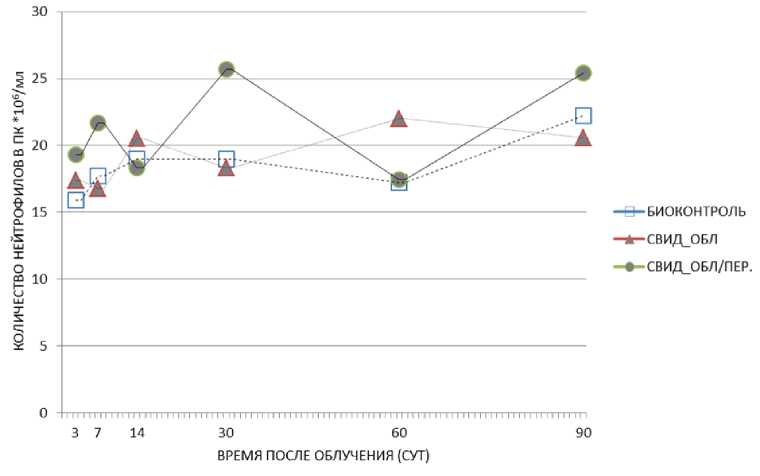
Рис. 5. Изменение относительного количества нейтрофилов в периферической крови животных необлучённых групп: биоконтроль, необлучённые мыши-«свидетели», содержавшиеся с облучёнными мышами в клетках без перегородки, необлучённые мыши-«свидетели», содержавшиеся с облучёнными мышами с перегородкой в различные сроки после радиационного воздействия. Представлены средние значения показателя в группе.
Таблица 3
Относительное количество нейтрофилов в периферической крови животных в различных экспериментальных группах через разное время после начала эксперимента, %
|
Время после начала экспери-мента, сут |
Биологический контроль |
Необлучённые свидетели |
Необлучённые свидетели (перегородка) |
Гамма-контроль |
Облучённые в одной клетке с необлучёнными свидетелями |
Облучённые в одной клетке с необлучёнными свидетелями (перегородка) |
|
3 |
15,9±1,4 |
17,4±2,44 t1=0,53; p=0,6 |
19,3±1,45 t1=1,69; p=0,11 |
19,5±1,66 t1=1,66; p=0,11 |
19,7±2,46 t1=1,34; p=0,2 t2= 0,07; p=0,94 |
14,7±1,11 t1=0,67; p=0,51 t2=2,4; p=0,03 |
|
7 |
17,7±2,73 |
16,8±0,9 t1=0,31; p=0,76 |
21,7±1,53 t1=1,28; p=0,22 |
26±2,14 t1=2,39; p=0,03 |
18,6±0,75 t1=0,32; p=0,75 t2=3,26; p=0,004 |
30±2,23 t1=3,49; p=2,6×10-3 t2=1,29; p=0,21 |
|
14 |
19±1,41 |
20,5±1,97 t1=0,62; p=0,54 |
18,3±1,12 t1=0,39; p=0,7 |
14,7±0,72 t1=2,73; p=0,01 |
21,7±2,41 t1=0,97; p=0,34 t2=2,78; p=0,012 |
12,1±0,71 t1=4,38; p=4×10-4 t2=2,59; p=0,019 |
|
30 |
19±0,98 |
18,3±1,74 t1=0,35; p=0,73 |
25,71±2,84 t1=2,23; p=0,04 |
16±0,82 t1=2,36; p=0,03 |
23,7±2,01 t1=2,1; p=0,05 t2=3,55; p=0,002 |
21,7±1,66 t1=1,4; p=0,18 t2=3,08; p=6,5×10-3 |
|
60 |
17,2±1,66 |
22±0,89 t1=2,55; p=0,02 |
17,44±1,31 t1=0,12; p=0,91 |
19,8±0,99 t1=1,35; p=0,19 |
11,4±1,14 t1=2,88; p=0,01 t2=5,58; p=3×10-5 |
15,3±1,79 t1=0,78; p=0,45 t2=2,2; p=0,041 |
|
90 |
22,2±1,06 |
20,6±3,05 t1=0,5; p=0,62 |
25,4±3,36 t1=0,91; p=0,37 |
20,1±1,06 t1=1,4; p=0,18 |
19,9±1,97 t1=1,03; p=0,32 t2=0,09; p=0,93 |
19,3±1,16 t1=1,85; p=0,08 t2=0,51; p=0,616 |
Примечание: t1 – значение t-критерия Стьюдента при сравнении с показателем в группе биологического контроля; t2 – значение t-критерия Стьюдента при сравнении со значением показателя в группе гамма-контроля; р – уровень значимости.
На 90 сут после начала эксперимента у необлучённых мышей-«свидетелей» наблюдается восстановление рассматриваемого показателя до уровня такового в контроле. Оценка процентного содержания нейтрофилов в крови показала разнонаправленные эффекты радиационного воздействия, наблюдаемые у облучённых мышей в разные временные интервалы после начала эксперимента: на 7 сут в группе облучённых животных наблюдалось возрастание рассматриваемого показателя (26% против 17,7% в необлучённом контроле, р=0,03) с последующим его значимым снижением на 14 и 30 сут (соответственно 14,7 и 16% против 19 и 19% в необлучённом контроле, р=0,01 и р=0,03) (табл. 3).
Результат совместного содержания экспонированных и неэкспонированных мышей заключался в следующем. У облучённых мышей выявлена нормализация изменённых в результате радиационного воздействия показателей, то есть приближение их к таковым в соответствующем необлучённом контроле. Так, у облучённых животных в клетке без перегородки на 7, 14 и 30 сут рассматриваемый показатель составил 18,6, 21,7, 23,7% против 26, 14,7, 16% в облучённой группе сравнения (р=0,004, р=0,012, р=0,002 соответственно) при 17,7, 19 и 19% в необлучённом контроле соответственно (рис. 6, табл. 3). Аналогичные закономерности выявлены и у облучённых мышей в клетке с перегородкой на 30 сут, при этом наблюдалось снижение относительного количества нейтрофилов на 14 сут (12,1% против 14,7% в облучённом контроле, р=0,019 при 19% в необлучённом контроле). В то же время у облучённых мышей, находящихся совместно с необ-лучёнными особями, на 60 сут происходит снижение рассматриваемого показателя (11,4 и 15,3% в клетке с перегородкой и без перегородки соответственно против 19,8% в облучённом контроле: р=0,00003 и р=0,041 соответственно при 17,2% в необлучённом контроле) с его нормализацией к 90 сут (рис. 6, табл. 3).
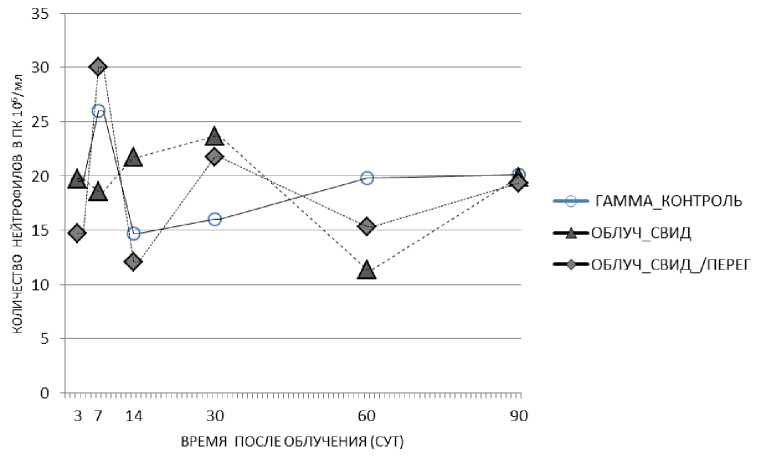
Рис. 6. Изменение относительного количества нейтрофилов в периферической крови животных облучённых групп: облучённый контроль, облучённые мыши, содержавшиеся с необлучёнными мышами в клетках без перегородки, облучённые мыши, содержавшиеся с необлучёнными в клетках с перегородкой в различные сроки после радиационного воздействия. Представлены средние значения показателя в группе.
Как у мышей группы облучённого контроля, так и у экспонированных мышей, содержавшихся совместно с необлучёнными животными-«свидетелями», на 90 сут после начала эксперимента рассматриваемый показатель не отличался от такового в группе необлучённого контроля (рис. 6, табл. 3). Другими словами, наблюдается восстановление индуцированных изменений у облучённых мышей всех групп.
Обсуждение
Итак, воздействие ИИ приводит к значимым эффектам в нарушении формулы крови как у облучённых, так и у необлучённых мышей, находящихся совместно. По нашим данным, за время постановки эксперимента процентное содержание эозинофилов в периферической крови необ-лучённых мышей (биологический контроль) находилось в диапазоне от 0,4 до 1,4%, моноцитов от 0,5 до 0,9% и нейтрофилов от 16 до 22%. Однако у необлучённых мышей-«свидетелей» при их совместном содержании с облучёнными животными в те или иные временные интервалы после начала эксперимента выявлены изменения в процентном содержании лейкоцитов различных видов. Отмечается явная тенденция к повышению процентного содержания моноцитов на 90 сут (клетка без перегородки) и значимые эффекты возрастания количества этих клеток крови на 30 и 90 сут (клетка с перегородкой). У неэкспонированных животных-«свидетелей» оказалось также повышенным относительное количество эозинофилов на 3, 14 и 30 сут (клетка без перегородки), на 14 и 90 сут (клетка с перегородкой). Совместное содержание экспонированных и неэкспонированных мышей приводило также к возрастанию относительного количества нейтрофилов в крови необлучённых животных: на 30 сут (клетка с перегородкой) и 60 сут (клетка без перегородки). Это явление вероятно следует рассматривать как «эффект свидетеля».
Изменения лейкоцитарной формулы крови выявлены не только у необлучённых мышей-«свидетелей», но и у содержавшихся в одной клетке с ними облучённых особей. Так, у облучённых мышей (клетка с перегородкой) на 30 и 90 сут отмечается существенное повышение относительного количества эозинофилов по сравнению с группой облучённого контроля. У экспонированных животных, контактирующих с необлучёнными мышами-«свидетелями», процентное содержание моноцитов в крови характеризовалось повышением по сравнению с группой экспонированного контроля на 3 и 14 сут (клетка без перегородки), а на 30 и 90 сут отмечался эффект многократного возрастания рассматриваемого показателя (клетка с перегородкой). Если говорить о нейтрофилах крови, с одной стороны, у облучённых мышей, содержавшихся с необлучён-ными особями-«свидетелями», наблюдается нормализация изменённых в результате радиационного воздействия показателей, то есть приближение их к таковым в соответствующем необлу-чённом контроле на 7, 14 и 30 сут (клетка без перегородки). Аналогичные закономерности выявлены и у облучённых мышей в клетке с перегородкой на 30 сут. С другой стороны, у экспонированных мышей, контактировавших с необлучёнными мышами-«свидетелями», наблюдается снижение относительного количества нейтрофилов на 14 сут (клетка с перегородкой) и на 60 сут (клетка с перегородкой и без перегородки) по сравнению с мышами группы облучённого контроля.
Таким образом, если говорить об эффектах, имеющих место у облучённых мышей, контактировавших с необлучёнными, вероятно речь идёт об «эффекте спасения». Однако, мы видим разные его проявления. С одной стороны, совместное содержание облучённых и необлучённых особей приводит к снижению негативных эффектов радиационного воздействия у экспонированных мышей, получивших «сигналы» от необлучённых животных-«свидетелей». Об этом свидетельствуют полученные нами данные по нейтрофилам, ассоциированные с определёнными экспериментальными «точками» (7-30 сут после начала эксперимента). С другой стороны, при анализе процентного содержания гранулоцитов (нейтрофилы, эозинофилы) и агранулоцитов (моноциты), в те или иные интервалы времени после облучения мы наблюдаем «усугубление» эффектов» у облучённых мышей в результате контакта с необлучёнными животными-«свидетелями» (получение «негативных сигналов» от необлучённых свидетелей). Этот факт, на наш взгляд, заслуживает особого внимания, так как в мировой литературе уже появились работы, к сожалению, выполненные только на культурах клеток, свидетельствующие о существовании не только «положительных», но и «отрицательных» эффектов влияния со стороны необлучённых свидетелей. Однако, следует отметить, что на настоящий момент нет экспериментальных доказательств того, что эти два противоположных эффекта являются просто различными проявлениями одного и того же феномена («эффект спасения»). Тем не менее, рассматриваемые изменения наблюдаются у облучённых клеток в результате их контакта с необлучёнными [10-13].
В результате наших недавних исследований [14] было выявлено, что такие же изменения, то есть индукция «эффекта свидетеля» и «эффекта спасения» происходят в лейкоцитах и лимфоцитах у содержащихся совместно необлучённых и облучённых животных. Аналогичные результаты были получены в работе [15] при исследовании костного мозга, тимуса и селезёнки мышей на 90 сут, следовательно, идёт комплекс изменений в кроветворной системе мышей-«сви-детелей», которые не были облучены, но содержались с облучёнными животными. Другие изменения при радиационных «эффектах свидетеля» и «эффектах спасения» показаны в работах авторов [16-20].
По данным литературы [5-7] результаты, предполагающие наличие «эффекта свидетеля», показывают, что в необлучённых клетках могут возникать изменения, аналогичные изменениям в облучённых клетках при радиационном воздействии. Наиболее важными ранними изменениями в этих клетках являются хромосомные аберрации, которые представляют собой фазу инициации «немишенных эффектов». Геномная нестабильность, которая приводит к потере генетического контроля, также является пострадиационным «немишенным эффектом». Особенно интересны работы по индуцированным изменениям в экспрессии генов, которые наблюдаются даже при действии радиации в очень низких дозах [2].
В другой работе [1] были определены гены, которые сопряжены с реакцией генома на повреждение ДНК и путей её репарации. Были созданы схемы взаимодействия между индуцированными белками, нарушения функционирования которых были сопряжены с «эффектом свидетеля». Авторы считают, что сигнальные пути апоптоза, ассоциированные с TLR-подобными и NLR-подобными рецепторами могут являться основными путями, которые участвуют в «немишенных эффектах». Предлагается биофизическая гипотеза регуляции «немишенных эффектов», основанная на повреждениях ДНК и градиентах апоптоза между облучёнными (точка облучения) и необлучёнными клетками, находящимися на различных расстояниях друг от друга, которые соответствуют «эффекту свидетеля» (5 мм) или «удалённым эффектам» (5 см) [1].
По литературным данным предполагается наличие нескольких возможных механизмов передачи радиационных нарушений при межорганизменном контакте: 1) непосредственный контакт и передача повреждающих факторов; 2) выделение соединений, вызывающих изменения у не-облучённых животных на расстоянии [16, 21]; 3) действие внеклеточной ДНК [22]; 4) действие биофотонов [6, 7] и др.
На основании приведённых в данной работе результатов показано, что межорганизменное взаимодействие действительно может приводить к определённым эффектам, возникающим при тактильном и обонятельном контактах животных, находящихся в одной клетке как без перегородки, так и с перегородкой. Эти эффекты можно характеризовать как «эффект свидетеля», так и «эффект спасения». Предполагается, что взаимодействие необлучённых животных с облучёнными приводит к индукции как неблагоприятных, так и положительных эффектов. Данная работа является одной из первых по изучению воздействия радиационного излучения на межорганизменном уровне. Полученные данные являются важным этапом в изучении «немишенных эффектов», в частности, «эффекта свидетеля» и «эффекта спасения» на организменном уровне.
Список литературы Изменения клеточного состава крови у необлучённых и облучённых мышей при их контакте на межорганизменном уровне
- Nikitaki Z., Mavragani I.V., Laskaratou D.A., Gika V., Moskvin V.P., Theofilatos K., Vougas K., Stewart R.D., Georgakilas A.G. Systemic mechanisms and effects of ionizing radiation: a new 'old' paradigm of how the bystanders and distant can become the players //Semin. Cancer Biol. 2016. V. 37-38, P. 77-95.
- Feng R.T., Weng K.L. Molecular mechanisms of low dose ionizing radiation-induced hormesis, adaptive responses, radioresistance, bystander effects, and genomic instability //Int. J. Radiat. Biol. 2015. V. 91, N 1. P. 13-27.
- Matsumoto H., Takahashi A., Ohnishi T. Radiation-induced adaptive responses and bystander effects //Biol. Sci. Space. 2004.V. 18, N 4. P. 247-254.
- Reis P., Lourenço J., Carvalho F.P., Oliveira J., Malta M., Mendo S., Pereira R. RIBE at an inter-organismic level: a study on genotoxic effects in Daphnia magna exposed to waterborne uranium and a uranium mine effluent //Aquat. Toxicol. 2018. V. 198. P. 206-214.
- Mothersill C., Smith R.W., Saroya R., Denbeigh J., Rowe B., Banevicius L., Timmins R., Moccia R., Seymour C.B. Irradiation of rainbow trout at early life stages results in legacy effects in adults //Int. J. Radiat. Biol. 2010. V. 86, N 10. P. 817-828.
- Mothersill C., Smith R., Wang J., Rusin A., Fernandez-Palomo C., Fazzari J., Seymour C. Biological entanglement-like effect after communication of fish prior to X-ray exposure //Dose Response. 2018. V. 16, N 1. P. 1559325817750067. DOI: 10.1177/1559325817750067.
- Richard S., Wang J., Seymour C., Fernandez-Palomo C., Fazzari J., Schültke E., Bräuer-Krisch E., Laissue J., Schroll C., Mothersill C. Homogenous and microbeam X-ray radiation induces proteomic changes in the brains of irradiated rats and in the brains of nonirradiated cage mate rats //Dose Response. 2018. V. 16, N 1. P. 1559325817750068. DOI: 10.1177/1559325817750068.
- Директива 2010/63/EU Европейского парламента и совета европейского союза по охране животных, используемых в научных целях. СПб.: Rus-LASA, 2012.
- Европейская конвенция о защите позвоночных животных, используемых для экспериментов или в иных научных целях. Страсбург, 1986. [Электронный ресурс]. URL: https://rm.coe.int/168007a6a8 (дата обращения 15.05.2023).
- Yu K.N. Radiation-induced rescue effect //J. Radiat. Res. 2019. V. 60, N 2. Р. 163-170.
- Chen S., Zhao Y., Han W., Chiu S.K., Zhu L., Wu L., Yu K.N. Rescue effects in radiobiology: unirradiated bystander cells assist irradiated cells through intercellular signal feedback //Mutat. Res. 2011. V. 706, N 1-2. P. 59-64.
- Fu J., Yuan D., Xiao L., Tu W., Dong C., Liu W., Shao C. The crosstalk between -irradiated Beas-2B cells and its bystander U937 cells through MAPK and NF-κB signaling pathways //Mutat. Res. 2016. V. 783. P. 1-8.
- Fu J., Wang J., Wang X., Wang P., Xu J., Zhou C., Bai Y., Shao C. Signaling factors and pathways of -particle irradiation induced bilateral bystander responses between Beas-2B and U937 cells //Mutat. Res. 2016. V. 789. P.1-8.
- Когарко И.Н., Петушкова В.В., Когарко Б.С., Пряхин Е.А., Нейфах Е.А., Ктиторова О.В., Андреев С.С., Ганеев И.И., Кузьмина Н.С., Селиванова Е.И., Пелевина И.И. Исследование действия ионизирующего излучения на радиационно-индуцируемые изменения клеток системы крови мышей на уровне организма //Радиация и риск. 2023. Т. 32, № 1. С. 48-60.
- Пелевина И.И., Когарко И.Н., Пряхин Е.А., Петушкова В.В., Когарко Б.С., Нейфах Е.А., Андреев С.С., Ктиторова О.В., Ганеев И.И. Изучение состояния системы крови при контакте необлучённых особей с животными, подвергшимися воздействию радиации //Радиационная биология. Радиоэкология. 2022. Т. 62, № 5. C. 477-483.
- Петушкова В.В., Пелевина И.И., Когарко И.Н., Нейфах Е.А., Когарко Б.С., Ктиторова О.В. Некоторые аспекты трансляции радиационно-индуцированных изменений при радиационном «эффекте сви-детеля» //Радиационная биология. Радиоэкология. 2020. Т. 60, № 3. С. 229-238.
- Пелевина И.И., Аклеев А.В., Когарко И.Н., Петушкова В.В., Когарко Б.С., Пряхин Е.А., Нейфах Е.А., Ктиторова О.В., Андреев С.С. Радиационно-химическое воздействие ионизирующего излучения на организм и генотоксические нарушения системы крови //Химическая физика. 2021. Т. 40, № 12. C. 48-55.
- Petushkova V.V., Pelevina I.I., Kogarko I.N., Neyfakh Е.А., Kogarko B.S., Ktitorova O.V. Radiation-induced inter-organism bystander effects. Some aspects of the transmission //Biol. Bull. 2020. V. 47, N 12. P. 1610-1617.
- Когарко И.Н., Петушкова В.В., Когарко Б.С., Пряхин Е.А., Нейфах Е.А., Ктиторова О.В., Андреев С.С., Ганеев И.И., Кузьмина Н.С., Селиванова Е.И. Исследование роли контактного воздействия облучённого животного на необлучённое при действии радиации //Ежегодная XXVII конференция ФИЦ ХФ отдела ХИМБИО: тезисы докладов. М., 2022. С. 77-86.
- Андреев С.С., Алдибекова А.Е., Когарко И.Н., Петушкова В.В., Аклеев А.В. Новые данные о межорганизменном эффекте свидетеля у мышей //VIII Съезд по радиационным исследованиям: тезисы докладов. Дубна, 2021. С. 83.
- Суринов Б.П., Духова Н.Н., Исаева В.Г. Изменение иммуномодулирующих и аттрактивных свойств летучих выделений мышей после радиационного воздействия или индукция «эффекта свидетеля» //Радиационная биология. Радиоэкология. 2021. Т. 61, № 1. С. 5-13.
- Ермаков А.В., Конькова М.С., Костюк С.В., Вейко Н.Н. ДНК-сигнальный путь, обеспечивающий развитие радиационного эффекта свидетеля в клетках человека //Радиационная биология. Радиоэкология. 2011. Т. 51, № 6. С. 651-659.


