Изменения перекисно-антиоксидантного метаболизма при эндопротезировании тазобедренного сустава
Автор: Божкова С.А., Мамаева Е.Г., Еропкина Е.М.
Журнал: Гений ортопедии @geniy-ortopedii
Статья в выпуске: 3, 2000 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/142120550
IDR: 142120550
Текст статьи Изменения перекисно-антиоксидантного метаболизма при эндопротезировании тазобедренного сустава
Операция тотального эндопротезирования тазобедренного сустава занимает одно из первых мест в ортопедической хирургии по сложности, объему и травматичности вмешательства, величине кровопотери и опасности развития местных и общих осложнений [8]. Анализ литературы показывает, что большая часть последних, представляющих угрозу для жизни пациента (жировая, тканевая и тромбоэмболия, острая недостаточность сердечно-сосудистой и дыхательной систем), вызывают гипоксию различных уровней, которая усиливается неизбежно возникающей операционной кровопотерей. Использование для стабильной фиксации компонентов эндопротеза костного цемента увеличивает вероятность развития осложнений как в ходе операции, так и в раннем послеоперацион- ном периоде [17]. Ряд авторов полагают, что ведущую роль в этом играет токсическое воздействие остаточного мономера метилметакрилата (ММА), который является одним из компонентов при приготовлении костного цемента [14, 20]. В настоящее время в эксперименте на животных и на культуре клеток показана высокая цитотоксичность мономера [9, 16, 18, 21]. Одним из их механизмов последней является генерирование свободных радикалов и, как следствие, усиление процессов перекисного окисления липидов (ПОЛ) в клетках, что было выявлено в эксперименте на культуре человеческих фибробластов [9, 21].
По существующим в настоящее время представлениям, реакции перекисного окисления липидов – одни из наиболее сильных модифика- торов биологических мембран при целом ряде патологических состояний организма, в том числе при гипоксии, являющейся одной из универсальных реакций на токсическое воздействие [1, 10]. Необходимо подчеркнуть, что в физиологических условиях свободнорадикальное ПОЛ протекает на низком уровне и находится под контролем антиоксидантной системы (АОС), что исключает накопление его конечных токсических продуктов (свободных радикалов жирных кислот, липоперекисей, альдегидов, кетонов, оксикислот) в концентрациях, опасных для жизнедеятельности организма [2, 4]. Чрезмерная активация перекисных процессов приводит к нарушению регуляции метаболизма мембранных липидов и изменениям физико-химических свойств и проницаемости биологических мембран [3]. Применяемый при эндопротезировании костный цемент дополнительно усиливает гипоксические изменения и оказывает на клетки организма прямое токсическое воздействие. В том числе за счет этого, вероятно, усиливаются свободнорадикальные процессы и, возможно, развивается оксидативный стресс, который может лежать в основе интра- и послеоперационных осложнений. Однако до настоящего времени остается открытым вопрос о воздействии костного цемента на изменения перекисноантиоксидантного баланса не на клеточном уровне, а на состояние соотношения процессов ПОЛ-АОС в целостном организме. Известно, что превышающие адаптационный уровень изменения метаболизма являются одними из ведущих механизмов в развитии осложнений операции и послеоперационного периода и нуждаются в своевременной коррекции [6]. Вышеизложенное послужило причиной данного исследования.
Цель исследования: изучить динамику показателей перекисно-антиоксидантного метаболизма у пациентов, перенесших первичное и ревизионное эндопротезирование тазобедренного сустава с цементной и бесцементной фиксацией компонентов эндопротеза.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Обследовано 80 пациентов (51 женщина и 29 мужчин), которым в плановом порядке под спинно-мозговой анестезией при сохраненном спонтанном дыхании произведено эндопротезирование тазобедренного сустава.
Первую группу составили 27 человек (17 женщин и 10 мужчин), у которых в ходе операции костный цемент не использовался, а вторую – 53 человека (34 женщин и 19 мужчин), у которых для фиксации компонентов эндопротеза применяли костный цемент.
Средний возраст пациентов – 53,4 ± 2,3 и 53,7 ± 1,9 года для I и II группы соответственно. При классификации объективного статуса больных по системе ASA до операции выявлено, что для пациентов второй группы он был достоверно (P <0,01) выше, чем для первой.
Кровопотеря во время операции составила 713 ± 90 мл для II группы, дренажные потери после операции – 625 ± 99 мл и 751 ± 72 мл для I и II группы соответственно, длительность операции 115 мин – в I группе, 106 мин – во II группе.
Диспластический и посттравматический кок-сартроз III стадии явился показанием для первичного эндопротезирования у 19 больных первой группы и 21 – второй; асептический некроз голов- ки бедренной кости – у 5-ти пациентов первой группы и 7-ми – второй; перелом шейки бедренной кости – у 1-го пациента первой группы и 7-ми – второй. Реэндопротезирование по поводу асептической нестабильности компонентов эндопротеза или его перелома проводили в первой группе у 2-х больных, а во второй – у 18-ти.
Забор крови осуществляли из кубитальной вены до операции, затем на 1, 3, 5, 7, 14 и 21-е сутки послеоперационного периода. Состояние ПОЛ оценивали путем определения малонового диальдегида в сыворотке крови по методу И.Д. Стальной и Т.Г. Гаришвили (1977). О состоянии АОС судили по уровню общей антиоксидантной активности [7] и активности антиоксидантных ферментов (АО-ферментов): каталазы по методу Miller et al. (1984) и супероксид-дисмутазы (СОД) [15] в сыворотке крови. Статистический анализ проводили с использованием программы "Statistica 5" (StatSoft, Inc. 1995). Достоверность различий оценивали с помощью метода непараметрической статистики «Wilcoxon matched pairs test», корреляцию показателей – с помощью метода непараметрической корреляции Pearson.
РЕЗУЛЬТАТЫ
Проведенное исследование показало, что при эндопротезировании без применения костного цемента только в первые сутки после операции выявлялись значительные изменения перекисноантиоксидантного баланса, которые выражались в снижении (P<0,05) по сравнению с исходным активности каталазы на 18% (рис. 1: диаграмма 1) и уровня ПОЛ на 31,8% (рис. 2: диаграмма 2), повышении (P, 0,05) общей антиоксидантной активности на 10,6% (рис. 2: диаграмма 1). На- чиная с 3-х суток после операции, исследуемые показатели не отличались от их дооперационно-го уровня до конца наблюдения. Достоверных изменений активности СОД у больных I группы в раннем послеоперационном периоде выявлено не было.
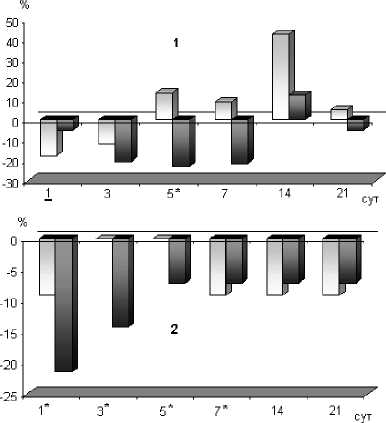
Рис. 1. Динамика изменения активности антиоксидантных ферментов в сыворотке крови больных после эндопротезирования тазобедренного сустава по отноше- нию к их дооперационному уровню.
Диаграммы: 1 - активность каталазы; 2 - активность

супероксиддисмутазы.
Обозначения на диаграммах :
-
- группа I c бесцементной фиксацией компонентов эндопротеза;
-
- группа II c цементной фиксацией компонентов эндопротеза.
-
1 - сутки, в которые показатель у пациентов I группы
достоверно (P<0,05) отличается от своего доопераци-онного уровня I
-
1 * - сутки, в которые показатель у пациентов II группы достоверно (P<0,05) отличается от своего доопераци-
- онного уровня
У пациентов II группы, которым в ходе эндопротезирования тазобедренного сустава применяли костный цемент, изменения перекисноантиоксидантного метаболизма носили более продолжительный характер. Как видно на диаграмме 2 (рис. 2), уровень ПОЛ возрастал с 3-х суток послеоперационного периода, превышая (P<0,05) свой дооперационный уровень на 7-е сутки на 27,6%, на 14-е - на 17,1%. Активность антиоксидантных ферментов после операции с использованием костного цемента значительно снижалась по сравнению с исходной (рис. 1): в первые сутки активность СОД составляла только 78% от дооперационной (P<0,05) и оставалась значительно сниженной (P<0,05) до 7-х суток, активность каталазы снижалась постепенно, достигая минимума на 5-е сутки (P<0,05), после чего повышалась до исходной. Общая антиоксидантная активность (рис. 2: диаграмма 1) в 1-е сутки после операции повышалась на 11% по сравнению с исходной (P<0,05), к 7-м суткам послеоперационного периода составляла только 87% от этого значения (P<0,05), после чего возрастала и к 21-м суткам превышала свой доопе-рационный уровень на 17% (P, 0,05).
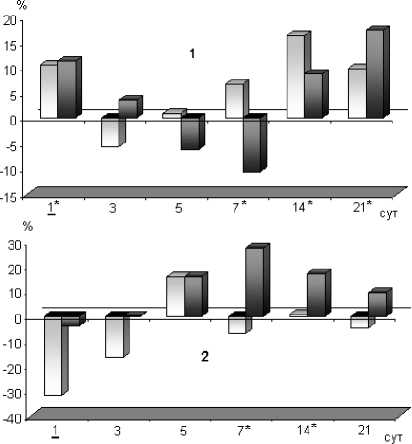
Рис. 2. Динамика изменения общей антиоксидантной активности и уровня перекисного окисления липидов (ПОЛ) в сыворотке крови больных после эндопротезирования тазобедренного сустава по отношению к их дооперационному уровню.
Диаграммы: 1 - общая антиоксидантная активность;
-
2 - уровень ПОЛ.
Обозна чения на диаграммах:
-
- группа I c бесцементной фиксацией компонентов эндопротеза;
I - группа II c цементной фиксацией компонентов эндопротеза.
-
1 - сутки, в которые показатель у пациентов I группы достоверно (P<0,05) отличается от своего доопераци-онного уровня I
1* - сутки, в которые показатель у пациентов II группы достоверно (P<0,05) отличается от своего доопераци-онного уровня
При сопоставлении послеоперационной динамики исследуемых показателей между группами выявлено, что у пациентов, которым проводили эндопротезирование тазобедренного сустава с использованием костного цемента, 1-е сутки после операции уровень процессов ПОЛ и активность каталазы были достоверно выше (P, 0,05), чем в первой группе (таблица 1). Кроме того, на 5-е и 7-е сутки послеоперационного периода у них была значительно ниже общая антиоксидантная активность. В то же время активность СОД до операции, на 7-е и 14-е сутки, была выше, чем в первой группе.
Корреляционный анализ полученных данных при бесцементном эндопротезировании показал наличие сильных положительных связей между активностью каталазы и АОА (r = 0,6), активностью СОД и уровнем ПОЛ (г = 0, 73).
Кроме того, отмечена сильная отрицательная корреляция между общей антиоксидантной активностью сыворотки крови и уровнем ПОЛ
(г = - 0,62). В то же время в группе с применением костного цемента сильных связей между исследуемыми показателями не выявлено.
При анализе осложнений раннего послеоперационного периода в первой группе общие отмечены у 22% больных, а местные - у 0,7% пациентов, во второй - общие найдены в 27% , местные - в 1,8%. Известно, что существует корреляция высоты класса по системе ASA и периоперационной летальности [12]. Состояние пациентов второй группы до операции было достоверно (P<0,05) более тяжелым, что и нашло свое подтверждение в числе послеоперационных осложнений.
Таблица 1.
Динамика уровня ПОЛ и показателей антиоксидантной системы в раннем послеоперационном периоде у пациентов после бесцементного эндопротезирования тазобедренного сустава (I) и с использованием костного цемента (II)
|
Показатели |
ПОЛ (ммольМДА/л) |
АОА (%) |
Каталаза (мкат/л) |
СОД (УЕ/мл) |
||||
|
Группа |
I |
II |
I |
II |
I |
II |
I |
II |
|
До операции |
3,5 |
3,0 |
67,6 |
62,9 |
63,0 |
74,4 |
1,1 |
1,4** |
|
1 -е сутки |
2,3 |
2,9* |
74,7 |
70,0 |
51,7 |
69,4* |
1,0 |
1,1 |
|
3-е сутки |
3,0 |
2,9 |
63,7 |
65,1 |
55,4 |
55,8 |
1,1 |
1,15 |
|
5-е сутки |
4,1 |
3,5 |
68,2 |
58,9* |
71,5 |
55,7 |
1,1 |
1,3 |
|
7-е сутки |
3,3 |
3,8 |
72,0 |
56,2** |
68,6 |
57,5 |
1,0 |
1,3* |
|
14-е сутки |
3,5 |
3,7 |
78,7 |
68,4 |
90,1 |
80,9 |
1,0 |
1,3* |
|
21-е сутки |
3,3 |
3,1 |
74,1 |
73,9 |
66,2 |
68,1 |
1,0 |
1,3 |
Примечание:
ПОЛ - перекисное окисление липидов
АОА - общая антиоксидантная активность
СОД - супероксиддисмутаза
* - величины, достоверно (P < 0,05) отличающиеся от аналогичного показателя в I группе
** - величины, достоверно (P < 0,001) отличающиеся от аналогичного показателя в I группе
ОБСУЖДЕНИЕ
Анализ полученных данных показал, что у пациентов II группы, которым была выполнена операция с цементной фиксацией компонентов эндопротеза, еще до вмешательства выявлялась более высокая активность АО-ферментов в сыворотке крови, особенно СОД (P < 0,05). В настоящее время одной из причин, приводящих с течением времени к нестабильности компонентов эндопротеза, считают усиление генерирования свободных радикалов [21], а ревизионное эндопротезирование по поводу нестабильности эндопротеза проводили в I группе только в 2-х случаях, во II группе - в 18-ти, что соответственно составило 7,4% и 34% от всех операций в каждой группе. Таким образом, достоверное повышение активности СОД во II группе могло быть вызвано компенсаторной активизацией фермента в условиях повышенного образования свободных радикалов в результате асептического воспаления в зоне нестабильного эндопротеза. Кроме того, каталаза и СОД-ферменты, которые в большом количестве присутствуют в эритроцитах и, по-видимому, другой причиной повышенной активности этих ферментов в сыворотке крови, могло быть нарушение проницаемости клеточных мембран. Это могло быть связано как с влиянием указанного выше асептического воспаления, так и с достоверно более тяжелой соматической патологией, имевшейся у пациентов второй группы, что было выявлено при дооперационном обследовании больных по системе ASA. Исходное напряжение антиоксидантной системы при тяжелой соматической патологии отмечали и другие исследователи [11].
Вероятно, выявленные особенности изменений перекисно-антиоксидантного баланса в сопоставляемых группах нельзя объяснять только травматичностью операции и массивной кровопотерей. Несмотря на то, что при эндопротезировании с применением костного цемента операционная кровопотеря была значительно выше (P<0,01), изменения исследуемых показателей в первые сутки после операции были более выражены в I группе. Кроме того, одновременно с послеоперационным падением уровня ПОЛ, общая антиоксидантная активность сыворотки крови повышалась. В настоящее время существуют данные о снижении уровня ПОЛ под влиянием анестезии [11], что по-видимому, и наблюдается у пациентов I группы. В группе с использованием цемента в первые сутки после операции сохранялась такая же тенденция, однако снижение уровня ПОЛ было менее выражено. Можно предположить, что такая динамика обусловлена, наряду с большей травматичностью вмешательства у больных второй группы, прямым воздействием ММА на свободнорадикальные процессы. По данным Н.В. Корнилова с соавт. (1999) и F.M. Vale et al. (1997), метилме-такрират вызывает увеличение продукции свободных радикалов, что является причиной его цитотоксичности. По-видимому, попадение остаточного ММА в кровь вызывает усиление процессов ПОЛ, что, в свою очередь, приводит к увеличению проницаемости клеточных мембран, в том числе и эритроцитарных. Доказательством этому предположению может служить более высокий уровень ПОЛ (P<0,05) в 1-е сутки после эндопротезирования с использованием костного цемента на фоне повышенной активности каталазы (P<0,05). При этом,однако, активность СОД не только не возрастает, но даже значительно (P<0,05) снижается у больных после использования костного цемента в ходе эндопротезирования. На основании данных ряда авторов о выходе этого фермента из сосудистого матрикса и его быстрой деградации при введении даже небольших доз гепарина [5, 21], можно предположить, что СОД так же, как каталаза, выходит из эритроцитов, но очень быстро подвергается разрушению в результате проведения всем больных при эндопротезировании антикоагулянтной терапии. Кроме того, более выраженное снижение активности СОД в первую неделю после операции у больных II группы, вероятно, обусловлено, с одной стороны, повышенным расходом фермента для нейтрализации свободных радикалов. С другой стороны, при резкой активации процессов ПОЛ происходит свободнорадикальное повреждение АО-ферментов, в свою очередь усиливает процессы ПОЛ, замыкая таким образом порочный круг [1].
Кроме того, в первой группе показано наличие сильных связей между активностью АО-ферментов и интегральными показателями состояния АОС и уровня ПОЛ в раннем послеоперационном периоде, тогда как в группе после цементного эндопротезирования сильных корреляций не выявлено. Это может свидетельствовать о нарушении регулирующих связей с перекисно-антиоксидантной системой у больных этой группы, вызванном, возможно, снижением функциональной активности ферментного звена АОС, и является, на наш взгляд, свидетельством уже дезадаптацонных изменений.
Анализ динамики изученных показателей позволил установить, что наиболее критическим сроком после эндопротезирования с цементной фиксацией компонентов протеза, когда нарушения перекисно-антиоксидантного баланса носят наиболее выраженный, зачастую дезадаптивный характер, является период с 5-х по 7-е сутки. В это время максимально усилены процессы ПОЛ, а уровень АОА и активность АО-ферментов значительно ниже исходной. Надо отметить также, что уровень ПОЛ остается повышенным у пациентов II группы до конца второй недели послеоперационного периода. Вероятно, применение антиоксидантной терапии позволило бы скорректировать эти изменения.
Таким образом, причиной выявленных нарушений перекисно-антиоксидантного баланса может быть то, что тяжелая ортопедическая операция вызывает развитие стресс-реакции, гипоксии и воспаления тканей, которые являются пусковым механизмом активации ПОЛ. По-видимому, использование костного цемента в ходе операции является дополнительным повреждающим фактором, который усиливает гипоксию и обладает прямым токсическим действием на ткани. Эти патологические факторы способствуют усилению процессов ПОЛ и развитию оксидативного стресса.
ВЫВОДЫ
-
1. Эндопротезирование тазобедренного сустава приводит к развитию оксидативного стресса за счет усиления свободнорадикальных процессов и развития перекисно-антиоксидантного дисбаланса;
-
2. Операции с цементной фиксацией компонентов эндопротеза сопровождаются развитием более выраженного и длительного оксидативно-го стресса, чем при бесцементном эдопротези-ровании;
-
3. Применение антиоксидантных и антиги-поксантных препаратов во время эндопротези-
- рования целесообразно вне зависимости от использования костного цемента для предотвращения развития оксидативного стресса;
-
4. При цементном эндопротезировании применение цитопротекторной терапии, включающей антигипоксантные и антиоксидантные средства, целесообразно в сроки в течение первых двух недель послеоперационного периода, причем в группу антиоксидантов, желательно включать препараты, направленные на восполнение активности ферментного звена АОС.


