Изменения таксономического состава и структуры прокариотного сообщества агродерново-подзолистой почвы при внесении биоугля
Автор: Шахназарова В.Ю., Орлова Н.Е., Орлова Е.Е., Банкина Т.А., Якконен К.Л., Рижия Е.Я., Кичко А.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Микробные сообщества почв
Статья в выпуске: 1 т.55, 2020 года.
Бесплатный доступ
В настоящее время в научной литературе активно обсуждается целесообразность применения в земледелии биоугля - одного из новых видов органогенных мелиорантов, получаемого из древесины или отходов растительного происхождения. Биоуголь рекомендуют использовать для увеличения биологической активности почв, повышения продуктивности культур, в ряде стран его активно внедряют в агротехнологии. Однако многие аспекты влияния биоугля на свойства и состояние агроценозов исследованы крайне слабо. Основное беспокойство вызывают данные о влиянии биоугля на минерализацию гумуса, так как дегумификация может привести к потере почвенного плодородия и снижению экологической устойчивости почв, особенно дерново-подзолистых, для которых характерно невысокое содержанием гумуса и слабая гумифицированность. Такие почвы исходно имеют низкую экологическую устойчивость и достаточно уязвимы для воздействия человека. При их использовании необходимо уделять значительное внимание микробиологическим и биохимическим процессам трансформации почвенного органического вещества...
Метагеномный анализ, высокопроизводительное секвенирование, почвенный микробоценоз, продукты пиролиза, дерново-подзолистая почва, олиотрофы, копиотрофы, почвенные гидролитики
Короткий адрес: https://sciup.org/142223780
IDR: 142223780 | УДК: 631.58:631.461:577.2 | DOI: 10.15389/agrobiology.2020.1.163rus
Текст научной статьи Изменения таксономического состава и структуры прокариотного сообщества агродерново-подзолистой почвы при внесении биоугля
Исследования проводились с использованием оборудования ЦКП «Геномные технологии, протеомика и клеточная биология» (ФГБНУ ВНИИСХМ). Работа выполнена при поддержке гранта РФФИ ¹ 18-016-00208а «Влияние биоугля на биохимические и микробиологические процессы трансформации органического вещества почв».
В последние десятилетия активно ведется поиск и разработка новых видов удобрений и мелиорантов, позволяющих поддерживать бездефицитный баланс гумуса почв и обеспечивать их высокое плодородие. Один из перспективных органогенных мелиорантов, активно применяемых в мировом агропроизводстве, — биоуголь. (анг. biochar) (1-3). Биоуголь получают пиролизом древесины или другой растительной массы в инертной атмосфере. Применение биоугля рассматривают как возможность решения ряда острых экологических проблем — утилизации органических отходов (4, 5), секвестрации углерода (6), восстановления нарушенных почв (5-7) и увеличения продуктивности сельскохозяйственных культур (4, 8, 9).
Состав и свойства различных видов биоугля, в частности исходное сырье для его производства (10), физические и физико-химические характеристики (11, 12), изучены достаточно подробно. Исследовано его влияние на агрономически ценные свойства некоторых типов почв, в том числе на содержание элементов минерального питания растений (4, 9, 13), реакцию почвенной среды и водно-физические свойства (5, 6, 12, 13). Однако механизмы, обусловливающие такие эффекты, не до конца понятны. Описаны изменения микробоценоза в почвах при разных дозах внесения биоугля (14-16), сроках инкубации (15, 17) и различном его качестве (18). Но при этом не выявлены четкие закономерности модуляции профиля микробиоты под влиянием биоугля. Ограничена и зачастую противоречива информация о сопряженных изменениях почвенной биоты и органического вещества почв — важнейших компонентов агроценозов, в значительной степени определяющих уровень их плодородия и экологическую устойчивость (19-22). Так, имеются сведения, что под влиянием биоугля микробная биомасса и биологическая активность почв увеличиваются, начинаются дегумификационные процессы (21-23). Согласно другим данным, биоуголь не оказывает стимулирующего действия на биомассу почвенных микроорганизмов, а интенсивность минерализационных процессов снижается (24-27). Также слабо проработана проблема трансформации состава гумуса при внесении биоугля в почвы. Недавно проведенные нами исследования показали, что внесение биоугля в дерново-подзолистую почву приводит как к негативным, так и к положительным модификациям в системе гумусовых веществ (28, 29). Интенсивные процессы минерализации гумуса (потери до 20 %) сопровождаются увеличением в его составе доли стабилизированных форм, что повышает устойчивость гумуса в целом (28).
Почвенные прокариоты активно участвуют в трансформации органического вещества, поэтому изучение влияния биоугля на прокариотное сообщество агродерново-подзолистой почвы представляет интерес как для понимания фундаментальных процессов формирования почвенного плодородия, так и для практики земледелия.
В настоящей работе впервые описаны изменения состава и структуры прокариотного сообщества агродерново-подзолистой почвы, сопутствующие ее дегумификации под воздействием биоугля (рост обилия оли-готрофов и ряда таксонов, представители которых участвуют в разложении сложных природных биополимеров, снижение доли копиотрофов). Кроме того, получены данные о метагеномном составе микробиоты дерновоподзолистой почвы северо-западной части Европейской России, сведений о котором для этого региона пока крайне мало.
Цель представляемого исследования заключалась в оценке влияния биоугля на особенности сообществ прокариот хорошо окультуренной аг-родерново-подзолистой супесчаной почвы Ленинградской области.
Методика. Образцы высокогумусированной агродерново-подзоли-стой супесчаной почвы (Меньковский филиал Агрофизического института, Ленинградская обл., Гатчинский р-н) отбирали из пахотного горизонта (0-20 см) в июне 2017 года. Биоуголь получали быстрым пиролизом из древесины березы и осины при 550 °С. Подробная характеристика почвы и биоугля приведена ранее (28, 29).
Исследования проводили в краткосрочном инкубационном эксперименте при комнатной температуре (20-22 °С). Масса почвы в сосудах составляла 300 г в пересчете на сухое вещество, содержание биоугля — 0 % (контроль) и 1,0 %. Влажность почвы в течение всего эксперимента оставалась равной 60 % от полной влагоемкости. Образцы почвы для анализа отбирали на 7-е и 90-е сут. Повторность вариантов опыта 3-кратная.
Агрохимические показатели почвы определяли по стандартным методикам (30): рН — потенциометрически, содержание почвенного органического углерода — по Тюрину, органического азота — микрохромовым методом Тюрина, нитратов — с дисульфофеноловой кислотой, аммония — с реактивом Несслера.
Для создания библиотек маркерного гена 16S рРНК в полимеразной цепной реакции (ПЦР) использовали универсальные праймеры для его вариабельного участка V4 F515/R806 (5'-GTGCCAGCMGCCGCGGT-AA-3'/5'-GGACTACVSGGGTATCTAAT-3') с присоединением адаптеров и уникальных баркодов («Illumina, Inc.», США). Для постановки ПЦР использовали T100 Thermal Cycler («Bio-Rad Laboratories, Inc.», США), реакцию проводили в 15 мкл реакционной смеси, содержащей 0,5-1,0 ед. полимеразы Q5 и ½1 Q5 Reaction Buffer («New England BioLabs Inc.», Великобритания), по 5 пкМ прямого и обратного праймеров, 10 нг ДНК матрицы и 2 нМ каждого dNTP («Thermo Fisher, Inc.», США). Смесь денатурировали при 94 °С 1 мин, после чего следовало 35 циклов: 94 °С — 30 с, 50 °С — 30 с, 72 °С — 30 с; финальная элонгация — при 72 °С 3 мин. Подготовку библиотек и секвенирование выполняли на платформе Illumina MiSeq с набором реагентов MiSeq ReagentKit v3 (600 cycle) с двусторонним чтением (2½300 н.) («Illumina, Inc.», США) в соответствии с протоколом Illumina для метагеномного секвенирования ампликонных библиотек 16S «MiSeq Reagent Kit Preparation Guide». Для демультиплексирования, исключения служебных последовательностей, оценки качества прочтения, обрывания и объединения двусторонних прочтений, проверки на наличие химерных последовательностей и гомополимеров использовали ПО Illumina («Illumina, Inc.», США) и программные пакеты Trimmomatic (31), fastQC , fastq-join и QIIME (32). Кластеризацию последовательностей и таксономическую идентификацию полученных операционных таксономических единиц (ОТЕ, Operational Taxonomic Unit) проводили с помощью программы QIIME.
Разнообразие и выравненность бактериальных сообществ агродерно-во-подзолистой почвы оценивали по числу ОТЕ (аналог видового богатства) и индексу Шеннона H = Σ pi ln( pi ), где pi — доля i -го вида в сообществе (33).
Статистическую обработку данных проводили с помощью программы IBM SPSS Statistics, Version 25 («IBM», США). Достоверность различий между вариантами оценивали по результатам однофакторного дис- персионного анализа с помощью критериев Дункана (Duncan’s test) или Стюдента-Ньюмена-Кейлса (Student-Newman-Keuls test, SNK) при p < 0,05 (n = 3). В таблицах представлены средние значения (M) с доверительным интервалом при p < 0,05 (t0,05 ½ SEM).
Результаты . Несмотря на высокое содержание в биоугле углерода, он представлен в основном инертными трудно окисляемыми формами, лабильных фракций крайне мало. В органическом веществе биоугля доля углерода, определяемого методом мокрого сжигания по окисляемости, составляет менее 1,5 %, содержание водорастворимых соединений углерода ничтожно (0,008 %) (27). Внесенный в почву биоуголь не влиял на содержание почвенного органического углерода (гумуса), так как представляет собой высокостабилизированное соединение.
Исследуемая агродерново-подзолистая почва характеризовалась слабокислой реакцией среды (рНH 2 O 6,7), высоким содержанием гумуса (4,45 %), минеральных и органических форм азота (табл. 1).
1. Минерализация органического вещества агродерново-подзолистой почвы при разных сроках инкубирования с добавлением биоугля ( n = 3, M ± t 0,05 ½ SEM)
|
Вариант опыта |
С орг. , % |
Формы соединений азота |
C орг. :N орг. |
|
N орг. , % N-NO 3 , мг/кг1 N-NH 4 , мг/кг |
|||
|
0 сут Исходная почва 2,56±0,05c 0,22±0,00c 11,2±0,7a 14,8±0,6e 11,6±0,3a Ч е р е з 7 сут Контроль 2,50±0,05bc 0,21±0,00c 18,9±1,5b 10,4±0,6d 11,9±0,4a Биоуголь 2,46±0,04b 0,21±0,01c 17,0±0,6b 9,3±0,04c 11,7±0,3a Ч е р е з 90-е сут Контроль 2,48±0,04b 0,19±0,01b 17,9±0,6b 6,8±0,05b 13,1±0,2b Биоуголь 2,22±0,04a 0,16±0,01a 12,6±0,7a 4,7±0,07a 13,9±0,4c П р и м еч а ни е. Разными буквами обозначены средние значения, статистически значимо различающиеся между собой при p < 0,05 (принадлежность к разным подмножествам). |
|||
В процессе инкубации под влиянием биоугля интенсифицировались процессы минерализации органического вещества почвы. К концу эксперимента (90 сут) в почве с биоуглем содержание органических форм азота и углерода было меньше, чем в контроле, соответственно на 16 и 10 %. При этом потеря гумуса в почве с биоуглем за период инкубации составила 0,57 %. Полученные данные согласуются с результатами наших предыдущих исследований по изучению влияния биоугля на содержание гумуса и его фракционно-групповой состав в агродерново-подзолистых супесчаных почвах (21). Таким образом, на основании проведенных краткосрочных (до 90 сут) экспериментов можно констатировать, что инкубирование агродерново-подзолистых почв легкого гранулометрического состава в присутствии биоугля может вызывать их дегумификацию.
Превалирование в ходе инкубации скорости минерализации органических соединений N над таковой органических соединений C приводило к достоверному (p < 0,05) увеличению значений C/N в вариантах с биоуглем, то есть степень гумифицированности почвенного органического вещества падала. В контрольной почве минерализация органического вещества сопровождалась уменьшением содержания аммонийного азота и увеличением количества нитратного азота, то есть усилением процесса нитрификации. В почве c биоуглем более резкое по сравнению с контролем снижение содержания N-NH4 к концу эксперимента (через 90 сут) происходило на фоне неизменного содержания N-NO3 в сравнении с его стартовыми значениями. Увеличение содержания N-NO3 в почве с биоуглем, сопоставимое с контролем, регистрировали лишь в начале инкубации (через 7 сут). По-видимому, при длительном компостировании катионы аммония, образуемые в результате минерализации органического вещества, могут сорбироваться отрицательно заряженными функциональными группами биоугля (6). В результате в почве уменьшалось содержание экстрагируемых форм аммония, а нитрификация лимитировалась количеством субстрата (аммония), доступного нитрифицирующим бактериям.
Отмеченные изменения органического вещества почвы протекали сопряжено с трансформацией таксономического состава и структуры прокариотов.
В результате кластеризации последовательностей вариабельного участка гена 16 S рРНК получили 6392 ОТЕ, на основе чего был проведен таксономический анализ имеющихся бактериальных сообществ (табл. 2). По числу ОТЕ существенных различий в структуре бактериальных сообществ в контроле и при добавлении в почву биоугля мы не отмечали. Индекс Шеннона свидетельствовал об отсутствии различий между вариантами в начале эксперимента, однако к его окончанию при добавлении биоугля он незначительно (на 7,5 %), но достоверно (р < 0, 05) возрастал, что может указывать на увеличение разнообразия и б о льшую выравненность сообщества под влиянием биоугля.
-
2. Число операционных таксономических единиц (ОТЕ) и выравненность структуры бактериальных сообществ в агродерново-подзолистой почве при разных сроках инкубирования с добавлением биоугля ( n = 3, M ± t 0,05 ½ SEM)
Показатель Контроль, 7 сут Биоуголь, 7 сут Контроль, 90 сут Биоуголь, 90 сут
Число ОТЕ 3211±1085a 3710±285a 3335±467a 3498±185a
Индекс Шеннона H 9,49±0,35ab 9,84±0,45ab 9,23±0,20b 9,91±0,11a
П р и м е ч а н и е. Разными буквами обозначены средние значения, статистически значимо различающиеся между собой при p < 0,05 (принадлежность к разным подмножествам).
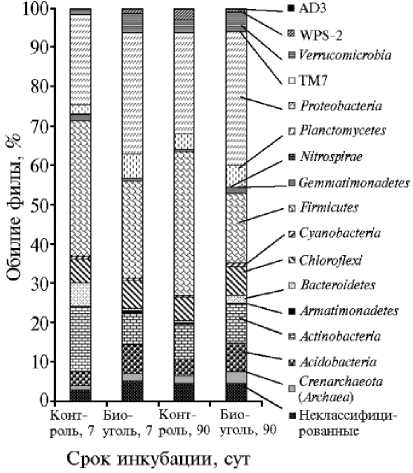
Обилие фил прокариотных организмов (%) в агродерново-подзолистой почве при разных сроках инкубирования с добавлением биоугля ( n = 3). Представлены филы, обилие которых хотя бы в одном из вариантов опыта превышает 0,1 %.
Соотношение представленности Archaea и Bacteria при внесении биоугля существенно не изменилось, отмечалась лишь тенденция к увеличению обилия архей в почве с биоуглем (рис.). Метагеномный анализ прокариотного сообщества показал, что во всех исследованных образцах доминировали филы Actinobacteria , Firmicutes , Proteobacteria , Chloroflexi , Acidobacteria , Planctomycetes , Ver-rucomicrobia , в почве, которую компостировали 7 сут без биоугля, кроме того, еще и Bacteroidetes
(рис.) . Преобладание перечисленных фил в целом характерно для дерново-подзолистых почв, за исключением филы Planctomycetes , обычно представленной в этих почвах не столь обильно (34, 35).
После краткосрочной (7 сут) инкубации в почве с биоуглем по сравнению с почвой без него обилие фил Acidobacteria , Verrucomicrobia и Planctomycetes достоверно (р < 0,05) возрастало, а фил Actinobacteriа ,
Nitrospirae , Fibrobacteres , Gemmatimonadetes — снижалось . Мы обнаружили существенные изменения и в обилии ряда классов, порядков, семейств и родов, относящихся в основном к филам Actinobacteria , Chloroflexi , Plancto-mycetes , Proteobacteria , Firmicutes (табл. 3). После 90-суточного компостирования различия в составе бактериального сообщества в почве с внесением и без внесения биоугля проявлялись значительно слабее, а изменения в обилии отмечались уже в основном для других таксонов. Так, возросла представленность фил Proteobacteria , Gemmatimonadetes, FBP, но снизилось обилие филы Firmicutes.
В настоящее время для разных почв не выявлено единой закономерности воздействия биоугля на обилие бактериальных фил. Например, отмеченное нами в исследуемой почве снижение обилия филы Actinobacteria в результате внесения биоугля согласуется с данными других авторов (16). В то же время в некоторых работах описано возрастание обилия этой филы при внесении указанного мелиоранта (14). Также нет единого мнения о воздействии биоугля на обилие в почве представителей фил Firmicutes (14, 18, 36), Verrucomicrobia (14), Planctomycetes (14, 18), Proteobacteria (14, 37). Вероятно, трансформация прокариотного сообщества связана опосредованно с изменениями физико-химических свойств почвы при внесении в нее биоугля: рН, сорбционной способности, емкости катионного обмена (4, 37).
-
3. Обилие таксонов прокариот (%) в агродерново-подзолистой почве при разных сроках инкубирования с добавлением биоугля ( n = 3)
Название таксона
Контроль, 7 сут
Биоуголь, 7 сут
Контроль, 90 су
г Биоуголь, 90 сут
Actinobacteria
16,29a
Фила
8,20b
9,10b
9,90b
Firmicutes
34,35a
24,41ab
29,20a
17,50b
FBP
0,05b
0,05b
0,03b
0, 12a
Fibrobacteres
0,03b
0a
0,01b
0,13ab
Gemmatimonadetes
1,6a
0,84b
0,62b
1,64a
Nitrospirae
0,15a
0,03b
0,01b
0,01b
Planctomycetes
2,28b
5,98a
4,20ab
5,56ab
Proteobacteria
22,81b
30,83ab
26,22b
33,83a
Verrucomicrobia
1,50b
5,00а
3,35ab
4,88ab
Sva0725
1,11a
Класс
0,18b
0,04b
0,07b
TM1
0,001b
0,01a
0,02а
0,02а
[Chloracidobacteria]
0,90a
0,07b
0,06b
0,02b
DA052
0,007b
1,01a
0,44а
0,91а
Actinobacteria
11,02a
3,29с
3,91bc
4,90b
Nitriliruptoria
0,01a
0b
0b
0b
Sphingobacteriia
1,93a
0,17b
0,15b
0,72a
Chloroflexi
0,85a
0,03b
0,02b
0,01b
Ktedonobacteria
0,07b
4,08a
4,13a
4,5a
TK10
0,41c
1,72a
0,96bc
1,45b
Bacilli
33,38a
21,00b
24,93b
15,05c
Planctomycetia
1,68b
5,08a
3,61ab
4,41ab
RB41
0,90a
Порядок 0,07b
0,0b
0,02b
Actinomycetales
11,01a
3,29c
3,90bc
4,90b
KD8-87
0,5a
0b
0b
0b
Thermogemmatisporales
0,004c
1,04b
1,05ab
2,21a
AKYG1722
0,35a
0,001b
0,004b
0,004b
JG30-KF-AS9
0,01b
0,97a
1,22a
0,56a
Nitrospirales
0,15b
0,03a
0,02a
0,01a
Rhizobiales
4,51b
9,72a
7,90ab
11,79a
Rhodospirillales
1,34b
3,67a
3,18ab
4,37a
Ellin6067
0,06b
0,43a
0,30ab
0,19ab
Myxococcales
2,12ab
2,68ab
1,80b
2,97a
Spirobacillales
0,31a
0,02b
0,04b
0,04b
Pseudomonadales
0,44a
0,04b
0,04ab
0,02ab
Xanthomonadales
2,23b
2,35b
2,02b
3,23a
Продолжение таблицы 3
Семейство
|
Actinospicaceae |
0,001b |
0,04a |
0,04a |
0,04a |
|
Dermabacteraceae |
0,05a |
0b |
0b |
0b |
|
Dermacoccaceae |
0b |
0,01b |
0,13a |
0,02b |
|
Intrasporangiaceae |
0,29a |
0,06b |
0,04b |
0,04b |
|
Microbacteriaceae |
1,86a |
0,16b |
0,43b |
0,14b |
|
Nakamurellaceae |
0,07a |
0,05a |
0,03b |
0,07a |
|
Propionibacteriaceae |
0,02a |
0,001b |
0,004ab |
0,01ab |
|
Chthonomonadaceae |
0,01b |
0,17a |
0,16ab |
0,09ab |
|
Gemmataceae |
0,07b |
1,71a |
0,94ab |
1,47ab |
|
Burkholderiaceae |
0,08c |
0,70b |
0,49b |
1,21a |
|
Comamonadaceae |
0,88a |
0,23b |
0,22b |
0,26b |
|
Coxiellaceae |
0,08b |
0,34a |
0,27ab |
0,14ab |
|
Xanthomonadaceae |
1,80a |
0,56b |
1,04ab |
1,52a |
|
[Chthoniobacteraceae] |
0,42b |
3,88ab |
2,72b |
3,96a |
|
Род |
||||
|
Actinotalea |
0,22a |
0 b |
0,002b |
0,01b |
|
Brachybacterium |
0,05a |
0b |
0b |
0b |
|
Agrococcus |
0,11a |
0,001b |
0,004b |
0,003b |
|
Actinoplanes |
0,15a |
0,02b |
0,02b |
0,05ab |
|
Catellatospora |
0,03a |
0,001b |
0,01b |
0,004b |
|
Pontibacter |
0,03a |
0,001b |
0b |
0b |
|
Dyadobacter |
0,06a |
0,001b |
0b |
0,02ab |
|
Ammoniphilus |
1,05a |
0,21b |
0,27b |
0,29b |
|
Coprococcus |
0,03b |
0,03b |
0,10a |
0,02b |
|
Symbiobacterium |
0,03a |
0,01b |
0,01b |
0,01b |
|
Gemmata |
0,02b |
0,49a |
0,28ab |
0,54а |
|
Nostocoida |
0b |
0,0006а |
0,0004a |
0,0004ab |
|
Asticcacaulis |
0,02ab |
0,01b |
0,01b |
0,06a |
|
Devosia |
1,17a |
0,10b |
0,16b |
0,26b |
|
Hyphomicrobium |
0,11b |
0,29a |
0,20ab |
0,35a |
|
Sphingomonas |
0,37a |
0,01b |
0,13b |
0,25a |
|
Burkholderia |
0,02с |
0,66b |
0,47b |
1,16a |
|
Methylibium |
0,05a |
0,01b |
0,02b |
0,01b |
|
Janthinobacterium |
0,01b |
0,02ab |
0,03a |
0,01b |
|
Pseudomonas |
0,07a |
0,01b |
0,01b |
0,01b |
|
Rhodanobacter |
0,25a |
0,06b |
0,25a |
0,26ab |
|
Pedosphaera |
0,001b |
0,05a |
0,02ab |
0,03ab |
П р и м е ч а н и е. Приведены таксоны, для которых хотя бы в один из сроков отмечали достоверные различия в обилии таксонов. Разными буквами обозначены средние значения, статистически значимо различающиеся между собой при p < 0,05 (принадлежность к разным подмножествам).
В целом можно отметить, что в исследованной почве в результате внесения биоугля на 7-е сут достоверно возросло обилие олиготрофных бактерий — фил FBP, Verrucomicrobia ( более чем втрое), Planctomycetes (более чем вдвое). Существенно увеличилась представленность олиготрофных бактерий родов Hyphomicrobium (7 сут инкубации) и Asticcacaulis (90 сут инкубации). В то же время достоверно (р < 0,05) снизилось обилие бактерий фил Actinobacteria (7 сут инкубации) и Firmicutes (90 сут инкубации), представители которых являются копиотрофами либо гидролитиками, способными существовать в условиях высоких концентраций питательных веществ. В частности, сократилось обилие класса Bacilli , включающего активных почвенных копиотрофов. Таким образом, внесение биоугля создало более благоприятные условия для бактерий, не способных выживать при высокой концентрации доступных органических соединений. Бактерии, хорошо растущие на богатых питательных средах ( Actinobacteria , Bacilli ), напротив, были несколько угнетены. Возможно, причина в том, что легкодоступное органическое вещество сорбируется на внесенном биоугле, как следствие, концентрация органических соединений в почвенном растворе снижается, что создает преимущества для более олиготрофных бактерий.
Помимо отмеченных изменений, внесение биоугля вызвало быстрое и значительное (в 5 раз) сокращение обилия бактерий филы Nitrospirae, представленной в исследуемой почве в основном бактериями-нитрифика- торами рода Nitrospira, что согласуется с подавлением нитрификации, наблюдаемым в этой почве при внесении биоугля (см. табл. 1).
Заметная перестройка произошла и в сообществе почвенных гид-ролитиков. Уже после краткой инкубации в почве с биоуглем по сравнению с контролем снизилось обилие филы Actinobacteria , чьи представители являются деструкторами многих трудногидролизуемых органических веществ. В то же время в тех же условиях увеличилась представленность порядка Myxococcales — активных гидролитиков трудноразлагаемых полимеров — и возросло обилие класса Sphingobacteriia , представители которого также известны как целлюлозолитики (38, 39). Кроме того, существенно повысилась доля представителей порядка Xanthomonadales , семейства Burkholderiaceae (на 7-е сут почти на порядок) и рода Asticcacaulis , которые, как недавно было показано, участвуют в разложении целлюлозы или продуктов ее деструкции (38). Следовательно, в изученных образцах почвы при внесении биоугля возросла представленность нескольких групп бактерий, ответственных за гидролиз труднодоступных для деструкции органических веществ.
Итак, с помощью методов метагеномного анализа показано, что внесение биоугля достаточно быстро приводит к изменениям в составе прокариотного сообщества агродерново-подзолистой почвы. Кардинальной перестройки сообщества мы не наблюдали, но доля олиготрофных бактерий возрастала, копиотрофов — снижалась, кроме того, были отмечены модификации в структуре сообщества гидролитиков. Последним, вероятно, объясняется выявленная нами интенсивная трансформация органических веществ в исследованной почве под влиянием биоугля. Безусловно, изучение структурных преобразований микробиоты, сопровождающих такую трансформацию, чрезвычайно интересно как частный случай изменений микробиоценоза, связанных с процессами гумификации и дегумификации почв. Этот вопрос нуждается в изучении, поскольку именно деятельность конкретных микроорганизмов приводит к интенсификации этих процессов и определяет их соотношение, напрямую влияющее на уровень почвенного плодородия и экологическую устойчивость агроценоза.
Список литературы Изменения таксономического состава и структуры прокариотного сообщества агродерново-подзолистой почвы при внесении биоугля
- Glaser B., Lehmann J., Zech W. Ameliorating physical and chemical properties of highly weathered soils in the tropics with charcoal - a review. Biology and Fertility of Soils, 2002, 35: 219-230 ( ). DOI: 10.1007/s00374-002-0466-4
- Lehmann J., da Silva Jr. JP., Steiner C., Nehls T., Zech W., Glaser B. Nutrient availability and leaching in an archaeological Anthrosol and a Ferralsol of the Central Amazon basin: fertilizer, manure and charcoal amendments. Plant and Soil, 2003, 249(7): 343-357 (doi: 10.1023/A:1022833116184).
- Yamato M., Okimori Y., Wibowo I.F., Anshori S., Ogawa M. Effects of the application of charred bark of Acacia mangium on the yield of maize, cowpea and peanut, and soil chemical properties in South Sumatra, Indonesia. Soil Science and Plant Nutrition, 2006, 52: 489-495 ( ). DOI: 10.1111/j.1747-0765.2006.00065.x
- Agricultural and environmental applications of biochar: advances and barriers. SSSA Spec. Publ. 63 /M. Guo, Z. He, S.M. Uchimiya (eds.). SSSA, Madison, WI, 2016 ( ). DOI: 10.2136/sssaspecpub63.frontmatter
- Zama E.F., Reid B.J., Arp H.P.H., Sun G.-X., Yuan H.-Y., Zhu Y.-G. Advances in research on the use of biochar in soil for remediation: a review. Journal of Soils Sediments, 2018, 18(7): 2433-2450 ( ). DOI: 10.1007/s11368-018-2000-9
- Amonette J.E., Joseph S. Characteristics of biochar: microchemical properties. In: Biochar for environmental management: science and technology /J. Lehmann, S. Joseph (eds.). Earthscan, London-Sterling, VA, 2009: 33-52.
- Liu Y., Wang Y., Lu H., Lonappan L., Brar S.K., He L., Chen J., Yang S. Biochar application as a soil amendment for decreasing cadmium availability in soil and accumulation in Brassica chinensis. J. Soils Sediments, 2018, 18(7): 2511-2519 ( ).
- DOI: 10.1007/s11368-018-1927-1
- Ippolito J.A., Laird D.A., Busscher W.J. Environmental benefits of biochar. J. Environ. Qual., 2012, 41(4): 967-972 ( ).
- DOI: 10.2134/jeq2012.0151
- Biederman L.A., Harpole W.S. Biochar and its effects on plant productivity and nutrient cycling: a meta-analysis. GCB Bioenergy, 2013, 5(2): 202-214 ( ).
- DOI: 10.1111/gcbb.12037
- González J.F., Román S., Encinar J.M., Martinéz G. Pyrolysis of various biomass residues and char utilization for the production of activated carbons. Journal of Analytical and Applied Pyrolysis, 2009, 85(1-2): 134-141 ( ).
- DOI: 10.1016/j.jaap.2008.11.035
- Keiluweit M., Nico P.S., Johnson M.G., Kleber M. Dynamic molecular structure of plant biomass-derived black carbon (biochar). Environ. Sci. Technol., 2010, 44(4): 1247-1253 ( ).
- DOI: 10.1021/es9031419
- Lehmann J., Joseph S. Biochar for environmental management: an introduction. In: Biochar for environmental management: science and technology /J. Lehmann, S. Joseph (eds.). Earthscan, London-Sterling, VA, 2009: 1-12.
- Verheijen F., Jeffery S., Bastos A., Velde M., Diafas I. Biochar application to soils, a critical scientific review of effects on soil properties, processes and functions. EUR 24099-En. European Commission, Luxembourg, 2010 (doi: 10.2788/472).
- Xu N., Tan G., Wang H., Gai X. Effect of biochar additions to soil on nitrogen leaching, microbial biomass and bacterial community structure. European Journal of Soil Biology, 2016, 74: 1-8 ( ).
- DOI: 10.1016/j.ejsobi.2016.02.004
- Xu M., Xia H., Wu J., Yang G., Zhang X., Peng H., Yu X., Li L., Xiao H., Qi H. Shifts in the relative abundance of bacteria after wine-lees-derived biochar intervention in multi metal-contaminated paddy soil. Science of the Total Environment, 2017, 599-600: 1297-1307 ( ).
- DOI: 10.1016/j.scitotenv.2017.05.086
- Gao L., Rui W., Shen G., Zhang J., Meng G., Zhang J. Effects of biochar on nutrients and the microbial community structure of tobacco-planting soils. Journal of Soil Science and Plant Nutrition, 2017, 17(4): 884-896 ( ).
- DOI: 10.4067/S0718-95162017000400004
- Jenkins R.J., Viger M., Arnold E.C., Harris Z.M., Ventura М., Miglietta F., Girardin C., Edwards R.J., Rumpel C., Fornasier F., Zavalloni C., Tonon G., Alberti G., Taylor G. Biochar alters the soil microbiome and soil function: results of next-generation amplicon sequencing across Europe. GCB Bioenergy, 2017, 9(3): 591-612 ( ).
- DOI: 10.1111/gcbb.12371
- Awasthi M.K., Li J., Kumar S., Awasthi S.K., Wang Q., Chen H., Wang M., Ren X., Zhang Z. Effects of biochar amendment on bacterial and fungal diversity for co-composting of gelatin industry sludge mixed with organic fraction of municipal solid waste. Bioresource Technology, 2017, 246: 214-223 ( ).
- DOI: 10.1016/j.biortech.2017.07.068
- Mueller C.W., Koegel-Knabner I. Soil organic carbon stocks, distribution, and composition affected by historic land use changes on adjacent sites. Biol. Fertil. Soils, 2009, 45(4): 347-359 ( ).
- DOI: 10.1007/s00374-008-0336-9
- Sohi S.P., Krull E., Lopez Capel E., Bol R. Chapter 2 - A review of biochar and its use and function in soil. In: Advances in agronomy, Vol. 105 /D.L. Sparks (ed.). Academic Press, 2010: 47-82 (
- DOI: 10.1016/S0065-2113(10)05002-9)
- Lehmann J., Rillig M.C., Thies J., Masiello C.A., Hockaday W.C., Crowley D. Biochar effects on soil biota - a review. Soil Biology and Biochemistry, 2011, 43(9): 1812-1836 ( ).
- DOI: 10.1016/j.soilbio.2011.04.022
- Birk J.J., Steiner C., Teixeira W.C., Zech W., Glaser B. Microbial response to charcoal amendments and fertilization of a highly weathered tropical soil. In: Amazonian dark earths: Wim Sombroek's vision /W.I. Woods, W.G. Teixeira, J. Lehmann, C. Steiner, A. WinklerPrins, L. Rebellato (eds.). Springer, Dordrecht, 2009: 309-324 ( ).
- DOI: 10.1007/978-1-4020-9031-8_16
- Bailey V.L., Fansler S.J., Smith J.L., Bolton H. Jr. Reconciling apparent variability in effects of biochar amendment on soil enzyme activities by assay optimization. Soil Biology and Biochemistry, 2011, 43(2): 296-301 ( ).
- DOI: 10.1016/j.soilbio.2010.10.014
- Dempster D., Gleeson D., Solaiman Z., Jones D. L., Murphy D. Biochar addition to soil changed microbial community structure and decreased microbial biomass carbon and net inorganic nitrogen mineralised. In: Soil solutions for a changing world /R. Gilkes, N. Prakongkep (eds.). Brisbane, 2010, Vol. 2.2.1: 9-12.
- Lehmann J., Czimczik C., Laird D., Sohi S. Stability of biochar in soil. In: Biochar for environmental management: science and technology /J. Lehmann, S. Joseph (eds.). Earthscan, London-Sterling, VA, 2009: 183-206.
- Kuzyakov Y., Bogomolova I., Glaser B., Biochar stability in soil: decomposition during eight years and transformation as assessed by compound-specific 14C analysis. Soil Biology and Biochemistry, 2014, 70: 229-236 ( ).
- DOI: 10.1016/j.soilbio.2013.12.021
- Luo Y., Zang H., Yu Z., Chen Z., Gunina A., Kuzyakov Y., Xu J., Zhang K., Brookes P. Priming effects in biochar enriched soils using a three-source-partitioning approach: 14C labelling and 13C natural abundance. Soil Biology and Biochemistry, 2017, 106: 28-35 ( ).
- DOI: 10.1016/j.soilbio.2016.12.006
- Orlova N., Abakumov E., Orlova E., Yakkonen K., Shahnazarova V. Soil organic matter alteration under biochar amendment practice: study on the Podzol soils of the Leningrad region (Russia). J. Soils Sediments, 2019, 19(6): 2708-2716 ( ).
- DOI: 10.1007/s11368-019-02256-z
- Орлова Н.Е., Орлова Е.Е., Банкина Т.А. Агроэкологическая оценка применения биоугля для повышения плодородия дерново-подзолистых низко гумусированных почв. В сб.: Почвы в биосфере. Томск, 2018: 113-115.
- Крейер К.Г., Банкина Т.А., Орлова Н.Е., Юрьева Г.М. Практикум по агрохимическому анализу почв. СПб, 2005.
- Bolger A.M., Lohse M., Usadel B. Trimmomatic: A flexible trimmer for Illumina Sequence Data. Bioinformatics, 2014, 30(15): 2114-2120 ( ).
- DOI: 10.1093/bioinformatics/btu170
- Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Fierer N., Gonzalez Peña A., Goodrich J.K., Gordon J.I., Huttley G.A., Kelley S.T., Knights D., Koenig J.E., Ley R.E., Lozupone C.A., McDonald D., Muegge B.D., Pirrung M., Reeder J., Sevinsky J.R., Turnbaugh P.J., Walters W.A., Widmann J., Yatsunenko T., Zaneveld J., Knight R. QIIME allows analysis of high-throughput community sequencing data. Nature Methods, 2010, 7(5): 335-336 ( ).
- DOI: 10.1038/nmeth.f.303
- Чернов Т.И., Тхакахова А.К., Кутовая О.Д. Оценка различных индексов разнообразия для характеристики почвенного прокариотного сообщества по данным метагеномного анализа. Почвоведение, 2015, 4: 462-468 ( ).
- DOI: 10.7868/S0032180X15040036
- Чернов Т.И., Тхакахова А.К., Железова А.Д., Кутовая О.Д. Метагеном генетических горизонтов почвенного профиля. В сб.: Основные достижения и перспективы почвенной метагеномики. СПб, 2017: 68-87.
- Филиппова В.А., Круглов Ю.В., Андронов Е.Е. Филогенетическая структура сообщества прокариот дерново-подзолистой почвы под озимой рожью не зависит от агротехнических приемов. Сельскохозяйственная биология, 2018, 53(5): 994-1003 ( ).
- DOI: 10.15389/agrobiology.2018.5.994rus
- Sheng Y., Zhu L. Biochar alters microbial community and carbon sequestration potential across different soil pH. Science of the Total Environment, 2018, 622-623: 1391-1399 ( ).
- DOI: 10.1016/j.scitotenv.2017.11.337
- Abujabhah I.S., Bound S.A., Doyle R., Bowman J.P. Effects of biochar and compost amendments on soil physico-chemical properties and the total community within a temperate agricultural soil. Applied Soil Ecology, 2016, 98: 243-253 ( ).
- DOI: 10.1016/j.apsoil.2015.10.021
- Eichorst S.A., Kuske C.R. Identification of cellulose-responsive bacterial and fungal communities in geographically and edaphically different soils by using stable isotope probing. Applied Environment Microbiology, 2012, 78(7): 2316-2327 ( ).
- DOI: 10.1128/AEM.07313-11
- Prasad S., Manasa B.P., Buddhi S., Pratibha M.S., Begum Z., Bandi S., Tirunagari P., Shivaji S. Arcticibacter svalbardensis gen. nov., sp. nov., of the family Sphingobacteriaceae in the phylum Bacteroidetes, isolated from Arctic soil. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(5):1627-1632 ( ).
- DOI: 10.1099/ijs.0.044420-0


