Изменения в интенсивности перекисного окисления липидов и образовании флавоноидов у интактных и генно-модифицированных растений картофеля ( Solanum tuberosum L.) после низкотемпературного воздействия
Автор: Прядехина Е.В., Лапшин П.В., Загоскина Н.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биохимия и физиология адаптации к стрессу
Статья в выпуске: 3 т.49, 2014 года.
Бесплатный доступ
Гипотермия сопровождается изменениями в метаболизме клеток, что может приводить даже к их гибели, в связи с чем большое внимание уделяется созданию сортов сельскохозяйственных культур с повышенной устойчивостью к низким температурам. Для подобных целей успешно используются современные методы биотехнологии, в том числе введение генов десатураз, катализирующих превращение одинарной связи между атомами углерода в ацильных цепях жирных кислот в двойные, что может повышать текучесть клеточных мембран и изменять состояние антиоксидантной системы клеток. К числу факторов защиты относятся полифенолы - вторичные метаболиты растений, выполняющие функцию низкомолекулярных антиоксидантов. В настоящей работе изучен эффект кратковременного действия низкой температуры (-9 оС в течение 10 и 40 мин) на интенсивность перекисного окисления липидов (ПОЛ) и содержание флавоноидов в листьях растений картофеля раннеспелого сорта Скороплодный, культивируемых в условиях in vitro, а также полученных из них трансгенных линий со средним (ТЛС) и высоким (ТЛВ) уровнем экспрессии гена Δ12-ацил-липидной десатуразы. Для получения трансгенных линий использовали конструкции, несущие ген desA из Synechocystis sp. PCC 6803 (трансляционно слит с последовательностью репортерного гена licBM3, кодирующего термостабильную лихеназу) под контролем сильного конститутивного промотора 35S РНК CaMV. Показано, что после 10-ми-нутного действия низкой температуры интенсивность ПОЛ у контрольных растений снижалась, а у трансформантов не менялась. В варианте, когда растения подвергали гипотермии в течение 40 мин, этот показатель был низким во всех вариантах, причем наименьшим - у ТЛВ. Под влиянием низкой температуры во всех случаях накопление флавоноидов в листьях повышалось, что наиболее ярко проявлялось у контрольного варианта.
Картофель, десатураза, низкая температура, пол, флавоноиды
Короткий адрес: https://sciup.org/142133515
IDR: 142133515 | УДК: 635.21:577.21:574.24:581.19
Текст научной статьи Изменения в интенсивности перекисного окисления липидов и образовании флавоноидов у интактных и генно-модифицированных растений картофеля ( Solanum tuberosum L.) после низкотемпературного воздействия
Снижение температуры окружающей среды — один из стрессовых факторов в период онтогенеза растений. Под его влиянием изменяется метаболизм клеток, что может приводить даже к их гибели (1). В связи с этим большое внимание уделяется изучению устойчивости растений к гипотермии, а также созданию сортов сельскохозяйственных культур с повышенной устойчивостью. Для подобных целей успешно используются современные методы биотехнологии, в частности генно-инженерные подходы, в том числе введение генов десатураз — ферментов, катализирующих превращение одинарной связи между атомами углерода в ацильных цепях жирных кислот в двойные (2). Как следствие, изменяется состояние клеточных мембран (повышается текучесть), возрастает общее содержание жирных кислот и их индекс ненасыщенности, происходят изменения в антиоксидантной системе клеток, что способствует повышению устойчивости растений к низким температурам (3-5).
К числу факторов защиты относятся такие вторичные метаболиты растений, как полифенолы (6). Они способны инактивировать активные формы кислорода, возникающие при стрессовых воздействиях, то есть выполняют функцию низкомолекулярных антиоксидантов (7). О повышении содержания фенольных соединений в растительных тканях в условиях гипотермии сообщалось в литературе (8, 9).
Целью нашей работы было изучение кратковременного действия низкой температуры на перекисное окисление липидов (ПОЛ) и содержа- ние флавоноидов в листьях растений картофеля, в том числе трансформированных геном Д12-ацил-липидной десатуразы (desA).
Методика . Объектом исследования были растения картофеля ( So-lanum tuberosum L.) раннеспелого сорта Скороплодный, культивируемые на агаризованной питательной среде Мурасиге-Скуга, которая содержала 2 % сахарозы. Для получения трансгенных линий использовали конструкции, несущие ген desA из Synechocystis sp. PCC 6803 (трансляционно слит с последовательностью репортерного гена licBM3 , кодирующего термостабильную лихеназу) под контролем сильного конститутивного промотора 35S РНК CaMV (10). Трансгенные линии (ТЛ) имели средний (ТЛС) или высокий (ТЛВ) уровень экспрессии гена desA (11). Контролем служили не-трансформированные растения. Условия выращивания — 24 ° С, 16-часовой фотопериод.
Пробирки с 30-суточными растениями (без ватно-марлевых пробок) помещали в климатическую камеру MIR-153 («SANYO Electric Co., Ltd.», Япония) с температурой 0 ° С, которую в дальнейшем постепенно снижали до - 9 ° С (со скоростью 0,3 ° С/мин). Растения выдерживали в этих условиях 10 и 40 мин (3).
Содержание ТБК-реактивных продуктов, основную долю которых составляет малоновый диальдегид (МДА) — один из конечных стабильных продуктов ПОЛ, — определяли по цветной реакции с тиобарбитуровой кислотой, измеряя оптическую плотность раствора при X = 532 нм (12).
Фенольные соединения извлекали из свежих листьев 70 % этанолом (13). Количество флавоноидов определяли спектрофотометрическим методом с 1 % водным раствором хлористого алюминия (9). Калибровочную кривую строили по рутину.
Эксперименты проводили в 3-кратной биологической и 3-кратной аналитической повторностях.
Полученные данные обрабатывали с использованием программы Statistica. На рисунке представлены средние значения и их доверительные интервалы.
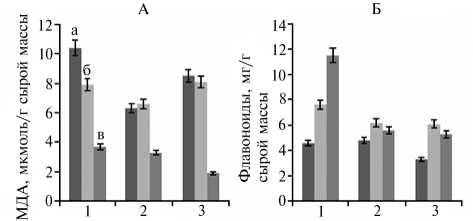
Результаты. Интенсивность ПОЛ — важный показатель физиоло гического состояния растений и их ответной реакции на стресс (14). У растений картофеля, выращенных в стандартных условиях (24 °С), наи большее количество МДА отмечали в контрольном варианте, у ТЛ оно было ниже, особенно у ТЛС (рис., А).
Вариант опыта
Содержание малонового диальдегида (МДА, А) и флавоноидов (Б) в листьях у растений картофеля ( Solanum tuberosum L.) сорта Скороплодный, нетрансформированных (1) и трансформированных геном desA со средним (2) и высоким (3) уровнем экспрессии: а — 24 ° С; б — 10 мин при - 9 ° С; в — 40 мин при - 9 ° С (лабораторный опыт).
Известно, что повышение количества МДА в клетках при стрессовом воздействии свидетельствует о деструкции липидных компонентов мембран в результате окислительного стресса и более слабой устойчивости растений к гипотермии (14, 15). В нашем случае после 10-минутного действия низкой температуры интенсивность ПОЛ снижалась только в контроле, тогда как после 40-минутного — во всех ва риантах, достигая наименьшего значения у ТЛВ. Следовательно, наличие гена desA и его активность предотвращали развитие стрессовой реакции в листьях у растений картофеля сорта Скороплодный при низкой температуре, что согласуется с данными других исследователей (16).
Основные соединения фенольной природы в листьях картофеля — флавоноиды. На их долю приходится 70 - 90 % от суммарного содержания полифенолов (10). У контрольных растений и ТЛС, выращиваемых в обычных условиях, содержание этих веществ было практически равным и превышало таковое у ТЛВ (см. рис., Б). При действии низкой температуры во всех случаях накопление флавоноидов в листьях усиливалось, что наиболее ярко проявлялось в контроле и в значительно меньшей степени — у ТЛВ и ТЛС. Следовательно, у растений картофеля, трансформированных геном desA , стимуляция накопления флавоноидов в листьях в ответ на стрессовое воздействие была выражена в значительно меньшей степени, чем у нетрансформированных.
Интересен и тот факт, что в условиях низкотемпературного стресса у контрольных растений картофеля отмечалась прямая взаимосвязь между накоплением флавоноидов и интенсивностью ПОЛ в листьях: чем выше было накопление этих вторичных метаболитов, тем менее выраженными были последствия стресса (интенсивность ПОЛ снижалась). Следовательно, проявлялась защитная роль флавоноидов (6, 7). В случае же трансгенных линий такой четкой тенденции не наблюдали.
Таким образом, в листьях растений картофеля (сорт Скороплодный), выращиваемых в условиях in vitro, при действии низкой отрицательной температуры происходили значительные изменения в содержании малонового диальдегида и флавоноидов, что не было характерно для растений, трансформированных геном desA . В частности, после 10-минутного воздействия низкой температурой интенсивность перекисного окисления липидов у контрольных растений снижалась, а у трансформантов не менялась. В варианте, когда растения подвергали гипотермии в течение 40 мин, этот показатель был низким во всех вариантах, причем наименьшим — у растений с высоким уровнем экспрессии гена desA . Это подчеркивает важную роль десатураз в адаптации растений к гипотермии. Под влиянием низкой температуры во всех случаях накопление флавоноидов в листьях повышалось, что наиболее ярко проявлялось у контрольного варианта.
Авторы выражают искреннюю благодарность Н.О. Юрьевой за любезно пре-доставленнные растения картофеля и их трансгенные линии (коллекция Института физиологии растений им. К.А. Тимирязева РАН, г. Москва).
Л И Т Е Р А Т У Р А
-
1. Трунова Т.И. Растения и низкотемпературный стресс. 64-е Тимирязевское чтение. М., 2007.
-
2. Лось Д.А. Десатуразы жирных кислот: адаптивная экспрессия и принципы регуляции. Физиология растений, 1997, 44: 528-540.
-
3. Демин И.Н., Дерябин А.Н., Синькевич М.С., Трунова Т.И. Введение гена desA ацил-липидной десатуразы цианобактерии повышает устойчивость растений картофеля к окислительному стрессу, вызванному гипотермией. Физиология растений, 2008, 55: 710-720.
-
4. Chi X., Yang Q., Pan L., Chen M., He Y., Yang Z., Yu S. Isolation and characterization of fatty acid desaturase genes from peanut ( Arachis hypogaea L.). Plant Cell Rep., 2011, 30: 1393-1404.
-
5. Los D.A., Mironov K.S., Allakhverdiev S.I. Regulatory role of membrane fluidity in gene expression and physiological functions. Photosynth. Res., 2013, 116(2-3): 489-509.
-
6. Запрометов М.Н. Фенольные соединения: распространение, метаболизм и функции в растениях. М., 1993.
-
7. Blokhina O., Violainen E., Fagerstedt K.V. Antioxidants, oxidative damage and oxygen deprivation stress. Ann. Bot., 2003, 91: 179-194.
-
8. Solecka D., Boudet A.M., Kacperska A. Phenylpropanoid and anthocyanin changes in low temperature treated winter oilseed rape leaves. Plant Physiol. Biochem., 1999, 37: 491-496.
-
9. Загоскина Н.В., Олениченко Н.А., Климов С.В., Астахова Н.В., Живу хи на Е.А., Трунова Т.И. Изменения в СО2-газообмене и образовании фенольных соединений у растений озимой пшеницы как следствие холодового закаливания. Физиология растений, 2005, 52: 366-371.
-
10. Загоскина Н.В., Прядехина Е.В., Лапшин П.В., Юрьева Н.О., Голденкова-Павлова И.В. Морфофизиологические и биохимические характеристики растений картофеля с различными уровнями экспрессии гена Д 12-ацил-липидной десатуразы. Известия РАН (серия биологическая), 2014, 2: 142-149.
-
11. Шимшилашвили Х.Р. Изучение экспрессии генов, вовлеченных в модификацию жирных кислот, на экспериментальных моделях: Автореф. канд. дис. М., 2010.
-
12. Лукаткин А.С., Голованова В.С. Интенсивность перекисного окисления липидов в охлажденных листьях теплолюбивых растений. Физиология растений, 1988, 35: 773-780.
-
13. Лукаткин А.С. Холодовое повреждение теплолюбивых растений и окислительный стресс. Саранск, 2002.
-
14. Apel K., Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction. Annu. Rev. Plant. Biol., 2004, 55: 373-399.
-
15. Дерябин А.Н., Юрьева Н.О. Экзогенная регуляция клубнеобразования у Solanum tuberosum L . в культуре in vitro. Сельскохозяйственная биология, 2010, 3: 17-25.
-
16. Demin I.N., Shimshilashvili C.R., Yur’eva N.O., Naraykina N.V., Goldenkova-Pavlova I.V., Los D.A., Nosov A.M., Trunova T.I. Overexpression of the acyl-lipid delta12-desaturase gene protects potato plants from low temperature damage. Acta Agronomica, 2011, 59: 87-99.
ФГБУН Институт физиологии растений им. К.А. Тимирязева РАН,


