Изменения в составе липидных жирных кислот вакуолярной мембраны при осмотическом стрессе
Автор: Озолина Н.В., Нестеркина И.С., Дударева Л.В., Нурминский В.Н., Гурина В.В.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 1 т.12, 2016 года.
Бесплатный доступ
Проведено исследование влияния различных типов осмотического стресса (гипо- и гиперосмотического) на состав липидных жирных кислот vacuolar мембран красной свеклы (Beta vulgaris L., Bordeaux). Примечательно, что интенсивное интенсивное стрессовое воздействие не привело к тому, что обычная неспецифическая реакция была связана с увеличением содержания микрожидкостей в ненасыщенных жирных кислотах. Эта особенность, по-видимому, может быть объяснена местоположением и биохимическими характеристиками исследуемой мембраны. Некоторое достоверное увеличение содержания короткоцепочечных насыщенных жирных кислот (C14: 0 + C15: 0) при гиперосмотическом напряжении и содержании длинноцепочечных насыщенных жирных кислот (C22: 0 + C23: 0) в обоих типах осмотического стресса. Было высказано предположение о том, что выявленные изменения в содержании насыщенных жирных кислот липидов пурпурной личинки красной свеклы были специфическими, и соответствующие жирные кислоты были наиболее чувствительны к воздействию осмотического стресса.
Короткий адрес: https://sciup.org/14323982
IDR: 14323982
Текст научной статьи Изменения в составе липидных жирных кислот вакуолярной мембраны при осмотическом стрессе
Известно, что липидный состав клеточных мембран зависит от условий окружающей среды. Действие различных стрессирующих факторов вызывает значительные изменения в их составе, что связано с регуляцией экспрессии отдельных генов, ответственных за синтез липидного метаболизма (Novickaya et al. , 2008). Жирные кислоты (ЖК) и их производные, входящие в состав мембранных липидов, играют существенную роль в клетке. Они являются резервным запасом, который может быть использован для получения энергии, в качестве строительных блоков в мембранах и действуют как сигнальные молекулы, запускающие в ответ на различные виды стрессовых факторов каскады сигнальных реакций (Baker et al. , 2006). Последние исследования показали, что жирные кислоты, являясь одними из наиболее важных липидных сигнальных молекул, активируют защитные реакции на транскрипционном уровне и способны менять конформацию и активность внутриклеточных белков и метаболитов (Hou et al. , 2015).
Липиды могут уменьшать действие стрессора, например, увеличивая количество ненасыщенных ЖК в составе мембранных липидов, что приводит к снижению микровязкости липидного бислоя (Los et al., 2013). Но, кроме этого хорошо изученного феномена, в мембране увеличивается синтез определенных липидов, которые содержатся в нормальных условиях в следовых количествах. Их содержание значительно возрастает в условиях стресса (Okazaki, Saito, 2014). К таким соединениям относятся некоторые насыщенные ЖК. Увеличение насыщенных ЖК в липидах мембран влечёт за собой уменьшение текучести мембран, что может негативно сказаться при защите от стрессирующего воздействия (Popov et al., 2012). Но, с другой стороны, эти ЖК могут принимать активное участие в сигнальной трансдукции. Целью исследования было изучение динамики содержания жирных кислот в липидах вакуолярной мембраны у корнеплодов столовой свёклы при разных видах осмотического стресса. MATERIALS AND METHODS
Объектом исследования служили корнеплоды столовой свеклы (Beta vulgaris L.), сорт Бордо. В экспериментах были использованы корнеплоды в период покоя, которые находились в овощехранилище в течение нескольких месяцев при температуре 4-5оС. Эти корнеплоды подвергали гипер- и гипоосмотическому стрессу. Для создания гиперосмотического стресса корнеплоды в течение 3-х суток выдерживали (подсушивали) на открытом воздухе при комнатной температуре, что приводило к частичной потере массы корнеплодов и увеличению осмотической концентрации клеточного сока. Для создания гипоосмотического стресса очищенные корнеплоды выдерживали в течение суток в дистиллированной воде, в результате чего осмоляльность клеточного сока (общая концентрация растворенных частиц в 1 кг воды) уменьшалась. Осмоляльность оценивали на осмометре ОМКА 1Ц-01 (Россия). Характеристики стрессов приведены на рис. 1. Влияние осмотического стресса на барьерные свойства мембран (стабильность мембран) изучали с использованием экспериментальной установки собственного изготовления, позволяющей получать серии компьютерных изображений (цейтраферная видеосъемка, частота кадров 0.1 мин-1 (1 кадр за 10 мин)), отражающих динамику процесса разрушения вакуолей (Nurminskiy et al., 2004). С помощью компьютерной обработки данных строили график зависимости количества сохранившихся вакуолей (%) от времени и рассчитывали значения периода полураспада изолированных вакуолей, в течение которого разрушаются 50% вакуолей (Т1/2).
Вакуолярные мембраны получали по методу (Salyaev et al. , 1981). Критерии оценки чистоты использованных в экспериментах изолированных мембран по ферментам-маркёрам приведены в статье (Ozolina et al. , 2013).
Из вакуолярных мембран, выделенных из нормальных и подвергнутых разным видам осмотического стресса корнеплодов, экстрагировали липиды по методу Блая и Дайера (Bligh, Dyer, 1959). Экстрагированные липиды использовали в экспериментах по изучению жирнокислотного состава липидов тонопласта. Для получения метиловых эфиров жирных кислот после упаривания к экстракту липидов добавляли 1% метанольный раствор H 2 SO 4. Полученную смесь нагревали на водяной бане при температуре 55ºС в течение 30 мин. После охлаждения метиловые эфиры жирных кислот трижды экстрагировали гексаном. Экстракт концентрировали в токе аргона
(Carreau, Dubacq, 1978) Далее метиловые эфиры жирных кислот липидов тонопласта и микродоменов анализировали на хромато-масс-спектрометре 5973 N/6890N MSD (Agilent Technology, США). Для разделения использовали капиллярную колонку HP-INNOWAX (30 м × 250 мкм × 0.50 мкм). Неподвижная фаза – полиэтиленгликоль. Подвижная фаза – гелий; скорость потока газа – 1 мл/мин. Температура испарителя 250ºС, источника ионов – 230ºС, детектора – 150ºС, температура линии, соединяющей хроматограф с масс-спектрометром – 280ºС. Хроматографирование проводили в изократическом режиме при 200ºС. Для идентификации пиков метиловых эфиров жирных кислот использовали значение времени удерживания стандартов и индекс эквивалентной длины алифатической цепи (ECL) (Christie, 1988).
В таблице и на графиках представлены средние арифметические значения величин и их стандартные отклонения, которые были получены в пяти независимых экспериментах, подсчитанные с помощью программы Microsoft Excel. Статистическую значимость различий сравниваемых средних значений оценивали с помощью U-критерия Манни-Уитни.
RESULTS AND DISCUSSION
Как видно их данных, приведённых на рис. 1, при осмотическом стрессе происходили существенные изменения массы корнеплода столовой свёклы и осмотической концентрации клеточного сока. Так, при осмотическом стрессе изменение массы корнеплода происходило приблизительно на 20% (в сторону увеличения или уменьшения в зависимости от вида стресса) и осмотическая концентрация клеточного сока снижалась на 12%. При гипоосмотическом стрессе в 2 раза снижался период полураспада изолированных вакуолей, что говорит о значительных нарушениях стабильности вакуолярной мембраны (рис. 2). Эти показатели позволяют говорить о том, что стрессовая нагрузка была достаточно интенсивной. Тогда как результаты изучение состава ЖК липидов тонопласта существенных изменений не показывают (табл. 1). Особенно удивляет отсутствие различий при осмотическом стрессе в содержании ненасыщенных ЖК (табл. 1), которые по общепринятому мнению в первую очередь должны реагировать на стрессовое воздействие (Los et al., 2013). Очень мало менялся индекс ненасыщенности (ИН, табл. 1) ЖК. Увеличение ненасыщенных ЖК было отмечено при разных видах абиотического стресса. Так, увеличение концентрации ненасыщенных ЖК является одним из важнейших факторов низкотемпературной адаптации, что было неоднократно продемонстрировано на многих растительных объектах (Badea, Basu, 2009). Влияние водного дефицита (засухи) на липидный метаболизм листьев Arabidopsis thaliana также вызывало активацию десатуразной активности и было показано, что уровень ненасыщенности полярных липидов увеличивался в растениях не чувствительных к водному дефициту. Подобные результаты были получены и многими другими исследователями (Gigon et al., 2004).
Как видно из приведенных данных (табл. 1), в составе липидов вакуолярных мембран корнеплодов столовой свеклы преобладали ненасыщенные ЖК, содержание которых в норме и при гипоосмотическом стрессе составляло 65.75% и 66.87% и немного уменьшалось при гиперосмотическом стрессе – до 65.31%, соответственно. Содержание насыщенных жирных кислот также изменялось в зависимости от стресса очень незначительно – сумма насыщенных ЖК в норме составила 34.25%, а при гипоосмотическом стрессе 33.13% и 34.69% при гиперосмотическом. Отсутствие различий в содержании ненасыщенных жирных кислот при осмотическом стрессе (табл. 1) может быть связано с объектом исследований – тонопластом корнеплодов столовой свёклы, который имеет определенное расположение внутри клетки (первое стрессирующее воздействие принимает плазмалемма). Кроме того, вакуоли клеток корнеплода столовой свеклы обладают мощными защитными антиоксидантными системами, к которым в первую очередь относятся бетацианины (Pedreno, Escribano, 2001).
Более тщательный анализ состава ЖК липидов тонопласта при разных видах осмотического стресса показал, что достоверные различия были обнаружены при сравнении суммы короткоцепочечных насыщенных жирных кислот (С14:0+С15:0) (рис. 3). И если при гипоосмотическом стрессе их суммарное содержание практически не отличалось от контроля, то при гиперосмотическом стрессе содержание суммы короткоцепочечных насыщенных ЖК увеличивалось в 1.4 раза. По литературным данным повышенное содержание короткоцепочечных ЖК характерно для морских водорослей (Fleurence et al., 1994). Кроме того, сообщалось об увеличении содержания ЖК С14 в ответ на солевой стресс у видов Isochysis (Repand, Parry, 1994). Значительное увеличение ЖК С12 и С14 было отмечено в плазматической мембране Zygosaccharomyces rouxii, когда клетки выращивали при повышенном содержании NaCl (Hosono, 1992). Такая же закономерность была отмечена при солевом стрессе в плазмалемме из каллуса Spartina paters (Wu et al., 2005). В настоящее время доказана важная роль короткоцепочечных ЖК как сигнальных молекул, принимающих участие в регуляции экспрессии целого ряда генов, регулирующих клеточные функции и поддерживающие гомеостаз (Tan et al., 2014). Можно предположить, что изменения в содержании короткоцепочечных ЖК является специфическим ответом на солевой и осмотический стресс, так как их повышенное содержание отмечено в основном при этих стрессирующих воздействиях.
Достоверные различия были выявлены также во фракции насыщенных длинноцепочечных ЖК (С22:0+С23:0) (рис. 4). Длинноцепочечные жирные кислоты обеспечивают плотность упаковки липидного бислоя (Taranov, 1988). При обоих видах осмотического стресса их суммарное содержание превышало контроль в 1.5 раза.
В последнее время в ряде исследований обнаружена зависимость адаптационных механизмов растительной клетки от содержания длинноцепочечных жирных кислот. Так, было отмечено 30%-е повышение относительного содержания этих ЖК в тканях проростков пшеницы, растущих в условиях низких (4ºС) температур (Makarenko et al., 2010). В 2 раза увеличивалось содержание насыщенных длинноцепочечных ЖК на первом этапе при действии лазерного излучения низкой интенсивности на каллусную ткань пшеницы ( Dudareva et al., 2014). Эффективная стратегия защиты у Noccaea caerulescens от стресса вызванного высокими концентрациями кадмия также была связана с синтезом длинноцепочечных ЖК (Zemanova et al., 2015). Повышенное содержание ЖК с очень длинной цепью было отмечено в липидах вегетативных органов галофитов. Рост насыщенности ЖК и длины их цепей вызывал уменьшение текучести мембран и индуцировал эффект снижения проницаемости мембран для ионов натрия. Был сделан вывод, что увеличение содержания в липидах длинноцепочечных ЖК является адаптивной реакцией, направленной на поддержание роста растений в условиях солевого стресса (Ivanova et al., 2009).
В наших экспериментах только для арахиновой ЖК (С20:0) было отмечено противоположное изменение её содержания при разных видах осмотического стресса. При гипоосмотическом стрессе содержание этой ЖК снижалось в 1.3 раза, а при гиперосмотическом увеличивалось в 1.5
раза. И хотя большая ошибка в контрольном варианте не позволяет утверждать, а только высказать предположение о тенденции в изменении её содержания при стрессе, характер этих изменений говорит о специфичности изменений в её содержании при разных видах осмотического стресса. Изменения в содержании арахиновой кислоты, судя по литературным данным, наблюдаются при всех видах стресса, но исследователи при анализе в первую очередь обращают внимание на изменения в содержании ЖК, количество которых в процентном отношении выше и чьи изменения более заметны. Так, при изучении жирнокислотного состава липидов мембран митохондрий проростков гороха при недостаточном увлажнении (гиперосмотический стресс) содержание арахиновой кислоты увеличивалось в 2 раза. Такие же результаты были получены на мембранах проростков гороха – содержание арахиновой кислоты в условиях недостаточного увлажнения возрастало в 2 раза по сравнению с контролем (Zhigacheva et al., 2010). При других видах абиотического стресса было отмечено снижение содержания арахиновой ЖК.
Table 1. Динамика изменения содержания жирных кислот липидов вакуолярных мембран корнеплодов столовой свеклы в норме и при разных видах осмотического стресса
|
Обозначение |
Содержание жирных кислот липидов тонопласта, % от общего содержания |
||
|
Норма |
Гипоосмотический стресс |
Гиперосмотический стресс |
|
|
С14:0 |
0.50 ±0.04 |
0.53 ± 0.07 |
0.74 ± 0.16 |
|
С15:0 |
0.83 ± 0.08 |
0.96 ± 0.10 |
1.09 ± 0.24 |
|
С16:0 |
28.28 ± 1.01 |
27.83 ± 0.79 |
28.15 ± 0.29 |
|
С16:1(n-9) |
1.66 ± 0.82 |
1.04 ± 0.13 |
1.48 ± 0.25 |
|
С17:0 |
0.29 ± 0.09 |
0.30 ± 0.07 |
0.21 ± 0.04 |
|
С18:0 |
2.55 ± 0.53 |
1.85 ± 0.90 |
1.88 ± 0.19 |
|
С18-1 (n-9) |
22.24 ± 1.38 |
20.01 ± 2.64 |
20.36 ± 0.38 |
|
С18-2 (n-6) |
37.53 ± 1.04 |
40.47 ± 2.97 |
38.89 ± 1.42 |
|
С18-3(n-3) |
4.03 ± 0.33 |
4.62 ± 0.43 |
4.40 ± 0.17 |
|
С20:0 |
0.76 ± 0.4 |
0.64 ± 0.16 |
1.10 ± 0.03 |
|
С 20:1 (n-11) |
0.45 ± 0.05 |
0.50 ± 0.04 |
0.45 ± 0.11 |
|
С22:0 |
0.31 ± 0.07 |
0.43 ± 0.05 |
0.51 ± 0.07 |
|
С22:1 (n-11) |
0.21 ± 0.04 |
0.23 ± 0.03 |
0.24 ± 0.04 |
|
С23:0 |
0.37 ± 0.06 |
0.56 ± 0.11 |
0.48 ± 0.14 |
|
∑ насыщенных |
34.25 ± 0.20 |
33.13 ± 1.45 |
34.69 ± 1.96 |
|
∑ ненасыщенных |
65.75 ± 0.19 |
66.87 ± 1.45 |
65.31 ± 1.96 |
|
ИДС |
1.11 ± 0.01 |
1.17 ± 0.05 |
1.12 ± 0.04 |
|
∑ ненасыщ./насыщенных жирных кислот |
1.93 ± 0.01 |
2.06 ± 0.14 |
1.91 ± 0.16 |
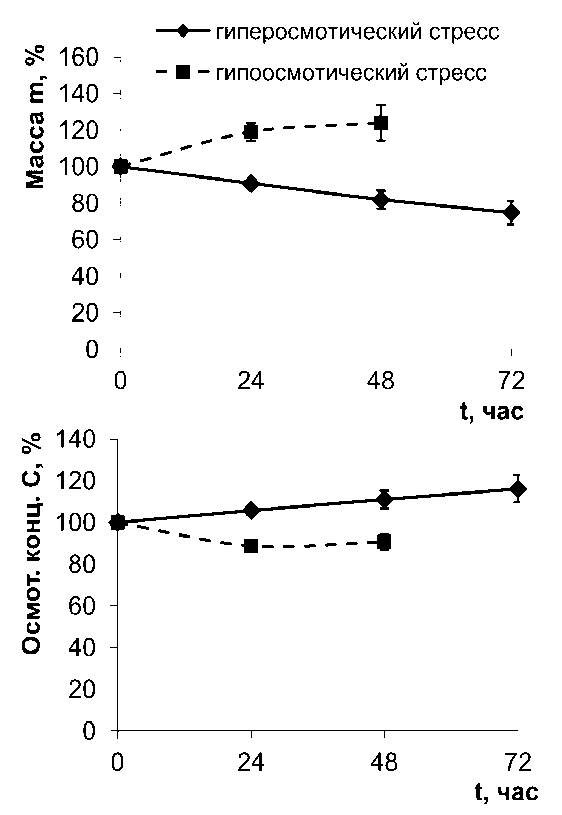
Figure 1. Характеристики гипо- и гиперосмотического стрессов. Изменение осмотической концентрации (С) клеточного сока и массы (m) корнеплодов.
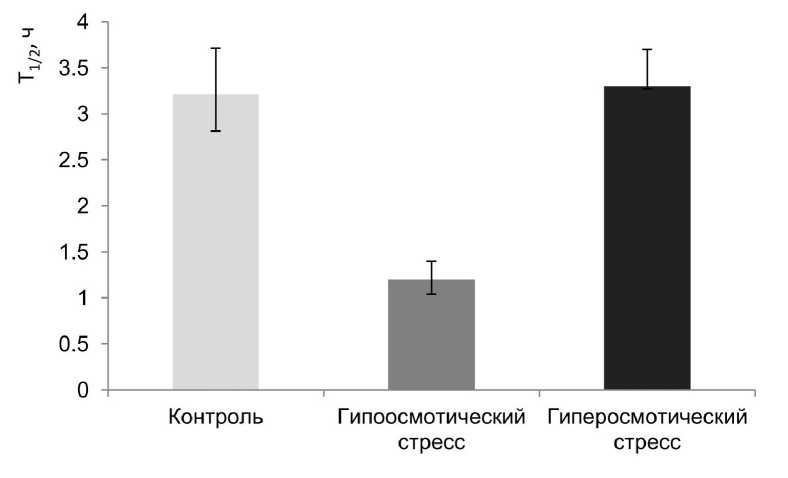
Figure 2. Влияние разных видов осмотического стресса на период полураспада изолированных
вакуолей Т 1/2 . Результаты получены методом цейтраферной видеосъемки.
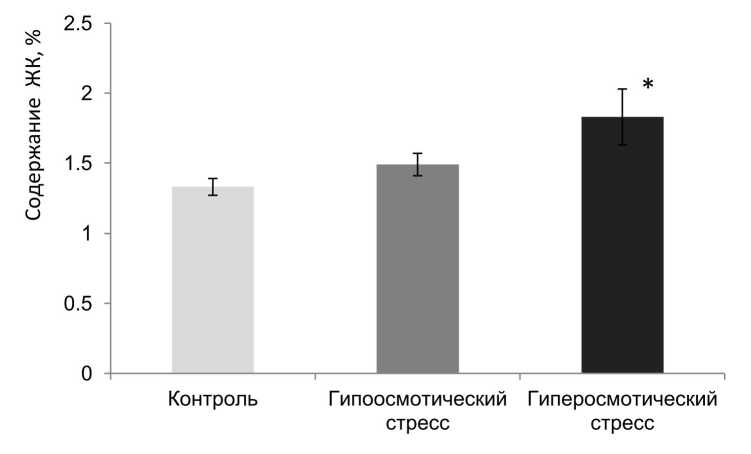
Figure 3. Сумма короткоцепочечных ЖК (С14:0+С15:0) в тонопласте в норме и при разных видах
осмотического стресса. * - различия достоверны (р<0.05, критерий Манна-Уитни).
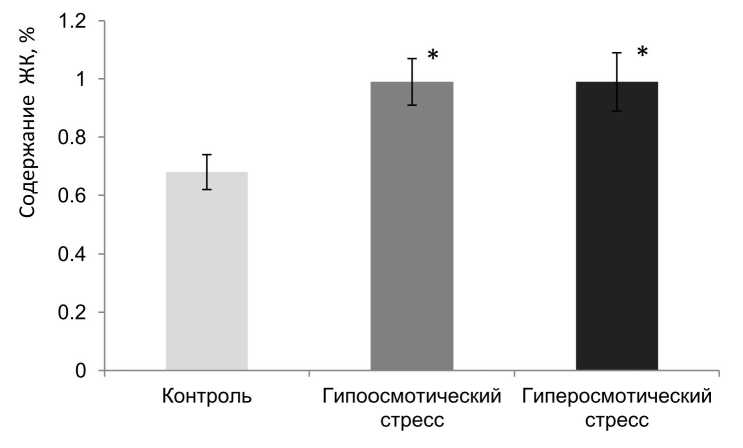
Figure 4. Сумма длинноцепочечных ЖК (С22:0+С23:0) в тонопласте в норме и при разных видах
осмотического стресса. * - различия достоверны (р<0.05, критерий Манна-Уитни).
При температурном стрессе (4ºС) у липидов колеоптилей и корней этиолированных проростков пшеницы содержание арахиновой кислоты снижалось в 1.8 раза у колеоптилей и в 1.5 раза у корней (Makarenko et al., 2010). Менее заметное снижение было отмечено этими авторами на других объектах (проростки кукурузы и проростки пырейника сибирского). Ещё более заметное снижение содержание арахиновой кислоты было отмечено при изучении жирнокислотного состава тканей каллусов пшеницы: после 5 мин низкоинтенсивного лазерного излучения, которое классифицировалось как стрессовое воздействие, содержание этой кислоты возрастало в 3.4 раза. (Dudareva et al., 2014). Таким образом, изменение содержания арахиновой ЖК в мембранах, вероятно, является специфичным для определённых видов абиотического стресса.
CONCLUSIONS
В результате проведённых экспериментов можно предположить, что при осмотическом стрессе у корнеплодов столовой свёклы одним из звеньев в цепи биохимических реакции, участвующих в формировании ответа на стрессовое воздействие является повышение содержания определённых насыщенных ЖК. Повышение содержания ненасыщенных ЖК в мембранах при абиотическом стрессе в данном случае не наблюдалось, что не подтвердило общепринятое представление. Это может быть связано с особенностями объекта исследования. Вакуолярная мембрана чувствительна к осмотическому стрессу, и выявленные изменения в содержании ЖК ее липидов могут являться специфичным ответом при этом стрессирующем воздействии.
ACKNOWLEDGMENT
Исследование выполнено при финансовой поддержке РФФИ в рамках научных проектов № 14-04-31103 мол_а. В работе использовалось оборудование Байкальского аналитического центра (ЦКП) ИНЦ СО РАН.
Список литературы Изменения в составе липидных жирных кислот вакуолярной мембраны при осмотическом стрессе
- Badea C., Basu S.K. (2009) Effect of low temperature on metabolism of membrane lipids in plants and associated gene expression. Plant Omics., 2, 78-84
- Baker A., Graham I.A., Holdsworth M., Smith S.M., Theodoulou F.L. (2006) Chewing the fat: β-oxidation in signaling and development. Trends Plant Sci., 11, 124-132
- Bligh E.G., Dyer W.J. (1959) A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol., 37, 911-917
- Carreau J.P., Dubacq J.P. (1978) Adaptation of macro-scale method to the micro-scale for fatty acid methyl transesterification of biological lipid extracts. J. Chromatogr., 151, 384-390
- Christie W.W. (1988) Equivalent chain lengths of methyl ester derivatives of fatty acids on gas chromatography: a reappraisal. J. Chromatogr., 447, 305-314
- Dudareva L.V., Rudikovskya E.G., Shmakov V.N. (2014) The influence of low-intensity He-Ne laser radiation on the fatty acid composition of callus tissues of wheat (Triticum aestivum L.). Biologicheskie Membrany, 31, 364-370
- Fleurence J., Gutbier G., Mabeau S., Leray C., (1994) Fatty acids from 11 marine macroalgae of the French Britany coast. J. Appl. Phycol., 6, 527-532
- Gigon A., Matos A.-R., Laferay D., Zuily-Fodil Y., Pham-Thi A.-T. (2004) Effect of drought stress on lipid metabolism in the leaves of Arabidopsis thaliana (Ecotype Columbia). Ann. Bot., 94, 345-351
- Hosono K., (1992) Effect of salt stress on lipid composition and membrane fluidity of the salt tolerant yeast Zygosaccaharomyces rouxil. J. Gen. Microbiol., 138, 91-96
- Hou Q., Ufer G., Bartels D. (2015) Lipid signaling in plant responses to abiotic stress. Plant Cell Environ DOI: 10.1111/pce.12666
- Ivanova T.V., Myasoedov N.A., Pchelkin V.P., Cydendambaev V.D., Vereschagin A.G. (2009) Enhanceable maintenance of fat acids with a very long chain in lipids of vegetative organs of halophytes. Fiziologiya Rastenii, 56, 871-878
- Los D.A., Mironov K.S., Allakhverdiev S.I. (2013) Regulatory role of membrane fluidity in gene expression and physiological functions. Photosynth. Res., 343, 489-509
- Makarenko S.P., Dudareva L.V., Katyshev A.I., Konenkina T.A., Nazarova A.V., Rudikovskaya E.G., Sokolova N.A., Chernikova V.V., Konstantinov Yu.M. (2010) Impact of low temperature on fatty acid composition of crop species with different cold resistance. Biologicheskie Membrany, 27, 486-488
- Novickaya G.V., Feofilaktova T.V., KocheshkovA T.K., Yusupova I.U., Novickiy Yu.I. (2008) Change of composition and maintenance of lipids in the leaves of magnitoorientations types of radish under influence of the weak permanent magnetic field. Fiziologiya Rastenii, 55, 541-551
- Nurminskiy V.N., Korzun A.M., Rozinov S.V., Salyaev R.K. (2004) Computer-based stop motion video-capturing of faction of isolated vacuoles. Biomeditsinskaya khimiya, 50, 180-187
- Okazaki Y., Saito K. (2014) Roles of lipids as signaling molecules and mitigators during stress response in plants. Plant J., 79, 584-596
- Ozolina N.V., Nesterkina I.S., Kolesnikova E.V., Salyaev R.K., Nurminsky V.N., Rakevich A.L., Martynovich E.F., Chernyshov M.Yu. (2013) Tonoplast of Beta vulgaris L. contains detergent-resistant membrane microdomains. Planta, 237, 859-871
- Pedreno MA., Escribano J. (2001) Correlation between antiradical activity and stability of betaine from Beta vulgaris L. roots under different pH, temperature and light conditions. J. Sci. Food Agric., 81, 627-631
- Popov V.N., Antipina O.V., Pchelkin V.P., Cydendambaev V.D. (2012) Change of maintenance and fatty acids composition of lipids of leaves and roots of tobacco at low temperature hardening. Fiziologiya Rastenii, 59, 203-208
- Salyaev R.K., Kuzevanov V.Ia., Khaptagaev S.B., Kopytchuk V.N. (1981) Segregation and cleaning of vacuoles and vacuolar membranes from the cell of plants. Fiziologiya Rastenii, 28, 1295-1305
- Tan J., McKenzie C., Potamitis M., Thorburn AN., Mackay CR., Macia L. (2014) The role of short-chain fatty acids in health and disease. Adv. Immunol., 121, 91-119
- Taranov N.P. (1988) Lipids of CNS under damaging influences. Science, Leningrad, Russia
- Wu J., Seliskar D., Gallagher J. (2005) The response of plasma membrane lipid composition in callus of the halophyte Spartina patens (Poaceae) to salinity stress. Am. J. Bot., 92, 852-858
- Zemanova V., Pavlik M., Kyjakova P., Pavlikova D. (2015). Fatty acid profiles of ecotypes of hyperaccumulator Noccaea caerulescens growing under cadmium stress. J. Plant Physiol., 180, 27-34
- Zhigacheva I.V., Mesharina T.A., Terenina M.B., Krikunova N.N., Burlakova E.B., Generozova I.P., Shugaev A.G., Fattakhov S.G. (2010) Fattty acid composition of pea germ mitochondrial membranes exposed to insufficient watering and treated with organophosphorus plant growth regulator. Biologicheskie Membrany, 27, 256-261


