Изменения в составе липидов мембран клеток и субклеточных фракций пресноводного растения Hydrilla verticillata (L. Fil.) Royle под действием ионов тяжелых металлов
Автор: Розенцвет О.А., Нестеров В.Н., Синютина Н.Ф.
Журнал: Самарская Лука: проблемы региональной и глобальной экологии @ssc-sl
Рубрика: Итоги научных исследований
Статья в выпуске: 1 т.19, 2010 года.
Бесплатный доступ
Проведено сравнительное исследование изменения состава и содержания липидов клеток и субклеточных фракций пресноводного растения Hydrilla verticill a t a (L. fil.) Royle после 1, 3 и 10 суточной обработки ионами Cu 2+ и Zn 2+. Растения инкубировали в 100 мкМ растворах нитратных солей ТМ. Накопление ТМ негативно влияло на рост биомассы, интенсивность процесса фотосинтеза, приводило к снижению содержание хлорофиллов a и b. Однако, степень и направленность изменений состава и содержания суммарных липидов, мембранных фосфо- и гликолипидов и жирных кислот зависели от природы ТМ. На субклеточном уровне организации исследуемые ТМ вызывают специфические перестройки состава, содержания и метаболизма липидов. В статье обсуждается взаимосвязь физиологических и биохимических нарушений, вызванных действием ионов Cu 2+ и Zn 2+, а так же защитные реакции с участием липидов на уровне организма и клеточных органелл.
Тяжелые металлы, мембраны, липиды, жирные кислоты, микросомы, митохондрии, хлоропласты
Короткий адрес: https://sciup.org/148314811
IDR: 148314811 | УДК: 581.192:577.7.15
Текст научной статьи Изменения в составе липидов мембран клеток и субклеточных фракций пресноводного растения Hydrilla verticillata (L. Fil.) Royle под действием ионов тяжелых металлов
Х имическое загрязнение водной среды тяжелыми металлами (ТМ) представляет собой одну из актуальных проблем экологии. В значительной степени это связано с биологической активностью многих элементов. Такие элементы, как медь и цинк в малых количествах необходимы для жизнедеятельности организмов. В высоких же концентрациях, наоборот, вызывают отрицательный эффект и могут приводить к гибели.
От состояния водной растительности во многом зависит направленность процессов происходящих в водоеме – самоочищения или загрязнения. Это средообразующее свойство водных растений базируется на физиологических и биохимических реакциях в ответ на тот или иной фактор среды.
Известно, что жизнедеятельность как одноклеточных, так и многоклеточных организмов во многом определяют биологические мембраны, поскольку они: отделяют содержимое клетки от внешней среды, участвуют в создании внутренней архитектуры клетки, поддерживают градиент концентраций и электрохимического потенциал, осуществляют транспорт питательных веществ внутрь клетки, а продуктов обмена веществ – наружу (Болдырев, 2001).
Основу биологических мембран представляют надмолекулярные ансамбли липидов, от состава и содержания которых зависит целостность мембран и их функциональная активность.
В связи с вышесказанным, исследование влияния тяжелых металлов (ТМ) на липидный комплекс клетки и ее органелл представляет научный интерес и имеет значение в понимании механизмов регуляции, адаптации и устойчивости водных растений как важного компонента многих водных экосистем.
Целью настоящей работы было сравнительное исследование изменения состава и содержания липидов мембран клеток и субклеточных фракций пресноводного растения Hydrilla verticillata (L. fil.) Royle под действием Cu2+ и Zn2+.
МЕТОДИКА
Объектом исследования служило водное сосудистое растение Hydrilla verticillata (L. fil.) Royle (Hydrocharitaceae) (Полонский, 1994). Растения выращивали в лабораторных условиях на 5% среде Хогланда-Арнона.
Постановка эксперимента . Перед началом эксперимента побеги растений разрезали на фрагменты весом 2-4 г и помещали их в вегетационные сосуды объемом 1 л. В опытные варианты добавляли соли Cu(NO3)2, Zn(NO3)2 в концентрации 100 мкМ. Использованная концентрация нитратных солей металлов выбрана, исходя из ранее исследованных концентрационных и временных зависимостей влияния ТМ на липидный, белковый и пигментный метаболизм водных растений (Розенцвет и др., 2005). Растения инкубировали в условиях освещения - 1400 ± 200 лк при 10-часовом световом дне и температуре 20оС. В данных условиях растения выдерживали 1, 3 и 10 суток. По истечении заданного времени часть растений промывали в проточной воде и использовали для анализов.
Содержание ТМ в тканях растений определяли на атомно-абсорбционном спектрофотометре МГА-915 (Россия) после мокрого озоления (Голубкина, 1995).
Выделение клеточных фракций проводили c помощью метода дифференциального центрифугирования в градиенте концентрации сахарозы (Кейтс, 1975).
Экстракцию липидов проводили по методу Блайя и Дайэра (1959). Количественное содержание СЛ определяли взвешиванием аликвот экстрактов, высушенных в вакууме до постоянного веса.
Разделение ФЛ проводили методом двумерной тонкослойной хроматографии на стеклянных пластинках (6 х 6 см) с закрепленным слоем силикагеля с использованием систем растворителей: хлороформ : метанол : бензол : аммиак (130 : 60 : 20 : 12) – первое направление; хлороформ : метанол : бензол : ацетон : уксусная кислота (140 : 60 : 20 : 10 : 8) – второе направление. Проявляли ФЛ опрыскиванием пластинок 10% H2SO4 в метаноле с последующим нагреванием их при температуре 180оC в течение 15 мин. Количество ФЛ определяли по содержанию неорганического фосфора (Vaskovsky, Latyshev, 1975)
Разделение ГЛ проводили методом одномерной ТСХ на пластинках (10 х 10 см) с закрепленным слоем силикагеля с использованием системы растворителей: ацетон : бензол : вода (91 : 30 : 8). Проявляли ГЛ опрыскиванием пластинок 5% 12MoO3 х H3PO4 в метаноле и последующим нагреванием их при температуре 150оC в течение 10 мин. Количество ГЛ определяли денситометрически (Кейтс, 1975).
Для анализа ЖК использовали их метиловые эфиры, которые получали путем кипячения в 5% HCl в метаноле (Кейтс, 1975). Полученные эфиры очищали препаративной ТСХ и анализировали на газо-жидкостном хроматографе “Хроматэк Кристалл 5000.1” (Россия) с использованием капиллярной колонки длиной 105 м и диаметром 0.25 мм “RESTEK” (США). Температура колонки - 180оС, испарителя и детектора -260оС. Скорость тока газа-носителя (гелий) - 20 мл/мин.
Определение путей синтеза липидов проводили с помощью радиоизотопов. Растения инкубировали в присутствии 100 мкM Cu(NO3)2, Zn(NO3)2 в течение 3 суток, затем выдерживали 1 час в воде с 185 кБк [2-14C]-ацетатом натрия. Включение 2-14С-ацетата в липиды измеряли с помощью счетчика Beckman LS-100 с комплексом электронной аппаратуры «Протока» марки 2154-1-1м.
Данные обрабатывали статистически. Определения проводили в трех биологических и трех аналитических повторностях. Значения в таблицах и рисунках представляют средние арифметические из всех опытов и их стандартные ошибки.
РЕЗУЛЬТАТЫ
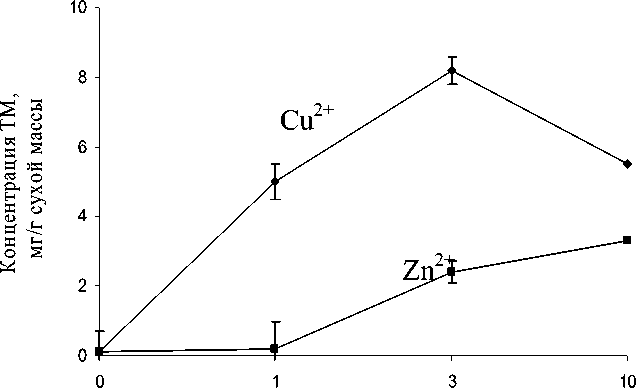
Как видно из рис. 1. H. verticillata аккумулировала Cu2+ в большей степени, чем Zn2+, с максимумом содержания на 3 сутки инкубирования в количестве 8,2 мг/г сухой массы. Содержание Zn2+ в растении возрастало монотонно и на 10 сутки эксперимента составило 3,3 мг/г сухой массы.
Опыты показали, что в отсутствии солей металлов в течение всего времени инкубирования H. verticillata наращивала биомассу, в среднем на 17,6 %. В присутствии ионов ТМ растения снижали прирост биомассы. Однако, степень изменения роста была связана как с динамикой аккумулирования, так и со свойствами элемента (табл. 1). Наибольшие потери массы зафиксированы на 10 сутки воздействия Cu2+ - 11,7%. Zn2+ вызывал потери массы на 6,1% после 3 суток и 7,3% после 10 суток инкубации.
Важной физиологической характеристикой, напрямую связанной с биопродуктивностью растений, является показатель интенсивности процесса фотосинтеза. Добавление ионов Cu2+ в среду инкубации приводило к снижению количества выделенного кислорода на 30,8-64,1% в сравнении с контролем. При влиянии Zn2+ содержание кислорода в воде уменьшалось не более чем на 10,3-17,9 % по отношению к контролю.
Некоторые авторы считают, что снижение уровня фотосинтеза у растений в присутствии ТМ связано в первую очередь с их негативным влиянием на фотосинтетические пигменты (Krupa, 1988; Krupa, Baszynsky, 1989; Tukendorf, Baszynski, 1991).
Продолжительность воздействия, сутки
Рис. 1. Динамика накопления ТМ в тканях растения H. verticillata (мг/г сухой массы)
В связи с этим было исследовано изменение содержания данных соединений в растениях, подвергавшихся воздействию ТМ.
К основным группам пигментов растительного происхождения, принимающих непосредственное участие в фотосинтезе, относятся хлорофиллы и каротиноиды. Каждая группа пигментов включает большое число различных пигментных форм. В данном исследовании мы анализировали наиболее важные для высших растений пигментные системы - хлорофиллы a и b, каротиноиды.
Наиболее токсичным ТМ для зеленых пигментов оказалась Cu2+ – содержание хлорофиллов а+b сокращалось на 54,9-74,6% в сравнении с контролем. Деградация пигментов, хотя и в меньшей степени, происходила под влиянием Zn2+ (на 9,9-40,8%).
Каротиноиды оказались менее подверженными негативному действию ТМ по сравнению с хлорофиллами, что согласуется с данными других авторов (Бриттон, 1986; Krupa, 1988; Skorzynska – Polit, Baszynski, 1995; Tukendorf, Baszynski, 1991). Лишь под действием Cu2+ наблюдались значительные перемены (снижение в 1,3-4,0 раза) в их содержании.
Таким образом, на фоне накопления ионов ТМ происходило ингибирование роста растений под влиянием Zn2+, а также потери биомассы под влиянием Cu2+. Снижение интенсивности фотосинтеза подтверждается уменьшением содержания фотосинтетических пигментов. Характер изменения зависел от длительности экспозиции растений с ТМ и их токсичности. Cu2+ ингибировала уровень фотосинтеза и отрицательно влияла на количество хлорофиллов в большей степени, чем Zn2+.
Суммарные липиды (СЛ), экстрагируемые из растений по используемой нами методике, содержат мембранные ФЛ и ГЛ.
Результаты анализа суммарных липидов показаны в табл. 2. В контрольных образцах, в отсутствии ТМ, содержание суммарных липидов составляло в среднем 7,0 -для H. verticillata в течение контролируемых 10 суток эксперимента. В присутствии Cu2+ содержание СЛ H. verticillata снижалось с первых суток воздействия на 35,758,6 %. Действие Zn2+ у H. verticillata способствовало увеличению количества СЛ на 32,9-57,1 %. Для детального исследования приспособительных реакций растений на молекулярном уровне необходимо было изучить динамику содержания отдельных групп липидов и их составляющих.
ФЛ, наряду с ГЛ представляют основную массу липидов мембран растительных клеток. Установлено, что в контрольных образцах H. verticillata содержалось в среднем 282.5 мг ФЛ на г липидов растений (табл. 2). Cu2+ способствовала деградации ФЛ на 49,6-73,4 % в сравнении с контролем. Воздействие Zn2+ приводило к достоверному снижению количества ФЛ относительно контроля только при 10 суточной инкубации – на 60,2 %.
Среди ФЛ у исследуемых видов растений, нами были индентифицированы следующие компоненты: ФХ, ФЭ, ФГ, ФИ, ДФГ и ФК. Данные из табл. 2 демонстрируют, что поведение индивидуальных ФЛ при воздействии различных ТМ было крайне неоднородным. При анализе состава ФЛ клеток H. verticillata в присутствии Cu2+ наблюдалось снижение основных структурных компонентов биомембран - ФХ, ФЭ относительно контроля на 15,7-25,8 % и 18,0-51,6 % соответственно. Одновременно увеличивалось относительное содержания ФГ – основного представителя ФЛ мембран хлоропластов на 41,2-66,5 % и продуктов распада ФЛ, таких как ФК на 16,9-74,6 %.
Динамика накопления ТМ в тканях растения H. verticillata (мг/г сухой массы), изменение биомассы (г) и параметров фотосинтеза в зависимости от длительности воздействия (условия инкубирования: концентрация ТМ - 100 мкМ, время воздействия - 1, 3,10 суток)
|
Металл/ время воздействия |
Содержание ТМ, мг/г сухой массы |
Прирост биомассы, г |
Параметры фотосинтеза |
||||
|
начало экспозиции |
конец экспозиции |
% |
Содержание О 2 в воде, мг/л на г растений |
Хлорофилл a+b, мг/г сырой массы |
Каротиноиды, мг/г сырой массы |
||
|
Контроль, 10 сут. |
< 0.1 |
3.98 ± 0,02 |
4.68 ± 0.04 |
+17.6 |
3.9±0.1 |
0.71±0.01 |
0.04 ± 0.00 |
|
Cu2+, 1 сут. |
5.0 (5.0) ± 0.6 |
3.84 ± 0.06 |
3.86 ± 0.01 |
+0.5 |
2.7±0.1 |
0,73±0.01 |
0.03 ± 0.00 |
|
Cu2+, 3 сут. |
9.6 (3.2) ± 1.1 |
4.00 ± 0.00 |
4.00 ± 0.00 |
0.0 |
1.4±0.1 |
0,32±0.02 |
0.01 ± 0.00 |
|
Cu2+, 10 сут. |
5.1 (0.5) ± 0.4 |
4.02 ± 0.10 |
3.55 ± 0.00 |
--11.7 |
2.0±0.2 |
0,18±0.02 |
< 0.01 |
|
Zn2+, 1 сут. |
0.2 (0.2) ± 0.0 |
3.81 ± 0,01 |
3.83 ± 0,09 |
+0.5 |
4.1±0.0 |
0,64±0.01 |
0,04 ± 0,00 |
|
Zn2+, 3 сут. |
2.5 (0.8) ± 0.8 |
3.76 ±0.01 |
3.53 ± 0.05 |
--6.1 |
3.5±0.1 |
0,52±0.03 |
0,04 ± 0,01 |
|
Zn2+, 10 сут. |
3.4 (0.3) ± 0.3 |
3.81 ± 0.06 |
3.53 ± 0.14 |
--7.3 |
3.2±0.1 |
0,42±0.04 |
0,04 ± 0,00 |
Примечание: в скобках указана скорость накопления металла, мг/г сухой массы сутки; (+) - прирост биомассы; (-) - потеря биомассы
Изменение содержания и состава суммарных липидов, фосфо- и гликолипидов в клетках H. verticillata под влиянием ТМ в зависимости от длительности воздействия (условия инкубирования: концентрация ТМ- 100 мкМ, время воздействия - 1, 3,10 суток)
|
Металл/ время воздействия |
Сум-мар-ные липиды, мг/г сырого веса |
Суммарные фосфолипиды, мг/г липидов |
Фосфолипиды, % от суммы |
Суммарные гликолипиды, мг/г липидов |
Гликолипиды, % от суммы |
|||||||
|
ФХ |
ФЭ |
ФГ |
ФИ |
ДФГ |
ФК |
МГДГ |
ДГДГ |
СХДГ |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
Контроль |
ri о -Н о |
о о ri -Н in С4 ОО ri |
40 о -н ОО m |
m о -Н о in ri |
о -Н <м об |
ri о -Н m об |
о 4? 40 m |
m о -Н о m |
о иб о с4 40 <м |
m о -Н 40 О 40 |
О НН m |
<м о -Н m in |
|
Cu 2+ , 1 сутки |
m о -Н |
^ |
О -Н ОО m |
ri о -Н in о ri |
m НН (М |
40 о -Н 40 |
<м о -Н <м |
о -Н m о |
о о о иб |
^ -н ОО гИ |
ОО гИ НН об |
<м о -Н ОО об |
|
Cu 2+ , 3 суток |
о -Н 04 |
о -Н о об ОО |
о -Н 40 m ri |
о НН с4 |
о -Н m о m |
04 О -Н |
<м о -Н 40 |
m НН с4 <м |
о -Н о vr> |
04 О -Н 40 |
<м о -Н m о |
40 о НН in |
Окончание табл. 2
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
Cu 2+ , 10 суток |
in о -H о |
in НН о in |
m ОО 40 ri |
40 с4 |
m о -Н ОО 40 ri |
ип о -н |
<м о НН |
04 с4 -н иб |
о о -н о 04 m |
о о -Н 40 ш |
in о НН |
о -Н m |
|
Zn2+, 1 сутки |
ш о -Н 40 40 |
о >п ri -Н •П с4 40 ri |
о с4 -Н 40 ОО ri |
о с4 -Н ОО о ri |
о <м с4 <м |
ип о -н ОО |
о ч} ОО с4 |
о НН |
о иб о |
с4 НН 40 ш |
<м с4 -Н 04 04 m |
in о -Н ОО m |
|
Zn 2+ , 3 суток |
о ^ m 04 |
о >п ri -Н о о ri |
о с4 -Н ОО 04 ri |
о с4 -Н •П >п ri |
о о 40 |
о <м с4 |
о о -Н о |
о о 40 |
о m -Н о о m |
о -Н ОО 40 ш |
о о НН 04 m |
о -Н |
|
Zn2+, 10 суток |
о -Н о |
о о ri -Н •П с4 |
о с4 -Н о об ri |
о о об |
о о с4 |
о 04 40 |
о |
о 04 04 |
о о -Н о иб <м |
о -Н in |
о -Н <м m |
о НН иб |
Изменение состава ЖК суммарных липидов H. verticillata под влиянием ТМ в зависимости от длительности воздействия
|
Металл |
Экспозиция, сутки |
Содержание ЖК, % от суммы |
|||||||||||
|
< 14:0* |
14:0 |
14:1 |
15:0 |
16:0 |
16:1 |
16:2+17:0 |
18:0 |
18:1 |
18:2 |
18:3 |
Х** |
||
|
Контроль |
0.8±0.1 |
1.2±0.0 |
0.1±0.1 |
0.5±0.1 |
27.3±0.4 |
2.2±0.2 |
0.2±0.0 |
2.3±0.1 |
1.0±0.1 |
20.1±1.1 |
41.9±0.1 |
2.4±01 |
|
|
Cu2+ |
1 |
0,9±0,2 |
2,5±0,0 |
0,2±0,1 |
2,7±0,1 |
35,6±0,8 |
1,1±0,1 |
2,7±0,1 |
5,4±0,2 |
5,2±0,2 |
14,8±0,5 |
25,5±0,6 |
3,4±1,6 |
|
3 |
1,9±0,2 |
3,4±0,3 |
0,9±0,1 |
3,3±0,2 |
36,8±2,4 |
0,9±0,0 |
4,4±0,3 |
8,9±0,5 |
5,5±0,6 |
10,4±0,5 |
20,9±2,2 |
2,7±0,1 |
|
|
10 |
1,0±0,2 |
5,6±0,2 |
- |
3,4±0,1 |
41,4±1,1 |
0,0 |
0,7±0,5 |
13,1±0,4 |
6,1±0,9 |
5,1±0,4 |
21,1±2,2 |
2,5±0,2 |
|
|
Zn2+ |
1 |
- |
1,0±0,1 |
- |
0,4±0,0 |
29,0±0,9 |
1,5±0,1 |
- |
2,6±0,1 |
1,7±0,2 |
19,2±0,6 |
39,0±2,5 |
5,6±0,5 |
|
3 |
0,3±0,0 |
1,0±0,0 |
- |
0,4±0,0 |
28,9±1,1 |
1,6±0,1 |
0,1±0,0 |
2,7±0,1 |
2,1±0,0 |
18,7±0,8 |
41,0±1,9 |
3,2±0,2 |
|
|
10 |
0,5±0,0 |
2,1±0,0 |
- |
0,9±0,0 |
32,7±1,0 |
2,7±0,1 |
1,2±0,0 |
4,1±0,1 |
2,3±0,1 |
20,6±0,6 |
27,8±1,1 |
5,1±0,0 |
|
Примечание:
* Кислоты с длиной цепи менее 14 атомов углерода Х** Неидентифицированные кислоты
При воздействии Zn2+ достоверное снижение доли ФХ и ФЭ происходило при самом продолжительном по времени – 10 суточном инкубировании и было ниже контроля на 11,9 и 28,0 % соответственно. Содержание ФГ уменьшалось на 3 и 10 сутки воздействия на 12,1 и 34,1 %. Содержание ФИ и ФК – возрастало с увеличением продолжительности воздействия ТМ, и на 10 сутки было выше контроля более чем в 1,5 раза.
ГЛ - главные структурные компоненты мембран хлоропластов, в меньшей степени они локализованы в плазмалемме. Присутствие ГЛ важно для образования изгибов мембран и формирования тилакоидов (Алехина и др., 2005).
В контрольных образцах H. verticillata содержалось в среднем 262,0 мг ГЛ на г липидов. Как видно из табл. 2, при воздействии Cu2+ количество ГЛ при всех временных интервалах снижается на 46,9-79,0 %. При 1 и 3 суточных воздействиях Zn2+ количество ГЛ возрастало на 82,1 % и 41,2 % соответственно, при 10 суточном – было равным контролю.
Итак, Cu2+ нарушает биосинтез ГЛ у H. verticillata . Содержание ГЛ при воздействии Zn2+ как правило возрастает, но в разной степени, в зависимости от продолжительности воздействия иона. Все это указывает на наличие специфического ответа растительной клетки на действие различных ионов ТМ.
Таблица 4
Влияние Cu2+ и Zn2+ на состав ФЛ субклеточных фракций H. verticillata , % от суммы
|
ТМ |
% от суммы |
|||||
|
ФХ |
ФЭ |
ФГ |
ФИ |
ДФГ |
ФК |
|
|
Микросомы |
||||||
|
Контроль |
41,9±0,4 |
31,1±4,0 |
10,7±3,6 |
7,6±0,6 |
3,4±0,4 |
5,4±0,3 |
|
Cu2+ |
27,3±1,1 |
7,3±0,2 |
28,8±0,3 |
11,3±3,0 |
6,2±3,0 |
19,1±2,3 |
|
Zn2+ |
41,7±0,5 |
26,8±1,3 |
9,8±2,3 |
12,8±3,7 |
2,5±0,3 |
6,4±0,4 |
|
Митохондрии |
||||||
|
Контроль |
43,7±7,0 |
20,1±7,2 |
16,0±0,4 |
8,8±0,6 |
5,7±1,8 |
5,9±3,9 |
|
Cu2+ |
19,5±1,2 |
8,2±3,0 |
24,6±4,0 |
10,2±0,2 |
7,4±3,0 |
30,4±5,0 |
|
Zn2+ |
42,9±1,1 |
15,0±0,5 |
17,8±2,3 |
13,2±2,3 |
4,0±1,2 |
7,2±1,6 |
|
Хлоропласты |
||||||
|
Контроль |
15,1±7,0 |
15,0±5,0 |
54,5±5,5 |
5,5±0,3 |
7,7±0,5 |
2,1±0,7 |
|
Cu2+ |
12,7±3,6 |
4,9±2,0 |
43,2±1,2 |
8,1±3,5 |
3,7±3,1 |
28,2±9,3 |
|
Zn2+ |
20,7±3,2 |
2,6±1,0 |
67,5±0,5 |
4,9±0,9 |
2,5±1,0 |
1,9±0,6 |
К ГЛ относятся: МГДГ, ДГДГ и СХДГ. При действии Cu2+ на растение, содержание МГДГ уменьшалось на 4,9-26,4 %, количество ДГДГ возрастало на 2,9-18,2 %. Содержание СХДГ возрастало на 37,7-184,9 %.
При действии Zn2+ содержание МГДГ не менялось более чем на 6,9 %. Количество ДГДГ возрастало при воздействии Zn2+ на 9,1-17,0 % в сравнении с контролем. Количество СХДГ снижалось при 1 и 3 суточной инкубации с Zn2+ на 28,3 % и 20,7 % соответственно.
Одним из важнейших показателей модификации биологических мембран служит состав жирных кислот (ЖК) липидов. Именно изменение качественного и количественного состава ЖК липидов считается главным фактором устойчи- вости растений к стрессам, прежде всего температурным (Хочачка, Сомеро, 1988; Nguyen, Mazliak, 1990; Xu, Siegenthaler, 1996). Как правило, ЖК листьев высших растений включают С16–С18 кислоты (Harwood, 1994). Из данных табл. 3 видно, что воздействие Cu2+ и Zn2+ приводило к различной направленности изменения состава ЖК в период аккумуляции ТМ. При влиянии Cu2+ происходило увеличение доли С16:0 на 30,4-51,6 %. Доля ненасыщенных ЖК (С18:2 и С18:3) уменьшалась максимально на 74,6 % и 50,1 % соответственно. При влиянии Zn2+ содержание С18:3 снижалось только при 10 суточном инкубировании на 33,6 % на фоне увеличения С16:0 на 19,8 %. При 1 и 3 суточном воздействии соотношение данных ЖК было равным контролю. Количество С18:2 варьировало на протяжении всего периода инкубирования.
Приведенные выше результаты касаются изменения липидных компонентов целостной клетки под действием Cu2+ и Zn2+. Однако известно, что помимо плазматической мембраны, отделяющей растительную клетку от внешней внеклеточной среды, существует целый ряд внутренних мембранных систем, разделяющих клетку на отдельные компартменты, внутри которых располагаются органеллы, выполняющие различные функции. Среди многообразия клеточных мембран существует две подсистемы полуавтономных органелл (хлоропластов и митохондрий), окруженных собственными мембранами. Эти органеллы играют важную роль в энергетике растений и сформировались при влиянии двух факторов, обуславливающих стратегию существования высших растений – фотоавто-трофоного типа питания и отсутствием активной подвижности. Поэтому представляло интерес провести более углубленное исследование влияния ионов ТМ на состав липидов отдельных мембранных образований растительной клетки, которое мы осуществили на примере растения H. verticillata .
Все исследования по влиянию Cu2+ и Zn2+ на состав липидов субклеточных фракций, результаты которых приведены ниже, были осуществлены в условиях 3-х суточного инкубирования, при концентрации ТМ 100 мкмоль/л. С помощью дифференциального центрифугирования из тканей растения были выделены фракции, обогащенные микросомами, митохондриями и хлоропластами.
Из данных табл. 4. видно, что как во фракции, обогащенной микросомами, так и во фракции, обогащенной митохондриями, лидирует ФХ, за которым следуют в порядке убывания ФЭ, ФГ, ФИ, ДФГ и ФК. В то же самое время во фракции хлоропластов, как и следовало ожидать, главным ФЛ оказался ФГ. Эти данные не противоречат имеющимся литературным сведениям о составе липидов субклеточных фракций, приведенных для наземных растений (Harwood, 1998).
При воздействии Cu2+ во фракции, обогащенной микросомами наблюдалось снижение содержания ФХ на 34,8 %, ФЭ – более, чем в два раза, на фоне увеличения относительного содержания всех остальных ФЛ. Особенно большие изменения в содержании отмечено для ФГ и ФК (более чем в два раза). При воздействии Zn2+ содержание ФЭ снижалось на 13,8 %, в то время как количество ФХ и ФГ практически не менялось. Среди остальных компонентов наиболее существенные изменения происходили в содержании ФИ, количество которого возрастало на 68,4 % в сравнении с контролем.
Среди ФЛ мембран митохондрий наблюдалось сходные по характеру изменения: при воздействии ТМ содержание ФХ и ФЭ снижалось на фоне увеличения ФГ, ФИ и ФК, но степень изменений зависела от природы иона. Так, при дейст- вии Cu2+ количество ФХ и ФЭ уменьшалось на 55,4 и 59,2 % соответственно. При действии Zn2+ количество ФХ не менялось, а ФЭ - снижалось на 25,4 %. Содержание ФГ, ФИ, возрастало под воздействием Cu2+ на 53,7, 15,9 %, а ФК – более чем в 4 раза. Под воздействием Zn2+ количество ФГ, ФИ и ФК возрастало на 11,2, 50,0 и 22,0 % соответственно.
В мембранной фракции хлоропластов, в отличие от мембран микросом и митохондрий, основную массу ФЛ составляет не ФХ и ФЭ, а ФГ (табл. 4). При воздействии Cu2+ содержание ФГ снижается на 20,7 %, а при воздействии Zn2+, наоборот, возрастает на 23,8 %. При этом, под влиянием Cu2+ снижалось содержание ФХ и ФЭ на 15,9 и 67,3 % соответственно и увеличение содержание ФК (более чем десятикратно). Под влиянием Zn2+ содержание ФЭ снижалось на 82,7 %, а доля ФХ увеличивалась на 37,1 % в сравнении с контролем .
Таблица 5
Влияние Cu2+ и Zn2+ на состав ГЛ фракции, обогащенной хлоропластами, % от суммы
|
ТМ |
ГЛ, % от суммы |
||
|
МГДГ |
ДГДГ |
СХДГ |
|
|
Контроль |
52,5±2,6 |
33,3±1,3 |
14,2±1,8 |
|
Cu2+ |
58,0±5,0 |
25,0±2.8 |
17,0±6.8 |
|
Zn2+ |
59,9±5,5 |
27,8±2,5 |
12,3±0,6 |
Как уже говорилось ранее, основными липидами хлоропластов являются ГЛ. Основной вклад в состав ГЛ мембран хлоропластов вносит МГДГ – 52,5 % от общего количества ГЛ. Доля ДГДГ была равна 33,3 %, СХДГ – 14,2% (табл. 5). При воздействии Cu2+ и Zn2+, содержание МГДГ возрастало на 10,5 и 14,1 % в сравнении с контролем, одновременно снижалось содержание ДГДГ на 24,9 и 16,5 % соответственно.
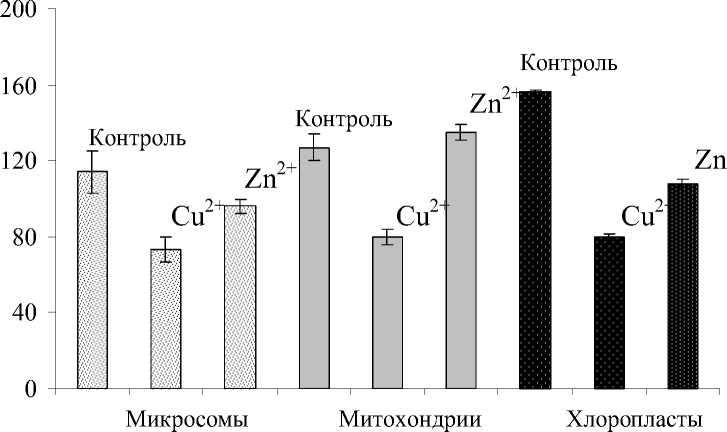
Рис. 2. Влияние Cu2+ и Zn2+ на индекс ненасыщенности ЖК липидов мембранных фракций микросом, митохондрий и хлоропластов
Как видно, при воздействии Cu2+ и Zn2+ значительно возрастает относительный вклад МГДГ, и снижается доля ДГДГ. Здесь существенных различий в действии Cu2+ и Zn2+ выявлено не было.
Как уже отмечалось, свойства липидов мембран во многом определяют входящие в их состав ЖК.
Таблица 6
Влияние Cu2+ и Zn2+ на включение 2-14С-ацетата натрия в полярные липиды субклеточных мембранных фракций (имп/мин на мг липидов) H. verticillata
|
Липиды |
Субклеточные фракции, удельная активность имп/мин на мг липидов |
||
|
микросомы |
митохондрии |
хлоропласты |
|
Контроль
|
ФХ |
760±50 |
168±30 |
19±1 |
|
ФЭ |
1310±60 |
520±30 |
100±10 |
|
ФГ |
1000±50 |
274±68 |
187±40 |
|
ФИ |
170±50 |
770±10 |
- |
|
ФК |
190±50 |
50±45 |
- |
|
МГДГ |
1020±25 |
486±50 |
468±50 |
|
ДГДГ |
90±20 |
50±2 |
95±10 |
|
Суммарное включение |
4540 |
2318 |
869 |
Cu2+
|
ФХ |
48±5 |
72±70 |
142±40 |
|
ФЭ |
761±20 |
911±50 |
100±24 |
|
ФГ |
174±20 |
406±50 |
651±76 |
|
ФИ |
62±8 |
57±10 |
289±100 |
|
ФК |
73±5 |
99±10 |
298±100 |
|
МГДГ |
774±50 |
628±10 |
851±100 |
|
ДГДГ |
48±5 |
36±8 |
156±50 |
|
Суммарное включение |
1940 |
2209 |
2487 |
Zn2+
|
ФХ |
599±22 |
123±30 |
341±40 |
|
ФЭ |
649±25 |
671±45 |
60±7 |
|
ФГ |
302±14 |
287±12 |
170±23 |
|
ФИ |
29±4 |
28±2 |
- |
|
ФК |
23±3 |
64±14 |
22±9 |
|
МГДГ |
285±17 |
763±55 |
620±75 |
|
ДГДГ |
- |
24±5 |
53±15 |
|
Суммарное включение |
1887 |
1960 |
1266 |
При воздействии Cu2+ и Zn2+ менялось содержание ненасыщенных кислот. Так, во фракции микросом уменьшался в целом ИН – на 36,0 и 15,8 % соответственно. Во фракции митохондрий, при воздействии Cu2+ происходило снижение ИН относительно контроля на 37,0 %, а при воздействии Zn2+ – увеличение на 6,3 %. Во фракции хлоропластов, на 48,7 % снижался ИН при воздействии Cu2+ и на 30,8 % при воздействии Zn2+. То есть самые значительные перемены состава ЖК происходили во фракции, обогащенной хлоропластами, а степень этих изменений зависела от природы ТМ. Снижение ИН происходило, главным образом, за счет снижения доли триеновых кислот 18:3, что, по-видимому, связано с изменением активности десатураз и элонгаз.
Изменения в составе липидов и ЖК являются результатом внутриклеточных процессов, происходящих как в процессе жизнедеятельности клетки, так и под воздействием внешней среды. Проведение экспериментов по включению 2-14С-ацетата в полярные липиды субклеточных фракций позволило проследить пути синтеза отдельных липидов в контрольных вариантах растения H. verticillata , а также в условиях воздействия Cu2+ и Zn2+. Полученные результаты приведены в табл. 6.
В контрольных опытах более высокий уровень включения метки фиксировался во фракции микросом – в среднем 4540 имп/мин на мг липидов.
Во фракции митохондрий и хлоропластов данный показатель был ниже – 2318 и 869 имп/мин на мг липидов соответственно. Причем во внепластидных фракциях более активно ацетат включался в такие липиды как ФЭ и ФГ по сравнению с ФХ. Также активно происходило включение радиоактивной метки в МГДГ. Во фракции хлоропластов наиболее активное включение ацетата наблюдалось для ФГ и МГДГ.
При воздействии Cu2+ интенсивность включения 2-14С-ацетата в полярные липиды микросом и митохондрий снижалась на 57,3 и 4,7 % соответственно, а в хлоропластах, наоборот, увеличивалась в 2,9 раз. При воздействии Zn2+ картина была аналогичной, но степень изменений для митохондрий и хлоропластов была отличной, то есть, включение радиоактивной метки в мембранные липиды митохондрий снижалось на 15,4%, в хлоропластных мембранах – увеличивалась на 45,7%. Включение метки в липиды микросом было ниже контрольного на 58,4%.
В микросомальной фракции при воздействии Cu2+ и Zn2+ было зафиксировано повсеместное снижение включения радиоактивности в индивидуальные липиды, например, в ФХ – на 93,7 и 21,2 %, в ФЭ – на 41,9 и 50,5%, в ФГ – на 82,6 и 69,8%.
При воздействии ТМ во фракциях митохондрий и микросом происходило перераспределение интенсивности включения 2-14С-ацетата в индивидуальные липиды.
Во фракции митохондрий происходило возрастание включения метки в ФЭ, ФГ, ФК и МГДГ – на 75,2%, 48,2%, 98,0%, 29,2% при воздействии Cu2+ и на 29,0%, 4,7%, 28,0%, 57,0% при воздействии Zn2+. В то время как включение 2-14С-ацетата в ФХ, ФИ и ДГДГ замедлялось в сравнении с контролем. Во фракции хлоропластов при действии Cu2+ удельная радиоактивность основных липидов – ФГ и МГДГ увеличивалась в сравнении с контролем на 248,1% и 81,8% соответственно. При действии Zn2+ наибольшее включение метки происходило в ФХ – более чем в 10 раз и МГДГ – на 32,5%.
ОБСУЖДЕНИЕ
Способность к накоплению ТМ, по-видимому, связана с анатомоморфологическими и физиологическими адаптациями водных погруженных растений к водной среде: тонкая листовая пластинка, слабо развитый восковой барьер, редукция покровных, механических тканей, проводящей системы растений (Лукина, Смирнова, 1988; Матвеев и др., 2005).
Как видно из полученных результатов, на фоне накопления ионов ТМ происходило замедление роста растений в первые сутки инкубации, а также потеря биомассы на 3 и 10 сутки. Снижение интенсивности фотосинтеза подтверждается уменьшением содержания хлорофиллов a и b . При этом, характер изменения зависел от длительности экспозиции растений с ТМ и природы элемента. Так, Cu2+ ингибировала уровень фотосинтеза и отрицательно влияла на количество хлорофиллов и каротиноидов в большей степени, чем Zn2+.
Снижение уровня каротиноидов под воздействием Cu2+ можно объяснить тем, что Cu2+ более всех остальных металлов способна повышать уровень свободных радикалов (Rama Deli, Prasad, 1999), вследствие чего снижается содержание веществ, способных нейтрализовать их отрицательный эффект. Следует подчеркнуть, что каротиноиды рассматриваются некоторыми авторами как один из факторов, выполняющих протекторную роль, защищая фотосинтетический аппарат и пигменты от неблагоприятных воздействий окружающей среды, в т.ч. от стресса, вызванного ТМ (Krinsky, 1971; Rama Deli, Prasad, 1999; Strzalka, Widomska, 2008).
Однозначно направленное снижение суммарных ФЛ в присутствие в среде инкубирования Cu2+ при всех временных интервалах говорит о разрушении мембранных систем растительных клеток. Мембранная система является тем барьером, который пропускает в клетку нужные ей вещества, а из клетки – продукты распада обмена веществ, а так же создает внутри клетки определенные отсеки – компартменты, что позволяет осуществлять самые разнообразные биологические процессы. Нарушение данного механизма способно повлиять на функциональное состояние растения, что и подтверждается анализом роста биомассы и фотосинтетических характеристик.
В сравнение с воздействием Cu2+, при воздействии Zn2+ снижение содержания суммарных ФЛ было наименьшим и сопровождалось различными перестройками состава ФЛ в зависимости от продолжительности воздействия, т.е. комплекс клеточных мембран по-разному реагирует на различные ионы металлов и очевидно имеет специфический отклик.
Различная направленность изменений происходила и в составе и содержании ГЛ растений. Cu2+ нарушает биосинтез ГЛ у H. verticillata . Содержание ГЛ при воздействии Zn2+, как правило, возрастает, но в разной степени и в зависимости от продолжительности воздействия иона. При этом состав ГЛ при воздействии различных ионов ТМ имел одну и ту же направленность – снижение доли МГДГ на фоне возрастания ДГДГ. Как известно из литературных данных, изменение соотношения МГДГ/ДГДГ является одной из характерных реакций на действие стрессора и выступает в качестве компенсаторного механизма, призванного минимизировать отрицательное влияние неблагоприятного фактора (Marechal et al., 1997).
Чем более детально анализировался биохимический компонент, тем более выраженными были различия в направленности действия Cu2+ и Zn2+. Так в структурной основе мембранных фракций микросом, митохондрий и хлоропластов, наряду с деградацией ряда соединений, например, ФХ и/или ФЭ; ДГДГ, происходит и относительное увеличение содержания таких компонентов как ФГ и/или ФИ, ФК; МГДГ что, по-видимому, является адаптационной реакцией суб- клеточных мембранных систем в ответ на воздействие ионов ТМ. При этом, эксперименты с применением меченого 2-14С-ацетата натрия показали, что несмотря на стрессовую ситуацию, созданную воздействием Cu2+ и Zn2+, синтез липидов не прекращается, а происходит его перераспределение как между мембранными системами клетки, так и между индивидуальными компонентами биомембран, то есть липидами. Общим было то, что при действии обоих ТМ в митохондриях и микросомах, по-видимому, преобладают процессы катаболизма липидов, а в хлоропластах наоборот – процессы анаболизма. Различия при воздействии Cu2+ и Zn2+ были следующими: степень ингибирования биосинтеза липидов (в митоходриях и микросомах) была выше при воздействии Zn2+, а образование липидов (в хлоропластах) было больше при действии Cu2+. Во фракции хлоропластов при действии Cu2+ увеличивалась удельная радиоактивность ФГ и МГДГ (в сравнении с контролем на 248,1 % и 81,8 % соответственно), а при действии Zn2+ наибольшее включение метки происходило в ФХ – более чем в 10 раз и МГДГ – на 32,5 %.
В наших экспериментах на уровне организма при влиянии избытка Cu2+ общей закономерностью являлось снижение содержания ненасыщенных ЖК (С18:2 и С18:3) на фоне увеличения насыщенной кислоты С16:0. Zn2+ способствовал увеличению количества ненасыщенных ЖК на фоне кислоты С16:0, но только в 1 и 3 сутки воздействия. Данные по составу ЖК СЛ показывают, что качественный состав липидов также претерпевал изменения. При этом, степень и их направленность зависела от природы иона и продолжительности его воздействия.
Перестройки ЖК состава липидов, очевидно, связаны как с активацией и инактивацией мембранносвязанных белков и ферментов (адаптационный, положительный эффект), так и с действием окислительного стресса, вызванным ТМ (отрицательный эффект). В первом случае, детоксицирующими свойствами могут обладать белки теплового шока, металлотионеины, изменение активности транспортных АТФаз, а во втором случае имеют место процессы перекисного окисления липидов.
Как видно из представленных результатов, регуляторная роль при воздействии различных ТМ заключается в перераспределении биосинтеза липидов между субклеточными мембранными образованиями, а также в разнонаправленном изменении состава и содержания липидов и их ЖК как на уровне органелл клек-ти, так и на уровне организма в целом.
Список литературы Изменения в составе липидов мембран клеток и субклеточных фракций пресноводного растения Hydrilla verticillata (L. Fil.) Royle под действием ионов тяжелых металлов
- Алехина Н.Д., Балнокин Ю.В., Гавриленко В.Ф. и др. Физиология растений. - М.: Издательский центр Академия, 2005. 640 с.
- Болдырев А.А. Матриксная функция биологических мембран // Соросовский образовательный журнал. 2001. № 7. С. 2-8.
- Бриттон Г. Биохимия природных пигментов. М.: Мир, 1986. 422 с.
- Голубкина Н.А. Флуорометрический метод определения селена // Журн. аналит. химии. 1995. Т. 50. С. 492-497.
- Кейтс М. Техника липидологии. М.: Мир, 1975. 323 с. (для переводчика полные выходные данные на англ. яз.) - Kates M. Techniques of Lipidology. M.: Mir, 1975. 323 p.


