Изотопный состав содержимого сосудов эпохи бронзы: верификация полученных результатов
Автор: Шишлина Н.И., Кузнецова О.В., Севастьянов В.С., Зазовская Э.П., Занина О.Г.
Журнал: Краткие сообщения Института археологии @ksia-iaran
Рубрика: Дискуссии
Статья в выпуске: 274, 2024 года.
Бесплатный доступ
Тестовый сравнительный анализ изотопного состава азота (515N) и углерода (513С) содержимого сосудов эпохи бронзы, данных фитолитного и спорово-пыльцевого анализов, дополнительное 14С-датирование парных углеродсодержащих образцов показали, что существует корреляция между изотопным составом содержимого сосудов и продуктами питания. Это позволяет использовать изотопный состав нагаров как маркер вероятных компонентов сгоревшей пищи, если возможность проведения дополнительных анализов отсутствует. Выделено пять групп. Предположительно, вариации изотопного состава (рис. 1) определены разными компонентами пищи, которую готовили в горшке или возжигали в курильнице: речную и озерную рыбу, ячмень, растения группы С3 или С4. Возможно, в горшках сохранились остатки пригоревшей пищи из растительных, мясных и молочных продуктов. Исследования пищевых белков в протеомах зубного камня на материалах индивидов эпохи бронзы степной зоны юга Восточной Европы показали, что представители ямной культуры пили овечье молоко, катакомбной - коровье, козье и овечье. Другим возможным компонентом пищи могли быть степные грибы, изотопный состав которых также отличается повышенной величиной 515N.
Содержимое сосудов, изотопный состав азота и углерода, фитолитный и спорово-пыльцевой анализы, бронзовый век
Короткий адрес: https://sciup.org/143182917
IDR: 143182917 | DOI: 10.25681/IARAS.0130-2620.274.406-424
Текст научной статьи Изотопный состав содержимого сосудов эпохи бронзы: верификация полученных результатов
Керамика является важным элементом многих культур, ее изучение позволяет провести культурную атрибуцию памятника, уточнить его хронологию. Глиняные сосуды степных культур эпохи бронзы характеризуются разной формой, присутствием или отсутствием декора. Черепки битой посуды найдены в культурных слоях поселений и стоянок; целые горшки, кувшины, банки и другие
сосуды входят в погребальные наборы. Очевидно, что большинство таких емкостей использовалось для приготовления пищи, скорее всего, на открытом огне. Об этом свидетельствуют нагары – пригоревшая пища. Такие органические остатки черного, темного, светло-коричневого, желтого цветов найдены на внешних и внутренних стенках некоторых горшков, абсорбированы в материал стенок сосудов или как свободные скопления – в осадочных компонентах на дне ( Regert et al ., 2008; Craig et al ., 2013).
Нагары представляют собой ценный источник информации для решения вопросов, связанных с преобразованием веществ с течением времени, а также их использованием, хранением и изменением в результате воздействий окружающей среды, которые могут включать физические, биохимические или химические процессы. Их изучение позволяет понять, из каких продуктов готовили ежедневную пищу, что могло стать погребальной трапезой при совершении захоронения. Они могут состоять из растительных масел, жира наземных и мор-ских/речных животных, молочного жира, растительных и пчелиных восков и многих других компонентов. У нагаров часто нет узнаваемых морфологических признаков, один из способов определить их природу и происхождение – это физико-химические методы анализа ( Evershed , 1993), в частности, метод газовой хроматографии ( Regert et al ., 1998; Stern et al ., 2008), нейтронно-активационный анализ, газовая хроматография-сжигание-масс-спектрометрия соотношения изотопов ( Garcea et al ., 2020) и другие анализы ( Рһіӏірѕеп , 2010) Кроме этого, используются фитолитный, спорово-пыльцевой анализы ( Шишлина и др ., 2017), а сами нагары служат образцами для радиоуглеродного датирования ( Выборнов и др ., 2014).
Однако не всегда возможно применить нескольких методов при изучении содержимого сосудов. Ограничения определены многими факторами, в первую очередь тем, что образец может быть мал, более важным для исследователя является проведение датирования методом ускорительной масс-спектрометрии, поскольку другие углеродсодержащие образцы на памятнике отсутствуют, или широкий спектр применения нескольких методов затруднен по финансовым причинам. В данной статье обсуждаются возможности и ограничения, связанные с применением метода изотопной масс-спектрометрии легких элементов – определение изотопного состава азота и углерода образцов содержимого сосудов и верификация полученных результатов другими методами. Используется часть уже опубликованных ( Шишлина и др ., 2017; Shishlina et al ., 2018) и новые данные. Такие результаты могут быть использованы при интерпретации полученных значений изотопного состава азота и углерода нагаров сосудов эпохи бронзы степной зоны и определении продуктов питания, из которых готовилась пища.
Основные подходы и образцы
Состав содержимого сосудов, включающего и нагары, сохранившиеся на стенках археологических сосудов, может изменяться при термической обработке продуктов, из которых приготовлена пища, из-за смешения остатков различной пищи в одной емкости, поскольку неизвестно, как часто мыли или очищали сосуд, а также в результате диагенетических изменений, связанных с помещением сосуда в закрытый погребальный комплекс.
Основной метод, который используется в данном исследовании для определения возможного состава пригоревших компонентов пищи, – это метод изотопной масс-спектрометрии легких элементов, в частности – углерода (13C/12С) и азота (15Ν/14Ν). Изотопный состав углерода и азота является наиболее важным химическим индикатором для восстановления жизнедеятельности человека в прошлом ( Shishlina et al. , 2016). Распределение стабильных изотопов легких элементов в различных биологических системах зависит от абиотических факторов и поэтому существенно различается. Особенности распределения связаны с процессами фракционирования, т. е. с изменением соотношения изотопов в ходе многих биологических и геохимических процессов. Способность к термодинамически упорядоченному распределению изотопов в сложных органических соединениях – специфическое свойство живых систем, поэтому изотопное отношение – хороший критерий для распознавания биогенных и абиогенных соединений ( Галимов , 1981). Для исследований пищевых продуктов наиболее важно фракционирование изотопов углерода при фотосинтезе, а также фракционирование изотопов углерода и азота при биохимической (микробной) трансформации органического вещества. Подавляющая часть известных экспериментальных данных относится к углероду 13С, что оправдано ролью, которую играет этот элемент в химии биологических соединений. Применение современных методов анализа, особенно изотопной масс-спектрометрии, позволяет определить происхождение веществ ( DeNiro , 1987).
Изотопный состав углерода отражает: (1) первичные источники углерода, (2) источники органического вещества в пищевой цепи, (3) условия окружающей среды ( Sрangenberg et al ., 2006).
Интерпретация значений δ13C, полученных в результате анализа обугленных или поглощенных остатков органических веществ в сосудах, основывается на принципах, созданных в 1970-х гг. на основе изотопных характеристик широкого круга растений и животных ( Evershed , 1993; 2008). Растения можно разделить на две основные группы: C3 и C4 и третью – растения CAM (Crassulacean Acid Metabolism), которые основаны на биохимических путях, участвующих в фиксации атмосферного CO2 во время фотосинтеза.
В группах C3 используется цикл Кальвина для включения углерода из атмосферного CO2. Этот способ включения приводит к образованию первого промежуточного соединения, содержащего три атома углерода. В течение этого цикла трансформации большая часть фракционирования происходит в ферментативном карбоксилировании СО2 рибулозо-1,5-бифосфаткарбоксилазой. Зерновые злаки и большинство растений, которые растут в умеренных широтах, относятся к этой группе растений. Биосинтез биомассы растениями группы С4 основан на цикле «Хатч-Стек», в котором первый компонент содержит четыре атома углерода. К этой категории относятся множество растений теплых регионов, например сахарный тростник, кукуруза, сорго, амарант, лебеда и многие виды злаков. CAM-растения используют два вида метаболизма, которые зависят от различных факторов (Winter et al., 2019). Средние значения δ13C для этих трех групп наземных растений составляют -27,1 ± 2,0‰ для растений C3 и -13,1 ± 1,2‰ для растений C4. Значения δ13C для группы CAM находятся в интервале от -22‰ до -12‰ (Silvera et al., 2010). Поскольку изотопное фракционирование углерода между тканями потребителя и его рационом очень мало, от 1 до 2‰, значения δ13C животных непосредственно связаны с изотопными значениями растений, потребляемых травоядными животными в начале трофической цепи (DeNiro, Eрstein, 1978). Однако значения изотопного состава изменяются в зависимости от ряда факторов, включая условия окружающей среды, виды тканей и биохимических фракций, физиологию, источник первичного углерода и систему питания.
Растения ареалов сухого климата или соленых почв имеют более положительные величины δ13C, чем растения, растущие при повышенной влажности и на менее соленых почвах. Значения δ13C для С3 растений, растущих в аридных условиях или подвергнутых водяному стрессу, могут изменяться на + 4‰, а для растений, растущих на соленых почвах, до + 10,8‰. ( Fagre et al ., 1991). С высотой увеличивается парциальное давление СО2, что приводит к увеличению эффективности поглощения СО2. Например, с увеличением высоты увеличивается значение δ13C.
Содержание изотопа δ15Ν в основном резервуаре азота, т. е. в молекулярном азоте атмосферы, составляет 0,366% от общего числа атомов. Если абсолютные отклонения изотопного состава азота выразить в относительной форме (относительно эталонного состава, в качестве которого используют азот атмосферы) и в промилле, то такие отклонения составят весьма заметные величины. Причина колебаний изотопного состава азота – фракционирование изотопов в биологических процессах азотного цикла. Практически все процессы превращения соединений азота дискриминированы относительно легкого изотопа азота 14Ν, а та часть азота, которая не участвует в процессах, обогащается изотопом 15Ν ( Mariotti et al ., 1981).
В природе важную роль играет фракционирование при трофическом сдвиге. Например, крупный рогатый скот поедает траву, и в коллагене его костной ткани величина δ15Ν возрастает на 3–4‰ по сравнению с изотопным составом азота растений, диапазон которых – от -4 до + 10‰ (среднее значение + 8,8‰) ( Ziółkowska et al ., 2018). Двигаясь по пищевой цепочке от травоядных (δ15Ν от + 1,0 до + 12,7‰) к хищникам (δ15Ν от + 5,3 до 18,8‰), на каждом трофическом уровне δ15Ν в среднем увеличивается на 3,4‰ ( Semenina, Tiunov , 2011). Водные растения (+ 7‰) имеют более положительные значения δ15Ν относительно наземных растений на + 4‰. Поэтому морская и земная фауна хорошо различима по изотопному составу азота ( Ambrose , 1991).
Азот поступает в ткани позвоночных из пищи и хорошо сохраняется в коллагене костей. В коллагене костной ткани животных происходит изотопный сдвиг азота на 3–5‰ в зависимости от системы питания. Не все травоядные имеют одинаковые величины δ15Ν, так как разные растения используют азот в различных формах и изотопный состав азота в них неодинаков. Например, такой климатический фактор, как повышенная температура, может привести к увеличению значений δ15Ν, а пониженная температура – к уменьшению активности почвенных бактерий и уменьшению изотопного фракционирования азота ( Макаров , 2009; Barnes et al ., 2007).
В обугленных остатках пищи, прилипших к поверхности керамики ( Yoneda et al ., 2019), изучались изотопные соотношения азота (значения δ15Ν) для оценки вклада водных (морских и пресноводных) ресурсов, необходимых при корректировке воздействия морских и пресноводных резервуаров. Выяснено, что обогащение δ15Ν у рыб и водных животных на более высоких трофических уровнях происходит при большей сложности водной экосистемы. Йошида и другие ( Yoshida et al ., 2013) измерили значения δ13C и δ15Ν и атомные соотношения C/Ν в обугленных материалах и пришли к заключению, что в древнейшей в мире глиняной посуде были приготовлены растительные и животные продукты питания, включая наземных млекопитающих и водных рыб. Показано, что корреляция между значениями δ15Ν и соотношениями C/Ν будет более корректным показателем вклада в рацион человека мяса животных с меньшим участием водных организмов. Такая система питания характерна для населения, удаленного от морского побережья.
Однако также следует отметить, что точная оценка трофического положения животных с помощью измерений общего количества δ15Ν влечет за собой некоторые трудности: (1) определение значения δ15Ν для растительных продуктов прошлого (первичных производителей) затруднено, поскольку растительная ткань разлагается быстрее, чем твердые ткани животных, такие как кости, и потому, что ценность первичных продуцентов может варьироваться в зависимости от местных условий окружающей среды ( Stevens, Hedges , 2004; Shishlina et al ., 2018); (2) сообщалось об относительно больших неопределенностях в отношении факторов, влияющих на степень обогащения δ15Ν, между добычей и ее потреблением не только для животных ( Ambrose , 2000), но также и для людей ( OʼConnell et al ., 2012). В случае всеядных видов, включая людей, может возникнуть дополнительная проблема, поскольку потребление ресурсов пресной воды может повысить значение δ15Ν, что приведет к переоценке его трофического положения в наземной экосистеме. Эти проблемы затрудняют точную оценку степени результатов изотопного анализа коллагена костной ткани ( Hedges, Reynard , 2007).
Определения значений общего изотопного состава углерода и азота дают средние значения для всех соединений, присутствующих в горшках, которые включают липиды, белки и полисахариды. Более конкретную информацию об органических остатках на сосудах можно получить путем определения изотопных значений отдельных компонентов.
Это можно сделать, применив другие методы. В данном исследовании были использованы тестовые исследования определения вероятных компонентов нагаров и содержимого сосудов фитолитным и спорово-пыльцевым методами, что позволило в некоторых случаях дифференцировать растения разных типов, а также выделить продукты водного происхождения. Для сравнительного анализа общего изотопного состава углерода (δ13C) и азота (δ15Ν) нагаров и расти-тельных/рыбных продуктов питания использовались опубликованные ( Шишлина и др ., 2017) и новые данные. Для верификации рыбного компонента одного из нагаров было проведено дополнительное УМС-датирование образца. Мы исходили из того, что, если в сосуде готовилась рыба и моллюски, радиоуглеродные даты по остаткам пищи могут быть старше, чем их археологический контекст ( Fischer, Heinemeier , 2003). Это вызвано влиянием резервуарного эффекта на радиоуглеродный возраст нагара ( ван дер Плихт и др ., 2016).
Определение общего изотопного состава углерода (δ13C) и азота (δ15Ν) проводилось следующим образом. Органические остатки с поверхности сосудов отбирались c помощью скальпеля ( Fujii et al ., 2021; Рoulain et al ., 2016) или деревянной ложки. Образцы, общий вес которых достигал от 2 до 10 г, далее делились на несколько частей для проведения дополнительных исследований. В оловянные капсулы помещали образцы массой 0,1 мг для определения изотопного состава углерода и 0,5 мг для определения изотопного состава азота анализировали на изотопном масс-спектрометре Delta Plus, соединенном с элементным анализатором Flash 1112 посредством интерфейсного блока ConFlo 3 (производство Thermo Scientific, Германия). Температура окислительного реактора 1020 °С, реактивы: оксид хрома, посеребренные гранулы оксида хрома. Температура восстановительного реактора 650 °С, реактивы: медь. Проверку правильности измерений осуществляли по международному стандарту масла ΝBS 22 (δ13СVPDB = -29,7‰), сульфата аммония IAEA-Ν-1 (δ15ΝAIR = +0,43‰) и нитрата калия USGS32 (δ15ΝAIR = +180‰). Изотопный состав рассчитывали по формуле:
δ13СVPDB = [(Rобр/Rст) – 1]·1000‰,
Rобр и Rст – отношения распространенностей изотопов 13С/12С в анализируемом образце и стандарте соответственно.
Проводилось минимум три параллельных измерения.
Геохимические исследования проведены в Институте геохимии и аналитической химии им. В. И. Вернадского РАН (Москва).
Отобранные для проведения фитолитного анализа сосуды промывали дистиллированной водой для избавления их от контаминации материалом вмещающих отложений. Затем в сосуд добавляли порциями воду и мыли с использованием зубной щетки, новой для каждого образца. В случае видимых образований, несмываемых/неразмягчаемых водой, использовали зубочистку. Для уменьшения потерь материала и получения осадка использовали вакуумную фильтрацию ( Loрatina, Zanina , 2024) через фильтр Владипор МФАС-СПА (с порами 1,5–3,0 мкм). Далее высушенный образец заливался на ночь 10 % HCl и кипятился около 10 мин., затем раствор освобождали от кислоты до нейтральной реакции. Далее промывкой дистиллированной водой на сите 0,25 мм удалялась крупная фракция. Полученный осадок отмучивался и подсушивался. Затем проводили сепарацию (разделение минеральных частиц и легкой биогенной фракции) в тяжелой жидкости KJ + СdJ2 (плотностью 2,2–2,3 г/см3) 10 мин. при 2000 оборотах; верхняя, легкая фракция сливалась и далее отмывалась от тяжелой жидкости двукратным центрифугированием с дистиллированной водой 2 мин. при 1500 оборотах, декантировалась и подсушивалась. Полученную фракцию анализировали в препаратах с глицерином с помощью светового микроскопа Carl Zeiss Axiolab A1 при увеличении в 100× и 400× c применением фазового контраста.
Спорово-пыльцевой анализ проводился по методике, описанной Гричук В. П., Заклинской Е. Д. ( Гричук, Заклинская , 1948).
Исследовались содержимое горшков, включая сгоревшую пищу (нагар), зола и сохранившиеся растительные остатки в чашах курильниц из погребений западноманычской катакомбной, восточноманычской катакомбной, срубной и сарматской культур. Дополнительно был проведен спорово-пыльцевой анализ четырех образцов, фитолитный анализ четырех образцов, продатировано два образца нагара методом ускорительной масс-спектрометрии. Отметим, что особенности почв в аридном регионе исследования способствуют сохранности растительных остатков, что подтверждено результатами радиоуглеродного датирования (ван дер Плихт и др., 2016). Для сосудов, происходящих из раскопок последних лет, анализировались фоновые образцы грунта (см.: Shishlina et al., 2018; Шишлина, 2007), отобранного из погребений; для сосудов из старых музейных коллекций такие фоновые образцы отсутствовали.
Для верификации полученных результатов использовались уже опубликованные и новые 14С-данные по другим углеродсодержащим образцам из погребений с сосудами с нагаром. Радиоуглеродные данные калибровались при помощи программы OxCal 4.4 ( Bronk Ramsey , 2017) и калибровочной кривой IntCal20 ( Reimer et al ., 2020).
Результаты и обсуждение
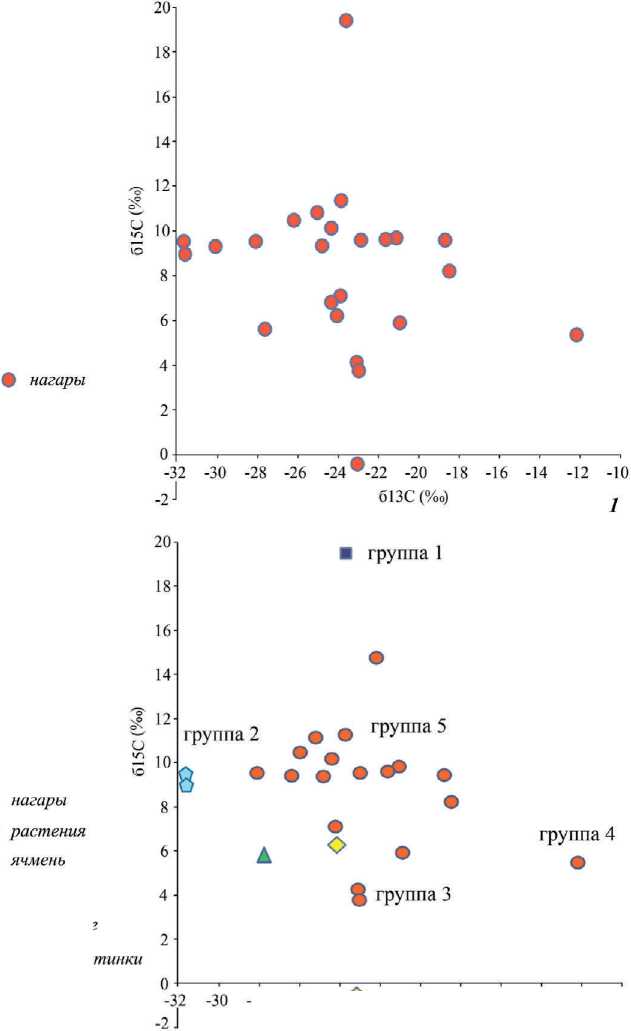
Изотопный состав нагаров и углистой массы представлен в табл. 1 (все табл. см. в конце статьи) и на рис. 1. Он отличается большими вариациями: δ13С: от -31,8 до -12,0‰; δ15Ν: от -0,5 до 19,47‰. Это означает, что состав пригоревшей пищи также различался. Можно высказать предположение, основываясь на вариациях изотопного состава углерода, что, скорее всего, основной растительный компонент сгоревшей пищи состоял из растений группы С3, хотя изотопный состав одного из образцов (δ13С = -12,0‰) свидетельствует, что часть растений в нагаре этого сосуда относилась к растениям группы С4. Эти данные близки изотопному составу сохранившихся в некоторых захоронениях восточноманычской и западноманычской катакомбной культур Прика-спия и Нижнего Подонья карбонизированных диких растений и семян, среди которых преобладают растения С3; для некоторых отмечены повышенные величины изотопного состава азота. Встречены, хотя и реже, растения группы С4 ( Shishlina et al ., 2018). Отметим, что изотопный состав азота в некоторых нагарах оказался крайне высоким, варьируя от 14,9 до 19,5‰.
Результаты фитолитного и спорово-пыльцевого анализа некоторых образцов позволили высказать предположение, что в шести сосудах пища включала достаточно много продуктов растительного происхождения: злаковые, эфедру, цикориевые и другие дикие растения степной зоны (табл. 2). Изотопный состав таких «растительных С3 нагаров» варьирует δ13С от -27,7 до -23,1‰, δ15Ν: от -0,5 до 6,9‰.
В двух образцах – из могильника Песчаный V, курган 18, погребения 4 и 6 – в жаровне из боковой части крупной корчаги была ячменевая «каша», в чаше курильницы также сожгли, скорее всего, стебли и зерна ячменя (рис. 1) (Ibid.). Изотопный состав этих двух образцов отличается самыми низкими величинами изотопного состава углерода δ13С = -31,8‰, что ниже изотопного состава углерода степных растительных компонентов С3. Средняя величина изотопного состава азота этих двух нагаров δ15Ν = 9,23 ± 0,27‰. Таким образом, нагары,
О
злаковые хитиновые
■ MUKL рыб
Рис. 1. Нагары сосудов из степной зоны юга Восточно-Европейской равнины
1 – изотопный состав азота (δ15Ν) и углерода (δ13С); 2 – группы проанализированных нагаров сосудов на основе анализа их изотопного состава азота (δ15Ν) и углерода (δ13С)
-28 -26 -240-22 -20 -18 -16 -14 -12 -10
613C(%o) 2
одним из компонентов которых является ячмень, выделяются особым изотопным составом. Население степной зоны юга Восточно-Европейской равнины в эпоху бронзы и раннего железного века земледелием не занималось ( Лебедева , 2005). При анализе фитолитного спектра нагаров из погребений запад-номанычской катакомбной культуры могильника Песчаный V высказывалось предположение, что ячмень мог быть привезен из предгорных или горных районов Северного Кавказа, население которого в эпоху бронзы уже было знакомо с культурными злаками ( Лебедева , 2015; Трифонов и др ., 2020). Проведенные исследования изотопного состава растений предгорной, горной и высокогорной зон Северного Кавказа показало, что на него влияют многие ландшафтные факторы, например эффект полога, годовой уровень осадков и другие. Это приводит к уменьшению δ13С растений ( Grocke et al ., 1997; Schwarcz et al ., 1999). Выявленное самое низкое значение изотопа углерода δ13С в двух образцах из могильника Песчаный V, возможно, указывает на то, что пригоревший ячмень, скорее всего, происходит не из степной геохимической среды, а, предположительно, из каких-то регионов Северного Кавказа, население которого в III тыс. до н. э. практиковало в небольшом объеме земледелие, выращивая пшеницу, ячмень на наделах ( Лебедева , 2015; Трифонов и др ., 2020). Довольно высокая по сравнению с аналогичными значениями для типичных степных растений С3 величина изотопа азота, возможно, свидетельствует о применении органических удобрений (кизяка) или о попадании в наделы, расположенные рядом с жилищами, мусора ( Bogaard et al ., 2007; Bakels , 2019).
Другой интересный результат получен для нагара сосуда 2 из кургана 1, погребения 5 могильника Зунда-Толга-2. Здесь найдено не только много растительных компонентов, но и большое количество хитиновых микропластинок от речной или озерной рыбы двух-трех видов (табл. 2). Именно для нагара этого сосуда зафиксирована самая высокая величина изотопного состава азота δ15Ν = 19,5‰. Сравнительный анализ этих данных с изотопным составом костей археологических и чешуи современных рыб из водоемов Нижнего Подонья показал, что изотопный состав азота как археологических, так и современных речных рыб также отличается высокой величиной δ15Ν (табл. 3).
В двух образцах – нагар с внешней и внутренней стороны жаровни из кургана 19, погребение 2 могильника Песчаный IV – не найдено никаких растительных компонентов, хотя отметим, что изотопный состав внешнего и внутреннего нагаров отличался, и для обоих образцов характерна достаточно высокая величина изотопного состава азота δ15Ν = 9,7 и 11,4‰ соответственно.
Для остальных образцов данные фитолитного и спорово-пыльцевого анализов отсутствуют.
Чтобы проверить в первую очередь наличие рыбного компонента в нагаре сосуда из кургана 1, погребение 5 могильника Зунда-Толга-2, было проведено 14С УМС-датирование образца нагара и древесины из этого захоронения (табл. 4).
Результаты датирования показали, что радиоуглеродный возраст нагара, состоящего из хитиновых микропластинок речной или озерной рыбы, древнее, чем радиоуглеродный возраст древесины из этого же захоронения, на 500 радиоуглеродных лет. Это является результатом влияния резервуарного эффекта
( ван дер Плихт и др ., 2016; Рhiliрsen , 2010). В табл. 4 приведены результаты парного датирования нагаров из растительных компонентов группы С3 и С4, сравнительный анализ которых показал, что радиоуглеродный возраст таких растительных нагаров и костей человека практически совпадает.
Заключение
Проведенный тестовый сравнительный анализ изотопного состава азота и углерода нагаров и зольной массы, сохранившихся в сосудах эпохи бронзы, результатов фитолитного и споро-пыльцевого анализов, а также дополнительное радиоуглеродное датирование парных углеродсодержащих образцов (нагар – древесина/кости человека) из синхронного контекста показал, что существует связь между изотопным составом нагаров и выявленными продуктами питания. Это позволяет при увеличении сопоставительной базы данных использовать изотопный состав нагаров как маркер вероятных компонентов сгоревшей пищи, если возможность проведения других дополнительных анализов отсутствует. Даже незначительная выборка проанализированных объектов позволила выделить несколько групп, маркирующих ту или иную пищу, которую готовили в горшке или возжигали в курильнице.
Для Группы 1 характерны самые высокие величинами изотопа азота δ15Ν = 19,5‰; средними величинами изотопа углерода δ13С = -23,7‰. Именно в нагаре с таким изотопным составом были найдены хитиновые микропластинки чешуи речной и озерной рыбы. Водный компонент как пищевой продукт подтвержден и значительно более древним радиоуглеродным возрастом нагара сосуда из могильника Зунда-Толга-2 по сравнению с фрагментом древесины из этого же захоронения. Поэтому с определенной долей вероятности можно предполагать, что экстремально высокие величины изотопа азота в нагаре сосудов указывают, что в нем могли варить речную рыбу. Хотя отметим, что в некоторых случаях близкие изотопные величины азота, отражающие эффект ари-дизации, зафиксированы и для местных растений эпохи бронзы ( Shishlina et al ., 2018. Suppl. file).
Группа 2 характеризуется максимально низкими значениями δ13С нагаров (δ13С = -33,77 ± 0,04‰; δ15Ν = 9,23 ± 0,27‰), в которых были обнаружены фитолиты ячменя. При полном отсутствии земледелия в степной зоне в III тыс. до н. э. ( Лебедева , 2005) полагаем, что компоненты сгоревшей пищи в двух сосудах, скорее всего, имеют не степное происхождение и связаны, предположительно, с предгорными/горными районами Северного Кавказа, где земледелие в это время практиковалось некоторыми группами населения в незначительном масштабе ( Лебедева , 2015; Трифонов и др ., 2020).
Группа 3 характеризуется изотопным составом, соотносимым с растительными компонентами группы С3, предположительно, дикорастущими степными злаками и другими съедобными растениями (δ13С = -23,70 ± 1,81‰; δ15Ν = 4,83 ± 2,39‰). Это не означает, что в таких сосудах варили только вегетарианские блюда. Иногда в горшках находят кости домашних животных, встречаются светло-коричневые тяжи бесклеточного строения, скорее всего, животного происхождения ( Шишлина , 2007).
Группа 4 , куда пока входит только один образец, может включать как растения С4, так и моллюски, некоторые виды речных и озерных рыб, потому что для изотопного состава именно таких пищевых компонентов отмечены самые высокие значения δ13С ( Шишлина , 2007). Присутствие в растительном покрове степной экосистемы растений группы С4 подтверждается и находками таких растений в погребениях, и при анализе современных степных растительных ассоциаций ( Shishlina et al ., 2018). Эта группа маркируется пока только одним значением δ13С = -12,0‰; δ15Ν = 5,6‰.
Группа 5 занимает срединное поле на графе, образуя отдельное скопление (рис. 1). Для нее характерен изотопный состав δ13С = -23,13 ± 2,88‰; δ15Ν = 10,36 ± 1,63‰. Требуется дополнительный анализ таких нагаров, чтобы определить состав их компонентов. Возможно, в горшках сохранились остатки пригоревшей пищи из растительных, мясных и даже молочных продуктов. Исследования пищевых белков в протеомах зубного камня на материалах индивидов эпохи бронзы степной зоны юга Восточной Европы показали, что представители ямной культуры пили овечье молоко, катакомбной – коровье, козье и овечье ( Scott et al ., 2022). Изотопный состав азота в таких нагарах выше, чем изотопный состав нагаров растительного происхождения. Возможно, в некоторых сосудах могли готовить мясо домашних животных, которые выпасались в аридных регионах. Другим возможным компонентом пищи могли быть степные грибы, изотопный состав которых также отличается повышенной величиной δ15Ν ( Шишлина и др ., 2021).
Продолжение исследования нагаров разными методами и расширение источниковой базы данных позволит верифицировать гипотетические изотопные группы, характерные для нагаров, состоящих из разных компонентов, и уточнить предлагаемые изотопные маркеры пищевых компонентов.
Список литературы Изотопный состав содержимого сосудов эпохи бронзы: верификация полученных результатов
- Выборнов А. А., Андреев К. М., Барацков А. В. и др., 2014. Новые радиоуглеродные данные для материалов неолита - энеолита Волго-Камья // Известия Самарского научного центра РАН. Т. 16. № 3. С. 242-248.
- Галимов Э. М., 1981. Природа биологического фракционирования изотопов. М.: Наука. 247 с.
- Гричук В. П., Заклинская Е. Д., 1948. Анализ ископаемых пыльцы и спор и его применение в палеогеографии. М.: Географгиз. 223 с.
- Макаров М. И., 2009. Изотопный состав азота в почвах и растениях: использование в экологических исследованиях (обзор) // Почвоведение. Т. 12. С. 1432-1445.
- Лебедева Е. Ю., 2005. Археоботаника и изучение земледелия эпохи бронзы Восточной Ивроны // OPUS: Междисциплинарные исследования в археологии. Вып. 4. М.: ИА РАН. С. 50-68.


