Изучение динамики опухолевого кровотока для оценки раннего ответа рака молочной железы на неоадъювантную химиотерапию
Автор: Павлов Михаил Викторович, Рыхтик Павел Иванович, Ильинская Ольга Евгеньевна, Субочев Павел Владимирович, Крейнина Юлия Михайловна, Масленникова Анна Владимировна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 т.19, 2020 года.
Бесплатный доступ
Введение. В течение последних 20 лет произошло изменение подходов к лечению рака молочной железы, в частности существенное повышение роли лекарственной терапии. Ответ на неоадъювантную химиотерапию рассматривается в настоящее время как суррогатный биомаркер, который позволяет оценить течение и прогноз заболевания. Для решения данной задачи необходимо проводить оценку функциональных и метаболических изменений опухолевой ткани в процессе лечения. Ультразвуковая допплерография - это неинвазивный, доступный и недорогой метод визуализации, который можно безопасно использовать для повторных измерений. Цель исследования - изучение динамики васку-ляризации опухоли ультразвуковым методом в режиме энергетического допплера для оценки раннего ответа рака молочной железы на неоадъювантную химиотерапию. Материал и методы. Исследование проводилось на базе ФБУЗ ПОМЦ ФМБА России с мая 2017 по август 2019 г. В исследование были включены 63 больных раком молочной железы, которым проводилась неоадъювантная химиотерапия. Оценка кровотока опухоли с использованием допплеровского сканирования проводилась до начала и перед вторым курсом неоадъювантной химиотерапии. Изменения кровоснабжения опухоли на фоне химиотерапии сопоставлялись с патоморфологическим ответом опухоли после оперативного лечения. Результаты. В подавляющем большинстве случаев (78 %) наблюдалось не зависящее от степени лечебного патоморфоза уменьшение количества опухолевых сосудов после первого курса химиотерапии. В 8 случаях повышения васкуляризации после первого курса неоадъювантной химиотерапии при гистологическом исследовании удаленной опухоли наблюдалось отсутствие ответа/слабый ответ на лечение при отсутствии перитуморального воспаления, в 5 случаях - резкое увеличение количества сосудов вокруг обширных зон интранодулярного некроза и обусловленного им перитуморального воспаления. В целом сопоставление динамики васкуляризации опухоли и патоморфологического ответа выявило слабую, хотя и статистически значимую отрицательную корреляцию между изменениями кровоснабжения опухоли на фоне химиотерапии и степенью лечебного патоморфоза. Выводы. Не удалось установить однозначной зависимости между реакцией сосудистого русла и ответом опухоли на цитостатическое воздействие. Повышение количества опухолевых сосудов при отсутствии перитумо-рального воспаления оказалось единственной ситуацией, когда изменения опухолевого кровотока на фоне проведения химиотерапии могут быть однозначно интерпретированы как предиктивный критерий отсутствия/слабого ответа опухоли на лечение.
Рак молочной железы, ультразвуковая диагностика, энергетический допплер, неоадъювантная химиотерапия, ранний ответ опухоли на лечение, кровоснабжение опухоли
Короткий адрес: https://sciup.org/140254397
IDR: 140254397 | УДК: 618.19-006.6-08:615.28 | DOI: 10.21294/1814-4861-2020-19-6-46-56
Текст научной статьи Изучение динамики опухолевого кровотока для оценки раннего ответа рака молочной железы на неоадъювантную химиотерапию
Рак молочной железы (РМЖ) занимает первое место среди онкологических заболеваний у женщин, а также является главной причиной смертности женщин от злокачественных опухолей [1]. В течение последних 20 лет произошло изменение подходов к лечению РМЖ, в частности существенное повышение роли лекарственной терапии [2, 3]. Неоадъювантная химиотерапия (НАХТ) изначально рассматривалась как метод «снижения стадии» местнораспространенных новообразований перед оперативным вмешательством [4], однако в последние годы показания к ее применению существенно расширились [5]. Ответ РМЖ на неоадъювантную химиотерапию рассматривается в настоящее время как суррогатный биомаркер, который позволяет оценить течение и прогноз заболевания [6]. Наилучшим показателем эффективности лечения, влияющим на общую и безрецидивную выживаемость, является полный ответ опухоли (pCR), определяемый как отсутствие жизнеспособных опухолевых клеток в молочной железе и регионарных лимфатических узлах [5, 7]. К сожалению, этот результат достигается не более чем у 13–33 % больных в зависимости от степени злокачественности, иммунофенотипа опухоли и схемы противоопухолевой терапии [4, 8]. У части больных предоперационная химиотерапия вообще не оказывает противоопухолевого эффекта, о чем свидетельствует отсутствие признаков лечебного патоморфоза [9–12]. В случае нечувствительности новообразования к химиотерапии встает проблема отсрочки оперативного вмешательства, развития токсических эффектов и высокой стоимости неэффективного, по сути, лечения [12]. С этой точки зрения актуальной является разработка методов, позволяющих прогнозировать ответ опухоли на лекарственную терапию в короткие сроки после ее начала. Стандартная на сегодняшний день оценка изменений новообразования по критериям RECIST имеет существенные ограничения, поскольку структурная визуализация отражает только изменения размеров опухоли, но не ее биологическую активность [13–15].
Для решения данной задачи необходимо проводить оценку функциональных и метаболических изменений опухолевой ткани в процессе лечения [16]. Одним из маркеров таких изменений может быть изменение кровоснабжения [17]. Существуют данные, что гибель опухолевой ткани в результате воздействия цитотоксических агентов может оказывать влияние на опухолевый неоангиогенез [18, 19]. Для определения перфузии сосудов опухоли в настоящее время применяются такие методы, как ПЭТ, МРТ и КТ с динамическим контрастным усилением, маммосцинтиграфия, УЗИ с контрастным усилением [15, 20–23], которые требуют введения контрастных веществ, использования радиофармацевтических препаратов и являются относительно дорогостоящими для повторного использования. Для сравнения, ультразвуковая допплерография – это неинвазивный, более доступный и менее затратный метод визуализации, который можно безопасно использовать для повторных измерений. Проведены исследования эффективности ультразвуковой допплерографии в качестве метода диагностики РМЖ [24, 25]. С целью ранней оценки ответа опухоли на лечение изучалась роль таких параметров допплерографии, как максимальная скорость кровотока (Vmax), пульсационный индекс (PI), индекс резистентности (RI) и изменения количества регистрируемых сосудов [26–28]. Уменьшение числа регистрируемых сосудов оказалось единственным независимым фактором, отражающим ответ опухоли на лечение. Авторы оценивали динамику параметров опухолевого кровотока уже после трех курсов НАХТ или перед проведением оперативного лечения, что не могло выявить раннюю реакцию новообразования на проводимую терапию.
Целью исследования явилось изучение динамики опухолевого кровотока ультразвуковым методом в режиме энергетического допплера для оценки раннего ответа РМЖ на неоадъювантную химиотерапию.
Материал и методы
Исследование было проведено на базе Приволжского окружного медицинского центра (г. Нижний Новгород) на основании разрешения Локального этического комитета. Критериями включения в исследование были гистологически подтвержденный рак молочной железы II–IV стадии; подписанное информированное согласие; планирование НАХТ в комплексном лечении рака молочной железы; удовлетворительное общее состояние (статус по ECOG 0–1). Критериями исключения были опухоли, прорастающие кожу, и возраст пациенток менее 18 лет. С мая 2017 г. по август 2019 г. изучение результатов неоадъювантной химиотерапии в рамках клинического протокола полностью закончили 63 пациентки (таблица).
До лечения всем пациенткам проводилось обследование в соответствии с клиническими рекомендациями Европейского общества медицинской онкологии (ESMO) [29], которое включало маммографию, УЗИ молочных желез и периферических лимфоузлов, биопсию опухоли с определением рецепторного статуса, HER2neu статуса и индекса пролиферации. Оценка кровотока опухоли с использованием допплеровского сканирования проводилась до НАХТ и перед 2-м курсом химиотерапии. После завершения НАХТ пациенткам проводилось оперативное вмешательство с последующим патоморфологическим исследованием опухоли и оценкой ответа опухоли на лечение. В соответствии с результатами гистологического исследования пациентки были разделены на 5 групп,
Таблица/table
Общая характеристика пациенток, включенных в исследование general characteristics of the patients included into the study
|
Параметр/Parameters |
Число пациенток/ Number of patients |
Для оценки состояния кровотока опухоли молочной железы была разработана оригинальная методика ультразвукового исследования. Сканирование зоны интереса проводилось на аппарате «Medison Accuvix-V20» (Samsung, Корея) с использованием 5,0–13,0 МГц мультичастотного линейного датчика в режиме энергетического допплера с шагом 5 мм во взаимно перпендикулярных плоскостях. Центр опухоли сопоставлялся с центром трафарета из прозрачного полимерного материала с точечными отверстиями в виде сетки через каждые 5 мм, через которые маркером на коже отмечались точки. По ним после удаления трафарета в режиме энергетического допплера с заданным размером окна интереса проводилось последовательное сканирование всей опухоли во взаимно перпендикулярных плоскостях. При этом если размер опухоли был менее 4 см, то достаточное число сканов составляло 18 (9 в сагиттальной и 9 в аксиальной плоскости). В случае опухолей размером более 4 см с помощью трафарета можно добавить количество точек, необходимое для сканирования всего объема опухолевой ткани. С помощью программы «Matlab» в каждой плоскости определялось отношение числа окрашенных пикселей (соответствующих сосудам) к общему числу пикселей на изображении. Таким образом обрабатывались все изображения и рассчитывалась средняя величина для всех изображений, полученных при сканировании всей опухоли (индекс васкуляризации). Васкуляризация оценивалась до начала лечения и перед вторым курсом НАХТ. Затем определялась разница индекса васкуляризации до и после первого курса НАХТ в процентах (∆ индекса васкуляризации) [31]. Данный показатель принимался в качестве параметра, который сопоставлялся с патоморфологическим ответом опухоли на лечение.
Корреляционный анализ между изменениями васкуляризации опухоли после начала химиотерапии ( ∆ индекса васкуляризации (%)) и патологическим ответом опухоли был выполнен в программе
GraphPad Prism (Graphpad Software Inc., La Jolla, CA, USA). Облако корреляции было создано и линейно аппроксимировано ранговым коэффициентом корреляции Спирмена, чтобы подтвердить гипотезу соответствия между этими показателями и ответом опухоли. Значение р<0,05 было принято в качестве статистически значимого.
Результаты
У подавляющего большинства пациенток после первого курса химиотерапии наблюдалось снижение или незначительное повышение опухолевого кровотока (рис. 1). Однако у 5 больных с различной степенью патоморфоза опухолевой ткани было выявлено существенное (не менее 50 %) увеличение количества опухолевых сосудов (рис. 1). У этих пациенток наблюдался тройной негативный (n=3) или люминальный В HER2neu позитивный (n=2) иммунофенотип РМЖ, а опухоли по данным УЗИ в B-режиме содержали обширные зоны некроза, что было подтверждено гистологическим исследованием. Динамика васкуляризации одной из этих пациенток представлена в клиническом примере № 1. Мы предположили, что увеличение размера опухоли и количества опухолевых сосудов в данной группе больных связано не с ответом опухоли на лекарственное лечение, а с возникновением выраженного перитуморального воспаления в области некроза, в связи с чем данные о динамике кровотока опухолей этих пациенток не были включены в дальнейший анализ.
Клинический пример № 1
Пациентка С., 49 лет, получала неоадъювантную химиотерапию (схема АС) по поводу рака правой молочной железы (неспецифицированная инфильтрирующая карцинома G3, трипл-негативный иммунофенотип) IIа стадии (T2N0M0). По данным УЗИ перед неоадъювантной химиотерапией определялся опухолевый узел с нечетким контуром, размером 36×35 мм, с признаками некроза в центре и скудным кровотоком по периферии (рис. 2А). При морфологическом исследовании (core-биопсия) выявлены обширные пласты некротической ткани со структурами инвазивного рака молочной железы и явлениями краш-синдрома (рис. 2Г (верхнее изображение)). По данным УЗИ после начала химиотерапии отмечено увеличение размера опухоли до 42×40 мм, значительное увеличение центральной зоны некроза и появление отека в перинодулярной области (рис. 2А). Отмечалось увеличение площади сосудов в исследуемой области на 54 %. Кровоток регистрировался в основном по периферии опухоли и в перинодулярной области (рис. 2Б). После 4 курсов НАХТ выполнена радикальная мастэктомия по Маддену. При морфологическом исследовании операционного материала – ЛП III степени по Miller and Pain с наличием обширной области некроза, занимающего центральную часть опухоли (рис. 2Г, нижнее изображение).
У 50 (78 %) из 58 пациенток, включенных в дальнейший анализ, после 1-го курса НАХТ наблюдалось различной степени выраженности
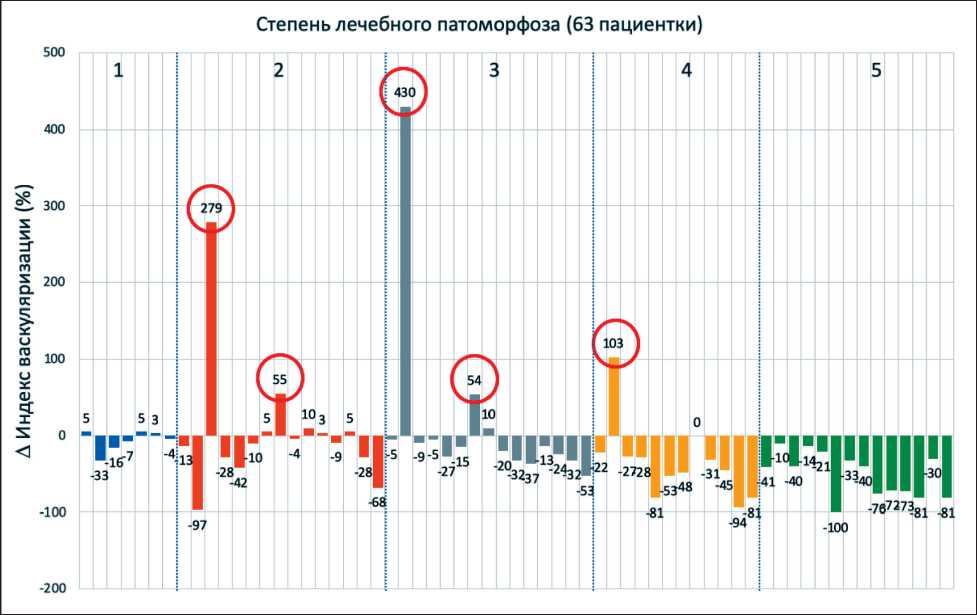
Рис. 1. Динамика кровоснабжения опухоли до начала химиотерапии и перед вторым курсом НАХТ в зависимости от степени лечебного патоморфоза (n=63). Красным кругом отмечены пациентки с некротическими изменениями опухоли
Fig. 1. Changes in tumor blood floor before chemotherapy and before the second cycle of NACT, depending on the grade of pathological tumor response (n=63). Red circle marks patients with necrotic changes in the tumor
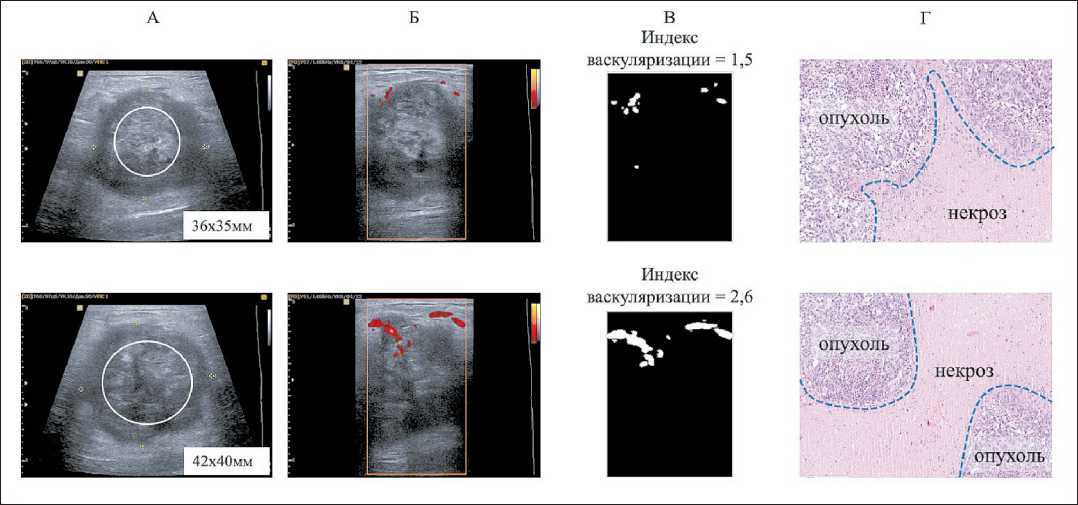
Рис. 2. Динамика кровоснабжения опухоли. Верхний ряд – результаты до НАХТ, нижний ряд – после 1-го курса НАХТ (А, Б, В) и после завершения НАХТ (Г): А – УЗИ в В-режиме, область некроза отмечена белым овалом; Б – УЗИ в режиме энергетического допплера; В – численная обработка изображения в программе «Мatlab»; Г – микрофото: верхнее изображение – core-биопсия, нижнее изображение – послеоперационный материал, окраска гематоксилином и эозином, ×50
Fig. 2. Changes in tumor blood floor. Upper row – results before NACT, lower row – after the 1st cycle of NACT (A, B, C) and after completion of NACT (D): A – ultrasound scan, B-mode, the necrosis zone is indicated by a white oval; B – image of ultrasound (energy
Doppler mode); C – numerical image processing in the Matlab program; D – histological samples, hematoxylin-eosin staining, ×50
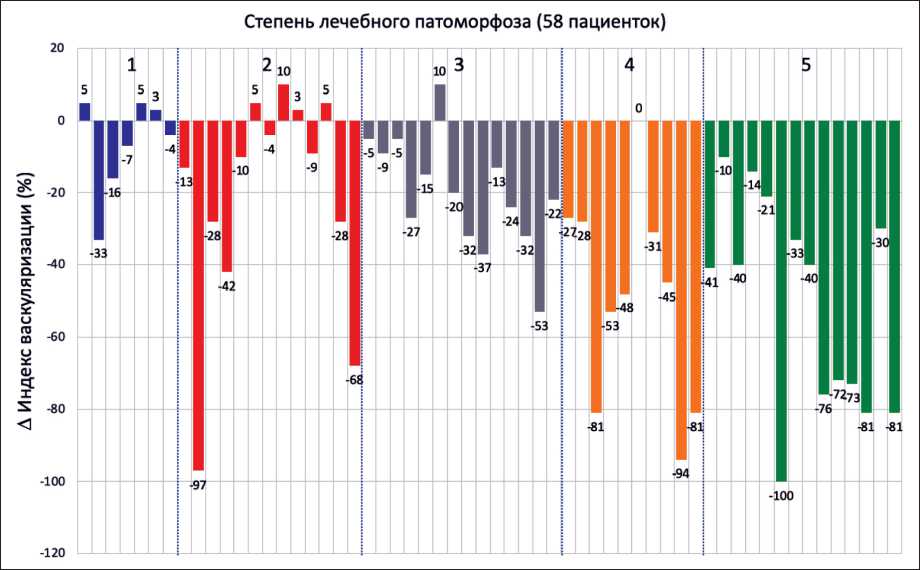
Рис. 3. Динамика кровоснабжения опухоли до начала химиотерапии и перед 2-м курсом НАХТ в зависимости от степени лечебного патоморфоза (n=58)
Fig. 3. Changes in tumor blood floor before chemotherapy and before the second cycle of NACT, depending on the grade of pathological tumor response (n=58)
уменьшение количества опухолевых сосудов (рис. 3). Динамика васкуляризации в данной группе представлена в клиническом примере № 2.
Клинический пример № 2
Больная В., 50 лет. Диагноз: рак правой молочной железы (неспецифицированная инфиль- трирующая карцинома G2) IIа стадии (T2N0M0), нелюминальный HER2neu позитивный иммунофенотип (рецепторы эстрогена 0 баллов, рецепторы прогестерона 0 баллов, Ki67 55 %). По данным УЗИ до неоадъювантной химиотерапии в молочной железе определялся опухолевый узел с неровным
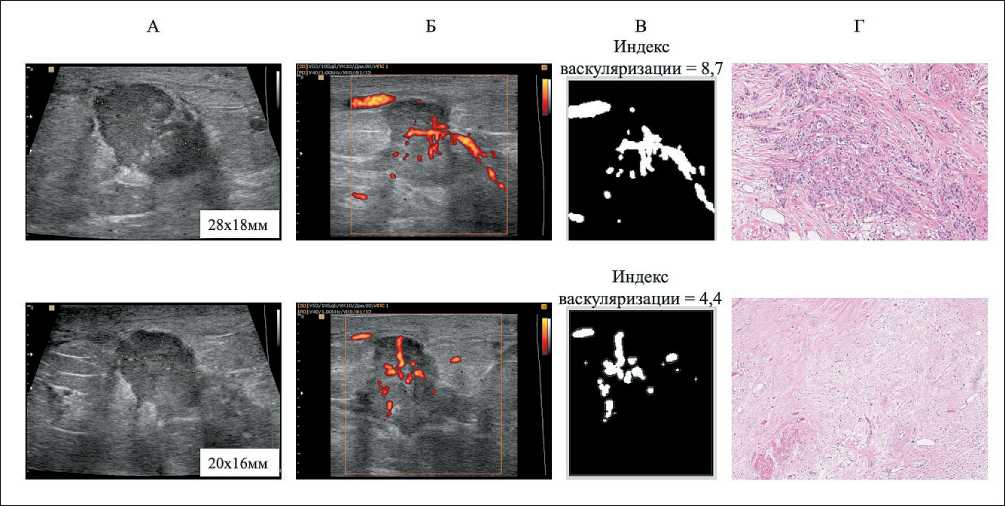
Рис. 4. Динамика кровоснабжения опухоли. Верхний ряд – результаты до НАХТ, нижний ряд – после 1-го курса НАХТ (А, Б, В) и после завершения НАХТ (Г): А – УЗИ в В-режиме; Б – УЗИ в режиме энергетического допплера; В – численная обработка изображения в программе «Мatlab»; Г – микрофото: верхнее изображение – core-биопсия, нижнее изображение – послеоперационный материал, окраска гематоксилином и эозином, ×50
Fig. 4. Changes in tumor blood floor. Upper row – results before NACT, lower row – after the 1st cycle of NACT (A, B, C) and after completion of NACT (D):
A – ultrasound scan, B-mode; B – image of ultrasound (energy Doppler mode); C – numerical image processing in the Matlab program; D – histological samples, hematoxylin-eosin staining, ×50
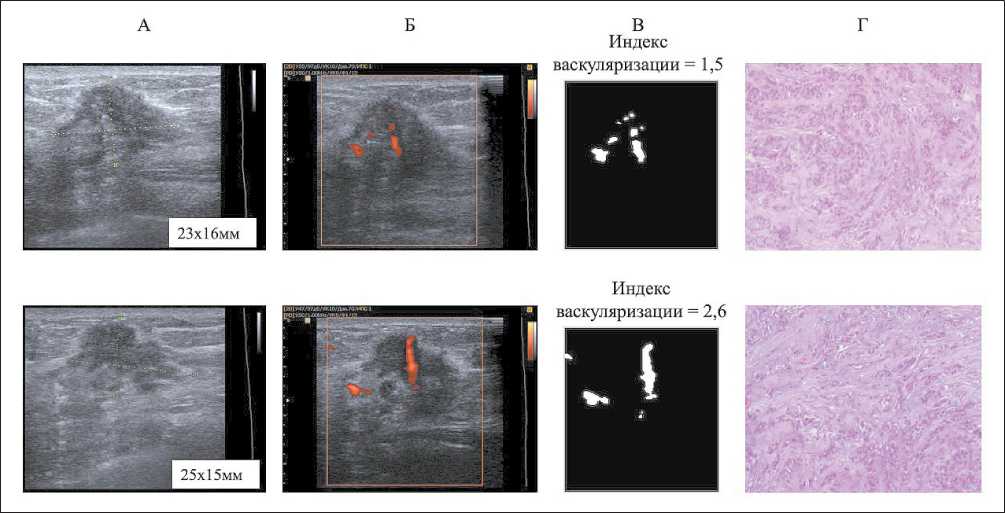
Рис. 5. Динамика кровоснабжения опухоли. Верхний ряд – результаты до НАХТ, нижний ряд – после 1-го курса НАХТ (А, Б, В) и после завершения НАХТ (Г): А – УЗИ в В-режиме; Б – УЗИ в режиме энергетического допплера; В – численная обработка изображения в программе «Мatlab»; Г – микрофото: верхнее изображение – core-биопсия, нижнее изображение – послеоперационный материал, окраска гематоксилином и эозином, ×50.
Fig. 5. Changes in tumor blood floor. Upper row – results before NACT, lower row – after the 1st cycle of NACT (A, B, C) and after completion of NACT (D):
A – ultrasound scan, B-mode; B – image of ultrasound (energy Doppler mode); C – numerical image processing in the Matlab program; D – histological samples, hematoxylin-eosin staining, ×50
нечетким контуром, размером 28×18 мм (рис. 4А). При морфологическом исследовании выявлена инвазивная протоковая карцинома (рис. 4Г, верхнее изображение). Исходный уровень васкуляризации – 7,3 %. Пациентке назначена неоадъювантная химиотерапия (схема CAF + трастузумаб). После первого курса НАХТ выявлено уменьшение размера опухоли до 20×16 мм (рис. 4А) и снижение опухолевого кровотока на 21 % по сравнению с исходным (рис. 4Б, В). Морфологическое исследование после 6 курсов НАХТ и оперативного лечения не выявило жизнеспособных клеток, что соответствует ЛП V степени (рис. 4Г, нижнее изображение).
Как известно, нелюминальный HER2neu позитивный РМЖ очень чувствителен к лекарственному лечению с применением таргетной терапии. Частота полных патоморфологических регрессий в данной группе может быть достигнута у 45–55 % пациенток [5]. В представленном клиническом примере уменьшение количества опухолевых сосудов отразило ответ опухоли на химиотерапию уже на раннем этапе лечения.
У 8 пациенток мы отметили увеличение количества опухолевых сосудов после первого курса НАХТ (рис. 4), которое наблюдалось в случае ЛП I или II степени (отсутствие ответа/сокращение числа опухолевых клеток после НАХТ до 30 %, клинический пример № 3).
Клинический пример № 3
Больная Е., 42 года. Диагноз: рак левой молочной железы (неспецифицированная инфильтрирующая карцинома G2) IIb стадия (T2N1M0), люминальный В HER2neu негативный рак (рецепторы эстрогена 8 баллов, рецепторы прогестерона 0 баллов, Ki67 40 %) При УЗИ до неоадъювантной химиотерапии определялся опухолевый узел с нечетким контуром, размером 23×16 мм (рис. 5А). При морфологическом исследовании выявлена инвазивная протоковая карцинома (рис. 5Г, верхнее изображение). Исходный уровень васкуляризации – 4,5 %. Пациентке назначена неоадъювантная химиотерапия (схема CAF). После первого курса НАХТ размеры опухоли не изменились (рис. 5А). Опухолевый кровоток по сравнению с исходным увеличился на 3 % (рис. 5Б, В). Морфологическое исследование после 6 курсов НАХТ и радикальной мастэктомии по Маддену выявило ЛП I степени (рис. 5Г, нижнее изображение).
В случае люминального HER2neu негативного РМЖ полная патоморфологическая регрессия достигается в 6–9 % [5]. Ввиду отсутствия молекулярной мишени для таргетной терапии крайне важной задачей остается выявление на самом раннем этапе отсутствия ответа на лечение у пациенток из данной группы. Представленный клинический пример продемонстрировал возможность УЗИ в режиме энергетического допплера предсказать отсутствие эффекта на лечение уже после первого курса НАХТ.
Обсуждение
Рациональное использование НАХТ при раке молочной железы требует как можно более ранней объективной оценки эффективности проводимого лечения [32]. Предполагается, что изменение кровоснабжения опухоли под влиянием лекарственного лечения может быть таким диагностическим критерием. В ряде исследований сообщалось, что увеличение кровоснабжения опухоли в процессе НАХТ является независимым прогностическим показателем плохого ответа на лечение при РМЖ. В нашем исследовании для оценки предиктивного значения изменений состояния сосудистого русла был разработан стандартизированный подход к сканированию опухоли и окружающих тканей, а также проведена компьютерная обработка изображений, что сделало оценку более точной и объективной. Анализ результатов показал, что в подавляющем большинстве случаев (78 %) наблюдается не зависящее от степени лечебного патоморфоза уменьшение количества опухолевых сосудов после первого курса НАХТ. Исключением является ситуация, когда в ответ на лечение возникало резкое увеличение числа опухолевых сосудов, что отмечено у 5 пациенток с различной степенью лечебного патоморфоза. После анализа ультразвуковых изображений в В-режиме и оценки данных послеоперационного гистологического исследования установлено, что данная сосудистая реакция была связана с наличием интранодулярного некроза и ассоциированного с ним перинодулярного воспаления. Такие особенности злокачественного роста характерны для наиболее агрессивных вариантов РМЖ [33]. Мы полагаем, что в случае интранодулярного некроза, выявленного при УЗИ в В-режиме, интерпретация изменений опухолевого кровотока может быть значительно затруднена и требует применения альтернативных методов. Кроме того, данный метод неинформативен при малых размерах опухоли (менее 10 мм) и отсутствии регистрируемых интранодулярных и перинодулярных сосудов до начала и после первого курса НАХТ.
У остальных пациенток в подавляющем большинстве случаев наблюдалось различной степени снижение васкуляризации вне зависимости от степени лечебного патоморфоза. При этом во всех 8 случаях повышения опухолевого кровотока после первого курса НАХТ при морфологическом исследовании операционного материала наблюдалось отсутствие ответа/слабый ответ на лечение. Сопоставление динамики васкуляризации и патоморфологического ответа выявило слабую, хотя и статистически значимую, отрицательную корреляцию между изменениями кровоснабжения опухоли на фоне химиотерапии и степенью ЛП (r =-0,53; p<0,01) (рис. 6).
Полученные результаты позволяют сделать вывод, что химиотерапия оказывает раннее влияние на сосудистое русло опухоли после начала
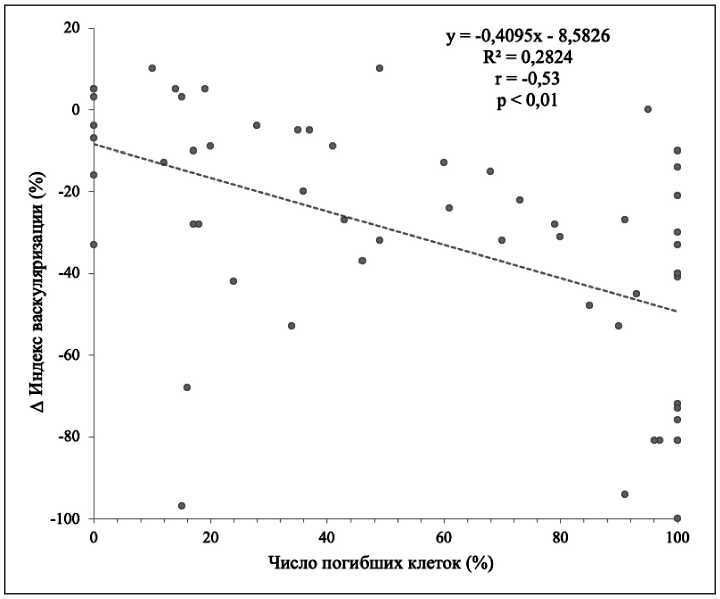
Рис. 6. Корреляция между ответом опухоли (число погибших клеток после завершения химиотерапии) и ∆ индекса васкуляризации (%) после первого курса НАХТ
Fig. 6. The correlation between the tumor response (the number of dead cells after completion of chemotherapy) and the ∆ vascularization index (%) after the first cycle of NACT лечения, однако нам не удалось установить однозначной зависимости между реакцией сосудистого русла и патоморфологическим ответом опухоли. Повышение количества опухолевых сосудов при отсутствии перитуморального воспаления оказалось единственной ситуацией, когда изменения опухолевого кровотока на фоне химиотерапии могут быть однозначно интерпретированы как
Список литературы Изучение динамики опухолевого кровотока для оценки раннего ответа рака молочной железы на неоадъювантную химиотерапию
- World health organization [Internet]. URL: http://www.who.int/ en/ (cited 07.03.2020).
- Fisher B. Laboratory and clinical research in breast cancer--a personal adventure: the David A. Karnofsky memorial lecture. Cancer Res. 1980 Nov; 40(11): 3863-74.
- Early Breast Cancer Trialists' Collaborative Group (EBCTCG), Peto R., Davies C, Godwin J., Gray R., Pan H.C., Clarke M, Cutter D, Darby S, McGale P., Taylor C., Wang Y.C., Bergh J., Di Leo A., Albain K., Swain S., PiccartM., PritchardK. Comparisons between different poly-chemotherapy regimens for early breast cancer: meta-analyses of long-term outcome among 100,000 women in 123 randomised trials. Lancet. 2012; 379(9814): 432-44. doi: 10.1016/S0140-6736(11)61625-5.
- Waljee J.F., Newman L.A. Neoadjuvant systemic therapy and the surgical management of breast cancer. Surg Clin North Am. 2007 Apr; 87(2): 399-415, ix. doi: 10.1016/j.suc.2007.02.004.
- Cortazar P., Zhang L., Untch M., Mehta K., Costantino J.P., Wol-markN., Bonnefoi H., Cameron D., Gianni L., Valagussa P., Swain S.M., Prowell T., Loibl S., Wickerham D.L., Bogaerts J., Baselga J., Perou C., Blumenthal G., Blohmer J., Mamounas E.P., Bergh J., Semiglazov V., Justice R., Eidtmann H., Paik S., Piccart M., Sridhara R., Fasching P.A., Slaets L., Tang S., Gerber B., Geyer C.E.Jr., Pazdur R., Ditsch N., Ras-togi P., Eiermann W., von Minckwitz G. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 2014 Jul; 384(9938): 164-72. doi: 10.1016/S0140-6736(13)62422-8.
- Gradishar W.J., Anderson B.O., Balassanian R., Blair S.L., BursteinH.J., Cyr A., Elias A.D., Farrar W.B., Forero A., Giordano S.H., Goetz M.P., Goldstein L.J., Isakoff S.J., Lyons J., Marcom P.K., Mayer I.A., McCormick B., Moran M.S., O'Regan R.M., Patel S.A., Pierce L.J., Reed E.C., Salerno K.E., Schwartzberg L.S., Sitapati A., Smith K.L., Smith M.L., Soliman H., Somlo G., Telli M.L., Ward J.H., Kumar R., SheadD.A. Breast Cancer, Version 4.2017, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2018 Mar; 16(3): 310-320. doi: 10.6004/jnccn.2018.0012.
- von Minckwitz G., Untch M., Blohmer J.U., Costa S.D., Eidtmann H., Fasching P.A., Gerber B., Eiermann W., Hilfrich J., Huober J., Jackisch C, Kaufmann M., Konecny G.E., Denkert C., Nekljudova V., Mehta K., Loibl S. Definition and impact of pathologic complete response on prognosis after neoadjuvant chemotherapy in various intrinsic breast cancer subtypes. J Clin Oncol. 2012 May 20; 30(15): 1796-804. doi: 10.1200/ JCO.2011.38.8595.
- Imai H., Kuroi K., Ohsumi S., Ono M., Shimozuma K. Economic evaluation of the prevention and treatment of breast cancer--present status and open issues. Breast Cancer. 2007; 14(1): 81-7. doi: 10.2325/ jbcs.14.81.
- Gonzalez-AnguloA.M., Morales-VasquezF., Hortobagyi G.N. Overview of resistance to systemic therapy in patients with breast cancer. Adv Exp Med Biol. 2007; 608: 1-22. doi: 10.1007/978-0-387-74039-3_1.
- Balmativola D., Marchid C., MauleM., Chiusa L., Annaratone L., Maletta F., Montemurro F., Kulka J., Figueiredo P., Varga Z., Liepniece-Karele I., Cserni G., Arkoumani E., Amendoeira I., Callagy G., Reiner-Concin A., Cordoba A., Bianchi S., Decker T., Gläser D., Focke C., van Diest P., Grabau D., Lips E., Wesseling J., Arisio R., Medico E., Wells C., Sapino A. Pathological non-response to chemotherapy in a neoadjuvant setting of breast cancer: an inter-institutional study. Breast Cancer Res Treat. 2014 Dec; 148(3): 511-23. doi: 10.1007/s10549-014-3192-3.
- Ono M., Tsuda H., Shimizu C., Yamamoto S., Shibata T., Yama-moto H., Hirata T., Yonemori K., Ando M., Tamura K., Katsumata N., Kinoshita T., Takiguchi Y., Tanzawa H., Fujiwara Y. Tumor-infiltrating lymphocytes are correlated with response to neoadjuvant chemotherapy in triple-negative breast cancer. Breast Cancer Res Treat. 2012; 132(3): 793-805. doi: 10.1007/s10549-011-1554-7.
- Schaafsma B.E., van de Giessen M., Charehbili A., Smit V.T., Kroep J.R., Lelieveldt B.P., Liefers G.J., Chan A., Löwik C.W., Dijkstra J., van de Velde C.J., Wasser M.N., Vahrmeijer A.L. Optical mammography using diffuse optical spectroscopy for monitoring tumor response to neo-adjuvant chemotherapy in women with locally advanced breast cancer. Clin Cancer Res. 2015 Feb 1; 21(3): 577-84. doi: 10.1158/1078-0432. CCR-14-0736.
- Therasse P., Arbuck S. G., Eisenhauer EA., Wanders J., Kaplan R.S., RubinsteinL., Verweij J., VanGlabbekeM, vanOosteromA.T., ChristianM.C., Gwyther S.G. New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada. J Natl Cancer Inst. 2000; 92(3): 205-16. doi: 10.1093/ jnci/92.3.205.
- Wang J., Wu N., Cham M.D., Song Y. Tumor response in patients with advanced non-small cell lung cancer: perfusion CT evaluation of chemotherapy and radiation therapy. AJR. 2009; 193(4): 1090-6. doi: 10.2214/AJR.08.1367.
- Wang J.W., Zheng W., Liu J.B., Chen Y, Cao L.H., Luo R.Z., Li A.H., Zhou J.H. Assessment of early tumor response to cytotoxic chemotherapy with dynamic contrast-enhanced ultrasound in human breast cancer xenografts. PLoS One. 2013; 8(3): e58274. doi: 10.1371/journal. pone.0058274.
- Marcus C.D., Ladam-Marcus V., Cucu C., Bouché O., Lucas L., Hoeffel C. Imaging techniques to evaluate the response to treatment in oncology: current standards and perspectives. Crit Rev Oncol Hematol. 2009 Dec; 72(3): 217-38. doi: 10.1016/j.critrevonc.2008.07.012.
- Cosgrove D., Lassau N. Imaging of perfusion using ultrasound. Eur J Nucl Med Mol Imaging. 2010; 37 Suppl 1: S65-85. doi: 10.1007/ s00259-010-1537-7.
- ShakedY., Ciarrocchi A., FrancoM., Lee C.R., ManS., CheungA.M., Hicklin D.J., Chaplin D., Foster F.S., Benezra R., Kerbel R.S. Therapy-induced acute recruitment of circulating endothelial progenitor cells to tumors. Science. 2006 Sep 22; 313(5794): 1785-7. doi: 10.1126/sci-ence.1127592.
- Marmé D., Fusenig N. Tumor Angiogenesis. Springer, 2008. 829 p.
- Koolen B.B., Pengel K.E., Wesseling J., Vogel W.V., Vrancken Peeters M.J., Vincent A.D., Gilhuijs K.G., Rodenhuis S., Rutgers E.J., Valdés Olmos R.A. Sequential (18)F-FDG PET/CT for early prediction of complete pathological response in breast and axilla during neoadjuvant chemotherapy. Eur J Nucl Med Mol Imaging. 2014 Jan; 41(1): 32-40. doi: 10.1007/s00259-013-2515-7.
- SharmaA., Sharma S., SoodS., SeamR.K., SharmaM., Fotedar V. DCE-MRI and parametric imaging in monitoring response to neoadjuvant chemotherapy in breast carcinoma: a preliminary report. Pol J Radiol. 2018 May 18; 83: e220e228. doi: 10.5114/pjr.2018.76271.
- Bellomi M., Petralia G., Sonzogni A., Zampino M.G., Rocca A. CT perfusion for the monitoring of neoadjuvant chemotherapy and radiation therapy in rectal carcinoma: initial experience. Radiology. 2007 Aug; 244(2): 486-93. doi: 10.1148/radiol.2442061189.
- MankoffD.A., DunnwaldL.K., Gralow J.R., Ellis G.K., Drucker M.J., Livingston R.B. Monitoring the response of patients with locally advanced breast carcinoma to neoadjuvant chemotherapy using [technetium 99m]-sestamibi scintimammography. Cancer. 1999 Jun 1; 85(11): 2410-23.
- Бусько Е.А., Семиглазов В.В., Мищенко А.В., Шишова А.С., Смирнова В.О., Костромина Е.В., Черная А.В., Артемьева А.С., Криворотько П.В. Возможности ультразвукового цветового доппле-ровского картирования в ранней диагностике рака молочной железы. Сибирский онкологический журнал. 2019; 18(6): 12-19. [Busko E.A., Semiglazov V.V., Mishchenko A.V., Shishova A.S., Smirnova V.O., Kostromina E.V., Chernaya A.V., Artemieva A.S., Kryvorotko P.V. Diagnostic value of ultrasound color doppler mapping in early detection of breast cancer. Siberian Journal of Oncology. 2019; 18(6): 12-19. (in Russian)]. doi: 10.21294/1814-4861-2019-18-6-12-19.
- Watanabe T., Kaoku S., Yamaguchi T., Izumori A., Konno S., Okuno T., TsunodaH., BanK., HirokagaK., Sawada T., Ito T., Nakatani S., Yasuda H., Tsuruoka M., Ueno E., Tohno E., Umemoto T., Shirakawa T. Multicenter Prospective Study of Color Doppler Ultrasound for Breast Masses: Utility of Our Color Doppler Method. Ultrasound Med Biol. 2019 Jun; 45(6): 1367-1379. doi: 10.1016/j.ultrasmedbio.2019.01.021.
- Singh S., Pradhan S., Shukla R.C., Ansari M.A., Kumar A. Color Doppler ultrasound as an objective assessment tool for chemotherapeutic response in advanced breast cancer. Breast Cancer. 2005; 12(1): 45-51. doi: 10.2325/jbcs.12.45.
- 27.Kumar A., SinghS., PradhanS., ShuklaR.C., AnsariM.A., Singh T.B., Shyam R., Gupta S. Doppler ultrasound scoring to predict chemotherapeutic response in advanced breast cancer. World J Surg Oncol. 2007; 5: 99. doi: 10.1186/1477-7819-5-99.
- Singh G., Kumar P., Parshad R., Seith A., Thulkar S., Hosten N. Role of color Doppler indices in predicting disease-free survival of breast cancer patients during neoadjuvant chemotherapy. Eur J Radiol. 2010 Aug; 75(2): e158-62. doi: 10.1016/j.ejrad.2009.12.027.
- Тюляндин С.А., Носов ДА., Переводчикова Н.И. Минимальные клинические рекомендации Европейского общества медицинской онкологии (ESMO). Медицинский алфавит. 2014; 3-4(18): 59-65. [Tyulandin S.A., Nosov D.A., Perevodchikova N.I. Minimum Clinical Guidelines of the European Society for Medical Oncology (ESMO). Medical Alphabet. 2014; 3-4(18): 59-65. (in Russian)].
- Ogston K.N., Miller I.D., Payne S., Hutcheon A.W., Sarkar T.K., Smith I., Schofield A., Heys S.D. A new histological grading system to assess response of breast cancers to primary chemotherapy: prognostic significance and survival. Breast. 2003 Oct; 12(5): 320-7. doi: 10.1016/ s0960-9776(03)00106-1.
- Pavlov M.V., Kalganova T.I., Lyubimtseva Y.S., Plekhanov V.I., Gol-ubyatnikovG.Y., IlyinskayaO.Y., Orlova A.G., SubochevP.V., SafonovD.V., Shakhova N.M., Maslennikova A.V. Multimodal approach in assessment of the response of breast cancer to neoadjuvant chemotherapy. J Biomed Opt. 2018 May; 23(9): 1-11. doi: 10.1117/1.JBO.23.9.091410.
- Fiorentino C., Berruti A., Bottini A., Bodini M.., Brizzi M.P., Brunelli A., Marini U., Allevi G., Aguggini S., TiraA., AlquatiP., OlivettiL., Dogliotti L. Accuracy of mammography and echography versus clinical palpation in the assessment of response to primary chemotherapy in breast cancer patients with operable disease. Breast Cancer Res Treat. 2001 Sep; 69(2): 143-51. doi: 10.1023/a:1012277325168.
- Livasy C.A., Karaca G., NandaR., TretiakovaM.S., Olopade O.I., MooreD.T., Perou C.M. Phenotypic evaluation of the basal-like subtype of invasive breast carcinoma. Mod Pathol. 2006; 19(2): 264-71. doi: 10.1038/modpathol.3800528.
- KiesslingF., Huppert J., PalmowskiM. Functional and molecular ultrasound imaging: concepts and contrast agents. Curr Med Chem. 2009; 16(5): 627-42. doi: 10.2174/092986709787458470.
- Фишер У., Баум Ф. Маммография: 100 клинических случаев. M., 2009. 125 c. [Fisher W., Baum F. Mammography: 100 clinical cases. Moscow, 2009. 125 p. (in Russian)].


