Изучение фармакологической эффективности производных пиридинкарбоновых кислот in vitro
Автор: Блинова Е.В., Дерябина О.Н., Епишкина А.А., Рубаданова Н.Р.
Журнал: Огарёв-online @ogarev-online
Статья в выпуске: 3 т.11, 2023 года.
Бесплатный доступ
Рак молочной железы - один из наиболее часто встречающихся видов злокачественных опухолей у женщин, занимающий второе место в структуре смертности после рака легких. Для оценки роли обратного транспорта как механизма первичной резистентности опухолевых клеток к новым противоопухолевым агентам, были использованы две клеточные линии трижды негативного рака молочной железы человека, одна из которых экспрессирует (культура клеток MDA-MB-231 (НТВ-26), АТСС, США), а другая не экспрессирует протеин обратного транспорта рака молочной железы BСRP (BT20, АТСС, США). В работе изучены соединения пиридинкарбоновых кислот с лабораторными шифрами ЛХТ-13-19 и ЛХТ-17-19. Экспериментально было показано наличие первичной резистентности к соединению ЛХТ-13-17 и ее отсутствие к веществу ЛХТ-17-19, обусловленное обратным BСRP-опосредованным транспортом молекул активного вещества.
Bcrp-протеин, пиридинкарбоновые кислоты, трижды негативный рак молочной железы
Короткий адрес: https://sciup.org/147250373
IDR: 147250373 | УДК: 615:616
Текст научной статьи Изучение фармакологической эффективности производных пиридинкарбоновых кислот in vitro
Рак молочной железы является часто встречающимся заболеванием в менее развитых и промышленно развитых странах, а также второй заметной причиной смертности в Европе и Соединенных Штатах Америки после рака легких [2].
Рак молочной железы представляет собой патологию, возникающую из ткани молочной железы, особенно из молочных протоков (протоковая карцинома составляет 80% случаев), а также из долек [1].
Трижды негативный рак молочной железы (ТНРМЖ) – молекулярный подтип опухоли составляет примерно 15% инвазивного рака молочной железы (РМЖ). Определяется отсутствием экспрессии рецептора эстрогена / рецептора прогестерона и рецептора 2 эпидермального фактора роста человека (HER2).
ТНРМЖ более распространен у женщин в пременопаузе, у носителей мутаций гена предрасположенности к раку молочной железы 1 или 2 (BRCA 1/2). ТНРМЖ имеет неблагоприятный прогноз по сравнению с другими подтипами РМЖ. Данный подтип характеризуется более агрессивным клиническим течением, более ранними рецидивами с метастатическим распространением и снижением общей выживаемости [3; 4].
Пациенты с трижды негативным раком молочной железы имеют различные клинические исходы, в том числе неоднородные показатели полного патологического ответа (pCR) после неоадъювантной химиотерапии (NACT) на ранней стадии заболевания, а также различный ответ на терапию и последующую выживаемость при метастазах [5]. Генетическая гетерогенность опухоли может в значительной степени объясняться этим феноменом [6; 7].
Крупные усилия по секвенированию генома расширили понимание молекулярной гетерогенности ТНРМЖ. Приблизительно 70% ТНРМЖ перекрывается с базальноподобным внутренним подтипом. Молекулярные подтипы TNBC также были идентифицированы Lehmann et al., которые включают базальноподобный 1 (BL1), базальноподобный 2 (BL2), иммуномодулирующий (IM), мезенхимальный (M), мезенхимальный стволоподобный (MSL), и люминальный андрогенный рецептор (LAR) [6]. Они были далее классифицированы Burstein et al. на четыре подтипа: положительные по андрогенным рецепторам (AR), мезенхимальные, базальноподобные иммуносупрессивные и базальноподобные иммуноактивируемые [7]. Несколько исследований показали, что эти подтипы могут предсказывать ответ на таргетную терапию. Однако эти подтипы обычно не используются в клинической практике, и цитотоксическая химиотерапия остается основным методом лечения. Дальнейшее понимание молекулярной и транскриптономической характеристики ТНРМЖ может привести к новой молекулярно-таргетной терапии ТНРМЖ [8].
Цель работы: изучить фармакологическую активность некоторых производных пиридинкарбоновых кислот in vitro .
Материал и методы. Для оценки роли обратного транспорта как механизма первичной резистентности опухолевых клеток к новым противоопухолевым агентам, были использованы две клеточные линии трижды негативного рака молочной железы человека, одна из которых экспрессирует (культура клеток MDA-MB-231 (НТВ-26), АТСС, США), а другая не экспрессирует протеин обратного транспорта рака молочной железы BСRP (BT20, АТСС, США).
В качестве объекта исследования изучены 2 соединения: производные пиридинкарбоновых кислот, соединения с лабораторными шифрами ЛХТ-13-19 и ЛХТ-17-19, синтезированные в отделе химии и технологии синтетических лекарственных средств и аналитического контроля Всесоюзного научного центра по безопасности биологически активных веществ под руководством д.х.н, профессора С. Я. Скачиловой.
Опухолевые линии инкубировали в течение 24 часов в присутствии исследуемых веществ в следующих средних подавляющих концентрациях: для соединения ЛХТ-17-19 – 4,8×10-5 М, для ЛХТ-13-19 – 8,4×10-5 М, для АХ-554 – 2,3×10-4 М.
Первоначально клетки каждой опухолевой линии рассеивались в количестве 8×103 штук на лунку в 96-ячеечный планшет. Водные растворы соединений добавляли в среду культивирования спустя 24 часа после начала культивации в эффективной противоопухолевой концентрации. Вещество в каждой изученной концентрации вносили в 5 лунок. Культуры инкубировали в СО 2 -инкубаторе в затемненных условиях в течение 24 часов.
Оценку выживаемости клеток проводили с помощью колориметрического теста с трифенилтетразолия хлоридом.
Результаты. Инкубация опухолевых клеток культуры ВТ20, не экспрессирующей BСRP-протеин, с 8,4×10-5 М соединения ЛХТ-13-19 также сопровождалась формированием заметного цитостатического эффекта, проявляющегося в гибели в среднем 77% опухолевых клеток. Однако экспозиция той же концентрации действующего вещества исследуемого соединения в культуре BСRP-позитивного трижды негативного рака молочной железы не вызывала цитотоксического действия (различия при межгрупповом сравнении достоверны при р = 0,001), следовательно, молекула ЛХТ-13-19 подвергается обратному переносу из опухолевых клеток культуры трижды негативного рака молочной железы и не может рассматриваться в качестве альтернативы препаратам, к которым сформирована первичная или вторичная резистентность (рис. 1).
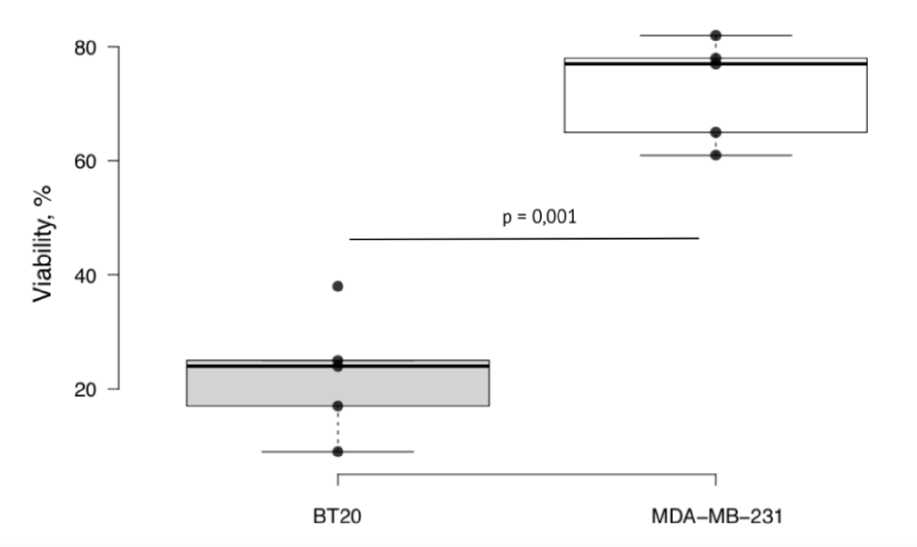
Рис. 1. Зависимость цитотоксического действия соединения ЛХТ-13-19 в концентрации 8,4×10-5 М в линейных координатах при культивировании в культурах клеток рака молочной железы человека ВТ20 и MDA-MB-231; по оси ординат – процент выживших клеток в тесте МТТ; достоверность различий определена с использованием критерия Манна-Уитни.
Инкубация опухолевых клеток культуры ВТ20, не экспрессирующей BСRP-протеин, с соединением ЛХТ-17-19 в концентрации 4,8×10-5 М, сопровождалась формированием значительного цитостатического эффекта, проявляющегося в гибели в среднем 86,5% опухолевых клеток. Экспозиция той же концентрации фармацевтической субстанции соединения в культуре BСRP-позитивного рака молочной железы также вызывала формирование сопоставимого цитотоксического действия (различия при межгрупповом сравнении недостоверны, р = 0,06). Это свидетельствует о том, что на представленной модели резистентного трижды негативного рака молочной железы в отношении соединения ЛХТ-17-19 не происходит активации механизма обратного транспорта молекулы лекарственного вещества (рис. 2).
Таким образом, резистентность к доксорубицину и паклитакселу тройного негативного РМЖ может быть обусловлена обратным BСRP-опосредованным транспортом молекул активного вещества. Подобный эффект наблюдается у соединения ЛХТ-13-19, тогда как соединение ЛХТ-17-19 не обладает резистентностью, обусловленное обратным BСRP- опосредованным транспортом молекул активного вещества.
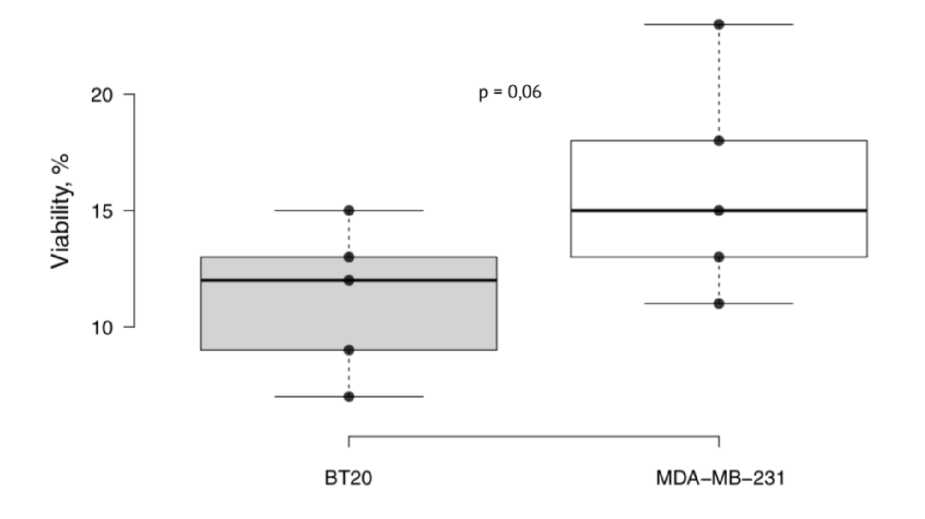
Рис. 2. Зависимость цитотоксического действия соединения ЛХТ-17-19 в концентрации 4,8×10-5 М в линейных координатах при культивировании культурах клеток рака молочной железы человека ВТ20 и MDA-MB-231; по оси ординат – процент выживших клеток в тесте МТТ; достоверность различий определена с использованием критерия Манна-Уитни.
Заключение. Цитотоксическое действие исследуемых производных пиридинкарбоновых кислот на молекулярно подобных культурах трижды негативного рака молочной железы человека имеет различие, обусловленное экспрессией BСRP-протеина, способствующего обратному транспорту молекул из опухолевой клетки. Это позволило выделить две потенциальные молекулы – кандидата и исключить одну молекулу с точки зрения первичной резистентности опухоли. Экспериментально было показано наличие первичной резистентности к соединению ЛХТ-13-17 и ее отсутствие к веществу ЛХТ-17-19, обусловленное обратным BСRP-опосредованным транспортом молекул активного вещества.
Список литературы Изучение фармакологической эффективности производных пиридинкарбоновых кислот in vitro
- Gonche M., Purnamdar Z., Salehinia H. Incidence, mortality and epidemiology of breast cancer in the world Asian package //j. Cancer Prev. APJCP. - 2016. - Vol. 17, supp. 3. - P. 43-46.
- Czerny G., Khmelik E., Czerny B., Toth T. New stage breast cancer based on TNM. Arch of Virchow // International J. Patol. - 2018. - Vol. 472 (5). - P. 697-703.
- Dent R., Trudeau M., Pritchard K. I., Hanna V. M., Kahn H. K., Savka K. A. Triple-negative breast cancer: clinical features and recurrence pattern // Wedge Cancer Res. - 2007. - Vol. 13 (15). - P. 4429-4434.
- Savci-Heijink C. D., Halfwerk H., Hooijer G.K.J., Horlings H.M., Wesseling J., van de Vijver M. J. A retrospective analysis of the metastatic behavior of breast cancer subtypes // Treatment of breast cancer. - 2015. - Vol. 150 (3). - P. 547-557.
- Silva J. L., Cardoso Nunes N.C., Izetti P. Triple negative breast cancer: a thorough review of biomarkers // Crit. Rev. Oncol. Hematol. - 2020. - Vol. 145. - P. 102855.
- Lehmann B. D., Pitenpole J. A. Clinical implications of molecular heterogeneity in triple negative breast cancer // Breast. - 2015. - Vol. 24 (2). - P. 36-40. EDN: VFKLQB
- Burshtein M. D., Tsimelzon A., Poazh G. M.Comprehensive genomic analysis reveals new subtypes and targets for triple-negative breast cancer // Wedge Cancer Res. - 2015. - Vol. 21 (7). - P. 1688-1698.
- Sukumar Ja., Gast K., Quiroga D., Lustberg M., Williams N. Triple-negative breast cancer: promising predictive biomarkers under development // Expert Review of Anticancer Therapy. - 2021. - Vol. 21 (2). - P. 135-148. EDN: RBBPLS


