Изучение фенольного состава растений: горца растопыренного, г. узколистного, г. земноводного, г. птичьего методом ВЭЖХ
Автор: Николаева Галина Григорьевна, Бальхаева Мария Викторовна, Николаева Ирина Геннадьевна, Маняк Виктор Андреевич
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Медицина
Статья в выпуске: SC, 2012 года.
Бесплатный доступ
В результате проведенных экспериментов в растениях горца было обнаружено 17 соединений фенольной природы. Высокая эффективность разработанных хроматографических методик для различных групп фенольных соединений является основой создания методики количественного определения действующих веществ в растениях горца.
Фенольные соединения, вэжх, лекарственные растения
Короткий адрес: https://sciup.org/148181388
IDR: 148181388 | УДК: 615.4:54+616.43
Текст научной статьи Изучение фенольного состава растений: горца растопыренного, г. узколистного, г. земноводного, г. птичьего методом ВЭЖХ
Хроматография занимает ведущее место в исследовании природных соединений, в том числе большой группы фенольных соединений растительного происхождения: флавоноидов, фенолкарбоновых кислот, дубильных веществ, кумаринов и др. [4,5,8,9]. Для анализа фенольных соединений используются различные хроматографические методы, такие как хроматография на колонке, тонкослойная хроматография, ГЖХ. Одним из наиболее подходящих хроматографических методов является современный метод высокоэффективной жидкостной хроматографии (ВЭЖХ). Преимуществом ВЭЖХ перед другими хроматографическими методами является возможность использования разных по механизму хроматографических процессов, различных видов детектирования, изократического и градиентного элюирования [10].
Важным достоинством является четкое разделение многокомпонентных смесей и независимость исследований от молекулярной массы анализируемых веществ.
Как правило, фенольные соединения – это гидроксилированные соединения, что является причиной их полярности; встречаются менее полярные метилированные производные. В растениях фенольные соединения большей частью встречаются в виде фенолкарбоновых кислот и флавоноидов и др. Из практики фенолкарбоновые являются более полярными соединениями, чем флавоноиды. Поэтому в обращенно-фазовой хроматографии скорость элюирования у них быстрее, чем у флавоноидов. В свою очередь, флавоноиды в растениях находятся в виде гликозидов и в виде агликонов, полярность которых заметно снижена по сравнению с гликозилированными формами. Структурные различия фенольных соединений и связанные с ними различия в полярности обусловливают возможность их хроматографического разделения [2, 3, 7, 8].
Разработка методики ВЭЖХ для изучения фенольного состава растения горца включает в себя подбор условий хроматографирования: тип колонки, сорбент, элюент, условия детектирования и др.
Исследование проводили на высокоэффективном жидкостном хроматографе («Waters», США). С учетом изучаемого состава фенольной фракции горца нами была выбрана металлическая колонка размером 4,6х250 мм, заполненная сорбентом «Кромасил» С18 с размером частиц 7 мкм (Швеция).
В качестве подвижной фазы использовали смесь ацетонитрил – 2%-ная уксусная кислота в различных соотношениях в зависимости от анализируемого объекта. Объем вводимой пробы –10 мкл. Скорость подачи элюента составляла 1 мл/мин.
Фенольные соединения имеют хромофоры и для их обнаружения было наиболее целесообразно использовать УФ-спектрофотометрическое детектирование [1, 6]. В качестве рабочей была выбрана длина волны 254 нм. Детектирование проводили с помощью УФ-детектора. В качестве свидетелей для идентификации фенольных соединений горца применяли ГСО и РСО стандарта.
Идентификация исследуемых соединений проводилась методом «внешнего стандарта», т.е. путем сравнения времени удерживания веществ в исследуемых образцах с временем удерживания стандартов-свидетелей. Достоверность идентификации была подтверждена при помощи «Метода добавок». Наблюдаемое увеличение площади пика свидетельствует об идентичности искомого и добавленного вещества.
Поскольку экстракты содержат большое количество соединений, целесообразно для более детального изучения фенольного состава растения горца исследовать объекты по группам соединений в изократическом режиме элюирования. Это позволяет добиться более четкого разделения всех компонентов смеси.
Изучаемые объекты исследовались по следующим группам соединений:
I группа – фенолкарбоновые кислоты: галловая; протокатеховая.
Оксикоричные кислоты: хлорогеновая; феруловая; кофейная; п-кумаровая.
II группа – флавоноидные гликозиды: рутин - кверцетин-3-О-[β-D-глюкофуранозил-(6)-О-α- L -рамнопиронозид]; гиперозид – кверцетин-3-О-β-D-галактопиранозид; лютеолин-7-гликозид; изокверцетин - кверцетин-3-β-глюкопиранозид; авикулярин - кверцетин-3-О-α- L -арабофуранозид; космосиин - апигенин-7-гликозид; кемферола-гликозид.
III группа – флавоноидные агликоны: лютеолин; кверцетин; апигенин; кемпферол.
Готовили 0,01 %-ные растворы всех стандартов. Составляли искусственные смеси по группам соединений. Подбирали оптимальные соотношения растворителей для подвижной фазы.
В результате эксперимента оптимальными подвижными фазами (ПФ) являются:
Для I группы – ацетонитрил – 2%-ная уксусная кислота в соотношении 15:85 (ПФ-1);
Для II группы - ацетонитрил – 2%-ная уксусная кислота в соотношении 20:80 (ПФ-2);
Для III группы - ацетонитрил – 2%-ная уксусная кислота в соотношении 36:74 (ПФ-3).
Разделение компонентов модельной смеси I, II и III групп представлены хроматограммами ВЭЖХ
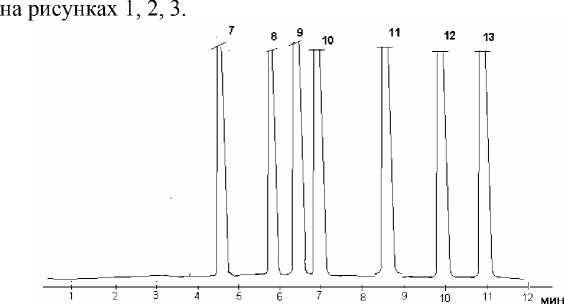
Рис. 2 ВЭЖХ-хроматограмма искуственной смеси флавоноидных гликозидов
7 рутин 4,6
8 гиперозид 5,8
9 лютеолин-7-гликозид 6,5
10 изокверцетин 7.0
11 авикулярин 8,7
12 космосиин 9,9
13 кемпферола гликозид 11,1
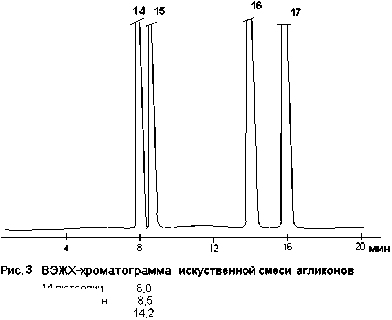
14 лютеолин
15 кверцетин
16 апигенин
17 кемпферол
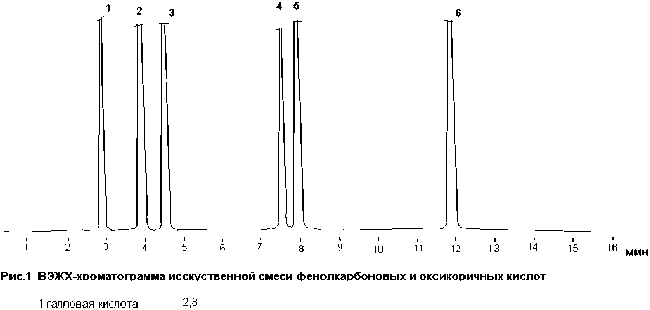
2 п р отокатехо в а я кисл ота 3,9
3 хпорогеновая кислота 4,5
4 феруловая кислота 7,6
5 кофейная кислота 8,0
6 п-кумаровая кислота 11,9
Для изучения фенольного состава растений горца использовали экстракт сырья в 70%-ном этиловом спирте в соотношении 1 : 10. Для анализа готовили следующее разведение: 10 мл экстракта переносили в мерную колбу на 100 мл, доводили объем колбы до метки 50%-ным этиловым спиртом и перемешивали. Полученный раствор фильтровали через фильтры Millipore с диаметром пор 0,22 мкм и далее анализировали на хроматографе.
Результаты проведенных исследований
При исследования I группы соединений в лекарственном растительном сырье были найдены следующие фенолкарбоновые и оксикоричные кислоты:
-
- в горце растопыренном (надземная часть) – галловая, протокатеховая, хлорогеновая, кофейная, п-кумаровая кислоты;
-
- в горце узколистном (надземная часть) - галловая, протокатеховая, хлорогеновая, феруловая, кофейная, п-кумаровая кислоты;
-
- в горце земноводном - галловая, протокатеховая, хлорогеновая, феруловая, кофейная, п-кумаровая кислоты;
-
- в горце птичьем – галловая, протокатеховая, хлорогеновая, кофейная, п-кумаровая кислоты;
-
- в горце растопыренном (корни) - галловая, протокатеховая, хлорогеновая, феруловая, кофейная, п-кумаровая кислоты;
Из хроматограмм следует, что в экстрактах, выделенных из горца, присутствуют следующие флавоноидные гликозиды:
-
- в горце растопыренном (надземная часть) – рутин, гиперозид, лютеолин-7-гликозид, изокверцетин, авикулярин, космосиин, кемферола гликозид;
-
- в горце узколистном (надземная часть) – рутин, гиперозид, изокверцетин, авикулярин, кемферо-ла гликозид;
-
- в горце земноводном– рутин, гиперозид, изокверцетин, авикулярин, космосиин, кемферола гликозид;
-
- в горце птичьем – рутин, гиперозид, лютеолин-7-гликозид, изокверцетин, авикулярин, космоси-ин, кемферола гликозид;
-
- в горце растопыренном (корни) – рутин, изокверцетин, авикулярин.
Из флавоноидных агликонов (III группа фенольных соединений) на хроматограммах извлечений горцев представлены следующие вещества:
-
- в горце растопыренном (надземная часть) – лютеолин, кверцетин, апигенин, кемферол;
-
- в горце узколистном (надземная часть) – кверцетин, кемферол;
-
- в горце земноводном – кверцетин, апигенин, кемферол;
-
- в горце птичьем – лютеолин, кверцетин, апигенин, кемферол;
-
- в горце растопыренном (корни) –кверцетин.
Выводы
В результате проведенных экспериментов в растениях горца было обнаружено 17 соединений фенольной природы. Высокая эффективность разработанных хроматографических методик для различных групп фенольных соединений является основой для создания методики количественного определения действующих веществ в растениях горца.


