Изучение физиолого-биохимических свойств новых штаммов микроорганизмов, выделенных из промышленных отходов
Автор: Утепешева Алия Алимгазиевна, Сопрунова Ольга Борисовна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биотехнология
Статья в выпуске: 5-3 т.13, 2011 года.
Бесплатный доступ
Дана характеристика новым штаммам микроорганизмов, выделенных из промышленных отходов, обладающих полезными свойствами.
Гетеротрофные микроорганизмы, свойства, деградация, поверхностно-активные вещества
Короткий адрес: https://sciup.org/148205559
IDR: 148205559 | УДК: [579/22:57.063.8]:661.185.002.68
Текст научной статьи Изучение физиолого-биохимических свойств новых штаммов микроорганизмов, выделенных из промышленных отходов
В настоящее время во всем мире, в том числе и в России, остро стоят проблемы загрязнения воздуха, почвы, воды различными поллютантами [2]. Такие соединения, как поверхностно-активные вещества (ПАВ), пестициды, различные органические соединения, содержащие нитрогруппу, галоидорга-нические соединения, фосфорорганические соединения, пластмассы, синтетические смолы и некоторые другие продукты промышленности органического синтеза разрушаются в природе медленно и отличаются высокой устойчивостью к действию микроорганизмов. Такие синтетические вещества кумулируются в водоемах и почве, загрязняют окружающую среду [7].
Целью исследований являлось выделение новых штаммов микроорганизмов из промышленных отходов и изучение их свойств. Задачи исследования: выделение микроорганизмов из сточных вод и почв прилегающей территории очистных сооружений; изучение культурально-морфологических и физиолого-биохимических свойств выделенных штаммов микроорганизмов; изучение способности микроорганизмов к деградации ПАВ (катионные и анионные).
Объектом исследований являются гетеротрофные микроорганизмы, выделенные из сточных вод и почв прилегающей территории завода «Стекловолокно».
Микроорганизмы выделяли методом Коха [1] с использованием поверхностного и глубинного культивирования на следующих питательных твердых средах: питательный агар и агаризованная среда М9 следующего состава (г/л): Na 2 HPO 4 – 6,0; KH 2 PO 4 – 3,0; NaCl – 0,5; NH 4 Cl – 1,0; pH 7,0–7,2. Для выделения специфичной микрофлоры использовали ПА и М9, в которые вносили ПАА в количестве 1 г/л. Посевы со средой ПА инкубировали при комнатной температуре в течение недели; со средой М9 – в течение 3-4 недель.
В результате микробиологических исследований установлено, что в сточных водах и почвах
присутствует гетеротрофная (1,7·106…1,4·107 КОЕ/мл; 6,0·104…1,4·105 КОЕ/г) и специфическая (3,0·104…1,7·107 КОЕ/мл; 0,2·102…0,4·102 КОЕ/г) микрофлора.
Доминирующие формы микроорганизмов представлены в основном бактериями кокковидной формы, Г+ спорообразующими и неспорообразующими палочками.
В результате периодических пересевов в чистые культуры выделено 12 штаммов бактерий, изучены их культурально-морфологические и физиологобиохимические свойства.
Для изучения физиолого-биохимических свойств исследовали особенности углеродного и азотного питания, амилолитические, протеолитические, эмульгирующие, фунгицидные свойства, а также способность выделенных штаммов усваивать поверхностно-активные вещества.
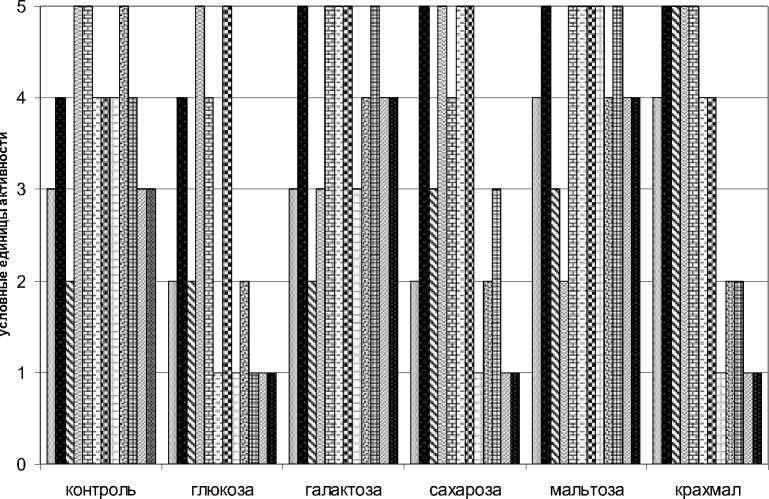
В качестве источников углерода использовали различные моно- и дисахариды, которые вносили (1%) в ПА [6]. Рост микроорганизмов оценивали визуально в баллах (шкала от 0 до 5) (рис. 1).
Для изучения способности использовать азот минеральных солей применяли среду следующего состава (г/л): глюкоза – 20,0; K 2 HPO 4 – 1,0; KH 2 PO 4 – 1,0; MgSO 4 ·7H 2 O – 0,5; NaCl – 0,5; агар-агар – 15,0; раствор микроэлементов – 1 мл (CuSO 4 ·5 H 2 O – 0,64 г; FeSO 4 ·7H 2 O – 0,11 г; MnCl 2 ·4H 2 O – 0,79 г; ZnSO 4 ·7H 2 O – 0,15 г; дистиллированная вода – 100 мл). Использование солей аммония определяли путем добавления к основной среде NH 4 Cl (1,0 г) и CaCO 3 (5,0 г), использование нитратов – KNO 3 (1,0 г). Среды стерилизовали при 0,5 атм.
Изучение роста бактерий на среде с различными источниками углерода показало, что наилучший рост всех штаммов наблюдается на среде с добавлением мальтозы и галактозы. На среде с добавление сахарозы штамм № 4 выделял пигмент красного цвета. Штаммы № 1, 3 и 5 растут на среде с добавлением NH 4 Cl, штаммы № 4 и 5 – с добавлением KNO 3 .
При изучении амилолитических свойств обнаружено, что выделенные штаммы микроорганизмов данной способностью не обладают.
Изучение протеолитических свойств показало, что этой способностью обладают штаммы № 4, 5,
10. Причем штамм № 4 при этом выделял пигмент цвета [6]. розового цвета, штамм № 10 – пигмент черного
■1■2в3□4а5□6в7□8в9в 10 □ 11 0 12
Рис. 1. Рост бактериальных штаммов на среде с различными источниками углерода.
Для определения эмульгирующей активности культуры выращивали в течение 5 сут на скошенной агаризованной среде. Клетки смывали средой следующего состава (г/л): K2HPO4 – 7,0; KH2PO4 – 3,0; CaCl2 (1%, мл) – 1,0; MgSO4 ·7H2O – 0,1; (NH4)2SO4 – 1,0; FeSO4 7H2O – 0,5; ZnSO4 7H2O – 0,5; MnSO4 3H2O – 0,5; H2SO4 (0,1н, мл) – 10,0. Суспензию клеток оставляли на сутки, далее 4 мл суспензии центрифугировали при 6000 об/мин в течение 15 мин. Эмульгирующую активность определяли путем добавления к 4 мл исследуемого образца 4 мл бензина и дизельного топлива (ДТ) с последующим встряхиванием в течение 10 мин. Полученную эмульсию оставляли на 24 ч при комнатной температуре. Эмульгирующую активность определяли как отношение высоты эмульсионного слоя к общей высоте жидкости в измерительной пробирке и выражали в % [8].
При изучении эмульгирующей активности наблюдалась высокая активность эмульгирования с использованием бензина у штаммов № 1 (40%), 3 (60%), 8 и 11 (53%); с использованием ДТ эмульгирующая активность значительно ниже (0-7%) (рис. 2).
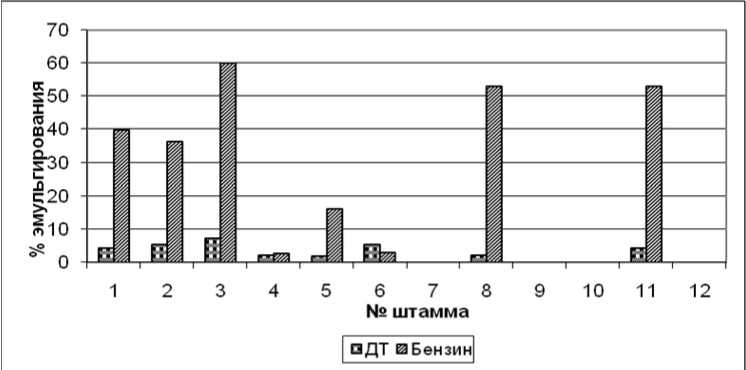
Рис. 2. Эмульгирующая активность бактериальных штаммов (%).
Изучение фунгицидной активности проводили в (КГА), содержащем картофельный экстракт – 230 чашках Петри на картофельно-декстрозном агаре мл, глюкозу – 20,0, водопроводную воду – 770 мл, 199
и глюкозо-пептонном агаре следующего состава (г/л): глюкоза – 5,0; пептон – 5,0; K 2 HPO 4 – 4,0; KH 2 PO 4 – 2,0; агар-агар – 15,0. Суспензию спор тест-гриба высевали на агаризованную среду, а исследуемую культуру вносили, делая посев уколом поверх газона гриба. Чашки инкубировали в термостате в течение 5-7 сут при температуре 25ºС. Антагонистов выявляли по наличию вокруг колонии бактерий зоны подавления роста тест-гриба [3].
В качестве тест-объектов для определения фунгицидной активности штаммов служили следующие мицелиальные грибы: Alternaria tennuissima , Fusarium culmorum , F. graminearum , Phytophtora ultum .
Изучение фунгицидной активности показало, что данным свойством обладают штаммы № 2, 6, 10, проявляя фунгицидную активность к Fusarium graminearum , F. culmorum, Phytophtora ultum .
Для определения способности штаммов микроорганизмов усваивать поверхностно-активные вещества (ПАВ) использовали ПА с добавлением катионных и анионных ПАВ. Микроорганизмы высевали радиальными штрихами. Контролем служили чашки с посевом без добавления ПАВ. Чашки помещали в термостат. Интенсивность развития культур бактерий по штриху оценивали в баллах визуально (шкала от 0 до 5) (рис. 3).
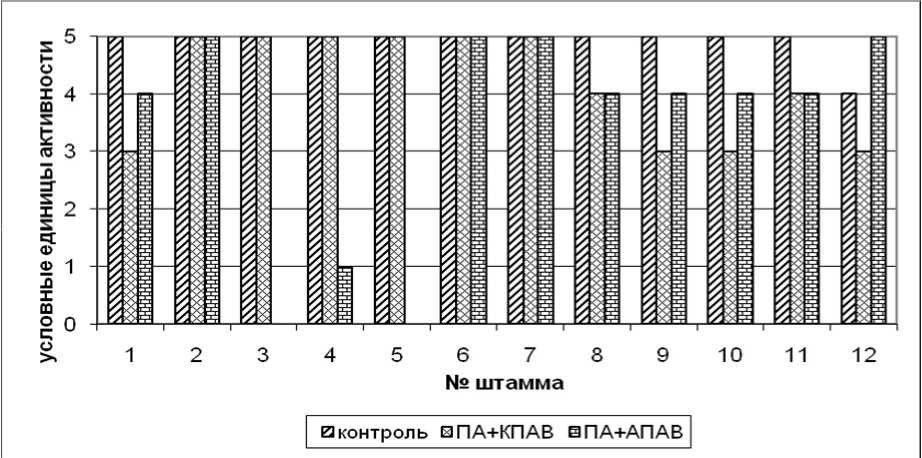
Рис. 3. Активность бактериальных культур по отношению к катионным и анионным ПАВ.
При изучении способности использовать КПАВ наблюдался рост всех штаммов микроорганизмов. На ПА с добавлением АПАВ активный рост наблюдался практически для всех культур, за исключением штаммов № 3, 4, 5.
Способность микроорганизмов деградировать ПАВ изучали флуориметрическим методом, который основан на экстракции хлороформом ионных пар АПАВ с красителем акридиновый желтый [5], деградации КПАВ – на экстракции хлороформом ионных пар КПАВ с красителем эозин [4] и измерении концентрации ПАВ в полученном экстракте с помощью анализатора жидкости «Флюорат-02».
Для эксперимента использовали растворы КПАВ с концентрацией 1, 5, 10 мг/л, растворы АПАВ – 1, 2, 10, 20 мг/л. В данные растворы вносили бактериальные штаммы, титр клеток, при внесении в растворы КПАВ составляет 2,5·103 КОЕ/мл, в растворы АПАВ – 1,47·106 КОЕ/мл. Убыль ПАВ и титр клеток в ходе эксперимента отмечали через каждые 24 ч в течение 4 сут.
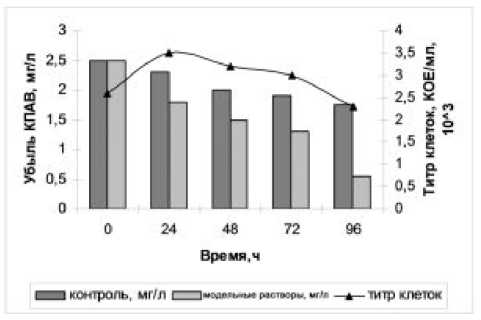
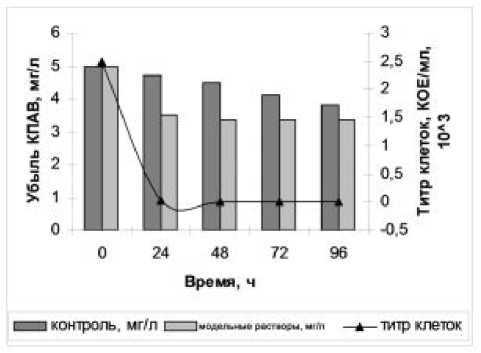
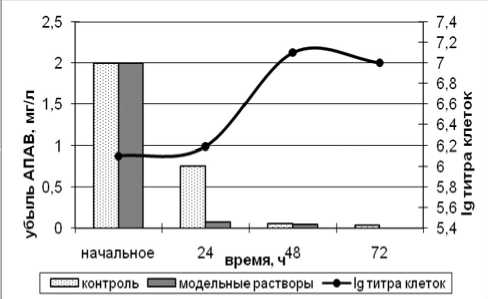
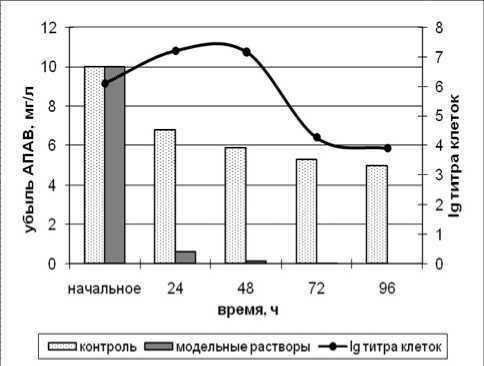
Установлено, что все исследуемые штаммы осуществляют деградацию КПАВ и АПАВ. Максимальной способностью деградировать ПАВ обладает штамм № 11. Деградация КПАВ с концен- трацией 1 мг/л в течение 96 ч достигла 60%, 5 мг/л – 65%, 10 мг/л – 62% (рис. 4). Деградация АПАВ в течение 96 ч достигла 100% во всех модельных растворах (рис. 5).
Убыль КПАВ с концентрацией 1 и 5 мг/л происходит постепенно в течение 96 ч. При этом численность микроорганизмов возрастает и убывает постепенно. В первом случае численность микроорганизмов имеет два пика: 24 ч и 72 ч, после чего резко уменьшается. При концентрации 5 мг/л титр клеток в первые 24 ч увеличивается, затем постепенно снижается в течение эксперимента. Деструкция КПАВ с концентрацией 10 мг/л происходит незначительно в первые 24 ч, затем никаких изменений не наблюдается. При этом численность микроорганизмов резко уменьшается также в течение 24 ч культивирования. Исходя из этого, можно предположить, что концентрация КПАВ 10 мг/л, является летальной для данного штамма.
Во всех модельных растворах происходит резкое снижение концентрации АПАВ в первые 24 ч, в последствии к 72 ч происходит полная деградация АПАВ. При этом титр клеток увеличивается (до 107) в течение 48 ч, затем постепенно снижается (до 104).
Таким образом, в ходе исследований выделены новые штаммы микроорганизмов, способные использовать поверхностно-активные вещества в качестве источников питания, что позволяют сделать вывод о возможности применения бактериальных культур для разработки способов очистки от ПАВ.
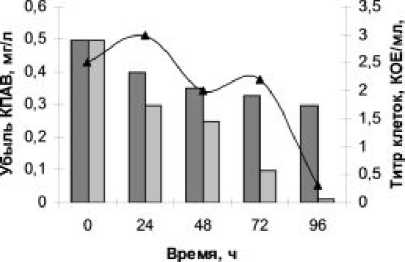
I I контроль, мг/л I J мс<мль»*»е соггвсои. w?p —д— TWip КЛОТОК
а
б
в
Рис. 4. Деградационная способность штамма № 11 по отношению к КПАВ: а) концентрация 1 мг/л; б) концентрация 5 мг/л; в) концентрация 10 мг/л.
б
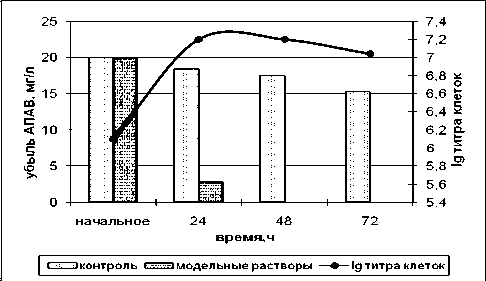
В
Рис. 5. Деградационная способность штамма № 11 по отношению к АПАВ: а) концентрация 2 мг/л; б) концентрация 10 мг/л; в) концентрация 20 мг/л.
Список литературы Изучение физиолого-биохимических свойств новых штаммов микроорганизмов, выделенных из промышленных отходов
- Градова Н.Б., Бабусенко Е.С., Горнова И.Б. Лабораторный практикум по общей микробиологии. М., 2004. 144 с.
- Егорова Т.А., Клоунова С.М., Живухина Е.А. Основы биотехнологии. М.: Академия, 2005. 208 с.
- Логинов О.Н. Бактерии Pseudomonas и Azotobacter как объекты сельскохозяйственной биотехнологии. М.: Наука, 2005. 166 с.
- ПНД Ф 14.1:2:4.39-95. Методика выполнения измерений массовой концентрации катионных поверхностно-активных веществ (КПАВ) в пробах природной, питьевой и сточной воды флуориметрическим методом на анализаторе жидкости «Флюорат-02»: Утв. 1995-06-23. М., 1995. 21 с.
- ПНД Ф 14.1:2:4.158-2000 Методика выполнения измерений массовой концентрации анионных поверхностно-активных веществ (АПАВ) в пробах природной, питьевой и сточной воды флуориметрическим методом на анализаторе жидкости «Флюорат-02»: Утв. 2000-03-15. М., 2000. 21 с.
- Практикум по микробиологии/А.И. Нетрусов, М.А. Егорова, Л.М. Захарчук и др. М.: Академия, 2005. 608 с.
- Ротмистров М.Н., Гвоздяк П.И., Ставская С.С. Микробиология очистки воды. Киев: Наукова думка, 1978. 268 с.
- Турковская О.В. Биологические и технологические аспекты микробной очистки сточных вод и природных объектов от поверхностно-активных веществ и нефтепродуктов: Дис. … докт. биол. наук. Саратов, 2000. 360 с.


