Изучение фосфатмобилизующей способности штаммов Agrobacterium radiobacter 10 и Pseudomonas chlororaphis ПГ7 in vitro
Автор: Железняков С.В., Калинина Т.В., Деева В.К., Лактионов Ю.В., Якоби Л.М.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Фитопатология
Статья в выпуске: 1 т.57, 2022 года.
Бесплатный доступ
Тся их способность к мобилизации фосфатов почвы и удобрений. В настоящей работе впервые была исследована фосфатмобилизующая способность двух штаммов бактерий - Agrobacterium radiobacter 10 и Pseudomonas chlororaphis ПГ7, имеющих научную и практическую значимость. Установлена способность A. radiobacter 10 метаболизировать фитат, используя его в качестве источника углерода и энергии в отсутствие других источников, и способность P. chlororaphis ПГ7 солюбилизировать неорганические (трикальций фосфат, гидроксиапатит) и органический (фитат кальция) фосфаты. Нашей целью было изучение потенциальной способности штаммов Agrobacterium radiobacter 10 и Pseudomonas chlororaphis ПГ7 мобилизовать фосфор из труднодоступных для питания растений минеральных и органический соединений. Для получения накопительной культуры штаммы размножали на гороховом агаре (по Хотяновичу). Исследование фосфатмобилизующей способности штаммов проводили in vitro на селективных питательных средах при 28 °С. Способность штаммов дефосфорилировать фитат натрия оценивали на двух жидких средах. Среда II имела следующий состав (г/л дистиллированной воды): (NH4)2SO4 - 1,0, K2SO4 - 0,2, фитат Na («Sigma-Aldrich», США) - 10, кукурузный экстракт - 0,2 (рН 6,8). Состав среды PSM (phytase screening medium) (г/л дистиллированной воды): D-глюкоза - 15,0, (NH4)2SO4 - 5,0, KCl - 0,5, MgSO4ʺ7H2O - 0,1, NaCl - 0,1, CaCl2ʺ2H2O - 0,1, FeSO4ʺ7H2O - 0,01, MnSO4ʺ7Н2О - 0,01; фитат Na («Sigma-Aldrich», США) - 5 (рН 6,5). Содержание общего фосфора, вносимого в среды с фитатом Na, определяли по методу E. Truog и A.H. Meyer с модификацией по J.B. Rodriguez с соавт. (1994) после озоления препарата по методу Н.Е. Гинсбург и Г.М. Щегловой (1960). О способности штаммов расти на жидких средах судили по изменению численности (КОЕ/мл суспензии) за период инкубации. Оценивали накопление свободного ортофосфата в среде за период инкубации. Способность штаммов растворять неорганические и органические фосфаты изучали при культивировании на трех плотных питательных средах. Среда NBRIP (National Botanical Research Institute's phosphate growth medium) имела следующий состав (г/л дистиллированной воды): D-глюкоза - 10, Ca3(PO4)2 - 5,0, MgCl2ʺ6H2O - 5,0, MgSO4ʺ7H2O - 0,25, KCl - 2,0, (NH4)2SO4 - 0,1, агар-агар - 20 (рН 6,8). Состав глюкозо-аспарагиновой среды с гидроксиапатитом (по Г.С. Муромцеву) (43): D-глюкоза - 10, аспарагин - 1, K2SO4 - 0,2, MgSO4ʺ7H2O - 0,2, кукурузный экстракт - 0,2, Са5(РО4)3О5 - 4, агар-агар - 20 (рН 6,8). Состав среды PSM представлен выше, дополнительно вносили 20 г/л агар-агара и доводили рН до 6,5, добавляя 10 % водный раствор Са(ОН)2, тем самым переводя растворимый фитат натрия в нерастворимый фитат кальция. Наблюдали за образованием зон просветления (гало) вокруг колоний. В опытах на жидкой среде II было показано, что штамм A. radiobacter 10 способен использовать фитат в качестве источника углерода и фосфора для роста и размножения и ферментативным путем дефосфорилировать фитат. Об этом свидетельствовало значительное увеличение численности за период культивирования (4 сут), сравнительно небольшое понижение рН относительно контроля (без инокуляции), а также накопление фосфора в осадке бактериальных клеток и свободного ортофосфата в среде. Штамм P. chlororaphis ПГ7 такой способностью не обладал: несмотря на увеличение численности, за учетный период не наблюдалось заметного накопления осадка бактериальных клеток и свободного ортофосфата в среде. Показано, что при культивировании на жидкой среде PSM оба штамма активно росли, очевидно, используя глюкозу в качестве источника углерода и энергии. В этих усло
Фосфатмобилизующая способность, agrobacterium radiobacter, pseudomonas chlororaphis, фитаты, трикальцийфосфат, гидроксиапатит, элективные питательные среды, иммобилизованный фосфор, ортофосфат
Короткий адрес: https://sciup.org/142234462
IDR: 142234462 | УДК: 579.64:631.811.2
Текст научной статьи Изучение фосфатмобилизующей способности штаммов Agrobacterium radiobacter 10 и Pseudomonas chlororaphis ПГ7 in vitro
Фосфор — один из ключевых элементов в жизнедеятельности растений. Он входит в состав ряда органических соединений, в частности нуклеиновых кислот, нуклеотидов, нуклеопротеидов, витаминов, фосфолипидов, фитина и многих других, играющих центральную роль в обмене веществ. Недостаток фосфора влияет практически на все процессы жизнедеятельности растений. Фосфор поступает в корневую систему и функционирует в растении в виде окисленных соединений, главным образом остатков ор-тофосфорной кислоты (Н 2 РО 4 - , НРО 4 2 - , РО 4 3 - ) (1, 2). Микоризообразующие грибы, участвующие в транспорте фосфора из почвенного раствора в корни растения-хозяина, также поглощают фосфор в основном в виде иона Н 2 РО 4 - (3-5).
В почвах фосфор встречается почти исключительно в виде ортофосфатов и входит в состав минеральных и органических соединений. Валовое содержание фосфора в пахотном слое почв составляет 0,03-0,2 %, или 1-6 т/га. Несмотря на значительные запасы фосфора в почвах, его доступность для растений во многом затруднена из-за низкого содержания ионов ортофосфорной кислоты в почвенном растворе, что обусловлено интенсивной ретроградацией фосфатов (переход легкоусвояемых форм в трудноусвояемые) (3, 6). В минеральных соединениях почв фосфор представлен большей частью малоподвижными формами, такими как первичные минералы почвообразовательных пород, разнообразные соединения вторичного происхождения в виде солей со щелочными и щелочноземельными основаниями и полуторными оксидами.
Растворимость минеральных фосфатов зависит от реакции почвы. Так, фосфаты кальция и магния становятся нерастворимыми в щелочной среде, а фосфаты алюминия и железа — в кислой. Наибольшее количество доступных для растений соединений фосфора присутствует в почвах со слабокислой и нейтральной реакцией, рН которых находится в диапазоне 6,5-7,0 (6, 7).
Известно, что почвенные микроорганизмы (бактерии и грибы) играют ключевую роль в циклическом круговороте почвенного фосфора и доступности его для питания растений (8). Ризосферные бактерии, участвующие в высвобождении (солюбилизации) фосфатов из нерастворимого неорганического сырья, используют различные стратегии для преобразования недоступных для растений форм в доступные. Многие бактерии выделяют углекислоту и подкисляют среду или, утилизируя сахара, выделяют низкомолекулярные органические кислоты (уксусную, яблочную, глюконовую и др.), которые обладают хелатирующими свойствами и образуют органоминеральные комплексы с катионами, связанными с фосфором, тем самым переводя его в растворимые формы. Мобилизация связанного в ризосфере фосфора может быть результатом активизации транспорта протонов из клеток корней и подкисления среды в ответ на инокуляцию бактериями. Кроме того, важную роль в повышении доступности фосфора способны играть бактериальные сидерофоры, хелатирующие железо и другие металлы с образованием устойчивых комплексов (9). В процессах солюбилизации неорганических фосфатов в почве участвуют представители родов Arthrobacter, Bacillus, Burkholderia, Beijerinckia, Mesorhizobium, Flavobacterium (10), Rhizo-bium (11, 12), Pseudomonas (13), Enterobacter, Klebsiella, Stenotrophomonas (14), а также Streptomyces, Leifsonia (15) и Lisinobacillus (16), ассоциированные с микоризными грибами.
Органический фосфор почвы составляет от 30 до 50 % от общего его содержания и представлен двумя различными по природе группами соединений — продуктами биологического синтеза и гумусообразования. К первой группе относятся нуклеопротеиды, фитин, фосфолипиды, фосфопротеины и другие органические соединения, которые входят в состав живых организмов. Наибольшую долю (30-60 %) среди органических фосфатов почвы занимают фитаты — соли фитиновой кислоты (D-мио-инозитол-1,2,3,4,5,6-гексакисдигидрофосфорная кислота), которая представляет собой сложный эфир циклического шестиатомного спирта мио-инозитола и шести остатков ортофосфорной кислоты. На распределение фитатов влияет кислотность почвы. Фитаты кальций и магния распространены в нейтральных почвах, фитаты железа и алюминия — в кислых (17). В большом количестве фитаты содержатся в растениях, особенно их много в семенах, где они представляют основную форму хранения фосфора. В почву фитаты попадают с растительными остатками и навозом (18).
Наиболее часто встречающийся в почве изомер инозитолфосфата мио-инозитол гексакисфосфат (InsP 6 ) — сильный хелатирующий полиани-онный агент. Он может образовывать нерастворимые комплексы с жизненно важными двухвалентными катионами металлов, а также с белками, углеводами, аминокислотами, превращая их в нерастворимые конгломераты (19). В кислых растворах протонирование (присоединение протонов к молекуле) фосфатных групп фитата способствует образованию свободной формы молекулы. В нейтральных и щелочных растворах депротонирование фосфатных групп увеличивает сродство к двухвалентным катионам металлов, что существенно снижает растворимость фитата (20).
Гидролиз InsP 6 осуществляется ферментами фитазами. Фитазы — это особая группа фосфатаз, способных к поэтапному дефосфорилированию фитата с образованием менее фосфорилированных производных миоинозитолфосфата, неорганического фосфата и свободных ионов металлов (21). На основании рН оптимума фитазы разделяют на два класса — кислые и щелочные. В настоящее время изучены биохимические свойства и механизм катализа отдельных ферментов — представителей этих классов, а также их структурные особенности, субстратная специфичность, температурная зависимость (19).
Основными продуцентами фитаз в почве служат микроорганизмы, которые делают фосфор органических соединений доступным для питания растений (22-24). Слабая фитазная активность обнаружена и в корнях растений. Однако фермент не секретируется в ризосферу, поэтому растения не могут усваивать самостоятельно фосфор, связанный в фитате (25). Среди микроорганизмов, обитающих в почве, к наиболее активным продуцентам внеклеточных фитаз относятся микромицеты из родов Aspergillus, Penicillium и Mucor (26). Фитазы обнаружены у дрожжей (27) и бактерий различных таксонов, в том числе Pseudomonas, Bacillus, Klebsiella, Enterobacter и многих других (22). Фитазы бактерий — это в основном внутриклеточные ферменты, однако бактерии родов Bacillus (28) и Enterobacter (29) способны про- дуцировать и внеклеточные фитазы, а у Escherichia coli фитаза представляет собой периплазматический белок, который с большой долей вероятности in vivo имеет доступ к фитатным субстратам (30). Способность к гидролизу фитатов выявлена также у некоторых представителей Arthrobacter (31), Flavobacterium (32), Burkholderia (33), Pantoea (34).
Согласно сформулированной Г.С. Муромцевым концепции, микробиологическая мобилизация фосфора из солей фитиновой кислоты протекает в две фазы: «неспецифическая» фаза (растворение фитатов Са, Mg, Fe и Аl) осуществляется разнообразными кислотообразующими микроорганизмами, «специфическая» (ферментативное дефосфорилирование фитиновой кислоты) — специфическими микроорганизмами, среди которых имеются формы, использующие фитин или продукт гидролиза фитина мио-инозитол в качестве источника углерода: Bacillus subtilis , Enterobacter aerogenes , Rhizo-bium leguminosarum bv. viciae, Sinorhizobium meliloti , Sinorhizobium fredii , Corynebacterium glutamicum и Lactobacillus casei (32) . В целом катаболический путь мио-инозитола после поглощения его клеткой изучен у Bacillus subtilis . Он включает множественные и поэтапные реакции с участием дегидрогеназы, дегидратазы и других ферментов. Конечный результат катаболического пути мио-инозитола — эквимолярная смесь из дигидроксиацетонфосфата, ацетил-СоА и CO 2 (35).
Способность ризосферных бактерий мобилизовать труднодоступные почвенные фосфаты давно рассматривается учеными как важный механизм положительного действия на фосфорное питание растений (36, 37). Известно также, что большинство видов фосфатмобилизующих бактерий благотворно влияют на рост и развитие растения в целом. Это происходит в результате повышения доступности других минеральных элементов (N, Fe, Zn и др.), выделения витаминов и фитогормонов, продукции антибиотиков, ингибирующих развитие патогенов, индукции механизмов системной устойчивости к стрессам абиотической и биотической природы (9, 38) и, наконец, образования внутриклеточных сигнальных молекул (вторичных мессенджеров), таких как InsP 3 — положительный регулятор многих сигнальных путей (39), имеющий важное значение для растительно-микробного взаимодействия и специфического взаимодействия между растениями и азотфиксирующими бактериями (40).
Однако для эффективного применения биопрепаратов нужны более полные знания о физиологических особенностях входящих в их состав микроорганизмов. К числу важнейших характеристик штаммов ризосферных бактерий, селектированных для разработки биопрепаратов удобрительного, стимулирующего или защитного действия, относится их способность к мобилизации фосфатов почвы и удобрений. При отсутствии таких сведений результаты действия биопрепаратов на фосфорное питание растений остаются мало предсказуемыми (7, 13). Исследования в этом направлении будут способствовать лучшему понимание потенциальных взаимодействий между PGPB (plant growth-promoting bacteria) и растениями, а также между PGPB и микоризами грибами.
В настоящей работе впервые была исследована фосфатмобилизую-щая способность двух штаммов бактерий — A. radiobacter 10 и P. chlororaphis ПГ7, имеющих научную и практическую значимость. Установлена способность A. radiobacter 10 метаболизировать фитат, используя его в качестве источника углерода и энергии в отсутствие других источников, и способность P. chlororaphis ПГ7 солюбилизировать неорганические (трикальций фосфат, гидроксиапатит) и органический (фитат кальция) фосфаты.
Нашей целью было изучение потенциальной способности штаммов
Agrobacterium radiobacter 10 и Pseudomonas chlororaphis ПГ7 мобилизовать фосфор из труднодоступных для питания растений минеральных и органический соединений.
Ìåòîäèêà . В работе использовали штаммы Agrobacterium radiobacter 10 и Pseudomonas chlororaphis ПГ7, которые хранятся в коллекции Всероссийского НИИ сельскохозяйственной микробиологии (ФГБНУ ВНИИСХМ). Известно, что первый способен фиксировать атмосферный азот при выращивании на безазотистой среде Виноградского, обладает ростостимулирующим действием для многих видов сельскохозяйственных растений и служит основой коммерческого биопрепарата Агрофил («ЭКОС БИОПРЕПАРАТЫ», Россия) (41, 42). Второй как потенциальный агент в биоконтроле фитопатогенных микроорганизмов проходит испытания в географической сети опытов (42). Штаммы были идентифицированы на основе анализа последовательности гена 16S рРНК в отделении геномных технологий ЦКП ФГБНУ ВНИИСХМ.
Для получения накопительной культуры штаммы размножали на бобовом агаре (по прописи А.В. Хотяновича) следующего состава (г/л горохового бульона): сахароза — 10, КН 2 РО 4 — 0,5, К 2 НРО 4 — 0,5, MgSO 4 •7Н 2 О — 0,3, мел — 1, агар-агар — 20 (рН 6,8-7,0).
Исследование фосфатмобилизующей способности штаммов проводили in vitro на селективных питательных средах при 28 ° С согласно методическим рекомендациям Г.С. Муромцева (43), В.Ф. Павловой с соавт. (43), B. Sasirekha с соавт. (44) и C.S. Nautiyal (45).
Способность штаммов дефосфорилировать фитат натрия оценивали в двух жидких средах. Среда II (43) имела следующий состав (г/л дистиллированной воды): (NH 4 ) 2 SO 4 — 1,0, K 2 SO 4 — 0,2, фитат-Na («Sigma-Aldrich», США) — 10, кукурузный экстракт — 0,2 (рН 6,8); среда PSM (phytase screening medium) (44) (г/л дистиллированной воды): D-глюкоза — 15,0, (NH 4 ) 2 SO 4 — 5,0, KCl – 0,5, MgSO 4 •7H 2 O — 0,1, NaCl — 0,1, CaCl 2 •2H 2 O — 0,1; FeSO 4 •7H 2 O — 0,01, MnSO 4 •7Н 2 О — 0,01; фитат-Na («Sigma-Aldrich», США) — 5 (рН 6,5). С этой целью по 25 мл сред разливали в стерильных условиях в плоскодонные колбы объемом 200 см3. Предварительно готовили по 100 мл исходных суспензий бактерий в 0,9 % водном растворе NaCl (смыв с поверхности одной чашки Петри с бобового агара. Затем по 400 мкл исходных суспензий бактерий вносили в колбы со средами (в контроле бактерии не вносили) и культивировали на орбитальном шейкере GFL 3015 («LAUDA-GFL», Германия) при 220 об/мин в течение 4 сут. Содержание общего фосфора, вносимого в среды с фитатом Na, определяли по методу E. Truog и A.H. Meyer (46) с модификацией по Rodriguez J.B. с соавт. (47) после озоления препарата по методу Н.Е. Гинсбург и Г.М. Щегловой (48). В пересчете на 1 мл среды II оно составило 3,98 мг Р 2 О 5 , в пересчете на 1 мл среды PSM — 1,99 мг Р 2 О 5 .
О способности штаммов расти на жидких средах судили по изменению титров (КОЕ/мл) за период инкубации. Титры определяли методом серийных разведений суспензии бактерий в физрастворе с высевом (по 100 мкл) на чашки Петри с бобовым агаром. Рост колоний учитывали после 2 сут культивирования при 28 ° С. Измеряли рН суспензий с помощью комбинированного электрода H1230B на портативном рН-метре HI 83141 («Han-na Instruments, Inc.», США) и мутность на фотоэлектроколориметре КФК-2 (ОАО «Загорский оптико-механический завод», Россия) при X = 590 нм. Бактериальные клетки (4 мл суспензии) осаждали центрифугированием в пробирках Эппендорфа в течение 5 мин при 12000 g на центрифуге ПЭ-162
6926 (ООО «ЭКРОСХИМ», Россия). Полученные осадки дважды промывали от культуральной среды физраствором, после удаления надосадочной жидкости в пробирки приливали по 1 мл концентрированной Н 2 SO 4 и обугливали осадки в течение 2 сут при 24 ° C. Интенсивность окрашивания кислоты в бурый цвет напрямую зависела от количества осадка в пробирке. Накопление иммобилизованного фосфора (общий фосфор в осадке бактериальных клеток) определяли вышеописанными методами, пересчитывая его в мг Р 2 О 5 на 1 мл суспензии.
Оценивали накопление свободного ортофосфата в среде за период инкубации, для чего суспензии бактерий центрифугировали в течение 5 мин при 12000 g, затем фильтровали надосадочную жидкость через мембранный фильтр Whatman FP 30/0,2 CA-S («Cytiva», Великобритания). Содержание фосфора определяли по методу E. Truog и A.H. Meyer (46) в модификации J.B. Rodriguez с соавт. (47).
Способность штаммов растворять неорганические и органические фосфаты изучали при культивировании на плотных питательных средах следующего состава (г/л дистиллированной воды): NBRIP (National Botanical Research Institute’s phosphate growth medium) (45) — D-глюкоза 10, Ca 3 (PO 4 ) 2 5,0, MgCl 2 •6H 2 O 5,0, MgSO 4 •7H 2 O 0,25, KCl 2,0, (NH 4 ) 2 SO 4 0,1, агар-агар 20 (рН 6,8); глюкозо-аспарагиновая с гидроксиапатитом (по Г.С. Муромцеву) (43) — D-глюкоза 10, аспарагин 1, K 2 SO 4 0,2, MgSO 4 •7H 2 O 0,2, кукурузный экстракт 0,2, Са 5 (РО 4 ) 3 О 5 4, агар-агар 20 (рН 6,8); PSM (44) — состав среды представлен выше, дополнительно вносили 20 г/л агар-агара и доводили рН до 6,5, добавляя 10 % водный раствор Са(ОН) 2 , чтобы перевести растворимый фитат натрия в нерастворимый фитат кальция. Наблюдали за образованием зон просветления питательной среды (гало) вокруг колоний.
Статистическую обработку полученных результатов (расчет средних значений, стандартных отклонений и ошибок выборочных средних) выполняли в программе Microsoft Excel 2010. Для проверки нулевой гипотезы при сравнении выборочных средних использовали интервальную оценку параметров распределения, для чего рассчитывали доверительные интервалы для генеральных средних. Использовали значения t -критерия Стьюдента для 5 % уровня значимости по Б.А. Доспехову (число степеней свободы 3, таблица 1 приложения) (49).
Результаты. Анализ фосфатмобилизующей способности штамма A. radiobacter 10 при культивировании в жидкой среде II показал, что он способен мобилизовать фосфор из фитата натрия ферментативным путем. Отмечалось увеличение содержания свободного ортофосфата в среде по сравнению с контролем (без инокуляции), а также значительное накопление иммобилизованного фосфора в осадке бактериальных клеток (табл.).
О росте бактерий, использующих фитат в качестве источника углерода, свидетельствовало увеличение титров (с 3,59½106 до 9,71½108 КОЕ/мл), помутнение суспензии, понижение рН среды (см. табл.), накопление биомассы бактериальных клеток (рис. 1, А, б). Для проверки достоверности вывода о биологической природе дефосфоризации фитата был проведен анализ на содержание свободного ортофосфата в 1 % водном растворе фитата натрия при изменении рН в рабочем диапазоне от 6,83 до 6,11, по результатам которого не выявили существенного влияния повышения кислотности среды на гидролиз фитата. Полученные результаты согласуется с данными литературы о наличии внеклеточной фитазы у некоторых представителей рода Agrobacterium, благодаря чему они осуществ- ляют гидролиз фитиновой кислоты с образованием субстратов, содержащих менее шести остатков фосфорной кислоты, — инозитолфосфатов, инозитола и неорганического фосфата (32). Вероятно, способность штамма A. radiobacter 10 ферментативным путем гидролизовать фитат в условиях, когда тот служит единственным источником углерода в среде, напрямую связана со способностью усваивать мио-инозитол в качестве источника углерода и энергии с участием тех механизмов, которые описаны для Bacillus subtilis (35).
Дефосфорилирующая способности штаммов Pseudomonas chlororaphis ПГ7 и Àgrobacterium radiobacter 10 при культивировании в жидких питательных средах с фитатом натрия при 28 ° С ( n = 4, учет на 4-е сут)
А

в

Рис. 1. Обугленные концентрированной H 2 SO 4 осадки клеток бактерий, выращенных в разных средах: А — среда II, Б — среда PSM; а — контроль (без бактерий), б — штамм Àgrobacterium radiobacter 10, в — штамм Pseudomonas chlororaphis ПГ7. Состав сред см. в разделе «Методика».
|
Вариант |
рН среды |
ОD 590 |
Свободный фосфор в среде, мг Р 2 О 5 /мл |
Общий фосфор в бактериальном осадке, мг Р 2 О 5 /мл суспензии |
Среда II
|
P. chlororaphis |
6,47±0,15 |
0,10±0,01 |
1,34±0,16 |
0,0005±0,0002 |
|
À. radiobacter |
6,12±0,13 |
0,53±0,09 |
3,04±0,47 |
0,0440±0,0100 |
|
Без инокуляции (контроль) |
6,47±0,09 |
0,08±0,01 |
1,34±0,11 |
0,0001±0,0000к |
|
P. chlororaphis |
4,25±0,13 |
Среда 1,50±0,22 |
PSM 0,02±0,01 |
0,0720±0,0180 |
|
À. radiobacter |
4,52±0,13 |
1,50±0,18 |
0,04±0,02 |
0,0380±0,0070 |
|
Без инокуляции (контроль) |
6,13±0,12 |
0,01±0,00 |
0,04±0,01 |
0,0001±0,0000к |
Примечание. Состав сред см. в разделе «Методика». В таблице представлены доверительные интервалы для генеральных средних при 5 % уровне значимости; к — представлены показатели контроля реактивов.
В свою очередь, штамм P. chlororaphis ПГ7 не показал способность к ферментативному гидролизу фитата натрия при культивировании в жидкой среде II. Несмотря на рост титров с 1,03½106 до 3,34½108 КОЕ/мл, за учетный период не происходило накопления свободного ортофосфата в среде, изменения рН и помутнения среды, а образование осадка бактериальных клеток и накопление в нем иммобилизованного фосфора было незначительным (см. табл., рис. 1, А, в). Можно предположить, что бактерии не могли использовать фитат в качестве источника углерода и энергии в отсутствие других источников и активировали иные метаболические пути.
При культивировании в жидкой среде PSM с двумя источниками углерода отмечали активный рост обоих штаммов. Так, за период инкубации титры À. radiobacter 10 и P. chlororaphis ПГ7 увеличилась соответственно с 3,59½106 до 1,33½109 и с 1,03½106 до 1,41½108 КОЕ/мл. При этом происходило значительное помутнение бактериальных культур и понижение рН среды относительно контроля, происходило увеличение биомассы осадков клеток и количества иммобилизованного фосфора в осадках, тогда как содержание свободного ортофосфата в растворе оставалось сопоставимым с контролем (см. табл., рис. 1, Б, б, в).
В опытах со штаммом Bacillus subtilis 60015, который способен метаболизировать инозитол, было показано, что наличие D-глюкозы и других легко метаболизируемых углеводов в среде подавляет продукцию инозитол-2-дегидрогеназы (первый фермент в катаболическом пути мио-инозитола) (30). Исходя из этих данных, мы сделали предварительное заключение, что штаммы À. radiobacter 10 и P. chlororaphis ПГ7 при культивировании на жидкой среде PSM используют глюкозу, а не фитат в качестве источника углерода и энергии.
Опыты, проведенные на жидкой среде PSM, не позволили однозначно сделать вывод о способности штаммов к ферментативному гидролизу фитата натрия, поскольку проверка влияния подкисления среды на дефосфоризацию фитата в этом случае дала положительные результаты. При понижении рН 0,5 % водного раствора фитата натрия с 6,50 до 4,19 наблюдалось существенное (на 16,7 %) увеличение содержания свободного ортофосфата в растворе — с 0,048±0,001 до 0,056±0,006 мг Р 2 О 5 /мл за 1 ч при комнатной температуре. В то же время существенное положительное влияние на продукцию внеклеточной фитазы у микроорганизмов может оказывать наличие в среде фитата натрия и глюкозы, а также аэрация, о чем свидетельствуют данные, полученные для P. aeruginosa (50), Mucor ra-cemosus NRRL (51) и Bacillus subtilis DR6 (52). На этом основании мы сделали предварительное заключение, что фосфорное питание штаммов в жидкой среде PSM осуществлялось за счет свободного ортофосфата, запасы которого пополнялись в результате как неферментативного гидролиза фитата при подкислении среды, так и ферментативного гидролиза фитата.
В опытах на плотных средах мы установили, что P. chlororaphis ПГ7 способен растворять неорганические фосфаты (трикальцийфосфат, гидроксиапатит), а также органический фосфат (фитат кальция). Об этом свидетельствовало образование зон гало вокруг колоний при культивировании штамма на средах NBRIP, глюкозо-аспарагиновой (по Г.С. Муромцеву) и PSM (рис. 2, А). Полученные результаты согласуются с данными о способности некоторых видов грамотрицательных бактерий из рода Pseudomonas растворять фосфаты кальция по схеме солюбилизации (13). Данные о солюбилизирующей способности P. chlororaphis в специальной литературе очень скудны (53). Полученные нами сведения позволяют рассматривать штамм P. chlororaphis ПГ7 не только как агент в биологической защите растений от патогенов, но и как стимулятор роста, улучшающий фосфор- ное питание.
Отсутствие зон гало вокруг колоний, образованных штаммом A. ra-diobacter 10 на тех же плотных средах, указывало на то, что он не обладал способностью к солюбилизации минеральных фосфатов и фитата кальция (см. рис. 2, Б). Как следует из источников литературы, многие представители рода Rhizobium — такие потенциальные солюбилизаторы. Они выделяют низкомолекулярные органические кислоты и растворяют неорганические фосфаты (11), чему способствует наличие глюкозы в среде (12). Остается необъяснимым отсутствие гало на агаризованной среде PSM, поскольку, как отмечалось ранее, жидкая среда PSM сильно подкислялась при культивировании штамма (см. табл.). Можно предположить, что это обусловлено меньшей метаболической активностью штамма A. radiobacter 10 на плотной среде по сравнению с жидкой.

Б
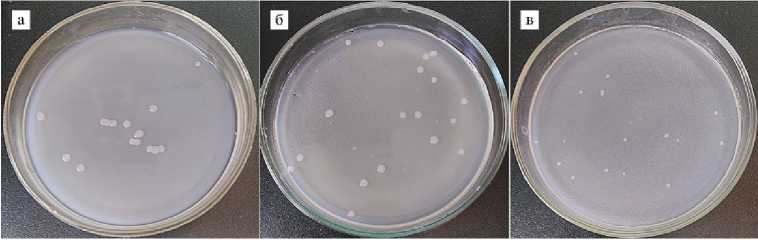
Рис. 2. Рост штаммов Pseudomonas chlororaphis ПГ7 (А) и Àgrobacterium radiobacter 10 (Б) на среде NBRIP с трикальцийфосфатом (а) , на глюкозо-аспарагиновой среде с гидроксиапатитом (по Г.С. Муромцеву) (б) и на среде PSM с фитатом кальция (в) . Состав сред см. в разделе «Методика».
Обсуждая наличие у штаммов фитазной активности с учетом физико-химических свойств фитиновой кислоты и ее комплексов с металлами (20, 54), можно сделать заключение о том, что зоны просветления вокруг бактериальных колоний на плотной среде не могут служить убедительным признаком дефосфоризации фитата кальция под действием фитазы, поскольку кислотообразующие бактерии способны растворять фитат кальция по схеме солюбилизации, как видно на примере с P. chlororaphis ПГ7. О ложноположительных результатах, получаемых на плотных средах при тестировании кислотообразующих бактерий на способность к ферментативному гидролизу фитата кальция, известно также из литературы (55). На этом основании можно рекомендовать для изучения способности бактерий к мобилизации фосфора из фитатов использовать жидкие, а не плотные среды или воспользоваться приемом, который позволяет нейтрализовать зоны гало, образованные в результате подкисления среды PSM, и сохранить те, что по- явились в результате ферментативного гидролиза фитата кальция (55).
Таким образом, штамм Agrobacterium radiobacter 10 может использовать фитат натрия в качестве источника углерода и фосфора при отсутствии других более доступных источников, тогда как штамм Pseudomonas chlor-oraphis ПГ7 такой способностью не обладает. При этом A. radiobacter 10 ферментативно гидролизует фитат, в результате чего в среду выделяется свободный ортофосфат, а в осадке бактериальных клеток накапливается иммобилизованный фосфор. Показано, что при культивировании в жидкой среде с двумя источниками углерода, глюкозой и фитатом натрия, оба штамма активно размножаются, используя глюкозу в качестве источника углерода. При этом происходит сильное подкисление среды, что способствует неферментативному гидролизу фитата. Это не позволяет сделать однозначной вывод о способности штаммов к ферментативному гидролизу фитата. Показано, что штамм P. chlororaphis ПГ7 способен растворять неорганические фосфаты (трикальцийфосфат, гидроксиапатит) и органический фосфат (фитат кальция) по схеме солюбилизации при культивировании на плотных питательных средах, тогда как A. radiobacter 10 таким свойством не обладает. Анализ на способность штаммов бактерий к растворению минеральных и органических фосфатов по схеме солюбилизации целесообразно проводить на плотных питательных средах с выявлением зон просветления вокруг колоний, тогда как ферментативный гидролиз фитатов необходимо оценивать в жидких средах во избежание получения ложноположительных или ложноотрицательных результатов. Основным показателем способности штаммов осуществлять ферментативный гидролиз фитатов служит накопление иммобилизованного фосфора в осадке бактериальных клеток и свободного ортофосфата в культуральной среде.
Список литературы Изучение фосфатмобилизующей способности штаммов Agrobacterium radiobacter 10 и Pseudomonas chlororaphis ПГ7 in vitro
- Полевой В.В. Физиология растений. М., 1989.
- Lambers H., Chapin F.S., Pons T.L. Plant Physiological Ecology. Second edition. Springer, New York, 2008.
- Marschner H. Mineral nutrition of higher plants. Academic Press, London, 1995 (doi: 10.1016/B978-0- 12-473542-2.X5000-7).
- Karandashov V., Bucher M. Symbiotic phosphate transport in arbuscular mycorrhizas. Trends in Plant Science, 2005, 10(1): 22-29 (doi: 10.1016/j.tplants.2004.12.003).
- Casieri L., Lahmidi N.A., Doidy J., Veneault-Fourrey C., Migeon A., Bonneau L., Courty P. E., Garcia K., Charbonnier M., Delteil A., Brun A., Zimmermann S., Plassard C., Wipf D. Bio-trophic transportome in mutualistic plant-fungal interactions. Mycorrhiza, 2013, 23(8): 597-625 (doi: 10.1007/s00572-013-0496-9).
- Ганжара Н.Ф. Почвоведение с основами геологии. М., 2013.
- Шеуджен А.Х. Агрохимия. Ч. 4. (фундаментальная агрохимия: учебное пособие. Краснодар, 2016.
- Richardson A.E., Lynch J.P., Ryan P.R., Delhaize E., Smith F.A., Smith S.E., Harvey P.R., Ryan M.H., Veneklaas E.J., Lambers H., Oberson A., Culvenor R.A., Simpson R.J. Plant and microbial strategies to improve the phosphorus efficiency of agriculture. Plant and Soil, 2011, 349: 121-156 (doi: 10.1007/s11104-011-0950-4).
- Шапошников А.И., Белимов А.А., Кравченко Л.В., Виванко Д.М. Взаимодействие ризо-сферных бактерий с растениями: механизмы образования и факторы эффективности ассоциативных симбиозов (обзор). Сельскохозяйственная биология, 2011, 3: 16-22.
- Goldstein A.H. Bacterial solubilization of mineral phosphates: historical perspective and future prospects. American Journal of Alternative Agriculture, 1986, 1(2): 51-57 (doi: 1010.1017/S0889189300000886).
- Gopalakrishnan S., Sathya A., Vijayabharathi R., Varshney R.K., Laxmipathi Gowda C.L., Krish-namurthy L. Plant growth promoting rhizobia: challenges and opportunities. 3 Biotech, 2015, 5: 355-377 (doi: 10.1007/s13205-014-0241-x).
- Jinturkar B.P. An application of phosphate solubilization by rhizobium strains: a study. Accent Journal of Economics Ecology & Engineering, 2016, 1(5): 1-3.
- Oteino N., Lally R.D., Kiwanuka S., Lloyd A., Ryan D., Germaine K.J., Dowling D.N. Plant growth promotion induced by phosphate solubilizing endophytic Pseudomonas isolates. Frontiers in Mycrobiology, 2015, 6(745): 1-9 (doi: 10.3389/fmicb.2015.00745).
- Liu M., Liu X., Cheng B.-S., Ma X.-L., Lyu X.-T., Zhao X.-F., Ju Y.-L., Min Z., Fang Y.-L. Selection and evaluation of phosphate-solubilizing bacteria from grapevine rhizospheres for use as bio-fertilizers. Spanish Journal of Agricultural Research, 2016, 14(4): e1106 (doi: 10.5424/sjar/2016144-9714).
- Mohandas S., Poovarasan S., Panneerselvam P., Saritha B., Upreti K.K., Kamal R., Sita T. Guava (Psidium guajava L.) rhizosphere Glomus mosseae spores harbor actinomycetes with growth promoting and antifungal attributes. Scientia Horticulturae, 2013, 150: 371-376 (doi: 10.1016/j.sci-enta.2012.11.019).
- Battini F., Cristani C., Giovannetti M., Agnolucci M. Multifunctionality and diversity of cultura-ble bacterial communities strictly associated with spores of the plant beneficial symbiont Rhizoph-agus intraradices. Microbiological Research, 2016, 183: 68-79 (doi: https://doi.org/10.1016/j.mi-cres.2015.11.012).
- Возбуцкая А.Е. Химия почвы. М., 1968.
- Sparvoli F., Cominelli E. Biofortification and phytic acid reduction: a conflict of interest for the plant? Plants, 2015, 4(4): 728-755 (doi: 10.3390/plants4040728).
- Балабан Н.П., Сулейманова А.Д., Валеева Л.Р., Шакиров Е.В., Шарипова М.Р. Структурные особенности и механизмы катализа p-пропеллерных фитаз бацилл (обзор). Биохимия, 2016, 81(8): 1011-1020.
- Oh B.-C., Choi W.-C., Park S.-C., Kim Y.-O., Oh T.-K. Biochemical properties and substrate specificities of alkaline and histidine acid phytases. Applied Microbiology and Biotechnology, 2004, 63: 362-372 (doi: 10.1007/s00253-003-1345-0).
- Lei X.G., Porres J.M. Phytase: an enzyme to improve soybean nutrition. In: Soybean and nutrition /H.A. El-Shemy (ed.). InTech, Rijeka, Croatia, 2011 (doi: 10.5772/20128).
- Jorquera M., Martinez O., Maruyama F., Marschner P., de la Luz Mora M. Current and future biotechnological applications of bacterial phytases and phytase producing bacteria. Microbes and Environments, 2008, 23(3): 182-191 (doi: 10.1264/jsme2.23.182).
- Мухаметзянова А.Д., Ахметова А.И., Шарипова М.Р. Микроорганизмы как продуценты фитаз. Микробиология, 2012, 81(3): 291-300.
- Hayatsu M. Utilization of phytic acid by cooperative interaction in rhizosphere. Microbes and Environments, 2013, 28(1): 1-2 (doi: 10.1264/jsme2.ME2801rh).
- Lei X.G., Porres J.M., Mullaney E.J., Brinch-Pedersen H. Phytase: source, structure and application. In: Industrial Enzymes. Structure, Function and Applications /J. Polaina, A.P. Maccabe (eds.). Springer, Dordrecht, 2007: 505-529 (doi: 10.1007/1-4020-5377-0_29).
- Jatuwong K., Suwannarach N., Kumla J., Penkhrue W., Kakumyan P., Lumyong S. Bioprocess for production, characteristics and biotechnological applications of fungal phytases. Frontiers in Microbiology, 2020, 11: 188 (doi: 10.3389/fmicb.2020.00188).
- Quan Ch., Zhang L., Wang Y., Ohta Y. Production of phytase in a low phosphate medium by a novel yeast Candida krusei. Journal of Bioscience and Bioengineering, 2001, 92(2): 154-160 (doi: 10.1016/S1389-1723(01)80217-6).
- Demirkan E., Baygin E., Usta A. Screening of phytate hydrolysis Bacillus sp. isolated from soil and optimization of the certain nutritional and physical parameters on the production of phytase. Turkish Journal of Biochemistry, 2014, 39(2): 206-214 (doi: 10.5505/TJB.2014.26817).
- Onawola O.O., Akande I.S., Okunowo W.O., Osuntoki A.A. Isolation and identification of phytase-producing Bacillus and Enterobacter species from Nigerian soils. Nigeria Journal of Biotechnology, 2019, 36(2): 127-138 (doi: 10.4314/njb.v36i2.13).
- Мухаметзянова А.Д., Маренова И.О., Шарипова М.Р. Получение и характеристика бацилл с инактивированным геном фитазы. Микробиология, 2013, 82(1): 52-58.
- Hill J.E., Kysela D., Elimelech M. Isolation and assessment of phytate-hydrolysing bacteria from the DelMarVa Peninsula. Environmental Microbiology, 2007, 9(12): 3100-3107 (doi: 10.1111/j.1462-2920.2007.01420.x).
- Терещенко Н.Н. Биоудобрения на основе микроорганизмов: уч. пос. Томск, 2003.
- Unno Y., Okubo. K., Wasaki J., Shinano T., Osaki M. Plant growth promotion abilities and microscale bacterial dynamics in the rhizosphere of Lupin analysed by phytate utilization ability. Environmental Microbiology, 2005, 7(3): 396-404 (doi: 10.1111/J.1462-2920.2004.00701.X).
- Balaban N.P., Suleimanova A.D., Valeeva L.R., Chastukhina I.B., Rudakova N.L., Sharipova M.R., Shakirov E.V. Microbial phytases and phytate: exploring opportunities for sustainable phosphorus management in agriculture. American Journal of Molecular Biology, 2017, 7(1): 11-29 (doi: 10.4236/ajmb.2017.71002).
- Yoshida K., Yamaguchi M., Morinaga T., Kinehara M., Ikeuchi M., Ashida H., Fujita Y. myoinositol catabolism in Bacillus subtilis. Journal of Biological Chemistry, 2008, 283(16): 10415-10424 (doi: 10.1074/jbc.M708043200).
- Rodriguez H., Fraga R. Phosphate solubilizing bacteria and their role in plant growth promotion. Biotechnology Advances, 1999, 17(4-5): 319-339 (doi: 10.1016/S0734-9750(99)00014-2).
- Philippot L., Raaijmakers J.M., Lemanceau P., van der Putten W.H. Going back to the roots: the microbial ecology of the rhizosphere. Nature Reviews Microbiology, 2013, 11: 789-799 (doi: 10.1038/nrmicro3109).
- Pérez-García A., Romero D., de Vicente A. Plant protection and growth stimulation by microorganisms: biotechnological application of Bacilli in agriculture. Current Opinion in Biotechnology, 2011, 22(2): 187-193 (doi: 10.1016/j.copbio.2010.12.003).
- Krinke O., Novotná Z., Valentová O., Martinec J. Inositol trisphosphate receptor in higher plants: is it real? Journal of Experimental Botany, 2007, 58(3): 361-376 (doi: 10.1093/jxb/erl220).
- Johnson T.D. Use of synergistic microorganisms and nutrients to produce signals that facilitate the germination and plant root colonization of mycorrhizal fungi in phosphorus rich environments. United States Patent No.: US 9,017.442 B2. Date of Patent: Apr. 28, 2015.
- Павлова В.Ф., Муромцев Г.С., Гетманская О.И. Штамм бактерий Agrobacterium radiobacter ВНИИСХМ-10 для получения удобрения под овощные культуры. База патентов СССР, № патента: 1756318. Всесоюзный научно-исследовательский институт сельскохозяйственной микробиологии. Заявка 4665197 23.03.1989. МПК: C05F 11/08, C12N 1/20. Опубл. 23.08.1992.
- Кожемяков А.П., Белоброва С.Н., Орлова А.Г. Создание и анализ базы данных по эффективности микробных биопрепаратов комплексного действия. Сельскохозяйственная биология, 2011, 3: 112-115.
- Методические указания по выделению микроорганизмов, растворяющих труднодоступные минеральные и органические соединения фосфора /Под ред. Г.С. Муромцева. Ленинград, 1981.
- Sasirekha B., Bedashree T., Champa Kl. Optimization and partial purification of extracellular phytase from Pseudomonas aeruginosa p6. European Journal of Experimental Biology, 2012, 2(1): 95-104.
- Nautiyal C.S. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms. FEMS Microbiology Letters, 1999, 170(1): 265-270 (doi: 10.1111/j.1574-6968.1999.tb13383.x).
- Агрохимические методы исследования почв /Под ред. А.В. Соколова. М., 1975.
- Rodriguez J.B., Self J.R., Soltanpour P.N. Optimal conditions for phosphorus analysis by the ascorbic acid-molybdenum blue method. Soil Sciens Society of America Journal, 1994, 58(3): 866870 (doi: 10.2136/sssaj1994.03615995005800030034x).
- Гинзбург К.Е., Щеглова Г.М. Определение азота, фосфора и калия в растительном материале из одного образца. Почвоведение, 1960, 5: 100-105.
- Доспехов Б.А. Методика полевого опыта (с основами статистической обработки результатов исследований). М., 1973.
- Sasirekha, B., Bedashree T., Champa Kl. Statistical optimization of medium components for improved phytase production by Pseudomonas aeruginosa. International Journal of ChemTech Research, 2012, 4(3): 891-895.
- Bogar B., Szakacs G., Pandey A., Abdulhameed S., Linden J.C., Tengerdy R.P. Production of phytase by Mucor racemosus in solid-state fermentation. Biotechnology Progress, 2003, 19(2): 312319 (doi: 10.1021/bp020126v).
- Singh N.K., Joshi D.K., Gupta R.K. Isolation of phytase producing bacteria and optimization of phytase production parameters. Jundishapur Journal of Microbiology, 2013, 6(5): 6419 (doi: 10.5812/jjm.6419).
- Klykova M.V., Dunajtsev I.A., Zhigletsova S.K., Kondrashenko T.N., Lev I.O., Sosna I. M., Torgonina I.V., Varlamova T.A. Phosphate-dissolving strain Pseudomonas chlororaphis ssp chlorora-phis vsk-26a3 with fungicidal and bactericidal activity. Russian Federation Patent No.: RU 2 603 281(13) C1. Date of publication: 27.11.2016. Bull. № 33.
- Справочник химика 21. Фитиновая кислота. Режим доступа: https://www.chem21.info/. Без даты.
- Bae H.D., Yanke L.J, Cheng K.-J., Selinger L.B. A novel staining method for detecting phytase activity. Journal of Microbiological Methods, 1999, 39(1): 17-22 (doi: 10.1016/S0167-7012(99)00096-2).


