Изучение генетического разнообразия популяций Eptesicus nilssonii (Chiroptera: Vespertilionidae), зимующих в искусственных подземельях Самарской Луки
Автор: Баишев Ф.З., Смирнов Д.Г., Вехник В.П.
Журнал: Самарская Лука: проблемы региональной и глобальной экологии @ssc-sl
Рубрика: Научные сообщения
Статья в выпуске: 4 т.23, 2014 года.
Бесплатный доступ
Изучение генетическое разнообразие популяций Eptesicus nilssonii (Chiroptera: Vespertilionidae), на зимовке в искусственных подземельях Самарской Луки. Используя метод ISSR-PCR анализа изучено генетическое разнообразие и определен уровень генетической дифференциации популяций в E. nilssonii, в условиях Жигулевских гор. В ходе анализа выяснилось, что популяции рукокрылых, характеризуются относительно высоким уровнем генетического разнообразия (R95=68,1%). Для отдельных групп населения рукокрылых, зимующих в различных подземельях, показана умеренная репродуктивная изоляция.
Анализ issr-pcr, генетическое разнообразие, межпопуляционная дифференциация
Короткий адрес: https://sciup.org/148314947
IDR: 148314947 | УДК: 599.426(470.40):575.17
Текст научной статьи Изучение генетического разнообразия популяций Eptesicus nilssonii (Chiroptera: Vespertilionidae), зимующих в искусственных подземельях Самарской Луки
Ру кокрылые – это одна из групп млекопитающих, которая в последнее десятилетие активно рассматривается как объект молекулярно-генетических исследований (Mayer, Helversen, 2001; Kiefer et al., 2002; Hoofer, Busscher, 2003; Spitzenberger et al., 2006; Furmankiewicz, Altringham, 2007; Artyushin et
al., 2009, 2012; Atterby et al., 2009; Smith et al., 2011; Kruskop et al., 2012; Bog-danowicz et al., 2013 и др.). Это обусловлено тем, что в ее пределах до сих пор остается весьма спорным систематическое положение многих таксонов, как видового, так и надвидового ранга, а также их родственные отношения. Эффективное же решение этих вопросов зачастую становится возможным лишь благодаря применению ряда молекулярных технологий. С другой стороны, при изучении рукокрылых весьма актуальными продолжают быть популяционные исследования. Выведение их на молекулярно-генетический уровень расширяет спектр решаемых вопросов и позволяет выявить не только генетический полиморфизм популяций, но и провести качественную оценку уровня их дифференциации, а, следовательно, понять процесс формирования популяций у этих животных. Если исследования первого рода для некоторых видов рукокрылых России уже известны (Матвеев, 2006; Artyushin et al., 2009, 2012; Kruskop et al., 2012), то второго – никогда не проводили.
Eptesicus nilssonii (Keyseling et Blasius, 1983) – широко распространенный в Евразии вид. В Европейской части России населяет хвойные, смешанные и отчасти лиственные леса северной и средней полосы, где приурочен к горам, крупным возвышенностям и выраженным карстовым формам рельефа (Ильин, Смирнов, 2000). В Поволжье южным пределом распространения вида является территория Самарской Луки, где он находит оптимальные условия для своего существования (Смирнов и др., 2013). E. nilssonii ведет оседлый образ жизни. На Самарской Луке местами его массовых зимовок служат системы искусственных подземелий, расположенные на правобережных склонах Жигулевских гор. В разные годы здесь на зимовке отмечается от 700 до 1000 особей (Смирнов и др., 2007, Смирнов, Вехник, 2011). По окончании зимовки значительная часть особей покидает подземелья и, не совершая дальних перекочевок, рассредоточивается в оптимальных для летнего обитания биотопах в непосредственной близости от мест зимовок. Максимальное расстояние, на которое удаляются рукокрылые, составляет 15 км, что подтверждается результатами кольцевания (Смирнов, Вехник, 2012). В районах летнего обитания встречаются как репродуктивные самки, так и взрослые самцы (Смирнов, Вехник, 2014). Летними убежищами служат дупла деревьев, из которых чаще всего животные встречаются в липе, реже клене и дубе.
Нами установлено (Смирнов и др., 2007), что рукокрылые крайне консервативны к своим зимовочным подземельям. Выбрав один раз одно из них, они никогда более не встречаются в других даже близко расположенных подземных убежищах. Предполагается, что в каждом таком подземелье на зимовку с обширной территории собирается отдельная популяция. Так как спаривание преимущественно происходит на местах зимовок, то вся зимующая на Самарской Луке группировка вида должна быть генетически неоднородна, и структурирована, то есть каждая популяция будет иметь определенную степень репродуктивной изоляции от таких же популяций из других подземелий. При этом мы не исключали, что между популяциями возможен поток генов.
Цель нашей работы – изучить генетическое разнообразие и выявить степень дифференциации популяций E. nilssonii , зимующих в разных искусственных подземельях Самарской Луки.
МАТЕРИАЛ И МЕТОДЫ
Материалом для работы послужили образцы тканей (биопсия перепонки крыла) E. nilssonii , собранных в зимние периоды 2011-2013 гг. Животных добывали в местах их массовых зимовок, которые локализованы в четырех штольнях: Бурлак, Попова, СХТ-1 и Верблюд. Штольни – это системы искусственных подземелий, выработанных в первой половине ХХ века в правобережных волжских склонах Жигулевских гор. Подземелья находятся на расстоянии друг от друга от 1 (СХТ-1–Попова) до 6 км (Бурлак–Верблюд). Всего образцов тканей от 38 особей E. nilssonii .
Для выделения ДНК из образцов тканей применяли стандартный метод фенольной депротеинизации с использованием протеиназы К и последующим осаждением этиловым спиртом.
Анализ полиморфизма ДНК проведен посредством PCR с использованием межмикросателлитных ISSR-маркеров (Inter-Simple Sequence Repeat). Микросателлитные последовательности окружают многие гены и могут быть использованы как якорные последовательности к этим генам. На этой особенности основан ISSR-метод, в котором применяется один или несколько праймеров длиной в 15–24 нуклеотида (Zietkiewicz et al., 1994). В работе нами было протестировано 3 праймера: ISSR-1 ((AG) 9 C), ISSR-2 ((GA) 9 C) и ISSR-6 ((ACC) 6 G). Один ампликон спектра рассматривали как один локус ДНК. Полиморфизм такого локуса оценивали по наличию-отсутствию ампликона соответствующей длины в спектрах. Программа амплификации включала в себя первичную денатурацию (t=94°С, 2 мин.); 30 циклов денатурации (t=94°С, 30 с.), отжига праймера (t=55°С, 30 с.), элонгации цепи (t=72°С, 2 мин.); а также финальную элонгацию (t=72°С, 10 мин.), ПЦР проводили на амплификаторе «Терцик» («ДНК-технологии», Россия). Продукты амплификации разделяли путем электрофореза в 6-процентном полиакриламидном геле, окрашивали бромистым этидием и фотографировали в гель-документирующей системы «BioRad» (США).
Для количественной оценки степени полиморфизма, полученные данные были представлены в виде матрицы бинарных признаков, в которой наличие или отсутствие в ISSR-спектре одинаковых по размеру ампликонов рассматривали соответственно как состояние 1 или 0. При этом учитывали только воспроизводимые в повторных экспериментах фрагменты.
Анализ молекулярно-генетического полиморфизма ДНК проводили с помощью компьютерной программы PopGen32 и специализированного макроса GenAlEx6 для MS-Excel с определением доли полиморфных локусов (при Р≤0,95), общего числа аллелей (na), эффективного числа аллелей (ne) (Zietkiewicz et al., 1994; Хедрик, 2003). В качестве показателей оценки генного разнообразия мы использовали такие параметры как: общее генное разно- образие в суммарной выборке (HT), среднее выборочное генное разнообразие по всем локусам (HS) и показатель подразделенности популяций (GST) (Хедрик, 2003). Генетическое расстояние между популяциями оценивали по M. Нею (Nei, 1972). Также для выявления генетического разнообразия внутри и между популяциями в качестве альтернативной оценки вышеописанному методу был выбран информационный индекс Шеннона (Nei, 1987), традиционно применяемый для характеристики генетического разнообразия на популяционном уровне (Chalmers et al., 1992). Индекс разнообразия Шеннона рассчитывали в отдельности для каждой зимующей популяции (Но), а также вычисляли среднее значение индекса для популяции (Hpop) и для суммарной выборки (Hsp). Долю внутрипопуляционного разнообразия определяли как Hpop/Hsp, а долю межпопуляционного разнообразия как (Hsp–Hpop)/Hsp (Борон-никова и др., 2007). Для построения дендрограмм использовали программу Past 2.15.
Под популяцией у оседлого вида рукокрылых мы понимали совокупность особей одного вида, населяющих определенную местность, и собранных в одно время. При этом ключевой территорией считали конкретное место зимовки или отдельное подземелье (штольню), где на время холодного периода собирается почти весь половозрастной состав популяции и где большинство ее особей участвует в спаривании (Смирнов, 2013).
РЕЗУЛЬТАТЫ
В пяти изученных популяциях выявлено 72 полиморфных фрагмента ДНК – ампликона, размер которых составляли от 200 до 800 пн. Общее число амплифицированных фрагментов ДНК в суммарной выборке Е. nilssonii варьировало в зависимости от праймера: для ISSR1 – 21 , для ISSR2 – 27 и для ISSR6 – 24.
Функцией от доли полиморфных локусов, числа аллелей на локус и вы-равненности частот аллелей служит эффективное число аллелей (n e ) и, таким образом, оно является мерой генетического разнообразия популяции или вида. Эффективное число аллелей оценивает величину, обратную гомозиготности, и представляет собой такое число аллелей, при одинаковой частоте которых в популяции гетерозиготность будет равна фактической. Абсолютное число аллелей на локус (в нашем случае – на фрагмент ДНК) в суммарной выборке E. nilssonii составило 1,43±0,05, а эффективное число аллелей на локус – 1,40±0,02. Общее генное разнообразие в суммарной выборке (H T ), представляющее собой гетерозиготность, для популяций E. nilssonii составило 0,29, а среднее выборочное генное разнообразие по всем локусам (H S ), являющееся средней гетерозиготностью, составило 0,24. Таким образом, средняя гетерозиготность в изученных популяциях оказалось несколько ниже, чем в суммарной их выборке. Коэффициент подразделенности популяций (G ST ) показывает, что на межпопуляционную компоненту приходится всего 18,0% генетического разнообразия у E. nilssonii . Эти данные указывают на умеренную генетическую дифференциацию между популяциями.
Оценка внутри и межпопуляционного генетического разнообразия была проведена также на основе информационного индекса Шеннона (Н о ). Наибольший показатель Н о отмечен в популяции штольни Верблюд (0,40), тогда как минимальный в штольне Бурлак (0,35). Кроме того, для оценки характера изменения генетического разнообразия в популяциях по годам нами были взяты выборки из популяции E. nilssonii отдельно в 2011 и 2013 гг., зимующей в штольне Попова. Анализ выявил, что генетическое разнообразие этой популяции в 2013 г. по сравнению с 2011 г. снизился в 1,3 раза.
Использование кластерного анализа позволило провести сравнение степени генетического разнообразия в популяциях по трем ISSR маркерам (рис. 1). В ходе процедуры классификации выделено два кластера. Первый из них объединяет популяции, зимующих в штольнях Верблюд и Попова11, которые обладают не только наибольшим сходством, но наибольшим среди всех популяций генетическим разнообразием. К этой группе примыкает популяция из штольни Бурлак, имеющая относительно низкое разнообразие. Второй кластер сформирован выборками из популяций штольни СХТ-1 и штольни Попова13.
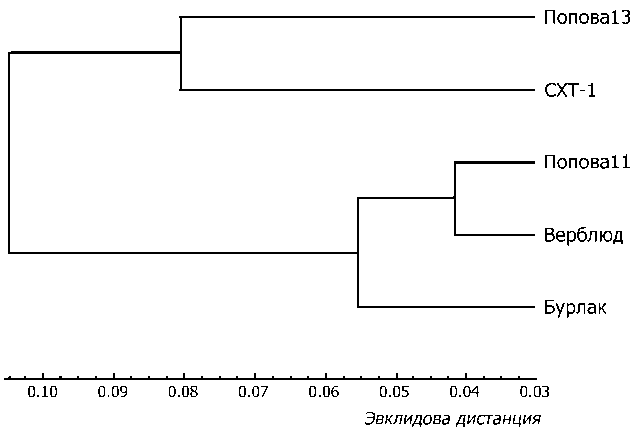
Рис. 1. Дендрограмма сходства популяций Eptesicus nilssonii , зимующих в пяти искусственных подземельях, построенная на основе значений генетического разнообразия по Nei (1973) трех ISSR маркеров (метод кластеризации UPGMA)
Расчет среднего значения индексов разнообразия Шеннона (H pop ) в популяциях E. nilssonii , зимующих во всех штольнях, составил 0,36, а индекса генетического разнообразия в суммарных выборках (Н sp ) – 0,45. Таким образом, по данным ISSR-анализа следует, что большая часть генетического разнообразия приходится на внутрипопуляционную изменчивость (80,0%) и значительно меньше на межпопуляционную (20,0%).
Оценка числа полиморфных локусов показала (таблица), что наименьшими показателями генетического полиморфизма обладают популяции E. nilssonii, зимующая в штольне Бурлак и штольне Попова в 2013 г. Самый вы- сокий показатель полиморфизма был отмечен у популяции штольни Верблюд.
Таблица
Показатели генетическое разнообразие в разных популяциях Eptesicus nilssonii
|
n a |
n e |
H T |
P |
P 95 (%) |
|
|
Бурлак |
1,32 |
1,39 |
0,23 |
45 |
62,5 |
|
СХТ-1 |
1,42 |
1,40 |
0,24 |
47 |
65,3 |
|
Верблюд |
1,57 |
1,43 |
0,26 |
56 |
77,8 |
|
Попова11 |
1,53 |
1,42 |
0,25 |
53 |
73,6 |
|
Попова13 |
1,31 |
1,33 |
0,20 |
44 |
61,1 |
Примечание: P – число полиморфных локусов, P 95 (%) – процент полиморфных локусов.
Результаты расчета генетической дистанции отражены на дендрограмме (рис. 2). Как и ожидалось выборки, взятые в разные годы из популяции штольни Попова, оказались наиболее близкими. Популяция, зимующая в штольне Верблюд, выглядит генетически ближе к группе популяций из штолен СХТ-1 и Бурлак и находится на большем генетическом расстоянии от популяции штольни Попова. Однако при попарном сравнении популяция из штольни Верблюд демонстрирует минимальную дистанцию не только с СХТ-1, но и с популяцией из штольни Попова11, тогда как максимальную дистанцию имеет с Попова13. Популяция из штольни Бурлак оказалась максимально дистанцированой от популяции из штольни Попова.
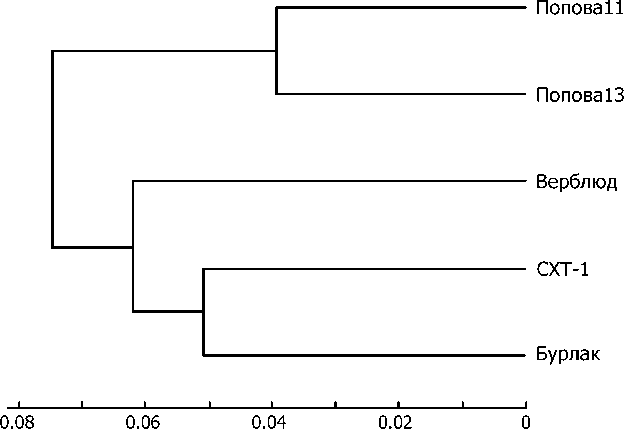
Дистанция Нея (Nei, 1978)
Рис. 2. Дендрограмма генетического сходства популяций Eptesicus nilssonii , зимующих в пяти искусственных подземельях (метод кластеризации UPGMA)
ОБСУЖДЕНИЕ
Для сохранения и прогнозирования существования природных популяций редких видов животных необходима организация комплексных биологических исследований, направленных на изучение динамики численности, пространственной, возрастной и генетической структуры популяций. Оценку генетического разнообразия природных популяций рекомендуется проводить по возможно большему числу выявленных полиморфных фрагментов ДНК с использованием молекулярно-генетических методов исследования (Боронни-кова и др., 2014). В нашем случае для изучения генетической изменчивости популяций E. nilssonii, обитающих на крайне южной границе распространения вида, был использован ISSR-метод. Его преимущество основывается на том, что он обеспечивает высокую разрешающую способность, обладая при этом большой воспроизводимостью спектра из-за большой длины праймера и его комплементарности микросателлитному повтору (Zietkiewicz et al., 1994).
Полученные нами с помощью ISSR-анализа данные свидетельствуют об относительно высоком уровне генетической изменчивости популяций E. nils-sonii (Р 95 =68,1%), обитающих в условиях Самарской Луки. Известно, что высокий уровень полиморфизма часто характерен для широкоареальных видов, тогда как для редких эндемичных видов, как правило, – низкий уровень. В популяциях, которые обитают на краю ареалов, из-за действия комплекса ограничивающих факторов, также возможна фиксация низкого уровня полиморфизма. Относительно высокое генетическое разнообразие в исследованных нами популяциях Е. nilssonii может быть объяснено наличием целого комплекса оптимальных для этого вида биотических и абиотических условий мест обитания, которые сложились в районе Жигулевских гор. Все эти факторы способствуют не только выживаемости вида на границе своего ареала, но и поддержанию его относительно высокой и стабильной численности в локальных условиях существования. Однако, как показывают наши исследования, такое разнообразие может быть неустойчивым, что демонстрирует изменение генетического разнообразия популяции, происходившее с 2011 по 2013 гг. в штольне Попова. Нам пока не до конца понятны истинные причины такого снижения генетического разнообразия в отдельно взятой популяции также как и неизвестны, происходят ли подобные изменения в других таких же популяциях этого вида.
Относительно небольшие показатели генетической дистанции, лежащие в пределах от 0,04 до 0,08, малое значение коэффициента подразделенности популяций и низкий уровень межпопуляционной изменчивости свидетельствует о слабой генетической дифференциации между исследуемыми популяциями вида, зимующих в пяти искусственных подземельях Самарской Луки. Такая ситуация может расцениваться неоднозначно. С одной стороны она может быть обусловлена наличием определенного потока генов между популяциями, который в целом может привести к увеличению генетического разнообразия и снижению межпопуляционной дифференциации. Поскольку из-за своей консервативности к своим зимним убежищам животные из разных мест зимовок не перемешиваются, то нарушение репродуктивной изоляции возможно лишь во время осенних перемещений на путях из районов летнего обитания к местам зимовок. В этом случае степень дифференциации популяций будет зависеть от уровня территориальной разобщенности в летний пе- риод особей, принадлежащих разным популяциям, а также степени пересечения их миграционных путей.
С другой стороны, выявленные относительно небольшие показатели генетической дистанции у зимующих в разных штольнях группировок Е. nils-sonii вполне соответствуют популяционному уровню дифференциации и характерны для многих других видов животных и растений (Боронникова и др., 2007; Орешкова и др., 2012; Цвирка, Кораблев, 2012; Переверзева и др., 2013) Так, на примере длиннохвостого суслика ( Spermophilus undulatus Pallas 1778) было показано, что ряду популяций этого вида также свойственна небольшая генетическая дистанция, даже не смотря на то, что они географически разобщены и поток генов между ними полностью исключен (Цвирка, Кораблев, 2012).
Таким образом, полученные данные дают основание полагать, что уровень генетической дифференциации между популяциями не достаточно мал, для того чтобы делать утверждение о таком потоке генов, который мог бы приводить к нарушению репродуктивной изоляции между зимующими популяциями и рассматривать их как одну слабо дифференцированную популяцию. На основании сказанного мы могли бы сделать предварительное заключение об умеренной репродуктивной изоляции у рассматриваемых популяций Е. nilssonii , которые собираются на зимовку в разные искусственные подземелья Самарской Луки. Однако точную констатацию можно сделать лишь после того, когда полученные нами данные о генетической структуре популяций Самарской Луки будут сравнены с географически удаленными популяциями этого вида.
Наконец, относительно высокая численность Е. nilssonii на Самарской Луке, которая обусловлена оптимальными условиями обитания и относительно высоким генетическим разнообразием изученных популяций, является, по-видимому, основой стабильного существования особей этого вида на южной границе своего ареала в пределах европейской части России.
Исследование выполнено при частичной финансовой поддержке РФФИ в рамках научного проекта № 15-04-01055 а.
Список литературы Изучение генетического разнообразия популяций Eptesicus nilssonii (Chiroptera: Vespertilionidae), зимующих в искусственных подземельях Самарской Луки
- Боронникова С.В., Кокаева З.Г., Гостимский С.А., Дрибноходова О.П., Тихомирова Н.Н. Анализ ДНК-полиморфизма реликтового вида Урала наперстянки крупноцветковой (Digitalis grandiflora Mill.) с помощью RAPID- и ISSR-маркеров // Генетика. 2007. Т. 43, № 5. С. 653-659.
- Ильин В.Ю., Смирнов Д.Г. Особенности распространения оседлых видов рукокрылых (Chiroptera: Vespertilionidae) на востоке Русской равнины и в смежных регионах // Экология. 2000. № 2. С. 118-124.
- Матвеев В.А. Систематика рукокрылых Старого Света по результатам исследования диспергированных повторов ДНК: Дис. … канд. биол. наук: М., 2006. 145 с.
- Орешкова Н.В., Белоконь М.М., Жамьянсурен С. Изменчивость ядерных микросателлитных локусов у лиственниц Гмелина (Larix gmelinii (Rupr.) Rupr.) и камчатской (Larix kamtchatica (Rupr.) Rupr.) // Хвойные бореальной зоны. 2012. № 1/2. С. 145-151.
- Переверзева В.В., Примак А.А., Дубинин Е.А. Генетическая структура популяций красной полевки Myodes (=Clethrionomys) rutilus Pallas, 1779 Среднего Приохотья по данным об изменчивости нуклеотидных последовательностей гена цитохрома b митохондриальной ДНК // Вавиловский журнал генетики и селекции. 2013. Т. 17, № 3. С. 435-443.


