Изучение геометрических, термодинамических свойств и гибкости углеводородных молекул методом Монте-Карло
Автор: Журкина Дмитрий Викторович, Рабинович Лександр Львович
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Физико-математические науки
Статья в выпуске: 8 (145) т.1, 2014 года.
Бесплатный доступ
Одна из главных задач физики конденсированного состояния - изучение взаимосвязей между химическим строением и физическими свойствами разных молекул. Углеводородные цепные молекулы играют важную роль в природных системах, широко используются в областях технологии. В настоящей работе методом Монте-Карло проведено моделирование 65 цепных углеводородных молекул вида CH-(CH 2) a-(CH=CH-CH 2) d-(CH 2) b-CH 3 (где a, b, d - целые). Изучены варианты N = 16, 18, 20, 22 (где N = a + b + 3d + 2 - количество атомов углерода), d = 0,1,..., 6 - количество двойных связей (конфигурация cis-); температура T = 293, 303 и 313 K. Все исследованные молекулы рассматривали в невозмущенном состоянии, генерирование значений торсионных углов осуществляли методом существенной выборки в диапазоне 0-360° и учетом взаимозависимости каждых трех из них вдоль по цепи. В итоге моделирования для каждой молекулы вычислены равновесная гибкость, конформационная теплоемкость, относительные флуктуации квадрата радиуса инерции и квадрата расстояния между концевыми атомами углерода. Проанализированы зависимости этих свойств от параметров строения молекул. Обнаружен ряд закономерностей, в том числе корреляция между величиной гибкости и относительными флуктуациями геометрических размеров молекул. Предложена интерпретация полученных зависимостей на основе данных эксперимента о характеристиках внутреннего вращения в цепях данного вида. Полученные данные способствуют углублению общего понимания взаимосвязей между структурой и свойствами рассмотренных молекул.
Ненасыщенные углеводороды, метод монте-карло, равновесная гибкость, флуктуации, конформационная теплоемкость
Короткий адрес: https://sciup.org/14750795
IDR: 14750795 | УДК: 541.64:539.199
Текст научной статьи Изучение геометрических, термодинамических свойств и гибкости углеводородных молекул методом Монте-Карло
Одной из фундаментальных проблем физики конденсированного состояния является установление взаимосвязей между химическим строением и физическими свойствами разных молекул и молекулярных систем в различных условиях. Компонентами таких систем часто выступают молекулы цепного строения [6]. Типичный пример – углеводородные цепные молекулы. Информация об их физических и химических свойствах важна не только с научной точки зрения, но и для развития разных технологических отраслей, причем обе задачи тесно связаны между собой. А именно, обсуждаемые данные нужны для углубления знаний о структуре и функциях биологических систем, так как углеводородные цепи входят в состав молекул фосфолипидов мембран [1], [16]. С другой стороны, существование последних основано на эффектах самоорганизации, а принцип самоорганизации является одним из базовых принципов современных нанотехнологий. Несмотря на острую необходимость в данных по свойствам многих систем, они подчас скудны или
отсутствуют в литературе. В настоящей работе методом Монте-Карло (МК), алгоритм которого был разработан ранее [5], при температурах T = 293, 303, 313 K проведено моделирование 65 углеводородных цепных молекул с двойными связями cis , вида CH3 – (CH2) a – (CH=CH – CH2)d – – (CH2) b – CH3 (где a , b , d – целые), в невозмущенном состоянии (в Θ-условиях [6]), с количеством N атомов углерода (где N = a + b + 3d + 2), равным 16, 18, 20, 22, и количеством двойных связей d = 0, 1, 2, ..., 6. В работе [3] при моделировании перечисленных выше молекул этим методом были исследованы характеристики их формы, а в настоящей работе изучены равновесная гибкость, конформационная теплоемкость, относительные флуктуации квадрата радиуса инерции и квадрата расстояния между концевыми атомами углерода молекул.
Модель цепной молекулы и расчет средних характеристик
«Θ-условия», при которых вычисляли свойства всех молекул, примерно отвечают условиям в жидком или аморфном состояниях вещества [6], [10], [22]. Основные этапы расчета состояли в следующем (математические основы модели и алгоритма МК описаны в [3], [5]). Моделировали конформационное поведение одиночных цепей, среднее значение
где R c – радиус-вектор центра масс рассматриваемой цепи:
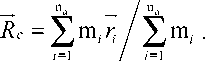
Здесь m
.
(i
=1, 2, .„, n
a
) - массы атомов;
^
(где
i
= 1, 2, …, n
a
) – радиус-векторы атомов в данной конформации; n
a
– общее количество атомов. Вычислены средние квадраты расстояний
^ 2 = « S 4) Ч S 21 )/( S 2)2’
е =(( 4ЧИ)/Ч’>.
Изучена равновесная гибкость молекул; в качестве меры гибкости использовано отношение
Описание строения молекул
Полное описание строения любой из рассматриваемых здесь углеводородных молекул требует указания общего количества атомов углерода (N) в ней, количества двойных связей (d), а также их положения в цепи. Последнее в общем случае требует указания еще d чисел. Однако перечислять положения каждой двойной связи не обязательно, поскольку химическое строение этих молекул специфично : между каждой парой двойных связей расположена только одна группа CH2, и положение всех двойных связей легко вычисляется, если известно, например, местоположение только первой двойной связи. Для этого можно задать параметр Δ [17] – номер атома углерода, ближайшего к заданному концу цепи и участвующего в образовании первой (от данного конца цепи) двойной связи. Атомы углерода при этом имеют номера от 1 до N подряд вдоль по цепи, начиная от одного из концевых. Положение всех двойных связей с помощью одного параметра можно описать и другим способом: указать местоположение X их «центра» [17], которое равно среднему арифметическому номеров атомов углерода, участвующих в образовании всех двойных связей. Например, если молекула содержит одну двойную связь, расположенную между 9-м и 10-м атомами углерода, то Δ = 9, а X = (9 + 10)/2 = 9,5; если молекула содержит 2 двойные связи, расположенные между 6-м и 7-м, 9-м и 10-м атомами углерода, то Δ = 6, а X = (6 + 7 + 9 + 10)/4 = 8, и т. д. В зависимости от обстоятельств в настоящей работе использован 1-й или 2-й вариант идентификации молекул (N, d, Δ или N, d, X). Параметры N, d, Δ в обозначениях молекул указаны сокращенной формулой N:d w ^cis.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Численные значения ряда полученных в настоящей работе характеристик (<
S
>, <
S
2>,
-
2>) для некоторых молекул и соответствующие данные литературы [8], [9], [10], [12], [13], [15], [17], [18], [19], [20] представлены в таблице; в целом они согласуются между собой. Важно отметить, что в большинстве работ приведены данные лишь для отдельных молекул или неболь- - ших групп, а в настоящей работе в идентичных условиях исследована большая их совокупность (65 молекул). Это позволяет выявить взаимосвязь между химическим строением молекул и свойствами веществ. При этом следует учесть, что на результаты могут оказывать влияние избранная
Характеристики* размеров углеводородных цепных молекул, полученные в эксперименте или при компьютерном моделировании (в расплаве или Θ-условиях). Параметры N, d, Δ в обозначениях молекул указаны сокращенной формулой N:dω Δcis
|
Молекула |
T , K |
< S >, Å |
(< S 2>)1/2, Å |
< S 2>, Å2 |
|
( |
|
Метод** |
Ссылка |
|
16:0 |
298 |
22±2 |
НР |
[10] |
|||||
|
298 |
4.9±0.2 |
МК |
[12]*** |
||||||
|
298 |
26.02±0.03 |
226.5±0.4 |
МД-а |
[15] |
|||||
|
298 |
23.10±0.04 |
189.3±0.6 |
МД-б |
[15] |
|||||
|
303 |
5.04±0.01 |
14.67±0.01 |
МК |
[8] |
|||||
|
303 |
4.909±0.001 |
24.26±0.01 |
13.95±0.01 |
199.9±0.1 |
МК |
Наст. раб. |
|||
|
313 |
4.903±0.001 |
24.20±0.01 |
13.92±0.01 |
199.2±0.1 |
МК |
Наст. раб. |
|||
|
318 |
4.8±0.2 |
НР |
[13] |
||||||
|
323 |
25.34±0.02 |
217.5±0.2 |
МД-а |
[15] |
|||||
|
323 |
22.66±0.02 |
183.7±0.3 |
МД-б |
[15] |
|||||
|
373 |
24.49±0.02 |
206.8±0.3 |
МД-а |
[15] |
|||||
|
373 |
21.94±0.02 |
175.1±0.3 |
МД-б |
[15] |
|||||
|
18:0 |
278 |
5.10±0.01 |
26.54±0.02 |
14.16±0.01 |
214.6±0.2 |
МК |
[17], [18]***** |
||
|
298 |
5.3±0.1 |
МК |
[12]*** |
||||||
|
303 |
5.05±0.01 |
26.06±0.01 |
13.95±0.01 |
208.8±0.2 |
МК |
[17],[18]***** |
|||
|
303 |
5.391±0.001 |
29.30±0.01 |
15.28±0.01 |
241.3±0.1 |
МК |
Нас т. раб. |
|||
|
313 |
5.384±0.001 |
5.406±0.001 |
29.22±0.01 |
15.25±0.01 |
15.51±0.01 |
240.5±0.1 |
МК |
Наст. раб. |
|
|
323 |
15.84±0.07 |
МК |
[20]**** |
||||||
|
497.5 |
4.92±0.01 |
13.52±0.07 |
БД |
[19] |
|||||
|
18:1 to 9cis |
313 |
5.010±0.001 |
14.09±0.01 |
МК |
Наст. раб. |
||||
|
497.5 |
4.80±0.01 |
13.18±0.04 |
БД |
[19] |
|||||
|
18:2 to 6cis |
278 |
4.52±0.01 |
20.91±0.1 |
11.99±0.04 |
157.9±0.8 |
МК |
[17], [18]***** |
||
|
313 |
4.745±0.001 |
4.769±0.001 |
22.74±0.01 |
12.92±0.01 |
13.31±0.01 |
177.1±0.1 |
МК |
Наст. раб. |
|
|
497.5 |
4.47±0.01 |
11.66±0.05 |
БД |
[19] |
|||||
|
18:3 to 3cis |
278 |
4.39±0.04 |
19.73±0.3 |
11.34±0.2 |
141.2±3.0 |
МК |
[17], [18]***** |
||
|
313 |
4.655±0.001 |
4.678±0.001 |
21.88±0.01 |
12.59±0.01 |
12.94±0.01 |
167.4±0.2 |
МК |
Наст. раб. |
|
|
497.5 |
4.32±0.01 |
10.60±0.05 |
БД |
[19] |
|||||
|
18:4 to 3cis |
278 |
4.10±0.02 |
17.20±0.2 |
10.16±0.1 |
116.0±2.0 |
МК |
[17], [18]***** |
||
|
313 |
4.446±0.001 |
19.94±0.01 |
11.91±0.01 |
150.3±0.2 |
МК |
Наст. раб. |
|||
|
18:5 to 3cis |
278 |
3.96±0.01 |
16.06±0.01 |
9.46±0.01 |
101.4±0.2 |
МК |
[17], [18]***** |
||
|
303 |
3.95±0.01 |
16.05±0.01 |
9.47±0.01 |
101.5±0.2 |
МК |
[17], [18]***** |
|||
|
313 |
4.369±0.002 |
19.26±0.02 |
11.60±0.02 |
141.9±0.4 |
МК |
Наст. раб. |
|||
|
20:0 |
298 |
5.7±0.1 |
МК |
[12]*** |
|||||
|
303 |
5.856±0.001 |
34.61±0.01 |
284.1±0.1 |
МК |
Наст. раб. |
||||
|
313 |
5.848±0.001 |
34.52±0.01 |
283.0±0.1 |
МК |
Наст. раб. |
||||
|
318 |
5.1±0.3 |
НР |
[13] |
||||||
|
500 |
36.17±0.01 |
312.7±0.1 |
МК |
[9] |
|||||
|
500 |
36.18±0.01 |
313.6±0.1 |
МК |
[9] |
|||||
|
500 |
36±1 |
311±15 |
МД |
[9] |
0240240240246 d
Рис. 2. Зависимости отношений
8 ( ), 9 ( ), 11 ( ) по группам молекул с одина ковым количеством N атомов углерода. Параметр Δ – номер атома углерода, участвующего в образовании первой двойной связи от конца цепи. Расчет методом МК при температуре T = 293 K. Доверительные интервалы, отвечающие 95%-ной надежности согласно t-распределению Стьюдента, меньше размеров символов на графиках d = Const и N = Const, тем, как правило, больше ее гибкость (см. рис. 1). Этот эффект объясняется разной степенью влияния наиболее низкоэнергетических (свернутых) конформаций фрагментов, содержащих двойные связи. Если фрагмент с двойными связями расположен у конца цепи, свернутые конформации оказываются в известном смысле «локальными» по сравнению с вытянутыми низкоэнергетическими конформациями оставшегося (насыщенного) участка цепи. Нали- чие такого фрагмента вблизи середины цепи разделяет насыщенную часть молекулы на 2 участка, низкоэнергетические конформации которых в общем случае вытянуты в разных направлениях, что уменьшает расстояние
Конкурентное влияние на величину
Наконец, при d = Const и X = Const гибкость молекулы растет (
Обсуждаемые для
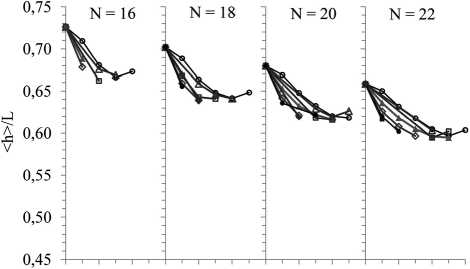
Относительные флуктуации геометрических размеров
. Наблюдается рост флуктуаций
E
h
2
(рис. 3) для всех моноеновых и диеновых цепей (d = 1, 2), а также достаточно длинных (N = 18, 20, 22) триеновых и тетраеновых цепей (d = 3, 4) при смещении X от концов к середине цепи. Если количество двойных связей в цепи еще больше (d = 5 и 6), то величина
E
h
2
зависит от параметра X немонотонно. Аналогично ведут себя относительные флуктуации
E
S
2
(данные здесь не представлены), хотя их амплитуда значительно, примерно в 5 раз, меньше, чем амплитуда
E
h
2
. Последнее вполне объяснимо:
S
вычисляется с учетом взаимных положений всех атомов молекулы, тогда как h2 – только двух концевых атомов углерода. Отметим, что общие тенденции, которые отражают зависимости величины
E
h2 от параметра X (см. рис. 3), качественно согласуются с тенденциями изменения от этого параметра величины гибкости, характеризуемой отношением
О 4 8 12 16 4 8 12 16 4 8 12 16 8 12 8 12 12 16
X
Рис. 3. Зависимости относительных флуктуаций £ ^ 2 квадратов расстояний между концевыми атомами углерода невозмущенных углеводородных молекул от параметра X. Условия и обозначения, как на рис. 1
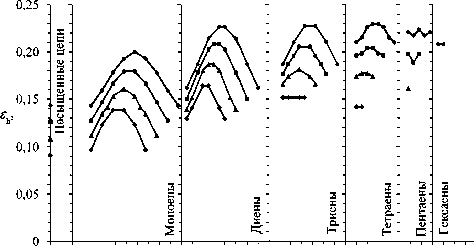
Удельная конформационная теплоемкость . Конформационная теплоемкость, приходящаяся на один угол вращения вокруг простой связи C-C, соседней с двойной (в ненасыщенных цепях), меньше, чем вокруг простой связи C-C в насыщенном участке цепи. Этот вывод следует из сравнения данных, например, для цепей 16:0 и 22:6 w 3 cis (рис. 4). Для обеих молекул Nφ = 13. Величина CV/Nφ для цепи 16:0 приходит-сяφ на угол вращения толφько вокруг простой связи C-C (углов другого типа Nφ не содержит). Для цепи 22:6 w 3 cis она почти полностью приходится на угол вращения вокруг связи C-C, соседней с двойной (таких углов 12 из 13). Различие между величинами C /N вызвано тем, что, как
Vφ упоминалось выше, первый торсионный барьер (~3 ккал/моль) больше, чем второй (~2 ккал/моль); минимумы поверхностей энергии в ненасыщенной цепи более пологие. В результате плотность высокоэнергетических состояний в насыщенной цепи оказывается больше, чем в ненасыщенной. С увеличением в молекуле количества двойных связей, то есть с ростом доли простых C-C
0 4 8 12 16 4 8 12 16 4 8 12 16 8 12 8 12 12 16 X
Рис. 4. Зависимости от параметра X удельных конформационных теплоемкостей C /N , связанных с флуктуаци-
Vφ ями энергии ближних взаимодействий невозмущенных углеводородных молекул. Условия и обозначения, как на рис. 1
связей, соседних с двойными, величина CV/Nφ молекулы постепенно уменьшается (см. рис. 4)φ. Удельная теплоемкость в цепях с N = Const, d = Const почти не зависит от X (см. рис. 4), поскольку при этом доля простых C-C связей, примыкающих к двойным, остается постоянной. Вклад внутреннего вращения в теплоемкость различных молекул цепного строения весьма важен; он обсуждается, например, в обзоре [21].
Итак, в работе установлена связь между химическим строением широко распространенных в природе цепных углеводородных молекул и относительными флуктуациями их геометрических размеров, а также конформационной теплоемкостью, связанной с флуктуациями энергии ближних взаимодействий, обобщен ряд тенденций изменения равновесной гибкости молекул. Полученные данные способствуют углублению общего понимания взаимосвязей между структурой и свойствами данного класса молекул.
-
* Работа выполнена при поддержке программ президента РФ «Ведущие научные школы» (гранты НШ-1642.2012.4, НШ-1410.2014.4).
Список литературы Изучение геометрических, термодинамических свойств и гибкости углеводородных молекул методом Монте-Карло
- Геннис Р. Биомембраны: Молекулярная структура и функции. М.: Мир, 1997. 624 с.
- Дашевский В. Г. Конформации органических молекул. М.: Химия, 1974. 428 с.
- Журкин Д. В., Рабинович А. Л. Оценка формы цепных углеводородных молекул методом Монте-Карло//Ученые записки Петрозаводского государственного университета. Сер. «Естественные и технические науки». 2014. № 6 (143). С. 109-117.
- Рабинович А. Л. Цепные молекулы как компоненты мембранных систем: компьютерное моделирование//Методы компьютерного моделирования для исследования полимеров и биополимеров. М.: Книжный дом «ЛИБРОКОМ», 2009. С. 410.
- Рабинович А. Л., Жу р к и н Д. В. Существенная выборка при моделировании непрерывного спектра конформаций макромолекул методом Монте-Карло//Труды Карельского научного центра Российской академии наук. Сер. «Математическое моделирование и информационные технологии». 2013. Вып. 4. С. 96-111.
- Флори П. Статистическая механика цепных молекул. М.: Мир, 1971. 440 с.
- Baschnagel J., Qin K., Paul W., Binder K. Monte Carlo Simulation of Models for Single Polyethylene Coils//Macromolecules. 1992. Vol. 25. № 12. P. 3117-3124.
- Bessières D., Pineiro M. M., De Ferron G., Plantier F. Analysis of the orientational order effect on n-alkanes: Evidences on experimental response functions and description using Monte Carlo molecular simulation//J. Chem. Phys. 2010. Vol. 133. 074507.
- Brown D., Clarke J. H. R., Okuda M., Yamazaki T. A molecular dynamics study of chain configurations in n-alkane-like liquids//J. Chem. Phys. 1994. Vol. 100. № 2. P. 1684-1692.
- Dettenmaier M. Conformation of n-alkane molecules in the melt and in cyclohexane solution studied by small-angle neutron scattering//J. Chem. Phys. 1978. Vol. 68. № 5. P. 2319-2322.
- Feller S. E., Gawrisch G., Mac K er ell Jr. A. D. Polyunsaturated Fatty Acids in Lipid Bilayers: Intrinsic and Environmental Contributions to Their Unique Physical Properties//J. Am. Chem. Soc. 2002. Vol. 124. № 2. P. 318-326.
- Ferguson A. L., Debenedetti P. G., Panagiotopoulos A. Z. Solubility and Molecular Conformations of n-Alkane Chains in Water//J. Phys. Chem. B. 2009. Vol. 113. № 18. P. 6405-6414.
- Goodsaid-Zalduondo F., Engelman D. M. Conformation of liquid n-alkanes//Biophys. J. 1981. Vol. 35. P. 587-594.
- Högberg C. J., Nikitin A. M., Lyubartsev A. P. Modification of the CHARMM Force Field for DMPC Lipid Bilayer//J. Comput. Chem. 2008. Vol. 29. P. 2359-2369.
- Mondello M., Gre s t G. S. Viscosity calculations of n-alkanes by equilibrium molecular dynamics//J. Chem. Phys. 1997. Vol. 106. № 22. P. 9327-9336.
- Nelson D. L., Cox M. M. Lehninger Principles of Biochemistry. 5th ed. N. Y.: Freeman W.H. and Co., 2008. Ch. 10. P. 343.
- Rabinovich A. L., R ip at t i P. O. Monte Carlo simulations of hydrocarbon oligomeric chains. Shape and dimension characteristics//Proc. SPIE. 2001. Vol. 4348. P. 225-236.
- Rabinovich A. L., R ip att i P. O. Monte Carlo simulations of hydrocarbon oligomeric chains: carbon skeleton cross sectional areas//Proc. SPIE. 2002. Vol. 4627. P118-128.
- Rey A., Kolinski A., Skolnick J. Effect of double bonds on the dynamics of hydrocarbon chains//J. Chem. Phys. 1992. Vol. 97. № 2. P. 1240-1249.
- Sun L., Siepmann J. I., Schure M. R. Conformation and Solvation Structure for an Isolated n-Octadecane Chain in Water, Methanol, and Their Mixtures//J. Phys. Chem. B. 2006. Vol. 110. P. 10519-10525.
- Wunderlich B. Phases of Amorphous, Crystalline, and Intermediate Order in Microphase and Nanophase Systems//Hot Topics in Thermal Analysis and Calorimetry. Vol. 8: Glassy, Amorphous and Nano-Crystalline Materials. Thermal Physics, Analysis, Structure and Properties. Dordrecht etc.: Springer Science+Business Media B.V., 2011. P. 93.
- Yoon D. Y., Flory P. J. Small angle neutron scattering by n-alkane chains//J. Chem. Phys. 1978. Vol. 69. № 6. P. 2536-2538. Zhurkin D. V., Petrozavodsk State University (Petrozavodsk, Russian Federation) Rabinovich A. L., Institute of Biology of Karelian Research Centre of RAS (Petrozavodsk, Russian Federation)


