Изучение гибридизации атома кислорода в комплексах n, v-типа методами рентгеноструктурного анализа, ядерного магнитного резонанса и электронной спектроскопии
Автор: Андреев Владимир Петрович
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Физико-математические науки
Статья в выпуске: 4 (133), 2013 года.
Бесплатный доступ
Методами 1Н-ЯМР-спектроскопии и РСА показано, что пространственная структура, а также тип гибридизации (sp 2 или sp 3) атома кислорода N-оксидной группы в молекулярных комплексах n, v-типа гетероароматических N-оксидов с BF 3 и другими кислотами Льюиса зависят от электронных факторов заместителей в гетероцикле, типа растворителя и пространственных напряжений, возникающих в процессе комплексообразования. Например, в хлороформе и ДМСО в аддукте N-оксида 4-метилпиридина с трифторидом бора связь O-B лежит в плоскости пиридинового кольца (sp 2-гибридизация), а в кристаллическом состоянии двугранный угол между плоскостями, проходящими через атомы N-O-B и пиридинового кольца, составляет 87,81° (sр 3-гибридизация). По-видимому, гибридное состояние атома кислорода в комплексах n, v-типа карбонильных соединений (альдегидов, кетонов, карбоновых кислот и их функциональных производных) обусловлено теми же причинами.
Гибридизация, координация, гетероароматические n-оксиды, рентгеноструктурный анализ, нуклеофильное замещение, ядерный магнитный резонанс
Короткий адрес: https://sciup.org/14750442
IDR: 14750442 | УДК: 513.71+547.821+547.831
Текст научной статьи Изучение гибридизации атома кислорода в комплексах n, v-типа методами рентгеноструктурного анализа, ядерного магнитного резонанса и электронной спектроскопии
Общепринято считать, что кислород в N-оксидной группе гетероароматических N-оксидов находится в состоянии sp2-гибридизации [2], [3], [5] и в сопряжении с гетероароматическим ядром. Однако в молекулярных комплексах N-оксидов пиридинов с BF3 состояние гибридизации атома кислорода, по-видимому, может зависеть от природы заместителей в ароматическом кольце. Так, нами обнаружено, что в 1Н-ЯМР-спектрах бор-фторидов N-оксидов 4-хлорпиридина, пиридина и 4-метилпиридина в CDC1 3 и DMSO-d 6 все протоны пиридинового кольца имеют различные химические сдвиги, но в комплексах более оснόвных N-оксидов 4-метоксипиридина и 4- (4-диметила-миностирил) пиридина протоны H2,6 и H3,5 попарно «эквивалентны». Этот феномен, на наш взгляд, хорошо объясним с точки зрения различной гибридизации атома кислорода, образующего связь с атомом бора в этих комплексах: sp 2 – в первых трех случаях и sp 3 – в остальных двух [6].
Очевидно, что при образовании одинарной связи между атомом азота пиридинового кольца и атомом кислорода, находящимся в состоянии sp 3-гибридизации, быстрые (во временных рамках ЯМР-спектроскопии) конформационные (вращение относительно связи N–O) изменения молекулы приведут к усреднению химических сдвигов протонов H2,6 и H3,5 (как в случае тетра-фенилбората 1-диметилкарбамоилокси-4- (4-ме-токсистирил) пиридиния [11]).
Тем не менее однозначный вывод о возможности sp2>sp: перегибридизации атома кисло
рода при взаимодействии гетероароматических N-оксидов с трифторидом бора можно сделать только на основании данных рентгеноструктурного анализа.
С этой целью в 2007 году [1] методом моно-кристального РСА мы исследовали атомно-молекулярную структуру комплексов N-оксидов 4-метил- и 4-метоксипиридина с BF3 (4-MePyO · BF 3 (I) и 4-MeOPyO • BF 3 (II)), полагая, что в соответствии с данными протонного магнитного резонанса в первом случае атом бора будет находиться в плоскости пиридинового кольца, а во втором нет. Однако оказалось (рис. 1), что в кристаллах аддуктов (I и II) валентные углы N–O–B (113,95 (15)° и 113,26 (16)°), а также двугранные углы между плоскостями, проходящими через атомы N–O–B и пиридинового кольца (87,81° и 87,63°), очень близки. Подобное расположение связей O-B однозначно указывает на невозможность сопряжения атома кислорода N-оксидной группы с гетероароматическим кольцом, то есть на его sp3-гибридное состояние в кристаллах обоих соединений.
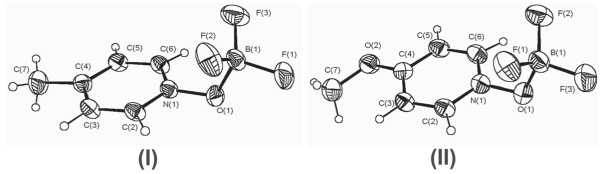
Рис. 1. Молекулы комплексов N-оксидов 4-метилпири-дина (I) и 4-метоксипиридина (II ) с BF3, эллипсоиды смещения изображены с вероятностью 50 %
Указанный факт находится в соответствии с данными 1Н ЯМР-спектроскопии в CDCl3 и DMSO-d6 для комплекса 4-MeOPyO • BF 3 (попарная равноценность протонов H2,6 и H3,5) и не согласуется с наличием четырех типов протонов в пиридиновом кольце 4-MePyO · BF3.
Это кажущееся противоречие, по-видимо-му, объясняется тем, что устойчивость и пространственная структура аддукта с BF3 менее основного N-оксида 4-метилпиридина (pKa [18]: 4-MePyO 1,29, 4-MeOPyO 2,05) в большей степе -ни зависит от природы и агрегатного состояния окружающих его молекул. Если в жидкой фазе (sp2-гибридизация атома кислорода) конформация комплекса (I) определяется и свойствами (дипольный момент, диэлектрическая проницаемость и т. д.) растворителя (сольватация и диссоциация являются динамическими процессами), то в твердой (sp3-гибридизация) - совокупностью внутри- и межмолекулярных взаимодействий атомов кристалла, находящихся в стационарном состоянии. По-видимому, при переходе из кристаллического состояния в раствор возрастание диэлектрической проницаемости растворителя должно ослаблять прочность связи O–B и увеличивать возможность сопряжения атома кислорода с пиридиновым кольцом, формируя координационную связь за счет sp2-гибридной орбитали (при полном разрыве связи образуется N-оксид, в котором атом кислорода находится в sp2-гибридном состоянии). Действительно, 1Н ЯМР-спектры комплекса низкоосновного (pKa 0,36 [13]) N-оксида 4-хлорпиридина из-за его диссоциации мы были вынуждены снимать [6] при добавлении к раствору лиганда избытка эфирата BF3.
В данном случае можно провести аналогию с бензойными кислотами (представив их как донорно-акцепторные комплексы бензоат-анионов с протоном), которые при диссоциации в растворе образуют карбоксилат-анионы, содержащие два равноценных атома кислорода в sp2-гибрид-ном состоянии. При этом повышение электронодонорных свойств заместителя в ароматическом кольце, уменьшение полярности растворителя и увеличение концентрации кислоты должно ослаблять диссоциацию последней с образованием межмолекулярной водородной связи (димеры). В виде плоских димеров бензойные кислоты существуют и в твердой фазе (например, 4-метокси-, 4-метил- и 4-нитропроизводные [12]; CSD refcode: ANISIC02, PTOLIC, NBZOAC02), что указывает на sp2-гибридное состояние всех четырех атомов кислорода.
Однако равновесные процессы образования аддуктов с участием, например, 4-метилбен-зоат-аниона или N-оксида 4-метилпиридина, с одной стороны, и протона или BF3 (кислоты Льюиса), с другой стороны, похожи (различие в заряде и размере донора и акцептора). Поэто- му можно сделать вывод, что sp2-гибридизации атома кислорода (более слабая координационная связь) должны благоприятствовать ослабление основности донора и кислотных свойств акцептора. Действительно, комплексы N-оксида 4-нитропиридина (pKa - 1,7 [1]) с 4-нитрофенолом и 4-нитробензойной кислотой (рис. 2а, 2б) в кристаллическом состоянии являются почти плоскими с углами N-O-H (между N-оксидной и гидроксильной группами) около 122°. Кроме того, с альдегидами, кетонами и сложными эфирами (очень слабые основания Льюиса, рис. 2г–е), содержащими карбонильную группу, сопряженную со стирильными и/или винильными фрагментами, даже сильная кислота Льюиса трифторид бора в кристалле образует аддукты (JADBEW, MOZCAF, MOZCEJ, MOZCIN, RUGYEX, VUSRAC), в которых атом бора находится в плоскости сопряженной системы, а валентные углы C–O–B составляют 124–127°. В комплексах диметилформамида с BBr (RUGXUM) и BI (RUGYAT) фрагмент B-O-C3H-NC2 также явля3 ется плоским. Таким образом, в этих соединениях атомы кислорода групп N^O и C=O образуют донорно-акцепторные связи с помощью sp2-гибридных орбиталей.
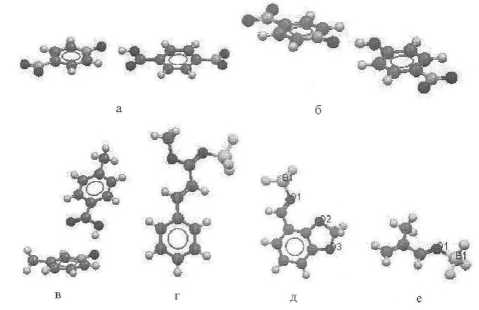
Рис. 2. Строение комплексов N-оксидов 4-нитропириди-на с 4-нитробензойной кислотой (CUZDAC) (а) и 4-нитрофенолом (JUDNAX) (б), N-оксида 3-метилпиридина с 4-метилбензойной кислотой (ROKQAJ) (в), метилового эфира коричной кислоты (MOZCAF) (г), 2,3-метиленди-оксибенз-альдегида (RUGYEX) (д) и 2-метилпропеналя-2 (VUSRAC) (е) с трифторидом бора согласно данным РСА [12]). Только в случае (в) атом кислорода находится в состоянии sp3-гибридизации
С другой стороны, комплексы N-оксида 3-метилпиридина (pKa - 1,08 [1]; гораздо более сильное основание, чем N-оксид 4-ни-тропиридина) с 4-метилбензойной кислотой (ROKQAJ, рис. 2в) и N-оксидов 4-нитропири-дина (MUFZUJ [15]) и хинолина (MUFZET [15]) с сильной кислотой Льюиса BF3 образуют координационную связь с участием атома кислорода в состоянии sp3-гибридизации. Тот факт, что углы между плоскостями пиридинового кольца и связей N–O–H в первом случае и N–O–B во втором и третьем составляют, соответственно, 53,49, 75,69 и 78,43°, полностью исключает возможность сопряжения атома кислорода с ароматической системой.
В полученных нами комплексах 4-MePyO · BF (I) и 4-MeOPyO · BF (II) длины связей N–O (1,372 (2); 1,370 (2)) и O-B (1,496 (3); 1,502 (3)) находятся в соответствии с данными для других комплексов гетероароматических N-оксидов n, v-типа [5]; для аддуктов N-оксидов 4-нитро-пиридина и хинолина с трифторидом бора они составляют: 1,368 (3) и 1,370 (3) Ǻ (N–O), 1,524 (5) и 1,513 (3) (O-B) [15]. Тетракоординирован-ный (sp3-гибридизация) атом бора в комплексах (I и II) образует валентные углы F–B–F 110–113°.
При этом существенный вклад в упаковку (рис. 3) молекул может быть обусловлен π–π и диполь-дипольным взаимодействием расположенных попарно и параллельно друг другу пиридиновых колец комплексов.
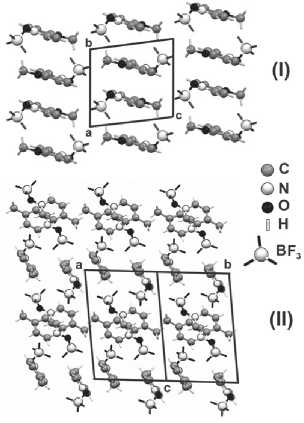
Рис. 3. Упаковка молекул в кристаллической структуре молекулярных комплексов N-оксидов 4-метилпиридина (I) и 4-метоксипиридина (II) с BF3
Подчеркнем, что другие подобные BF 3 кислоты Льюиса (FeCl3, TlCl3, TlBr3, TLI3 и т. д.), в отличие от него, способны образовывать комплексы с двумя молекулами N-оксидов пиридинов (IJIYIJ, CYPOTL10, DEPHAH, COHMIV), в которых молекулы акцепторов являются плоскими, а координационная связь образуется за счет атома кислорода в sp3-гибридном состоянии (двугранный угол C N-O-металл составляет 50–82°). 5
Особый интерес с точки зрения органической химии представляют комплексы BF 3 с N-оксидами 4-нитропиридина и 4-нитрохинолина, поскольку их образование облегчает нуклеофильное замещение группы NO2 [7].
Обычно реакции S N в ряду N-оксидов пиридинов и хинолинов со слабыми нуклеофилами
(галогенид-ионами) требуют кипячения с концентрированными водными растворами HCl или HBr либо использования галогенангидридов уксусной кислоты или фосфорилгалогенидов и в ряде случаев сопровождаются побочными процессами, например образованием продуктов дезоксидирования [17].
Мы обнаружили, что при добавлении BF3 · Et2O в реакционную среду, содержащую N-оксид 4-нитрохинолина (или использовании твердого аддукта N-оксида с BF 3 ), и триэтилбен-зиламмоний хлорида (источник хлорид-иона) в безводном ацетонитриле реакция замещения нитрогруппы на атом хлора и в первом, и во втором случаях заканчивается за одно и то же время (при комнатной температуре за 1 ч, при 65 °C за 30 мин [7]). Это указывает на участие в нуклеофильном замещении молекулярного комплекса с BF3, в котором за счет связывания с v-акцептором увеличивается электрофильность N-оксида.
В работе [15] приводятся константы устойчивости (К) молекулярных комплексов N-оксидов 4-нитропиридина и 4-нитрохинолина с BF в ацетонитриле (4-NO PyO · BF 2800 M-1, 4-NO32QO · BF3 1700 M-1), ч2исленные3 значения которых вызывают некоторое удивление. Ввиду того что N-оксид 4-нитропиридина (pKa– 1,7) является более слабым основанием [1], чем N-оксид 4-нитрохинолина [pKa - 1,39], он должен образовывать менее устойчивые комплексы с v-акцепторами. Кроме того, данные работ [1], [7] о гораздо более высокой скорости замещения нитрогруппы на атомы галогена в комплексе N-оксида 4-нитрохинолина с трифторидом бора по сравнению с пиридиновым аналогом также указывают на большее смещение электронной плотности в процессе координации из ароматической системы к атому бора, благоприятствующее образованию донорно-акцепторной связи O–B.
Для того чтобы подтвердить правомерность наших сомнений, мы определили, как описано в работе [8], значения констант устойчивости комплексов состава 1:1 цинк-тетрафенилпорфи-на (значительно более слабого акцептора, чем трифторид бора) с этими лигандами в хлороформе при 25 °С. Как и ожидалось, в нашем случае порядок изменения констант устойчивости комплексов с 4-NO2PyO и 4-NO2QO находится в согласии с величинами основности лигандов и значения К составляют, соответственно, 134 ± 3 и 267 ± 9 M-1, то есть N-оксид 4-нитрохинолина является более сильным нуклеофилом (электро-нодонором) в процессах координации.
Подчеркнем, что для очень слабых оснований 4-NO2PyO и 4-NO2QO комплексы с BF3 должны быть еще менее устойчивыми, чем с N-оксидом 4-хлорпиридина, и в растворах процесс sp2^sp3-перегибридизации атома кислорода группы N→O в этих двух соединениях, с нашей точки зрения, вряд ли происходит в значительной степени, но его вероятность возрастает с уменьшением электроноакцепторных (увеличением электронодонорных) свойств заместителя в пиридиновом кольце, как это показано для реакции нуклеофильного замещения нитрогруппы на атом хлора в апротонных растворителях типа хлороформа и ацетонитрила.
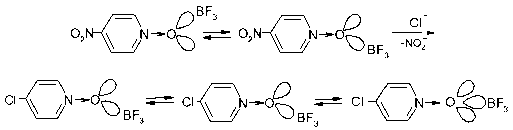
Ранее подобным же образом (на начальном этапе реакции N-оксидов пиридинов с иоди-стым метилом наиболее вероятно образование связи с участием хорошо доступной sp2-гибрид-ной, а не участвующей в сопряжении с пиридиновым кольцом p-орбитали атома кислорода) нам удалось объяснить аномальное влияние стерических факторов при взаимодействии N-оксидов пиридинов с алкилгалогенидами [3].
Образование активированного комплекса [XC 5 H 5 N^O 8- • • • 8+CH 3 • • • 18- ‘ ] * между ио-дистым метилом и производным N-оксида пиридина можно представить как равновесный процесс, константа диссоциации которого будет зависеть от относительной термодинамической устойчивости исходных соединений и продуктов реакции. В свою очередь, прочность связи O–C должны увеличивать электронодонорные и уменьшать акцепторные заместители Х. Действительно, согласно работе [10], при растворении в ацетонитриле метоксипиридиний иодида, полученного препаративно, происходит накопление N-оксида пиридина и иодистого метила, а концентрация иодид-иона уменьшается и достигает такого же значения, как и при образовании соли из исходных реагентов, взятых в соответствующих концентрациях. Прибавление тетраметиламмоний иодида в реакционную систему после установления равновесия увеличивает концентрацию метилиодида (эффект одноименного иона).
Появление же электронодонорных групп в пиридиновом кольце N-оксида должно сначала приводить к упрочению связи O-C, образованной sp2-гибридной орбиталью кислорода, а затем к перегибридизации атома кислорода и образованию связи O–C за счет его sp3-гибридной орбитали. Поэтому в случае высокоосновных N-оксидов 4-метокси- и 4-диметиламинопири-динов равновесие практически нацело смещено в сторону образования алкоксипиридиниевых солей [2].
Устойчивость ацил- (как и алкокси-) производных N-оксидов пиридинов в растворах зависит от донорно-акцепторных свойств заместителей в пиридиновом кольце и при атоме кислорода, а также природы (нуклеофильно-сти/основности) аниона. Если тетрафенилборат 1-диметилкарбамоилокси-4- (4-метоксистирил) пиридиния [11] стабилен в апротонных растворителях, то твердый безводный продукт взаимодействия N-оксида пиридина с бензоилхло-ридом даже в бензоле распадается практически полностью на исходные реагенты [9].
В твердом же состоянии (подобно молекулярным комплексам N-оксидов пиридинов с BF3) все соли N-алкокси-, N-арилокси- и N-гетери-локсипиридиния, для которых расшифрована структура методом РСА (CANTIU, SIRWUL, TAJPUP и др.), содержат атом кислорода в состоянии sp3-гибридизации, так как в их конформациях атомы фрагмента N-O-C находятся в плоскости, перпендикулярной к плоскости пиридинового кольца, полностью исключая возможность сопряжения между ним и атомом кислорода.
Следует отметить, что, в отличие от гетеро-ароматических N-оксидов (sp2-гибридизация атома кислорода), в анилинах состояние гибридизации атома азота, согласно данным РСА [4], зависит от электронных эффектов заместителей в бензольном кольце: электронодонорные группы благоприятствуют sp3-гибридизации, а акцепторные – sp2.
В дальнейшем мы предполагаем привлечь для исследования молекулярных комплексов N-оксидов с v-акцепторами метод газовой электронографии, так как полученные результаты могут дать дополнительную информацию о влиянии межмолекулярных взаимодействий на процесс sp2→sp3 перегибридизации атома кислорода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
N-оксиды 4-метилпиридина и 4-метоксипи-ридина были получены, как описано в работах [14], [16]. Их молекулярные комплексы с трифторидом бора (I) и (II) готовили добавлением эквимолярных количеств BF 3 • Et 2 O к насыщенным ацетоновым растворам соответствующих N-оксидов. Выпавшие бесцветные кристаллы высушивали на воздухе. 4-MePyO · BF Т. пл. 125–127 °С, 4-MeOPyO · BF3 Т. пл. 116–3117 °С. 1H ЯМР-спектры [6] записаны на спектрометре Bruker WM 400 (400 МГц) вDMSO-d6.
Структурные данные депонированы в Кембриджском банке структурных данных (КБСД) – CCDC 848664 и 848665.
* Работа выполнена при поддержке Программы стратегического развития на 2012-2016 годы «Университетский комплекс ПетрГУ в научно-образовательном пространстве Европейского Севера: стратегия инновационного развития», подпроект «Создание и развитие деятельности Междисциплинарной и межкафедральной лаборатории по разработке перспективных материалов на основе нанокомпозитов с использованием природных соединений», а также гранта Правительства Российской Федерации по Постановлению № 220 «О мерах по привлечению ведущих ученых в российские образовательные учреждения высшего профессионального образования» по договору № 11.G34.31.0052 от 19 октября 2011 г., заключенному между Минобрнауки России, ведущим ученым А. Н. Полтораком и Петрозаводским государственным университетом.
INVESTIGATION OF HYBRIDIZATION OF OXYGEN ATOM IN n, v-TYPE COMPLEXES BY METHODS OF X-RAY ANALYSIS, NUCLEAR MAGNETIC RESONANCE, AND ELECTRONIC SPECTROSCOPY
Список литературы Изучение гибридизации атома кислорода в комплексах n, v-типа методами рентгеноструктурного анализа, ядерного магнитного резонанса и электронной спектроскопии
- Андреев В. П. Молекулярные комплексы гетероароматических N-оксидов и ацетиленовых аминов с v-акцепторами как модель исследования нуклеофильности и основности соединений с пространственно доступными реакционными центрами: Дис.. д-ра хим. наук. Петрозаводск, 2007. 427 с.
- Андреев В. П. Относительная нуклеофильная реакционная способность пиридинов и пиридина-оксидов («супернуклеофильность» пиридина-оксидов)//ЖОрХ. 2009. Т. 45. № 7. С. 1073-1082.
- Андреев В. П. Влияние электронных факторов на реакционную способность гетероароматических N-оксидов//ХГС. 2010. № 2. С. 227-242.
- Андреев В. П. Гибридизация атомов азота в анилинах и их молекулярных комплексах с v-акцепторами//Ученые записки Петрозаводского государственного университета. Сер. «Естественные и технические науки». 2012. № 6 (127). С. 82-86.
- Андреев В. П., Вапиров В. В., Нижник Я. П., Алешина Л. А., Семенова Т. А. Изменение гибридизации атома кислорода группы N→O при комплексообразовании N-оксидов пиридинов и хинолинов с v-акцепторами//ЖОрХ. 2008. Т. 78. Вып. 5. С. 830-840.
- Андреев В. П., Нижник Я. П. Исследование комплексообразования N-оксидов пиридинов и хинолинов с трифторидом бора методом протонного магнитного резонанса//Координационная химия. 2007. Т. 33. № 9. С. 703-708.
- Андреев В. П., Рыжаков А. В. Активация v-акцепторами реакций нуклеофильного замещения в N-оксиде 4-нитрохинолина//ХГС. 1999. № 11. С. 1523-1527.
- Андреев В. П., Соболев П. С., Зайцев Д. О., Ремизова Л. А., Тунина С. Г. Координация Zn-ТФП с первичными аминами и со спиртами в хлороформе//ЖОХ. 2012. Т. 82. Вып. 6. С. 1023-1033.
- Литвиненко Л. М., Олейник Н. М. Механизмы действия органических катализаторов. Основный и нуклеофильный катализ. Киев: Наукова думка, 1984. 264 с.
- Попов А. Ф., Матвеев А. А., Коблик И. В., Савелева В. А., Матвиенко В. Н. Кинетика и продукты реакции пиридин-N-оксидов с галогеналканами//ЖОрХ. 1996. Т. 32. Вып. 4. С. 609-612.
- Шредер Г., Рыбаченко В. И., Чотий К. Ю., Коваленко В. В., Гребенюк Л. В., Ленска Б., Эйтнер К. Константы скорости и равновесия переноса диметилкабамоильной группы между N-оксидами пиридина//ЖОХ. 2003. Т. 73. Вып. 3. С. 486-493.
- Allen F. H. Acta Crystallogr., Sect. B.//Structural Science. 2002. Vol. 58. P. 380. Cambridge Structural Database [Electronic resource]. Access mode: http://www.ccdc.cam.ac.uk
- Dega-Szafran Z., Grundwald-Wyspianska M., Kania A., Kosturkiewicz Z., Szafran M., Tykarska E. FT-IR, UV-visible and X-ray studies of complexes of pyridine N-oxides with pentachlorophenol//J. Mol. Structure. 1995. Vol. 356. P. 169-182.
- Katritzky A. R. The preparation of some substituted pyridine 1-oxides//J. Chem. Soc. 1956. № 7. P. 2404-2408.
- Nizhnik Ya. P., Lu J., Rosokha S. V., Kochi J. K. Lewis acid effects on donor-acceptor associations and redox reactions: ternary complexes of heteroaromatic N-oxides with boron trifluoride and organic donors//New J. Chem. 2009. Vol. 33. P. 2317-2325.
- Ochiai E. Recent Japanese work on the chemistry of pyridine 1-oxides and related compounds//J. Org. Chem. 1953. Vol. 18. № 5. P. 534-551.
- Ryzhakov A. V., Andreev V. P., Rodina L. L. Molecular complexes of heteroaromatic N-oxides and their reactions with nucleophiles//Heterocycles. 2003. Vol. 60. № 2. P. 419-435.
- Szafran M., Brycki B., Dega-Szafran Z., Nowak-Wydra B. Differantiation of substituent effects from hydrogen bonding and protonation effects in carbon-13 NMR spectra of pyridine N-oxides//J. Chem. Soc. Perkin Trans. 2. 1991. Vol. 8. P. 1161-1166.


