Изучение химической структуры лигнинов родиолы розовой (Rhodiola rosea L.) и серпухи венценосной (Serratula coronata L.) методом 2D ЯМР-спектроскопии
Автор: Белый В.А., Алексеев И.Н., Садыков Р.А.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Химические науки
Статья в выпуске: 3 (11), 2012 года.
Бесплатный доступ
Впервые выделены лигнины растений родиолы розовой (Rhodiola rosea L.) и серпухи венценосной (Serratula coronata L.). Методом двумерной ЯМР- спектроскопии определены общие закономерности химического строения. По- казано, что изучаемые лигнины построены из гваяцильных, сирингильных и пара-кумаровых фрагментов, соединенных, преимущественно, -О-4-связью. Установлены структурные различия лигнинов. В частности, выявлено, что ацетатные группы и кумаратовые фрагменты в лигнине родиолы розовой присутствуют только в -положении фенилпропановых единиц. Предшествен- никами лигнина родиолы розовой могут быть кумараты и ацетаты конифери- лового и синапового спиртов.
Лигнин, фенилпропановая единица, phenyl-propanе unit, двумерная ямр-спектроскопия
Короткий адрес: https://sciup.org/14992544
IDR: 14992544 | УДК: 547.022
Текст научной статьи Изучение химической структуры лигнинов родиолы розовой (Rhodiola rosea L.) и серпухи венценосной (Serratula coronata L.) методом 2D ЯМР-спектроскопии
Лигнин – это структурный компонент травянистых и древесных растений, образующийся путем полимеризации кониферилового, синапового и п-кумарового спиртов, придающий жесткость клеточным стенкам, а также стойкость к воздействию микроорганизмов [1]. Особенность лигнинов как особой группы биополимеров состоит в неупорядоченности их химической структуры, проявляющейся в большом разнообразии ди- и тримерных фрагментов, составляющих структуру. Однако лигнины растений различных видов характеризуются определенными особенностями строения, точнее, структура лигнина на каждом уровне структурной организации (как на молекулярном, так и на топологическом) определяется его ботаническим происхождением [2]. Особенностям химического строения и физикохимическим свойствам лигнинов травянистых рас- тений до настоящего времени уделялось мало внимания, а данные по лигнинам лекарственных растений отсутствуют вообще.
Родиола розовая ( Rhodiola rosea L.) – многолетнее травянистое растение семейства толстян-ковых, произрастающее на Алтае, Урале, заполярных районах Якутии, в горных районах Восточной Сибири и Дальнего Востока. В медицине используют ее экстракты, обладающие стимулирующим и адаптогенным действием, применение которых направлено на улучшение физической выносливости, внимания, памяти, а также резистентности организма [3].
Серпуха венценосная ( Serratula coronata L.) – многолетнее травянистое растение семейства Asteraceae, встречающееся в европейской части России, на Кавказе, в Западной Сибири, Дальнем
Востоке и Средней Азии. Серпуха венценосная является источником фитоэкдистероидов – растительных гормонов, обладающих целым рядом ценных фармакологических свойств [4]. Исследования низкомолекулярной, экстрактивной составляющей родиолы розовой и серпухи венценосной представлены в работах [5, 6].
Поиск путей рационального использования лекарственного растительного сырья, в частности, родиолы розовой и серпухи венценосной, требует детального изучения структуры их лигнинов.
Спектроскопические методики, и особенно 1D и 2D ЯМР, дают исчерпывающую информацию о структуре макромолекул и являются мощными инструментами для исследования лигнинов различного ботанического происхождения. В этой статье представлены результаты исследования химической структуры лигнинов родиолы розовой и серпухи венценосной с использованием 2D ЯМР-спект-роскопии.
Материалы и методы
Образцы. Сырьем для извлечения лигнина в данной работе являлись корневища родиолы розовой, которые заготавливали с конца цветения до конца вегетации растения, и стебли серпухи венценосной. Растения выращены и собраны в Ботаническом саду Института биологии Коми НЦ УрО РАН (г. Сыктывкар, Республика Коми).
В исходных образцах растений по общепринятым методикам [7] предварительно было определено содержание лигнина, целлюлозы и других компонентов (табл. 1).
Таблица 1
Компонентный состав родиолы розовой и серпухи венценосной
|
Растение |
Целлюлоза, % |
Лигнин, % |
Зольность, % |
Легкогид-ролизуе-мые вещества, % |
Экстрактивные вещества, % |
|
Rhodiola rosea L. |
9,0±0,2 |
21,1±0,4 |
1,9±0,1 |
36,2±0,6 |
31,8±0,5 |
|
Serratula coronata L. |
44,9±0,7 |
16,3±0,4 |
7,1±0,1 |
25,1±0,4 |
6,6±0,1 |
Предварительная подготовка растительного сырья заключалась в экстракции водой и спирто-бензольной смесью. Образцы лигнинов серпухи венценосной (ДЛС) и родиолы розовой (ДЛР) получали экстрагируя растительное сырье смесью диоксан-вода 9:1 в присутствии HCl2 (0,7 %) при температуре кипения в течение 2 ч. Полученный раствор лигнина упаривали в вакууме и высаживали в 1 %-ный раствор сульфата натрия. Лигнин отмывали от соли, подсушивали на воздухе, затем переосаждали из диоксанового раствора в диэтиловый эфир и сушили в вакууме. Выход лигнина серпухи венценосной составил 22 %, родиолы ро- зовой – 30 % от содержания в исходном растительном сырье.
Двумерные спектры ЯМР регистрировали при 25°С в 5 мм ампулах на спектрометре Bruker AVANCE II 300, рабочая частота 300 МГц (1Н) и 75 МГц (13С). Около 80 мг лигнина растворяли в 0,6 мл дейтерированного диметилсульфоксида, затем 2D ЯМР спектры записывались в HSQC (Heteronuclear Single Quantum Correlation), COSY (Correlation Spectroscopy) и HMBC (Heteronuclear Multiple Quantum Coherence) экспериментах. Ширина спектров составила 5 тыс. и 20 тыс. Гц в 1Н и 13С измерениях соответственно. Число накоплений составляло 20 тыс. с задержкой 5 с. В качестве внутреннего стандарта использовался сигнал растворителя (δ С 40.1; δ Н 2.5). Кросс-сигналы спектров HSQC интерпретировались по литературным данным [8, 9]. При регистрации 13С-спектров время релаксации искусственно уменьшалось добавлением трис-ацетил-ацетоната хрома (0.02 моль/л).
Результаты и обсуждение
Лигнины, выделенные диоксаном по описанной выше методике, часто используются для структурных исследований, поскольку они являются наиболее представительной частью всего лигнина в растении [10]. Поэтому в данной работе для исследования структуры лигнинов лекарственных растений применяли именно диоксановый метод выделения образцов. Однако необходимо иметь в виду, что выводы, сделанные по выделенным препаратам, могут иметь лишь предположительный характер в отношении всего лигнина, находящегося в растении.
Строение лигнина характеризуется наличием ароматических ядер, замещенных метоксильными, гидроксильными функциональными группами и алкильными цепочками. Описание характеристик лигнина как вещества нерегулярного строения возможно через определение его фрагментного состава, демонстрирующего статистические параметры химической структуры лигнина.
Ароматические фрагменты. Наиболее интенсивные корреляционные сигналы в ароматическом регионе HSQC-спектров (δ Н /δ С 5.5-8.5/96-150 м.д.), представленных на рис. 1, соответствуют ароматическим кольцам различных структурных единиц лигнина. В HSQC-спектрах шкала химических сдвигов атомов 1Н отложена по оси абсцисс, атомов 13С – по ординат. Сигнал 6.68/103.8 м.д. на рис. 1, согласно [9], соответствует атомам во втором и шестом положениях сирингильного кольца (рис. 2 S), для сирингильных структурных единиц, имеющих карбонильную группу в α-положении, характерен сигнал 7.36/104.0 м.д. [9], присутствующий на спектрах ДЛР (рис. 1 а) и ДЛС (рис. 1 б). Присутствие в образцах п -кумаровых звеньев (рис. 2 H) подтверждается корреляционным сигналом δ Н /δ С 7.28/127.5 м.д [9].
Хорошо разрешенные сигналы п -кумарато-вых фрагментов (рис. 2 Y) наблюдаются в спектрах лигнина родиолы розовой (рис. 1 а). Кросс-сигналы δ Н /δ С 7.5/145.0 м.д и 6.5/115.0 м.д. (рис. 1 а) соот-
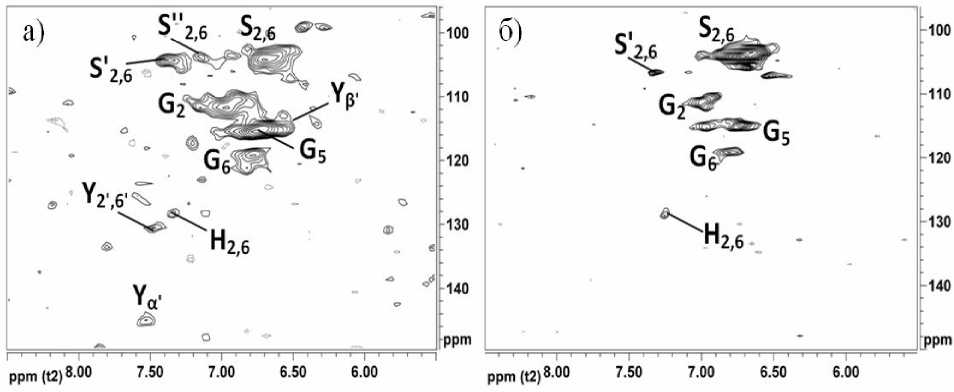
Рис. 1. Область сигналов ароматических атомов на HSQC-спектрах ДЛР (а) и ДЛС (б).
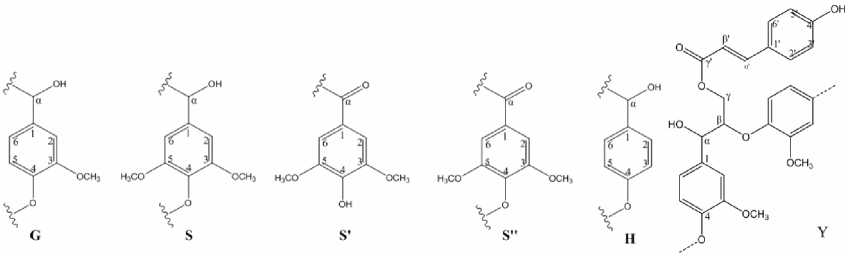
Рис. 2. Мономерные структурные единицы лигнинов: G – гваяцильные, S – сирингильные, H – п -ку-маровые, Y – ацилированные п -кумаровой кислотой.
ветствуют α (рис. 2 Y α' ) и β (рис. 2 Y β' ) атомам боковой цепочки п -кумаратов [9], а сигналы при δ Н /δ С 7.40/130.5 м.д. и 6.77/116.2 м.д. относятся к ароматическому кольцу п -кумаратов (рис. 2 Y 2', 6' ) и (рис. 2 Y 3', 5' ) соответственно [9].
Во многих исследованиях лигнинов травянистых растений указывалось на присутствие в структуре остатков п-кумаровой кислоты, соединенной с фенилпропановыми единицами сложноэфирной связью [11–14]. В этих работах предполагались два различных пути вовлечения п-кумаровой кислоты в процесс биосинтеза – либо этерификация п-кумаровой кислотой спиртовых групп уже собранной макромолекулы лигнина, либо ацилирование монолигнолов с образованием п-кумаратов синапо-вого и кониферилового спиртов. Для решения этого вопроса требовалось определение вариантов присоединения п-кумаратов к фенилпропановым единицам. ЯМР исследования лигнина, выделенного из кукурузы [15], пшеницы [16] и некоторых других трав [8, 17], показали, что п-кумараты присутствуют только в γ-положениях звеньев лигнина. Эти результаты однозначно указывали на то, что этерификация происходила до образования макромолекулы лигнина. Теперь широко признано, что предшественниками лигнинов могут быть сложные эфиры гидроксокоричных спиртов и п-кумаровой или бензойной кислот, а также ацетаты конифери- лового и синапового спиртов [18–21]. Ацилированные в γ-положении фрагменты были определены в лигнинах многих растений [18, 19].
Идентификация п -кумаратов в ДЛР представлена на рис. 3. Спектр ЯМР 13С (рис. 3 а) демонстрирует сигналы четвертичных атомов углерода, на наличие п -кумаратов указывает сигнал γ'-атома 167.4 м.д [9]. HSQC- и COSY-спектры (рис. 3 б) также подтверждают наличие п -кумаратов в ДЛР, в представленной на них области отмечены сигналы α' и β' атомов. Для выяснения точки присоединения п -кумаратов к структурным единицам лигнина на спектре (рис. 3 в) были выделены области сигналов, характерные для структурных единиц с присоединенными в α-положении п -кумаратовыми фрагментами (α- p CA), а также в γ-положении во фрагментах Y (рис. 2). По результатам анализа спектров на рис. 3 определено, что фрагменты п -кумарата присоединены в ДЛР только в γ-положении фенилпропановых единиц (δ Н /δ С 4.1/64.5 м.д.) в структурах, подобных Y, поскольку не обнаружено сигналов α-атома, образующего связь с п -кумаратом (δ Н /δ С 6.1/75.0 м.д. [9]). Для лигнина серпухи венценосной (образец ДЛС) наличие п -кумаратов не характерно.
В спектрах ДЛР выявлены сигналы ацетатных групп (δ Н /δ С 1.7/20.7 и δ С 170.7 м.д. [9]). На рис. 3 в отмечены сигналы атомов боковой цепочки фенилпропановых единиц, связанных с ацетатными
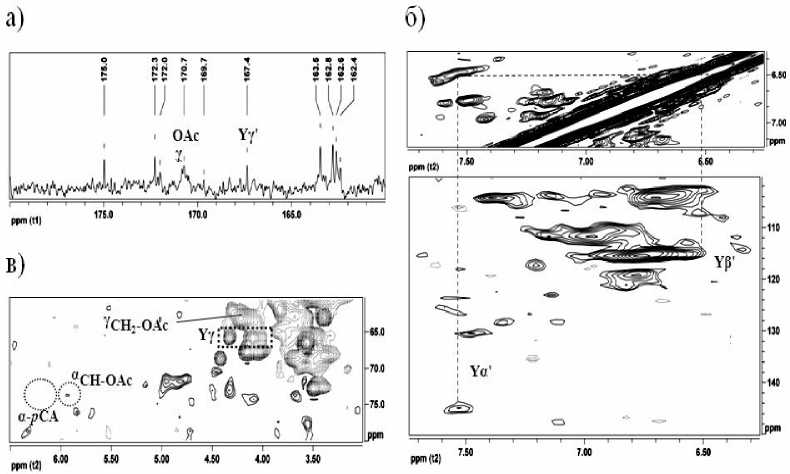
Рис. 3. Определение п-кумаратов в ДЛР по HSQC- и COSY-спектрам.
группами: в γ-положении (δ Н /δ С 4.2/63.0 м.д. [9]), а также в α-положении (δ Н /δ С 5.9/74.7 м.д. [9]). Связь с ацетатами в α-положении выявляется в лигнинах травянистых растений сравнительно редко, чаще встречается исключительно в γ-положении [17]. И, согласно предположению, выдвинутому Ральфом [10], может существовать миграция ацетатных групп от γ – к α-атому.
Простые эфирные связи между фенилпропановыми единицами. Область сигналов атомов боковых цепочек на HSQC-спектре (δН/δС 2,55,5/50-90 м.д.), представленная на рис. 4 и в табл. 2, дает информацию о связях между звеньями макромолекулы лигнина. Также в этой области спектра находятся сигналы метоксильных групп при δН/δС 3.7/55.7 м.д., которые характерны для всех известных лигнинов. Содержание метоксильных групп в разных лигнинах варьирует от 15 до 20 % в зависи- мости от соотношения гваяцильных, сирингильных и п-кумаровых структурных единиц [22]. Лигнин серпухи венценосной содержит еще и этоксильные группы. Это предположение основано на корреляционных сигналах СН3-фрагмента (δН/δС 1.10/15.0 м.д.) и СН2 (δН/δС 3.4/62.5 м.д. см. рис. 4 а). Подтверждением является кросс-сигнал на COSY спектре δН/δН 1.10/3.4 м.д.
Характерными для структуры β-арилового эфира (рис. 5 А) корреляционными сигналами, в соответствии с [9], являются δ Н /δ С 3.5/60.1 м.д. (рис. 4 Aγ) и 4.7/71.1 м.д. (рис. 4 Аα). Необходимо отметить, что сигнал β-атома гваяцильной или сирин-гильной единицы, соединенной с гваяцильной, имеет корреляцию при δ Н /δ С 4.4/84.0 м.д (рис. 4 Aβ S/G-O-G ) [9]. Этот корреляционный сигнал обычно четко разделен с корреляционными сигналами δ Н /δ С 4.0/87.7 м.д. β-атома сирингильных единиц,
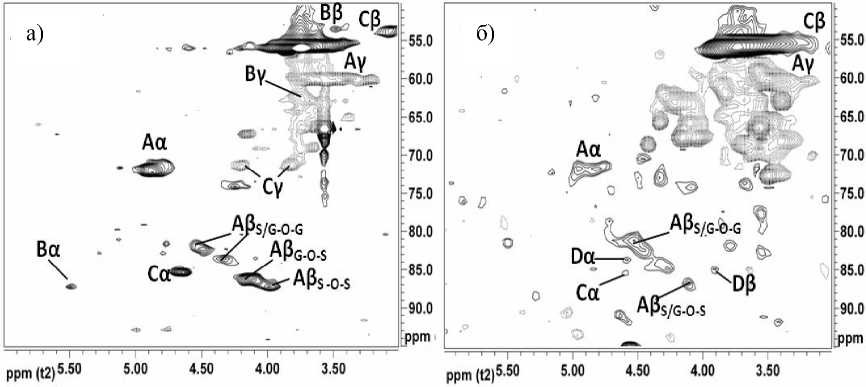
Рис. 4. Области HSQC-спектров лигнинов серпухи венценосной (а) и родиолы розовой (б).
Таблица 2
Отнесение кросс-сигналов 1Н-13С в HSQC-спектрах лигнинов ДЛС и ДЛР [8, 9]
Алифатические фрагменты. В диапазоне δ Н /δ С 3.0-1.1/50-10 м.д. на HSQC-спектре (рис. 6 нижний) присутствуют сигналы алифатических углеводородных фрагментов, не связанных с атомом кислорода, в основном групп СН 2 . Эти сигналы не
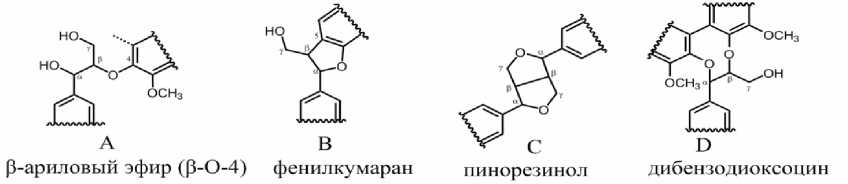
Рис. 5. Структурные фрагменты лигнинов.
имеющих в β-положении аналогичную связь с сирингильными (рис. 4 Aβ S-O-S ), а также со структурами с сигналом при δ Н /δ С 4.2/86.3 м.д. (рис. 4 Aβ G-O-S ) [9]. Структуры β-арилового эфира считаются преобладающими во всех лигнинах [2], и спектры лигнинов родиолы и серпухи (рис. 4 а и б) демонстрируют четкие и интенсивные характерные сигналы.
Фенилкумарановые фрагменты (рис. 5 В) распространены в гваяцилсирингильных лигнинах (лигнины лиственных) реже, чем в гваяцильных (лигнины хвойных), где их количество составляет 810 на 100 фенилпропановых единиц [11]. Наличие большого количества сирингильных звеньев, с метоксилированным пятым поло-
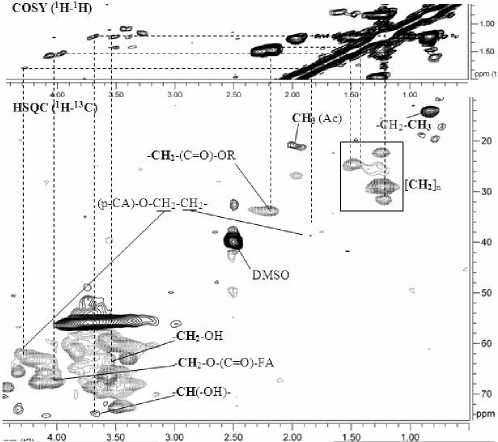
Рис. 6. COSY- и HSQC-спектры ДЛР.
принадлежат боковым цепочкам фенилпропановой единицы, они характерны для атомов углерода насыщенных ациклических структур с длиной цепи 7 и более атомов углерода [11]. Структурообразующими компонентами клеточных стенок растений, построенными из остатков жирных кислот и высших спиртов, являются кутин и суберин [23]. Эти компоненты обычно извлекаются из растения экстракцией нейтральными растворителями в ходе предварительной подготовки сырья для извлечения лигнина, поэтому присутствие жирных кислот и высших спиртов в препарате лигнина может быть либо в виде примеси, либо в виде фрагментов структуры, ковалентно связанных с фенилпропановыми единицами.
В работе [23] по исследованию состава жирных кислот корневищ ряда растений было выявлено, что для родиолы ( Rhodiola pamiroalaica ), как и для остальных, свойственно преобладание жирных кислот с цепочками С 16 и С 18 . На основе данной работы проведено соотнесение сигналов в спектрах лигнинов с фрагментами на примере фрагмента FA (от англ. fatty acids), представленного на рис. 7. Отнесение сигналов показано в табл. 3.
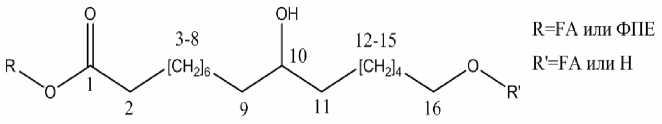
Рис. 7. Фрагмент 10, 16-дигидроксигексадекановой кислоты в составе лигнина (усл. обозн. – FA).
Таблица 3
Отнесение сигналов 1Н и 13С жирных кислот [23]
|
Положение |
Фрагмент |
1 13 С δ, м.д. |
1 Н δ, м.д. |
|
1 |
RO-( C =O)-CH 2 - |
172-175 |
- |
|
2 |
RO-(C=O)- CH 2 - |
34.08 |
2.20 |
|
3-8, 12-15 |
- CH 2 - |
25-32 |
1.2-1.5 |
|
9, 11 |
- CH 2 -CH(OH)- |
37.40 |
1.24 |
|
10 |
- CH (-OH)- |
73.85 |
3.69 |
|
16 |
- CH 2 -OH |
62.80 |
3.63 |
Возможно, что концевые спиртовые группы FA (положение 16 на рис. 7) этерифицированны п -кумаровой кислотой (δ Н /δ Н 4.30/1.80 м.д.; δ Н /δ С 4.30/62.0 м.д.) и аналогичными фрагментами FA (δ Н /δ Н 4.05/1.50 м.д.; δ Н /δ С 4.05/67.5 м.д.). Дополнительным подтверждением является сигнал δ Н /δ С 4.30/167.4 на HMBC-спектре образца ДЛР (рис. 8), регистрирующий дальние протон-углеродные взаимодействия четвертичного углерода п -кумара-тового фрагмента с протонами в 16-й позиции FA (рис. 7). Также на этом HMBC-спектре выявлены корреляционные сигналы, подтверждающие наличие сложноэфирных связей между цепочками FA (δ Н /δ С 4.05/172.5 м.д.). Тип связи фрагментов FA с фенилпропановыми звеньями лигнина родиолы розовой по полученным спектрам, установить не удалось. Причинами могут служить как наложение сигналов, так и сравнительно низкая распространенность связей между FA и лигнином. Однако высока вероятность того, что FA являются фрагментами индивидуального компонента клеточной стенки, оказавшегося связанным с лигнином в ходе выделения препарата, поскольку даже процедура переосаждения лигнина из диоксана в диэтиловый эфир не привела к отделению этого компонента.
Особенностью лигнина серпухи венценосной является наличие в его структуре этоксильных групп. Это предположение основано на корреляционных сигналах на HSQC-спектре ДЛС: δ Н /δ С 1.10/15.0 м.д. (СН 3 ; эта область спектра не представлена), δ Н /δ С 3.4/62.5 м.д. (СН 2 ; рис. 4 а), COSY(не представлен): δ Н /δ Н 1.1/3.4 м.д. Согласно [9], химический сдвиг протонов СН 2 -фрагмента этоксильной группы 3.4 м.д. характерен для этоксильной группы в алифатической цепочке фенилпропановых единиц.
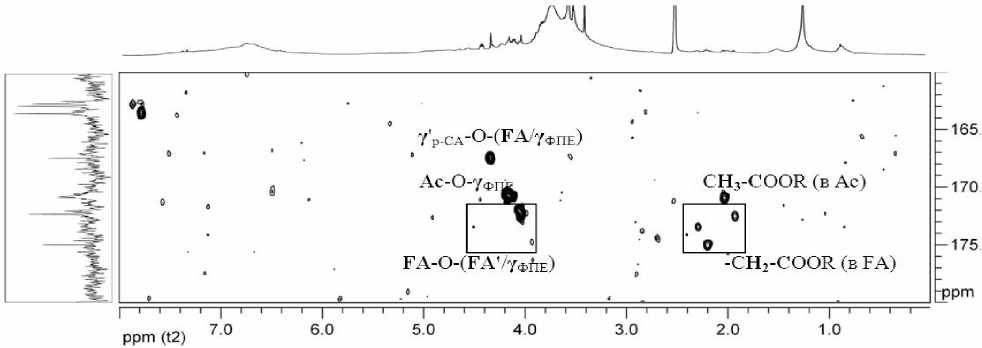
Рис. 8. HMBC-спектр ДЛР область корреляции сигналов атомов сложноэфирных связей.
Заключение
Лигнины, образовавшись в растительной ткани, выполняют разнообразные функции. В зависимости от роли растительной ткани, типа растения и его филогенетического происхождения, эти вещества могут различаться по химическому составу и структуре, но неизменно одно – все они построены из фенилпропановых структурных звеньев, соединенных простыми эфирными и углерод-углеродными связями [24]. Весьма необычно, по сравнению с известными на сегодняшний день лигнинами, выглядит лигнин, выделенный из родиолы розовой. В этом образце не выявлены фенилкумарановые фрагменты, считающиеся характерными для всех лигнинов. В составе этого образца значительную долю занимают длинные насыщенные алифатические цепочки. Предшественниками этого лигнина, помимо трех классических монолигнолов, могут быть кумара-ты кониферилового и синапового спиртов и, возможно, ацетаты этих спиртов. Лигнин серпухи венценосной не содержит сложноэфирных связей и структур дибензодиоксоцина, но его особенность в том, что в его структуре имеются этоксильные группы в боковой цепочке фенилпропановых единиц.
Работа выполнена в рамках Программы Президиума РАН «Создание и совершенствование методов химического анализа и исследования структуры веществ и материалов» (проект № 12-П-3-1024).
Список литературы Изучение химической структуры лигнинов родиолы розовой (Rhodiola rosea L.) и серпухи венценосной (Serratula coronata L.) методом 2D ЯМР-спектроскопии
- Лигнины (структура, свойства и реакции)/Под ред. К. Сарканена, К. Людвига. М.: Лесная пром-сть, 1975. 632 с.
- Карманов А.П. Самоорганизация и структурная организация лигнина. Екатеринбург: УрО РАН, 2004. 270 с.
- Wiegant F., Surinova S., Ytsma E. et al. Plant adaptogens increase lifespan and stress resistance in C. Elegans//Biogerontology. 2009. Vol. 10. № 1. P. 27-42.
- Уфимцев К.Г., Ширшова Т.И., Якимчук А.П., Володин В.В. Гормональное, токсическое и адаптогенное влияние экдистероидов Serratula coronata L. на личинок Ephestia Kiihniella. Zell.//Растительные ресурсы. 2002. Т. 38. №2. С. 29-39.
- Avula B., Wang Y. H., Ali Z., Smillie T. J. et al. RP-HPLC determination of phenylalkanoids and monoterpenoids in Rhodiola rosea and identification by LC-ESI-TOF//Biomed Chromatogr. 2009. Vol.23. № 8. P. 865-872.
- Ангаскиева А.С., Андреева В.Ю., Калинкина Г.И. и др. Исследование химического состава серпухи венценосной, культивируемой в Сибири//Химия растительного сырья. 2003. № 4. С. 47-50.
- Оболенская А.В., Ельницкая З.П., Леонович А.А. Лабораторные работы по химии древесины и целлюлозы. М.: Экология, 1991. 256 с.
- Ralph J., Marita J. M., Ralph S. A. et al. Solutionstate NMR of lignin//AdVances in Lignocellulosics Characterization. 1999. P. 55-108.
- Ralph S.A., Ralph J., Landucci L. NMR database of lignin and cell wall model compounds. Madison, WI, U.S.: Forest Products Laboratory, 2004. (http://ars.usda.gov/Services/docs.htm?docid). 498 p.
- Ralph J. An unusual lignin from kenaf//J. Nat. Prod. 1996. № 59. P. 341-342.
- Калабин Г.А., Каницкая Л.В., Кушнарев Д.Ф. Количественная спектроскопия ЯМР природного органического сырья и продуктов их переработки. М.: Химия, 2000. 408 с.
- Smith D. C. C. Ester groups in lignin//Nature. 1955. Vol. 176. P. 267-268.
- Nakamura Y., Higuchi T. Ester linkage of pcoumaric acid in bamboo lignin. III. Dehydrogenative polymerization of coniferyl p-hydroxybenzoate and coniferyl p-coumarate//Cellul. Chem. Technol. 1978. Vol. 12. P. 209-221.
- Ralph J., Helm, R. F. Lignin/hydroxycinnamic acid/polysaccharide complexes: Synthetic models for regiochemical characterization. In Forage Cell Wall Structure and Digestibility, International Symposium. Madison, WI: ASACSSA-SSSA, 1993. P. 201-246.
- Ralph J., Hatfield R. D., Quideau S. et al. Pathway of p-coumaric acid incorporation into maize lignin as revealed by NMR//J. Am. Chem. Soc. 1994. Vol. 116. Р. 9448-9456.
- Crestini C., Argyropoulos D. S. Structural analysis of wheat straw lignin by quantitative 31P and 2D NMR spectroscopy. The occurrence of ester bonds and R-O-4 substructures//J. Agric. Food Chem. 1997. Vol. 45. Р. 1212-1219.
- Rio J., Rencoret J., Marques G. et al. Highly acylated (acetylated and/or p-coumaroylated) native lignins from diverse herbaceous plants//J. Agric. Food Chem. 2008. Vol. 56. No. 20. P. 9525-9534.
- Ralph J., Lundquist K., Brunow G. et al. Lignins: natural polymers from oxidative coupling of 4-hydroxyphenylpropanoids//Phytochem. 2004. No 3. P. 29-60.
- Landucci L. L., Deka G. C., Roy D. N. A. 13C NMR study of milled wood lignins from hybrid Salix clones//Holzforschung. 1992. Vol. 46. Р. 505-511.
- Sun R. C., Fang J. M., Goodwin A. et al. Fractionation and characterization of ball-milled and enzyme lignins from abaca fibre//J. Sci. Food Agric. 1999. Vol. 79. Р. 1091-1098.
- Lu F., Ralph J. Detection and determination of p-coumaraloylated units in lignin//J. Agric. Food Chem. 1999. Vol. 47. Р. 1985-1992.
- Далимова Г.Н., Абдуазимов Х.А. Лигнины травянистых растений//Химия природных соединений. 1994. № 2. С. 160-177.
- Tsydendambaev V.D., Christie W.W., Brechany E.Y., Vereshchagin A.G. Identification of unusual fatty acids of four alpine plant species from the Pamirs//Phytochemistry. 2004. Vol. 65. P. 2695-2703.
- Резников В.М., Михасева М.Ф. О филогении лигнина//Химия древесины. 1982. № 6. С. 77-87.


