Изучение эффективности комбинации стереотаксической лучевой терапии и иммунотерапии у пациентов с метастатическими солидными опухолями
Автор: Зозуля А.Ю., Мусаелян А.А., Новиков С.Н., Орлов С.В., Одинцова С.В., Соловьева Е.П., Киндялова Л.В., Арсеньев А.И., Антипов Ф.Е., Гирдюк Д.В., Нехаева Т.Л.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 5 т.24, 2025 года.
Бесплатный доступ
Цель исследования – изучить возможности совместного применения стереотаксической лучевой терапии (СТЛТ) и иммунотерапии у пациентов с генерализованными злокачественными новообразованиями. Материал и методы. У 20 больных распространенными злокачественными новообразованиями с резистентностью к проводимой системной терапии осуществлялась попытка индукции/ реиндукции иммунного ответа с помощью комбинации СТЛТ на один из опухолевых очагов и системной терапии ингибиторами контрольных точек иммунного ответа (ИКТИ). СТЛТ осуществлялась в режиме 3 фракций по 8 Гр. Оценка выживаемости без прогрессирования (ВБП), общей выживаемости (ОВ), локального контроля осуществлялась с момента окончания облучения. Частота объективных ответов определялась через 12 нед после завершения СТЛТ с помощью критериев iRECIST. Статистический анализ проводился с помощью программ Microsoft Excel 2010 и R v. 3.6.2. Анализ выживаемости выполнялся с использованием метода Каплана–Майера. Результаты. Частота объективных ответов через 12 нед после окончания СТЛТ составила 15 %; 3и 6-месячный локальный контроль – 75 и 44,4 % соответственно. Медиана ВБП достигла 4 мес, однолетняя ОВ – 60,5 %. Заключение. Полученные показатели ВБП позволяют предположить, что даже в прогностически крайне неблагоприятной группе больных комбинация СТЛТ и ИКТИ в ряде случаев позволяет достигнуть ответа на терапию.
Метастатические опухоли, стереотаксическая лучевая терапия (СТЛТ), иммунотерапия
Короткий адрес: https://sciup.org/140312760
IDR: 140312760 | УДК: 616-006.04-08:615.849.1:615.37 | DOI: 10.21294/1814-4861-2025-24-5-17-26
Текст научной статьи Изучение эффективности комбинации стереотаксической лучевой терапии и иммунотерапии у пациентов с метастатическими солидными опухолями
Purpose: to study the combination of immunotherapy and stereotactic body radiation therapy (SBRT) in patients with metastatic solid tumors. Material and Methods. The efficacy of a combination of SBRT and systemic therapy with immune checkpoint inhibitors was assessed in 20 patients with metastatic solid tumors resistant to systemic therapy. SBRT was administered in 3 fractions of 8 Gy. Progression-free survival (PFS), overall survival (OS), and local control were assessed from the end of irradiation. The objective response rate was determined 12 weeks after completion of STRT using iRECIST criteria. Statistical analysis was performed using Microsoft Excel 2010 and R v. 3.6.2. Survival analysis was performed using the Kaplan-Mayer method. Results. The objective response rate at 12 weeks after SBRT was 15 %. The 3- and 6-month local control rates were 75 and 44.4 %, respectively. The median PFS reached 4 months, and the 1-year OS rate was 60.5 %. Conclusion. Progression-free survival rates obtained in our study suggest that the combination of SBRT and immune checkpoint inhibitors may provide a treatment response even in patients with extremely unfavorable prognosis.
Активное применение ингибиторов контрольных точек иммунного ответа (ИКТИ) позволило достигнуть существенного увеличения показателя общей выживаемости при злокачественных новообразованиях различных локализаций, в первую очередь у больных немелкоклеточным раком легкого и меланомой [1, 2]. Однако большинство пациентов с распространенными солидными новообразованиями, получающих ИКТИ, имеют первичную резистентность к лечению, а у больных, которые отвечают на терапию, отмечается приобретенная резистентность, которая приводит к неэффективности дальнейшего применения ИКТИ [3–5].
Множественные пути уклонения опухоли от иммунного ответа лежат в основе как первичной, так и приобретенной устойчивости к ИКТИ. Комбинированные подходы с другими ИКТИ, химиотерапией и/или таргетной терапией позволили значительно увеличить эффективность терапии ИКТИ при ряде солидных опухолей [6]. Одним из таких подходов в преодолении механизма ускользания опухоли от иммунного ответа является сочетание лучевой и иммунотерапии [7].
Стереотаксическая лучевая терапия (СТЛТ) представляет собой метод дистанционной луче- вой терапии, обеспечивающий возможность подведения высокой тумороцидной дозы к мишени с субмиллиметровой точностью за одну или несколько фракций. Важными особенностями СТЛТ являются значительное необратимое повреждение облученной опухоли, существенное снижение радиационной нагрузки на окружающие нормальные ткани и низкая гематологическая токсичность [8]. Стереотаксическая лучевая терапия может индуцировать системные эффекты за счет интенсивного повреждения опухолевой ткани, а именно массивное высвобождение ассоциированных с опухолью антигенов, активацию противоопухолевого иммунитета, увеличение инфильтрации опухоли Т-клетками, повышение уровня T-киллеров, T-хелперов, снижение уровня Т-регуляторных клеток, изменение микроокружения опухоли [9, 10]. В клинических исследованиях показано, что СТЛТ не только вызывает выраженный локальный ответ со стороны облученных очагов, но и способствует индукции системного противоопухолевого ответа, вероятно, опосредованного иммунными механизмами [11].
Особого внимания заслуживают сообщения о том, что в эксперименте у животных с так называемым синдромом истощения иммунной системы, которые после первичного ответа на терапию ИКТИ демонстрируют признаки прогрессирования опухолевого процесса, облучение одного или нескольких метастатических очагов может «восстановить» эффективность проводимой иммунной терапии [12]. К сожалению, в клинической практике вопрос наличия аддитивного или супераддитивного эффекта при совместном использовании СТЛТ и терапии ИКТИ остается малоизученным.
По этой причине нами инициировано проспективное исследование, посвященное изучению возможностей совместного применения СТЛТ и терапии ИКТИ у больных с генерализованными злокачественными новообразованиями. В представленной работе проанализированы промежуточные результаты совместного использования ИКТИ и СТЛТ.
Цель исследования – изучить возможности совместного применения стереотаксической лучевой терапии (СТЛТ) и иммунотерапии у пациентов с генерализованными злокачественными новообразованиями.
Материал и методы
На момент проведения промежуточного анализа в исследование включено 20 пациентов (7 женщин и 13 мужчин) с метастатическими формами злокачественных новообразований различных локализаций; средний возраст больных составил 61,7 года [95 % ДИ 56,9–66,5], клинико-морфологические характеристики представлены в табл. 1.
Основные критерии включения в исследование: гистологически подтвержденный диагноз солидной опухоли с инструментальными признаками метастатического процесса; доступная локализация как минимум одного опухолевого очага для выполнения СТЛТ; проведение терапии с использованием ИКТИ; статус пациента по шкале ECOG<2. Критериями исключения стали анамнестические сведения и данные лабораторных исследований, свидетельствующие об имеющейся гематологической патологии (количество нейтрофилов <1,5; количество тромбоцитов <100), наличие сопутствующего заболевания в стадии декомпенсации.
Все пациенты, включенные в протокол, после подписания добровольного информированного согласия проходили лучевое лечение в отделении радиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России. Системную лекарственную терапию больные получали в условиях ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. ак. И.П. Павлова» Минздрава России и ООО «Ев-роСитиКлиник». У 20 (85 %) больных терапия ИКТИ уже проводилась до этапа выполнения СТЛТ. У 2 (10 %) больных СТЛТ в сочетании с ИКТИ инициировалась сразу после установления метастатического характера опухолевого процесса, в 8 (40 %) случаях СТЛТ выполнялась при увеличении размеров очагов в процессе лечения в рамках стабилизации, у оставшихся 10 (50 %) пациентов попытка проведения СТЛТ и применения ИКТИ осуществлялась на фоне отмеченного прогрессирования заболевания. У 3 (15 %) пациентов СТЛТ проводилась вместе с началом терапии ИКТИ, в 17 (85 %) случаях СТЛТ использовалась при наличии прогрессирования заболевания на фоне проводимой иммунотерапии. В соответствии с первичной локализацией злокачественных новообразований пациенты, включенные в исследование, распределялись следующим образом (табл. 2): немелкоклеточный рак легкого (n=11), мелкоклеточный рак легкого (n=3), меланома (n=3), колоректальный рак (n=3).
Стереотаксическая лучевая терапия выполнялась на линейном ускорителе электронов «Novalis Tx» или «TrueBeam» (Varian Medical System, США). Предлучевая топометрическая подготовка осуществлялась на КТ-симуляторе «Somatom Definition AS» (Siemens, Германия) с использованием стандартных устройств для иммобилизации пациента с синхронизацией по дыханию (при необходимости). Для установления точных границ облучаемого очага, в зависимости от его локализации, использовались диагностические КТ, ПЭТ-КТ и МРТ изображения. Планирование СТЛТ в режиме ротационного объемно-модулированного облучения (VMAT) осуществлялось с помощью планирующей системы Eclipse, версия 4.0. Во всех случаях СТЛТ выполнялась в режиме 3 фракций с разовой дозой 8 Гр (СОД 24 Гр). Следует отметить, что этот режим фракционирования дозы рассматривается как субоптимальный с точки зрения локального контроля над облученной опухолью – суммарная очаговая доза, эквивалентная облучению в режиме классического фракционирования дозы (EQD) для α/β-10, составила 36 Гр, что было существенно ниже традиционных тумороцидных доз (EQD (для α/β-10) – 100 Гр и выше), используемых при СТЛТ. Однако в настоящее время режим 3 фракции по 8 Гр рассматривается как наиболее «иммуногенный режим облучения» и представляется наиболее перспективным с точки зрения потенцирования эффектов терапии ИКТИ [13]. В связи с тем, что в представленном исследовании СТЛТ рассматривалась как инструмент усиления ответа на терапию ИКТИ, нами не облучались все выявляемые метастатические очаги, а проводилось облучение не более 2 опухолевых очагов (зона первичной опухоли/метастаз), обладающих наибольшим «иммуногенным» потенциалом [14].
В соответствии с целями исследования анализировались показатели выживаемости без прогрессирования (ВБП), общей выживаемости (ОВ) и частоты локального контроля через 3 и 6 мес после завершения СТЛТ. Расчет показателей вы-
|
Клинико-морфологическая характеристика пациентов Clinical and morphological characteristics of patients |
Таблица 1/table 1 |
||||
|
№ |
X R О a |
aj ад co О m |
Первичная локализация/ Primary localization |
Гистология (PD-L1, молекулярный профиль – при наличии)/ Histology (PD-L1, molecular profile – if available) |
Кол-во линий системной терапии до СТЛТ/ Number of lines of systemic therapy before SBRT |
|
1 |
Ж/ F |
50 |
Сосудистая оболочка глаза/ Choroid |
Смешанная веретеноклеточная пигментная меланома/ Mixed spindle cell pigmented melanoma |
1 |
|
2 |
Ж/ F |
58 |
Легкое/Lung |
Аденокарцинома легкого, PD-L1: TPS 90 %/ Adenocarcinoma, PD-L1: TPS 90 % |
5 |
|
3 |
М/ М |
61 |
Легкое/Lung |
Плоскоклеточная карцинома, PD-L1: TPS 10 %/ Squamous cell carcinoma, PD-L1: TPS 10 % |
2 |
|
4 |
Ж/ F |
57 |
Сигмовидная кишка/ Sigmoid colon |
Умеренно дифференцированная аденокарцинома/ Moderately differentiated adenocarcinoma |
4 |
|
5 |
М/ М |
74 |
Легкое/Lung |
Плоскоклеточная карцинома/Squamous cell carcinoma |
0 |
|
6 |
Ж/ F |
43 |
Кожа/Skin |
Невоклеточный тип меланомы кожи, BRAF-/Melanoma, BRAF- |
1 |
|
7 |
М/ М |
79 |
Легкое/Lung |
Низкодифференцированная плоскоклеточная карцинома/ Poorly differentiated squamous cell carcinoma |
0 |
|
8 |
М/ М |
66 |
Легкое/Lung |
Мелкоклеточная карцинома/Small-cell carcinoma |
1 |
|
9 |
М/ М |
82 |
Легкое/Lung |
Немелкоклеточная крупноклеточная карцинома, PD-L1: TPS 55 %/ Non-small-cell carcinoma, PD-L1: TPS 55 % |
4 |
|
10 |
Ж/ F |
67 |
Легкое/Lung |
Мелкоклеточная карцинома/Small-cell carcinoma |
6 |
|
11 |
М/ М |
71 |
Легкое/Lung |
Инвазивная муцинозная аденокарцинома легкого, KRAS+/ Mucinous adenocarcinoma, KRAS+ |
2 |
|
12 |
М/ М |
55 |
Легкое/Lung |
Низкодифференцированная аденокарцинома, PD-L1+; КRАS+; АLК, ROS-1, EGFR – не обнаружены/ Poorly-differentiated adenocarcinoma, PD-L1+; КRАS+; АLК, ROS-1, EGFR – non detected |
2 |
|
13 |
М/ М |
55 |
Легкое/Lung |
Аденокарцинома солидно-железистого строения, PD-L1 низкий; EGFR, ALK, ROS1, RET, NTRK, MET, HER2, KRAS, BRAF – не обнаружены/ Adenocarcinoma, PD-L1 –low; EGFR, ALK, ROS1, RET, NTRK, MET, HER2, KRAS, BRAF – non detected |
2 |
|
14 |
М/ М |
54 |
Прямая кишка/ Rectum |
Аденокарцинома кишки низкой степени злокачественности/ Adenocarcinoma |
5 |
|
15 |
М/ М |
62 |
Легкое/Lung |
Мелкоклеточная карцинома/Small-cell carcinoma |
5 |
|
16 |
М/ М |
55 |
Легкое/Lung |
Аденокарцинома, PD-L1: TPS 10 %, HER2 ex20ins+; ROS1, ALK, EGFR, KRAS – не обнаружены/ Adenocarcinoma, PD-L1: TPS 10 %, HER2 ex20ins+; ROS1, ALK, EGFR, KRAS – non detected |
2 |
|
17 |
Ж/ F |
60 |
Легкое/Lung |
Плоскоклеточная карцинома/Squamous cell carcinoma |
4 |
|
18 |
М/ М |
47 |
Меланома/ Melanoma |
Эпителиоидноклеточная беспигментная меланома/Epithelioid cell melanoma. |
1 |
|
19 |
М/ М |
61 |
Легкое/Lung |
Плоскоклеточная карцинома, PD-L1: TPS<1 %/ Squamous cell carcinoma, PD-L1: TPS<1 % |
1 |
|
20 |
Ж/ F |
37 |
Сигмовидная кишка/ Sigmoid colon |
Аденокарцинома кишечного типа low grade, KRAS+; MSI, BRAF, NRAS – не обнаружены/ Adenocarcinoma low grade, KRAS+; MSI, BRAF, NRAS – non detected |
2 |
Примечание: таблица составлена авторами.
Note: created by the authors.
Таблица 2/table 2
Распределение пациентов по первичной локализации, облучаемому очагу и проведенной системной терапии
Characteristics of patients by primary localization, irradiated tumor and systemic therapy performed
|
Первичная локализация/ Primary localization |
Кол-во пациентов/ облученных очагов/ Number of patients/ irradiated foci |
Кол-во линий лекарственной терапии до СТЛТ (медиана)/ Lines of systemic therapy before SBRT |
Локализация облученного очага/Localization of the irradiated focus |
|||||
|
К |
g § R |
\ и |
СЛ о ° £ ffl |
сл |
12 к |
|||
|
Немелкоклеточный рак легкого/ Non-small cell lung cancer |
11/13 |
2 |
1 |
9 |
0 |
1 |
1 |
1 |
|
Мелкоклеточный рак легкого/ Small cell lung cancer |
3/3 |
5 |
1 (очаг облучен частично)/ 1 (partially irradiated) |
1 |
1 |
0 |
0 |
0 |
|
Меланома/ Melanoma |
3/3 |
1 |
1 (очаг облучен частично)/ 1 (partially irradiated) |
0 |
2 |
0 |
0 |
0 |
|
Колоректальный рак/ Colorectal cancer |
3/4 |
4 |
3 |
0 |
0 |
0 |
1 |
0 |
|
Всего/ Total 20/23 Примечание: таблица составлена авторами. |
3 |
6 |
10 |
3 |
1 |
2 |
1 |
|
Note: created by the authors.
живаемости осуществлялся с момента окончания СТЛТ. Кроме того, через 12 нед после облучения оценивалась частота объективных ответов на лечение. Частота объективных ответов (процент пациентов, у которых достигнут частичный или полный ответ на терапию в течение определенного периода времени) оценивалась с помощью iRECIST. Систематизацию, статистический анализ и визуализацию данных проводили с помощью программ Microsoft Excel 2010 и R v. 3.6.2. Анализ выживаемости выполнялся с использованием метода Каплана–Майера.
Результаты
Выживаемость без прогрессирования заболевания рассматривалась как основной показатель эффективности проводимой терапии. В исследуемой группе медиана ВБП составила 4 мес (рис. 1), через 6 мес наблюдения у 6 из 19 пациентов (1 случай – цензурируемый) не зафиксировано признаков прогрессирования опухолевого процесса: 6-месячная ВБП – 35 % [95 % ДИ 19,3–63,6 %]). При этом 9-месячная ВБП снизилась до 11,7 % [95 % ДИ 3,3–41,9 %]. При анализе показателей общей выживаемости медиана не была достигнута (рис. 2).
Учитывая небольшой период наблюдения (медиана наблюдения – 6,5 мес), проанализированы краткосрочные результаты проведенной терапии. В общей группе 14 из 20 больных прожили 6 и более мес после окончания лучевого лечения, в 3 случаях время наблюдения оказалось меньше 6 мес (цензурированные больные), еще 3 больных погибли в первое полугодие после окончания СТЛТ. Таким образом, 6-месячная ОВ достигла 78,4 % [95 % ДИ 61,6–99,7 %], 1-летняя актуриальная ОВ составила 60,5 % [95 % ДИ 39,0–93,8 %].
Несмотря на то, что СОД, подводимая на опухолевые очаги, была существенно ниже тумороцид-ной (EQD – 36 Гр по сравнению со стандартным EQD – 100 Гр и выше), через 3 мес после завершения облучения локальный контроль сохранялся у 15 (75 %) из 20 пациентов. Однако через 6 мес наблюдения локальный контроль сохранялся только у 8 (44,4 %) из 18 облученных больных, 2 пациента не достигли 6-месячного срока наблюдения. При этом следует отметить, что в 2 случаях в связи с большим размером метастатических очагов (V>90 см³), наличием обширной зоны некроза при проведении СТЛТ с целью индукции иммунного ответа облучалась часть метастатического очага, накапливающая контрастный препарат и расположенная на периферии опухоли. Обращает на себя внимание, что у 14 (70 %) из 20 пациентов, включенных в промежуточный анализ, СТЛТ выполнялась на фоне многоочагового прогрессиро-
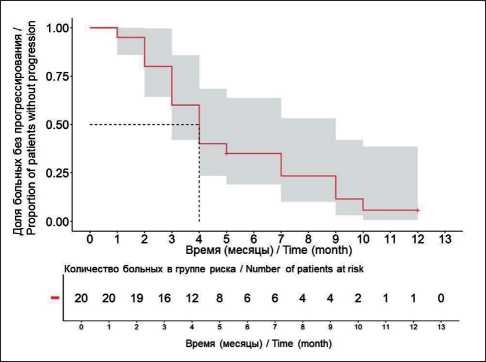
Рис. 1. График выживаемости без прогрессирования. Примечание: рисунок выполнен авторами Fig. 1. Progression-free survival graph.
Note: created by the authors
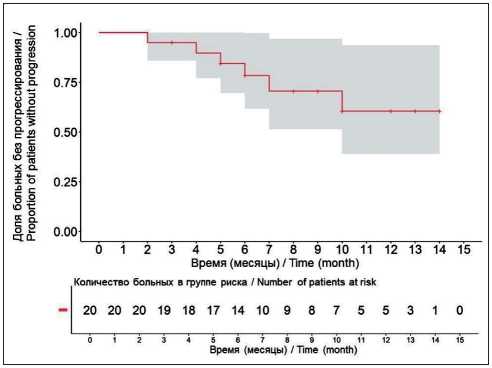
Рис. 2. График общей выживаемости.
Примечание: рисунок выполнен авторами Fig. 2. Overall survival graph. Note: created by the authors
вания опухолевого процесса, и облученный очаг был не единственным проявлением заболевания. Как правило, в этих случаях облучению подвергались наиболее массивные и/или быстро растущие опухолевые очаги.
Через 12 нед после облучения частичный ответ наблюдался у 3 (15 %) больных: у 1 пациента с меланомой кожи, которому проводилось облучение пораженных аксиллярных лимфоузлов, у больного мелкоклеточным раком легкого, которому облучали метастазы в лимфоузлы средостения, и у больной колоректальным раком (СТЛТ проводилась на метастаз в перивезикальной клетчатке уретеро-вагинальной области). У всех 20 больных не зафиксировано постлучевых осложнений после проведенной СТЛТ, что позволяет говорить о безопасности метода.
Обсуждение
В последние годы появляется все больше данных о том, что комбинация ингибиторов контрольных точек иммунного ответа и лучевой терапии может привести к повышению эффективности системного лечения. Ранее в проведенном нами исследовании было показано, что использование СТЛТ у пациентов с метастатическими формами солидных опухолей ассоциировано с активацией Т-клеточного иммунного ответа, выражающейся в виде увеличения количества Т-лимфоцитов (CD3+CD19-); Т-хелперов (CD3+CD4+); активированных Т-хелперов (CD3+CD4+HLA-DR+) и активированных цитотоксических Т-лимфоцитов (CD3+СD8+HLA-DR+). При этом наиболее выраженные и значимые изменения показателей иммунного статуса были отмечены через 3–4 нед после завершения СТЛТ [15].
В настоящее время активно изучаются системные эффекты СТЛТ, в первую очередь ее влияние на состояние иммунной системы и противоопухоле- вый иммунитет. СТЛТ потенцирует эффективность терапии ИКТИ и в ряде клинических ситуаций способствует преодолению ускользания опухоли от иммунного ответа у больных после длительного приема ИКТИ [16]. Вместе с тем, клинические доказательства эффективности совместного применения СТЛТ и ИКТИ немногочисленны, отсутствуют четкие представления об оптимальных режимах СТЛТ при ее использовании для потенцирования действия ИКТИ, оптимальном порядке сочетания терапии ИКТИ и СТЛТ [13].
Однако отдельные публикации, посвященные указанным вопросам, позволяют предположить наиболее перспективные направления исследований в этой облаcти. В доклинических исследованиях сочетания ИКТИ и радиотерапии на мышах обнаружено, что иммуномодулирующий эффект гипофракционированной лучевой терапии был более выраженным по сравнению с однократной высокой абляционной дозой облучения [9]. E.B. Golden et al. и M.A. Postow et al. отмечают, что абскопальные ответы у пациентов с распространенной меланомой и НМРЛ зарегистрированы у пациентов, получавших ИКТИ (анти-CTLA4) и облучение в разовой дозе менее 10 Гр в количестве 3–5 фракций [17, 18]. D. Schaue et al. указывают, что «для облегчения перекрестной презентации антигена» при облучении опухоли необходимо использовать разовую дозу от 7,5 Гр или выше [19].
Особого внимания заслуживает проспективное исследование PEMBRO-RT, в котором у онкологических больных сравнивалась противоопухолевая эффективность пембролизумаба в режиме монотерапии (контрольная группа) с комбинацией СТЛТ на одиночный очаг в режиме 3 фракции по 8 Гр, которые выполнялись за неделю до начала терапии пембролизумабом (эскпериментальная группа) [20]. В экспериментальной группе частота объективных ответов на 12-й нед составила 36 %, тогда как в контрольной группе этот показатель равнялся 18 %. Кроме того, результаты исследования свидетельствуют о значимом преимуществе в выживаемости без прогрессирования (медиана ВБП в контрольной группе – 1,9 мес, в экспериментальной – 6,6 мес) и общей выживаемости (медиана ОВ в контрольной группе – 7,6 мес, в экспериментальной – 15,9 мес) у пациентов с метастатическим немелкоклеточным раком легкого, получающих СТЛТ и иммунотерапию. Исследователями выбран режим фракционирования 3 фракции × 8 Гр на опухолевый очаг из-за возможности реализации Т-клеточного противоопухолевого иммунного ответа с минимальным потенциалом развития токсических эффектов, вызванных добавлением лучевой терапии [20].
В проспективном многоцентровом рандомизированном исследовании II фазы CHEERS [21] проводилось сравнение эффективности и безопасности комбинации СТЛТ с ИКТИ у 99 пациентов с олигометастатическими солидными опухолями (метастатическая меланома, почечно-клеточный рак, уротелиальный рак, плоскоклеточный рак головы и шеи, немелкоклеточный рак легкого). Пациенты были рандомизированы (1:1) для иммунотерапии анти-PD-1 или анти-PD-1 препаратами в соответствии со стандартом лечения (контрольная группа, n=52) или в сочетании со стереотаксической лучевой терапией на метастатические очаги в режиме 3 фракции по 8 Гр, максимум на 3 очага, до второго или третьего цикла иммунотерапии, в зависимости от частоты введения (экспериментальная группа, n=47). Первичной конечной точкой была выживаемость без прогрессирования (ВБП); вторичные конечные точки включали общую выживаемость (ОВ), частоту объективных ответов, частоту местного контроля и токсические эффекты. Улучшение ОВ или ВБП после добавления субаблативной СТЛТ к ИКТИ у исследуемых пациентов не отмечено, хотя тенденция к улучшению отдаленных результатов прослеживалась. Медиана ВБП при иммунотерапии составила 2,8 мес (95 % ДИ, 2,5–8,4) против 4,4 мес (95 % ДИ, 2,8–7,8) при добавлении лучевой терапии (HR, 0,95; 95 % ДИ, 0,58–1,53; р=0,82). Медиана ОВ составила 11,0 (95 % ДИ, 9,0 – не достигнуто) и 14,3 (95 % ДИ, 11,0 – не достигнуто) мес соответственно (ОР 0,82; 95 % ДИ 0,48–1,41; р=0,47). Исследователи также сообщили о незначительной разнице в частоте объективных ответов – 22 и 27 % соответственно (р=0,56).
Отдельного внимания заслуживает исследование A. Sharabi et al., результаты которого


