Изучение кинетических особенностей синтеза анилина на Ni-содержащем сверхсшитом полистироле
Автор: Мушинский Лев Сергеевич, Навроцкая Ирина Викторовна, Бровко Роман Викторович, Долуда Валентин Юрьевич
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Химические науки
Статья в выпуске: 4 т.6, 2020 года.
Бесплатный доступ
В работе представлено исследование кинетических закономерностей каталитического гидрировании нитробензола с образованием анилина в присутствии Ni-содержащего катализатора на основе сверхсшитого полистирола. Гидрирование анилина является сложным многостадийным процессом сопровождающимся образованием большого количества как промежуточных, так и побочных продуктов, включая азобензол, азоксибензол, нитрозобензол, фенилгидроксиламин и т. п. В связи с чем изучение кинетики этого процесса является важной научно-технической задачей необходимой для повышения выхода целевого продукта - анилина. Реакцию гидрирования нитробензола проводили в шестиячеечном реакторе высокого давления Parr instruments, Series 5000. Анализ продуктов осуществлялся хроматографический методом с использованием газового хроматографа Кристаллюкс-4000М (Россия, Мета-Хром). Было исследовано влияние температуры, давления, концентрации катализатора, выбраны оптимальные условия проведения реакции, обеспечивающие максимальный выход анилина...
Нитробензол, анилин, гидрирование, кинетика, сверхсшитый полистирол
Короткий адрес: https://sciup.org/14116206
IDR: 14116206 | УДК: 544.47 | DOI: 10.33619/2414-2948/53/02
Текст научной статьи Изучение кинетических особенностей синтеза анилина на Ni-содержащем сверхсшитом полистироле
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 544.47
Анилин является важным продуктом органического синтеза, широко использующимся в производстве анилинформальдегидных смол, добавок к резине, красителей, присадок к моторным топливам и маслам, а также фармацевтических препаратов [1–5]. В настоящее время мировое производство анилина достигло 8 млн т/год при этом к 2027 г. планируется рост производства до 10 млн т/год [1–3], что может способствовать разработке новых более эффективных технических решений в синтезе анилина.
Известны различные способы получения анилина, из которых необходимо отметить каталитическое гидрирование нитробензола (НБ) с использованием никеля Ренея [1–5] и некаталитическое гидрирование нитробензола при кислотном растворении металлов.
Синтез с использованием никеля Ренея разнообразен по условиям проведения процесса. Основными достоинствами следует указать достаточно высокий выход анилина – 70–93% [6–7], возможность его восстановление после дезактивации и не высокая стоимость по сравнению с использованием металлов платиновой группы. Недостатком метода является то, что катализатор готовится непосредственно перед синтезом из сплава никеля и алюминия, изготовление которого в лабораторных условиях невозможно. Также, данный катализатор пирофорен при контакте с воздухом и дезактивируется при многократном использовании, а также в кислой, щелочной и водной среде.
Гидрирование с использованием катализатора на основе меди является одним из самых распространенных в промышленности. Достоинствами метода являются возможность восстановления после нескольких циклов использования, а также доступность по сравнению с металлами платиновой группы. Из недостатков можно отметить различие диффузии молекул водорода и нитробензола во внутренние части зерен катализатора, что негативно сказывается на выходе продукта и более быстрой дезактивации катализатора [8–10].
На основании изученных данных можно сделать вывод о необходимости модернизации технологии синтеза анилина (Рисунок 1), которая требует улучшения катализатора, подбора параметров реакции для получения лучших значений селективности и конверсии и изучения кинетических особенностей получения анилина. Последовательность протекающих в процессе гидрирования реакций (Рисунок 1) определяет большое количество как промежуточных, так и побочных продуктов, наличие которых отрицательно влияет на выход целевого продукта анилина.
O
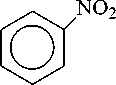
нитробензол
[Cat] H 2
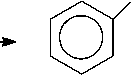
нитрозобензол
NO [Cat]
H 2
NN
азоксибензол
[Cat] H 2
NN
[Cat] H 2
[Cat] H 2 т
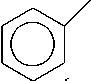
азобензол
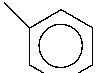
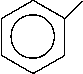
NHOH
фенилгидроксиламин
[Cat]
---►
H 2
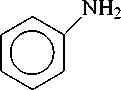
анилин
[Cat]
-<-------
H 2
NH NH
гидразобензол
Рисунок 1. Каталитическое гидрирование нитробензола.
Материал и методы исследования
Каталитическое гидрирование нитробензола проводилось на установке Parr Series 5000 Multiple Reactor System (Рисунок 2).
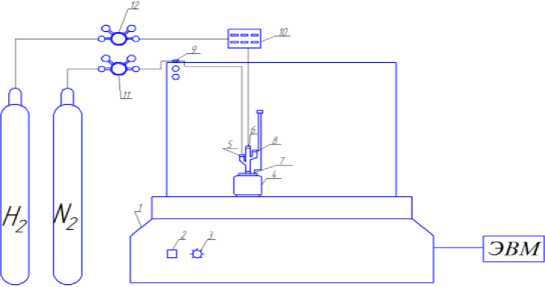
Рисунок 2. Реактор Multiple Reactor System (MRS) Series 5000: 1 — основной блок; 2 — тумблер питания; 3 — ручка регулирования частоты оборотов мешалок в «ячейках»; 4 — «ячейки» реактора; 5 — клапан для продувки реакторов азотом; 6 — клапан подачи водорода и отбора проб; 7 — термопара, 8 — манометр; 9 — клапан регулирования подачи азота; 10 — клапан регулирования подачи водорода; 11–12 — редукторы давления газов, подаваемых в реактор.
Она состоит из стального термостарируемого реактора, имеющего штуцеры для продувки, подачи инертного газа и отбора проб. Перемешивание производится магнитной мешалкой, приводимой в движение электродвигателем (максимальное число оборотов в минуту — 1600). Контроль за давлением производился с помощью датчика давления. Термостатирование реактора осуществляется программируемым нагревательным элементом. Точность поддержания температуры составляет 0,1 ° С.
Для исследования области в которой протекает реакция были проведены предварительные эксперименты при варьировании температуры от 90 до 160 ̊С, начальной концентрацией нитробензола (С 0 ) от 0,15 до 0,94 моль/л, при оптимальной концентрации катализатора 0,085–0,342 моль(Ni)/л и давлении от 1 до 7 МПа.
Стандартный эксперимент проводили следующим образом. Колбу с навесками катализатора, нитробензола и метилового спирта продували 3 раза 100 мл азота под давлением от 1 до 7 МПа, затем нагревали до необходимой температуры в атмосфере азота и 3 раза продували водородом. Гидрирование нитробензола в среде метилового спирта осуществлялось в следующих условиях: масса катализатора (25 мас.% Ni на сверхсшитом полистироле) от 0,1 г до 0,4 г., время реакции 60 минут, температура от 90 до 160 °С, частота вращения мешалки 1100 об/мин.
Формулы, используемые при расчетах представлены ниже (1) и (2).
Конверсия:
(1) ' ■Ициков '
Селективность:
(2) ^ПШИ АН+^ПБ
Анализ продуктов проводили методом газовой хроматографии с использованием газового хроматографа Кристаллюкс-4000М (Россия, Мета-Хром), оснащенного детекторами ПИД и ДТП последовательно подключенными.
Результаты и обсуждение
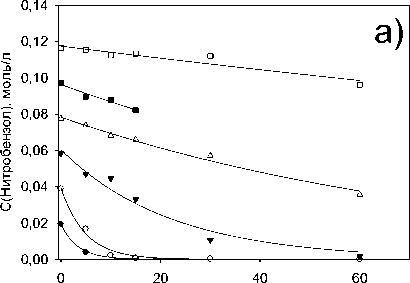
Исследование влияния начальной концентрации нитробензола на скорость его трансформации представлено на Рисунке 3. Уменьшение начальной концентрации нитробензола (Рисунок 3а) приводит к пропорциональному снижению скорости. Увеличение соотношения катализатора к нитробензолу с 0,2 до 0,6 кг(Кат)/кг(НБ) приводит к линейному росту скорости трансформации нитробензола с 0,0002 кг(НБ)/(кг(Кат)*с) до 0,0028 кг(НБ)/(кг(Кат)*с) (Рисунок 3б), дальнейшее увеличение соотношения концентрации катализатора к концентрации нитробензола до 1,2 кг(Кат)/кг(НБ) приводит к стабилизации скорости трансформации нитробензола на уровне 0,003 кг(НБ)/(кг(Кат)*с).
Время, мин
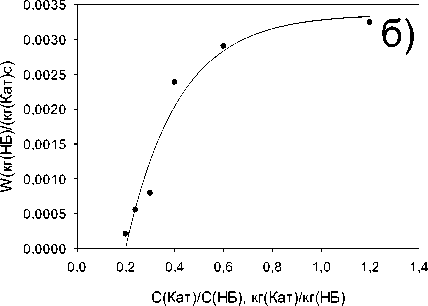
Рисунок 3. Влияние а) начальной концентрации нитробензола на скорость гидрирования нитробензола б) соотношения концентрации катализатора к нитробензолу на скорость гидрирования нитробензола (t=120 °C, p(H2)=23,5 атм, с(Ni-СПС)=2 г/л, с(Ni)=0,007 моль/л).
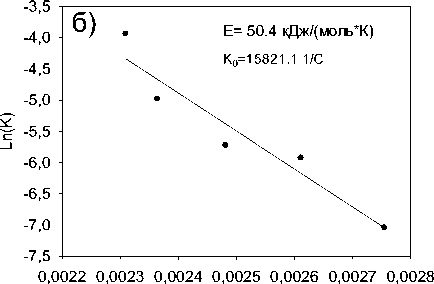
Результаты исследования влияния температуры проведения процесса гидрирования нитробензола на скорость его трансформации приведены на Рисунке 4а. Увеличение температуры проведения реакции с 90 до 160 °С способствует значительному росту скорости трансформации нитробензола. Построение зависимости константы скорости реакции трансформации нитробензола от температуры в координатах уравнения Аррениуса (Рисунок 4б) позволило рассчитать энергию активации процесса, которая составила 50,4 кДж/моль и предэкспоненциальный множитель, который составил 15821,1 1/с.
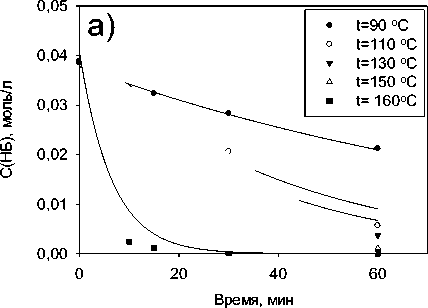
Рисунок 4. Влияние а) Температуры на скорость гидрирования нитробензола; б) графическое выражение уравнения Аррениуса для реакции гидрирования нитробензола до анилина (t=90–160 °C, p(H2)=23,5 атм, с(Ni-СПС)=2 г/л, с(Ni)=0,007 моль/л).
1/T [1/K]
Значения энергии активации процесса гидрирования нитробензола близко к данным полученным для реакции проводимой с использованием промышленного катализатора никеля Ренея или нанесенного на оксид алюминия никеля (50–54 кДж/моль), что указывает на одинаковый механизм гидрирования нитробензола [3, 6, 8].
Наиболее часто процесс гидрирования нитробензола описывают с использованием механизма Ленгмюра-Хиншельвуда [3], включающего в себя стадии адсорбции субстратов на активных центрах и поверхностную реакцию, спиловер реагентов по поверхности катализатора и десорбцию (Уравнения 3–6) продукта.
НБ+[Ац]о [НБ-Ац](3)
Н2+[Ац] ^ [Н2 - Ац](4)
[НБ — Ац] + [Н2 — Ац] -» [Ан — Ац](5)
[Ан - Ац] оАн+Ац(6)
В соответствии с моделью Ленгмюра-Хиншельвуда уравнение для скорости трансформации нитробензола может быть выражено уравнением 7.
d(HE) _ ^ ^б*2?Иг
dt (1+^^+^phJ’ где: k — константа скорости, 1/(атм с);
K 1 — константа адсорбции нитробензола, кг(Кат)/кг(НБ);
K 2 — константа адсорбции водорода, 1/атм;
С НБ — концентрация нитробензола, кг(НБ)/кг(Кат);
Pн 2 — давление водорода, атм.
Которое с учетом уравнения Аррениуса может быть выражено уравнением 8.
d(HE)_ , -^ K°b RTC^b RT pH^
---Л А в T------------------------ 7 2
dt L / E? E° \
I н<в_ятс^6+я°в-ят РНг \
Где k 0 — предэкспоненциальный множитель константы скорости реакции гидрирования нитробензола, 1/(атм с),
E акт — энергия активации процесса гидрирования нитробензола, кДж/(кг К),
^1 — предэкспоненциальный множитель константы адсорбции нитробензола, кг(Кат)/кг(НБ),
^1 — энергия активации процесса адсорбции нитробензола, кДж/(кг К),
^2 — предэкспоненциальный множитель константы адсорбции водорода, 1/атм,
^2 — энергия активации процесса адсорбции водорода, кДж/(атм К),
Уравнение 7 было решено численными методами в среде Matlab с использованием метода Левенберга-Марквардта, полученные значения констант и энергий активаций приведены в Таблице.
Таблица.
ЗНАЧЕНИЯ ПРЕДЭКСПОНЕНЦИАЛЬНЫХ МНОЖИТЕЛЕЙ И ЭНЕРГИЙ АКТИВАЦИИ ПРОЦЕССОВ ГИДРИРОВАНИЯ НИТРОБЕНЗОЛА, АДСОРБЦИИ НИТРОБЕНЗОЛА
И АДСОРБЦИИ ВОДОРОДА
|
Константы |
Единицы измерения |
Значение |
σ 95% |
|
k0 |
1/с |
15821 |
±790 |
|
Eакт |
кДж/(кг К) |
50,4 |
±3,2 |
|
кг(Кат)/кг(НБ) |
4537 |
±224 |
|
|
B? |
кДж/(кг К) |
24 |
±1.4 |
|
1/атм |
3627 |
±165 |
|
|
кДж/(атм К) |
16 |
±0,8 |
На основе полученных предэкспоненциальных множителей была определена оптимальная область проведения процесса гидрирования нитробензола Pн 2 =15–18 атм, С(НБ)=1,2 кг(НБ)/кг(Кат), t=115–120 °C обеспечивающая максимальную скорость проведения каталитического процесса, что коррелирует с результатами литературных данных по гидрированию нитробензола на никельсодержащих катализаторах [6–8].
Заключение
Каталитическое гидрирование нитробензола на никельсодержащем сверхсшитом полистироле является сложным химическим процессом, включающим в себя стадии адсорбции нитробензола и водорода на активных центрах катализатора, спиловер реагентов по поверхности никеля или его оксида, поверхностную реакцию, и десорбцию анилина с поверхности катализатора. Варьирование условий проведения процесса в широких диапазонах температуры (90–160 °С), давления (10–70 атм.) и соотношения количеств нитробензола и катализатора (0,2–1,4) позволило получить кинетические закономерности гидрирования нитробензола, которые были описаны с помощью модели Ленгмюра-Хиншельвуда. Численными методами в среде Matlab были определены значения предэкспоненциальных множителей и энергий активации процессов гидрирования нитробензола, адсорбции нитробензола и адсорбции водорода, что позволило установить область проведения процесса гидрирования нитробензола Pн 2 =15–18 атм., С(НБ)=1,2 кг(НБ)/кг(Кат), t=115–120 °C обеспечивающая максимальную скорость.
Исследование выполнено в рамках проекта РНФ 18-79-10157.
Список литературы Изучение кинетических особенностей синтеза анилина на Ni-содержащем сверхсшитом полистироле
- Lamture J. B. Aniline and Its Analogs. Notion Press, 2018.
- Leggetter B. E., Brown R. K. Reduction of monohalogenated nitrobenzenes with hydrazine and raney nickel. a convenient preparation of halogenated anilines // Canadian Journal of Chemistry. 1960. V. 38. №12. P. 2363-2366. DOI: 10.1139/v60-320
- Petrov L., Kumbilieva K., Kirkov N. Kinetic model of nitrobenzene hydrogenation to aniline over industrial copper catalyst considering the effects of mass transfer and deactivation // Applied catalysis. 1990. V. 59. №1. P. 31-43. DOI: 10.1016/S0166-9834(00)82185-5
- Latypova A. R., Filippov D. V., Lefedova O. V., Bykov A. V., Doluda V. Y. Environmentally safe synthesis of hydrogenation nickel catalysts // Известия высших учебных заведений. Серия: Химия и химическая технология. 2019. Т. 62. №9. С. 46-52. DOI: 10.6060/ivkkt.20196209.6065
- Doluda V. Yu., Sidorov A. I., Sulman E. M., Latypova A. R., Filippov D. V. F., Lefedova O. V. Synthesis, structure and catalytic properties of Pd nanostructured materials in p-nitroaniline catalytic hydrogenation // Известия высших учебных заведений. Серия: Химия и химическая технология. 2019. Т. 62. №6. С. 60-68. DOI: 10.6060/ivkkt.20196206.6041
- Qu Y., Chen T., Wang G. Hydrogenation of nitrobenzene catalyzed by Pd promoted Ni supported on C60 derivative // Applied Surface Science. 2019. V. 465. P. 888-894. DOI: 10.1016/j.apsusc.2018.08.199
- Jiang Y., Li X., Qin Z., Ji H. Preparation of Ni/bentonite catalyst and its applications in the catalytic hydrogenation of nitrobenzene to aniline // Chinese Journal of Chemical Engineering. 2016. V. 24. №9. P. 1195-1200. DOI: 10.1016/j.cjche.2016.04.030
- Venkateshwarlu V. et al. Advantage of carbon coverage over Al2O3 as support for Ni/C-Al2O3 catalyst in vapour phase hydrogenation of nitrobenzene to aniline // Catalysis Communications. 2016. V. 86. P. 1-4. DOI: 10.1016/j.catcom.2016.07.026
- Chen G. et al. Hierarchical Pd@ Ni catalyst with a snow-like nanostructure on Ni foam for nitrobenzene hydrogenation // Applied Catalysis A: General. 2019. V. 575. P. 238-245. DOI: 10.1016/j.apcata.2019.02.001
- Qu Y., Chen T. Fullerene derivative supported Ni for hydrogenation of nitrobenzene: Effect of functional group of fullerene derivative // Chemical Engineering Journal. 2020. V. 382. P. 122911. DOI: 10.1016/j.cej.2019.122911


