Изучение комплекса грибов Armillaria mellea sensu lato в центральных районах Красноярского края
Автор: Раздорожная Т.Ю., Шилкина Е.А.
Журнал: Лесохозяйственная информация @forestry-information
Рубрика: Охрана и защита лесов
Статья в выпуске: 1, 2016 года.
Бесплатный доступ
Приведены данные о высокой устойчивости сибирских штаммов опенка к низким температурам. Выполнена их видовая идентификация классическими и современными генетическими методами, при этом один из видов комплекса Armillaria mellea s. l. определен как Armillaria borealis.
Фитопатогены, днк-диагностика, секвенирование, видовая идентификация
Короткий адрес: https://sciup.org/14336713
IDR: 14336713 | УДК: 581.2
Текст научной статьи Изучение комплекса грибов Armillaria mellea sensu lato в центральных районах Красноярского края
Раздорожная, Т. Ю. Изучение комплекса грибов Armillaria mellea sensu lato в центральных районах Красноярского края [Электронный ресурс] / Т. Ю. Раздорожная, Е. А. Шилкина // Лесохоз. информ. : Электрон. сетевой журн. – 2016. – № 1. – С. 48–59. URL:
В задачи исследования входило:
-
1. Отобрать образцы грибов комплекса Armillaria mellea s. l. в разновозрастных хвойных древостоях на территории Красноярского и Еме-льяновского лесничеств Красноярского края, выделить чистые культуры.
-
2. Изучить влияние температуры на рост мицелия выделенных штаммов опенка осеннего.
-
3. Дать оценку агрессивности штаммов Armillaria mellea s. l. путем искусственного внедрения патогена в ткани растения.
-
4. Провести видовую идентификацию штаммов, устойчивых к низким температурам и проявляющих агрессивные свойства в отношении растения-хозяина.
Решение указанных задач позволяет изучить особенности развития исследуемых грибов в условиях Красноярского края, облегчить диагностику возбудителей корневых гнилей, в том числе с использованием инновационных молекулярногенетических методов, и в дальнейшем дать рекомендации по сдерживанию их развития.
Объекты и методы исследований
Объекты исследования – грибы комплекса Armillaria mellea sensu lato, отобранные с усыхающих деревьев хвойных и лиственных пород на территории Красноярского и Емельяновского лесничеств Красноярского края. Детальное лесопатологическое обследование изучаемых территорий показывает, что корневые системы хвойных и лиственных пород всех категорий, включая внешне здоровые, в той или иной степени повреждены гнилями. Периферическая часть древесины разрушается по типу белой волокнистой коррозионно-деструктивной гнили, типичной для воздействия грибов рода Armillaria .
Для выделения чистых культур грибов с комлевой части и корней усыхающих деревьев отбирали образцы древесины размером 3–5 см, а также плодовые тела и культивировали их в чашках Петри на агаризированном сусло-агаре (1,5–2,0 %, 4о по Баллингу) в термостате при температуре 24–26 оС. Чистоту культур проверяли микроскопированием [4].
Исследование экологических особенностей представителей комплекса Armillaria mellea s.l. проводили на 5 штаммах, выделенных в процессе работы и отличающихся географической и субстратной приуроченностью (табл. 1).
Влияние температур на рост грибницы изоля-тов Armillaria mellea s. l. изучали методом агаровых блоков (d = 0,5 см) путем инкубирования в течение 4 недель в холодильной камере при температуре 6 и 24 оС. При этом еженедельно фотографировали и фиксировали интенсивность зарастания чашки Петри мицелием гриба с помощью лабораторно-программного комплекса по исследованию радиального прироста древесных растений [5].
Таблица 1. Характеристика использованных штаммов
|
Штамм |
Растение-хозяин |
Категория состояния деревьев |
Район сбора образцов |
|
1 |
Populus tremula L. |
I |
Красноярское лесничество |
|
2 |
Pinus sylvestris L. |
II |
То же |
|
3 |
Pinus sibirica Du Tour |
I |
Емельяновское лесничество |
|
4 |
Pinus sylvestris L. |
I |
То же |
|
5 |
Betula pendula Roth. |
V |
«-» |
Патогенность (агрессивность) изолятов комплекса Armillaria mellea sensu lato изучали в питомнике путем инокуляции 2-летних саженцев сосны обыкновенной, лиственницы сибирской, ели обыкновенной, сосны кедровой сибирской (кедра сибирского) чистыми культурами патогена по модифицированной методике Соколова [6]. Модификация заключалась в том, что у отобранных саженцев с соблюдением асептики отрезали тонкий кусочек коры, мицелий патогена плотно прикладывали к камбию и прижимали корой. Для предотвращения высыхания и разрушения опенка почвенными грибами и бактериями кусочек коры закрепляли с помощью полиэтилена. Эксперимент проводили в конце мая – начале июня при среднесуточной температуре 2,7 оС и влажности воздуха 69 %. Для учета результатов по внедрению патогена в ткани растения осуществляли вскрытие сделанной прививки, микроскопирование древесины, а также дублирование выделения чистой культуры из пораженной древесины. Часть саженцев оставляли для учета степени усыхания от воздействия изучаемого гриба.
Видовую принадлежность изолятов Armillaria mellea sensu lato идентифицировали с помощью морфологического описания плодовых тел, а также методов «ди-мон» и секвенирования.
Макроскопические характеристики опенка осеннего фиксировали на стадии плодовых тел. Сбор и высушивание проводили согласно общепринятым методикам. Для микроскопирования частей сухих плодовых тел методом «раздавленная капля» использовали 5 %-й раствор КОН, 3–10 %-й аммиачный раствор конго красного. Значения количественных показателей базиро- вались на измерении не менее 20 спор и различных специфических структур (базидии, цистиды, пряжки и т.п.) [7].
Для видовой идентификации методом «димон» (дикарион-монокарион) использовали метод совместного культивирования, сращивая поочередно диплоидные изоляты рода Armillaria mellea s. l., инокулированные на агаровые блоки, и штаммы-тестеры нескольких интестерильных групп, любезно предоставленные в 2006 г. доктором Кари Корхоненом (Финляндия) [8]. К одной интерстерильной группе диплоидный изолят относили при явном изменении морфологии хотя бы одного из 5-ти тестеров на крустозный тип мицелия и отсутствии демаркационной линии на границе двух культур в течение 4-недельного культивирования [9].
Молекулярно-генетическую диагностику грибов проводили методом полимеразной цепной реакции с последующим секвенированием фрагментов [10]. Анализировали регион рДНК, включающий следующую последовательность локусов: 18S рРНК-ВТС1-5,8S-рРНК-ВТС2-28SрРНК [11]. Экстракцию ДНК проводили из свежей культуры гриба. Выделение ДНК осуществляли с помощью набора реагентов DiatomTM (ООО «Лаборатория Изоген»), согласно протоколу фирмы-производителя.
Для проведения полимеразной цепной реакции использовали набор реагентов GenPak PCA Core (ООО «Лаборатория Изоген») и универсальные праймеры ITS1 F (5-TCCGTAGGTGAACCT-GCGG-3) (10 мкм); ITS4 R (5-TCCTCCGCT-TATTGATATGC-3) (10 мкм). Процесс амплификации проводили в термоциклере по следующей программе:
-
1) денатурация t = 4 мин, T = 96 оС;
-
2) денатурация t = 1 мин, T = 96 оС;
-
3) отжиг t = 30 сек, T = 55 оС;
-
4) элонгация t = 2 мин, T = 72 оС; со 2-го по 4-й шаг, 30 циклов;
-
5) элонгация t = 10 мин, T = 72 оС;
-
6) охлаждение реакционной смеси t = 5 мин, T = 4 оС.
Электрофоретическое разделение фрагментов ДНК осуществляли в агарозном геле (2 %). Загрузочный раствор каждой дорожки состоял из 5 мкл образца ДНК и 2 мкл загрузочного буфера (30 %-й глицерин, 0,5 %-й бромфеноловый синий). Электрофорез проводили при комнатной температуре в течение 2 ч при параметрах тока 90 V/60 мА. Детекция продуктов электрофореза достигалась окрашиванием гелевых пластин в растворе бромистого этидия. Для визуального наблюдения гель помещали в УФ-трансиллюминатор. Фотодокументирование продуктов электрофореза достигалось за счет видеосканирования в УФ-свете специальной системой GelImager.
Для видовой идентификации патогенов осуществлялось иссечение фрагмента геля, содержащего ДНК-фрагмент гриба. Очистку фрагментов ДНК от геля выполняли в соответствии с протоколом набора реагентов Clean up mini (Евроген). Секвенирование фрагментов ДНК проводили с помощью генетического анализатора ABI PRISM 310 (Applied Biosystems) по методике, предложенной фирмой-производителем. Интерактивный анализ нуклеотидных последовательностей образцов осуществляли с помощью программы Sequencing Analysis v.6 и Variant Reporter v.2, CLC DNA Workbench v. 6. Результаты секвенирования в формате FASTA использовали для идентификации с помощью баз данных NCBI и Mycobank.
Результаты и обсуждение
Согласно литературным данным, оптимальными температурами для роста мицелия опенка являются 19–25 оС [6, 12]. При температуре ниже 11 оС их рост очень слабый, а ниже 5 оС и выше 35 оС – полностью прекращается. Северные европейские виды A. borealis, A. cepistipes, A. ostoy-ae имеют более низкий температурный оптимум, чем южные (из низких широт) виды A. gallica и A. mellea [8].
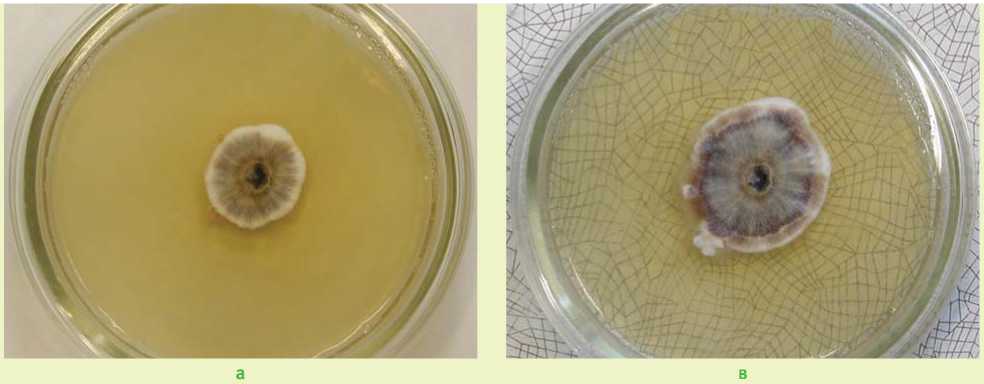
Исследование влияния температуры на рост грибницы выделенных корневых патогенов выявило наличие особых свойств сибирских штаммов. Образцы, отобранные с деревьев I–II класса Крафта, по скорости формирования грибницы в оптимальных температурных условиях относились к группе быстрорастущих штаммов, но при температуре 6 оС имели низкую способность формирования мицелия. В то же время были отмечены изоляты, имеющие среднюю скорость роста при оптимальных условиях, а также проявившие себя быстрорастущими при низкой температуре, например, штаммы 3, 4, 5 (рис. 1). Это свидетельствует о высокой устойчивости сибирских видов опенка к низким температурам, что согласуется с данными И. Н. Павлова и др. [13, 14].
Такая устойчивость для патогенов комплекса Armillaria mellea sensu lato играет положительную роль, так как их развитие начинается при более низких температурах и завершается позднее, чем у других дереворазрушающих грибов. Это позволяет грибнице не только достичь камбиального слоя, но и привести дерево к гибели, успешно закрепиться, создав защитные структуры, а также позволяя опенку осеннему успешно перезимовать.
Искусственному заражению подверглись саженцы 5-ти хвойных пород (по 10 шт.). Активное внедрение патогена в здоровое растение наблюдалось только для штамма 4 в отношении сосны кедровой сибирской и сосны обыкновенной (табл. 2, рис. 2). Штаммы 1, 2, 3 и 5 не проявили агрессивных свойств в отношении заражаемых растений-хозяев: у инфицированных участков растений отсутствовали признаки поражения, штаммы искусственно внедренных фитопатогенов из тканей саженцев не выделялись.
В результате проведенных исследований штамм 4 A rmillaria mellea s. l. был отобран для дальнейшей видовой идентификации по трем направлениям: морфологическое описание, ме-

б
Рис. 1. Рост мицелия Armillaria mellea sensu lato при различных температурах (на примере штамма 4): а – при температуре 24 оС (1 неделя эксперимента);
б – при температуре 6 оС (1 неделя эксперимента);
в – при температуре 24 оС (4 неделя эксперимента);
г – при температуре 6 оС (4 неделя эксперимента)
г
Таблица 2. Результаты искусственного заражения хвойных растений штаммами Armillaria mellea sensu lato, шт.
|
Растение-хозяин |
Штаммы Armillaria mellea sensu lato |
||||
|
1 |
2 |
3 |
4 |
5 |
|
|
Лиственница сибирская |
0/10 |
0/10 |
0/10 |
0/10 |
0/10 |
|
Сосна обыкновенная |
0/10 |
0/10 |
0/10 |
2/10 |
0/10 |
|
Сосна кедровая сибирская |
0/10 |
0/10 |
0/10 |
5/10 |
0/10 |
|
Ель обыкновенная |
0/10 |
0/10 |
0/10 |
0/10 |
0/10 |
тод скрещивания культур с тестерами и молекулярно-генетическая идентификация.
Морфологическое описание плодовых тел штамма 4 Armillaria mellea sensu lato (рис.
-
3). Шляпка полукругло-выпуклая до распростертой, поверхность темно-кремовая, бледноохристая. Чешуйки темно-коричневые, лохматые, торчащие вверх, состоящие из нескольких
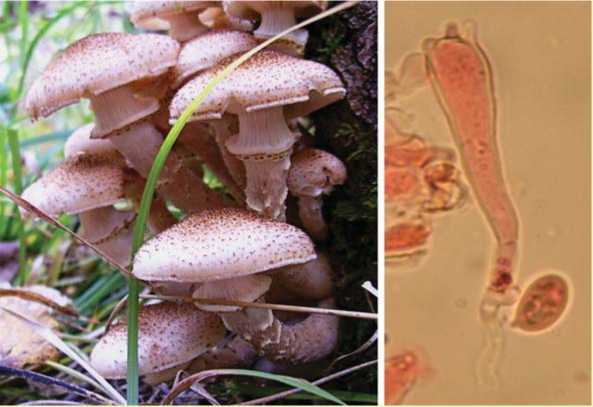
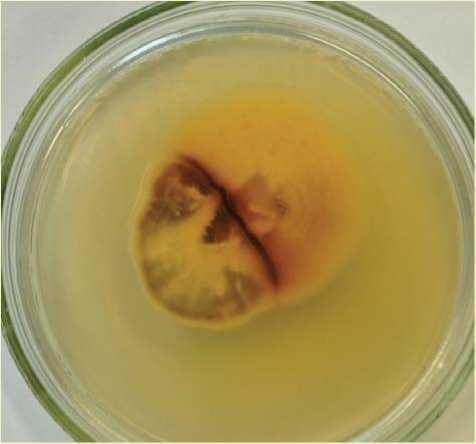
пучков, густо расположенные в центральной части, более редкие по краям. Поверхность шляпки точечно-крапчатая, иногда местами голая. Край шляпки белесый с остатками частного покрывала без чешуек, ровный. Пластинки светло-кремовые, почти белые; коротко низбе-гающие, частые с пластиночками. Край пластинок ровный. Пластинки светлыми линиями продолжаются до кольца. Кольцо двойное, пушисто-войлочное. Имеется белая ложбинка между верхней и нижней частью кольца. Верхняя часть беловойлочная. Нижняя часть кольца обычно окрашена в желтоватый и желтый цвет и покрыта многочисленными бурыми, отдельно расположенными точечными чешуйками. Ножка того же цвета, что и пластинки. К основанию имеет буроватый оттенок, само основание темно-бурое. Вся поверхность ножки покрыта клочками частного покрывала с бородавками. Плодовые тела растут пучками на корневых лапах сосны обыкновенной. Микроскопирование: базидии булавовидные длиной 45 мкм и диаметром 8–10 мкм, септированные, основание с пряжками. Это подтверждает, что данное плодовое тело не относится к группе A. mel-lea . Имеются 2–4 стеригмы высотой 5 мкм и более. Споры крупные, размером 12 x 8 мкм, от овальных до миндалевидных.
Согласно полученному описанию данный штамм предположительно относится к виду Armillaria borealis [15].
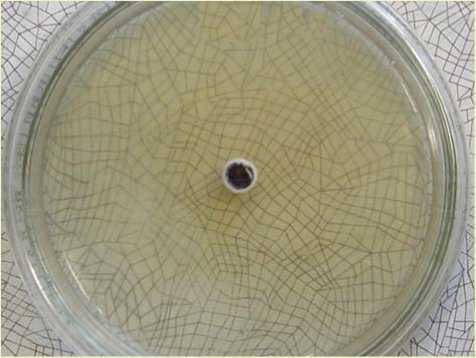
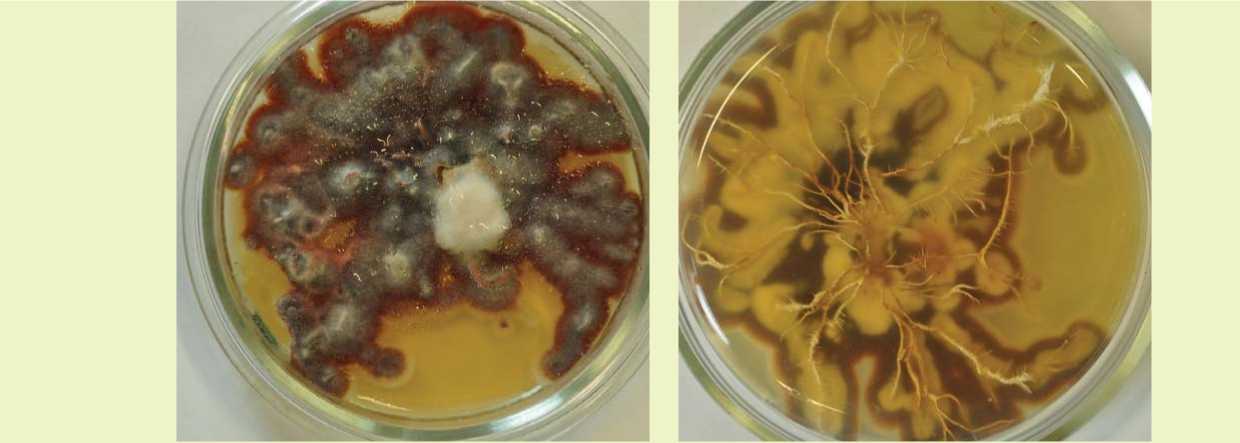
Тест-скрещивание проводили со следующими видами: A. mellea, A. ostoyae, A. gallica, A. borealis, A. cepistipes . Данный метод, основанный на сексуальной совместимости грибов, показал, что штамм 4 относится к виду Armillaria borealis (рис. 4). Согласно литературным данным [9, 12], указанный вид не характеризуется агрессивными свойствами и не играет весомой роли в ослаблении древостоев на территории Европы и Америки, однако его способность вызывать в Сибири массовые очаги усыхания хвойных пород представляет большой научный и практический интерес.
Молекулярно-генетические исследования подтвердили ранее полученные нами данные о
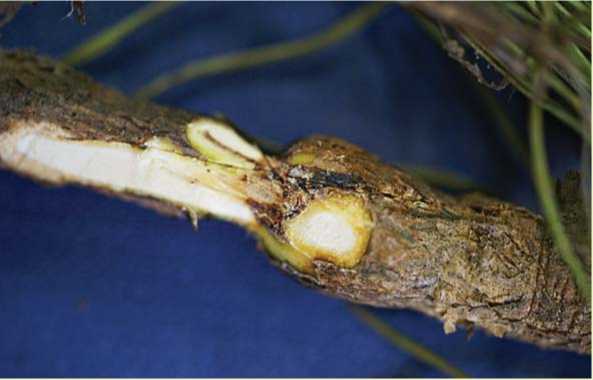
Рис. 2. Стволик 2-летнего саженца сосны кедровой сибирской, искусственно инфицированный штаммом 4 Armillaria mellea sensu lato: в месте заражения наблюдается некроз тканей
аб
Рис. 3. Морфологическое описание опенка осеннего: а – плодовые тела Armillaria borealis, б – базидия с 4-мя стеригмами, пряжкой и спорой
видовой принадлежности исследуемого штамма. Сравнение полученного сиквенса с генетической базой данных позволило достоверно определить его вид как Armillaria borealis (AJ250052.1). Полученные данные свидетельствуют о том, что трудоемкие и длительные по времени классические методы видовой идентификации могут быть успешно заменены на генетические, как более быстрые, но не менее надежные.
а
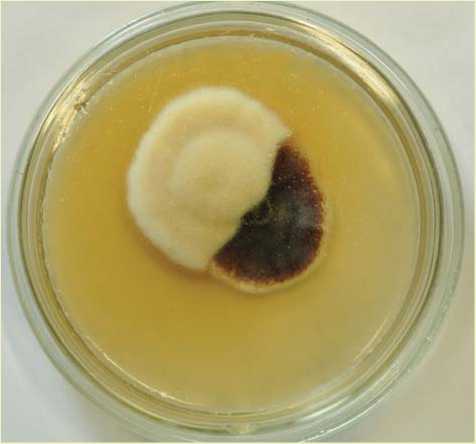
Рис. 4. Тест-скрещивание A. borealis с тестерами: а – положительная реакция;
б – отрицательная реакция
б
Выводы
-
1. Большинство штаммов фитопатогенных грибов комплекса Armillaria mellea s. l., отобранных в ослабленных древостоях на территории центральной части Красноярского края, характеризуются способностью к активному формированию грибницы и защитных структур при низких температурах окружающей среды. Эта особен-
- ность сибирских штаммов Armillaria mellea s. l. может служить причиной усиления их патогенных свойств, приводящих к массовому куртинному усыханию хвойных лесов в Красноярском крае. Целесообразно расширить ареал исследований в данном направлении на территории Сибири.
-
2. В результате видовой идентификации наиболее агрессивный и патогенный из выде-
- На наш взгляд, изучение проблемы корневых патогенов, представленных комплексом Armillaria mellea s.l., имеет большое прикладное значение. В настоящее время вредоносность указанного комплекса недооценена, в том числе по причине наличия множества противоречивых данных о его видовом составе. Учитывая, что комплекс включает ряд агрессивных видов, таких как A. ostoyae и A. borealis, а идентификация
их систематической принадлежности традиционными методами весьма затруднительна из-за отсутствия определителей для сибирских видов, возникает потребность в расширении арсенала используемых методов, например, с помощью молекулярно-генетической диагностики. Это позволит провести детальные исследования особенностей видового состава комплекса Armillaria mellea s. l. с целью написания новых ключей для определителей сибирских штаммов и создания базы данных по их пространственной распространенности. Наличие такой базы будет способствовать осуществлению более качественного мониторинга корневых гнилей в древостоях хвойных и лиственных пород.
Список литературы Изучение комплекса грибов Armillaria mellea sensu lato в центральных районах Красноярского края
- Стороженко, В. Г. Комплексы сапрофитных грибов на валеже в еловых древостоях различного происхождения/В. Г. Стороженко//Лесоведение. -1992. -№ 5. -С. 64-67.
- Пояснительная записка к проекту организации и ведения хозяйства Минусинского лесхоза. -Т. I; Кн. 1. -Красноярск, 2004. -300 с.
- Денисов, Б. С. Современные проблемы защиты леса/Б. С. Денисов//Лесохоз. информ. -2003. -№ 2. -С. 23-25.
- Афанасова, Е. Н. Изучение питательных сред при культивировании/Е. Н. Афанасова, Н. В. Пашенова//Микология и фитопатология. -2005. -№ 2. -С. 62-65.
- Лабораторно-программный комплекс по исследованию радиального прироста древесных растений: Свид. 2003612095 РФ/И. Н. Павлов, А. А. Марков, С. П. Якимов, Н. А. Степаненко, С. Ю. Гортман. -RU. -№ 2003611608; Заявл. 15.07.03; Опубл. 08.09.03, Бюл. № 9.
- Соколов, Д. В. Корневая гниль от опенка и борьба с ней/Д. В. Соколов. -М.: Лесн. пром-сть, 1964. -372 с.
- Коваленко, А. Е. Род Camarophyllopsis в России: новые находки и новый вид С. albofloccipes/А. Е. Коваленко, Е. В. Малышева, О. В. Морозова//Микология и фитопатология. -2012. -Т. 46. -Вып. 1. -С. 54-66.
- Guillaumin, J. J. Armillaria species in the northen temprate hemisphere/J. J. Guillaumin, C. Mohammed, S. Berthelay; ed. D. J. Morrison//Proceedings of the 7th international conference on root and butt rots (Vernon and Victoria, August, 1988). -Victoria: IUFRO, 1988. -P. 27-43.
- Радзиевская, М. Г. Структура комплекса Armillaria mellea sensu lato: автореф. дисс. … к. б. н.: 03.00.24/М. Г. Радзиевская. -М.: МГУ им. Ломоносова, 1989. -23 с.
- Падутов, В. Е. Методы молекулярно-генетического анализа/В. Е. Падутов, О. Ю. Баранов, Е. В. Воропаев. -Мн.: Юнипол, 2007. -176 с.
- Молекулярно-генетическая диагностика грибных болезней в лесных питомниках // О. Ю. Баранов, В. А. Ярмолович, С. В. Пантелеев, Д. Г. Купреенко // Лесное и охотничье хозяйство. - 2012. - № 6. - 9 с.
- Shaw, III C.G. Armillaria root disease/III C. G. Shаw, G. A. Kile//Agriculture Handbook. -Washington D.C. -1991. -№ 691. -P. 233.
- К вопросу влияния лесорастительных условий на устойчивость сосняков Минусинской впадины к корневым патогенам/И. Н. Павлов //Хвойные бореальной зоны. -Т. 25. -2009. -Т. 25. -№ 1-2. -С. 28-36.
- Основная причина массового усыхания пихтово-кедровых лесов в горах Восточного Саяна -корневые патогены/И.Н. Павлов //Хвойные бореальной зоны. -Т. 26. -2009. -№ 1. -С.33-41.
- Кутафьева, Н. П. Морфология грибов: учеб. пособ.; 2-е изд., испр. и доп. -Новосибирск: Сиб. унив. изд, 2003. -215 с.


