Изучение механизма и кинетики получения синего оксида вольфрама прокаливанием паравольфрамата аммония
Автор: Колмакова Л.П., Ковтун О.Н., Довженко Н.Н.
Журнал: Журнал Сибирского федерального университета. Серия: Техника и технологии @technologies-sfu
Статья в выпуске: 3 т.3, 2010 года.
Бесплатный доступ
Изучены механизм и кинетика получения синего оксида вольфрама прокалкой паравольфрамата аммония в «автогенной» атмосфере. Предложены оптимальные параметры процесса.
Синий оксид вольфрама, прокалка, паравольфрамат аммония, термодинамика, механизм, кинетика
Короткий адрес: https://sciup.org/146114541
IDR: 146114541 | УДК: 669.85/.86
Текст научной статьи Изучение механизма и кинетики получения синего оксида вольфрама прокаливанием паравольфрамата аммония
Надежность и долговечность электровакуумных приборов во многом зависят от свойств и качества материалов, применяемых для их изготовления. Поэтому вольфрам используется главным образом в виде сплавов, так как чистый вольфрам не удовлетворяет условиям работы и не обеспечивает высокого качества и надежности приборов.
Благодаря своим уникальным свойствам вольфрам широко используется в производстве быстрорежущих и специальных сталей, твердых сплавов специального назначения. В последнее время за рубежом количество вольфрама, потребляемого специальными областями техники, увеличивается. В связи с этим к исходным и промежуточным соединениям, используемым для производства изделий из вольфрама и его сплавов, предъявляются повышенные требования по химическому составу и физическим свойствам.
В работе [1] изучены условия получения синего оксида вольфрама (СОВ) в водородной и водородно-азотной атмосфере. Нами изучено влияние температуры на степень разложения аммиака, выделяющегося при прокаливании ПВА. Состав образующейся при этом газовой фазы получил название «автогенной» атмосферы. Термодинамические и кинетические исследования процесса получения промышленного СОВ прокалкой ПВА в «автогенной» атмосфере позволили установить механизм и кинетику восстановления WO 3 до WO 2,9 , исследованиями и полупромышленными испытаниями показана высокая скорость получения СОВ из ПВА. Рекомендованы основные параметры процесса.
-
* Corresponding author E-mail address: n.dovzhenko@sfu-kras.ru
-
1. Механизм получения синего оксида вольфрама прокаливанием паравольфрамата аммония
Разложение ПВА – многостадийный процесс [2], и количества удаляемых веществ определяются природой исходного вещества и темпом роста температуры. Для изучения механизма получения синего оксида вольфрама (СОВ) прокаливанием паравольфрамата аммония (ПВА) использовали ПВА Кировоградского завода твердых сплавов, содержание WO 3 в котором 88,82 %, что соответствует формуле 5(NH4)2(>12WO ; \5H2O. Кристаллы исследуемой соли имеют форму неправильных многогранников с трещинами и адсорбированными мелкими частицами, которые просматриваются при увеличении в 500, 1000, 1500 и 2500 раз (рис. 1).
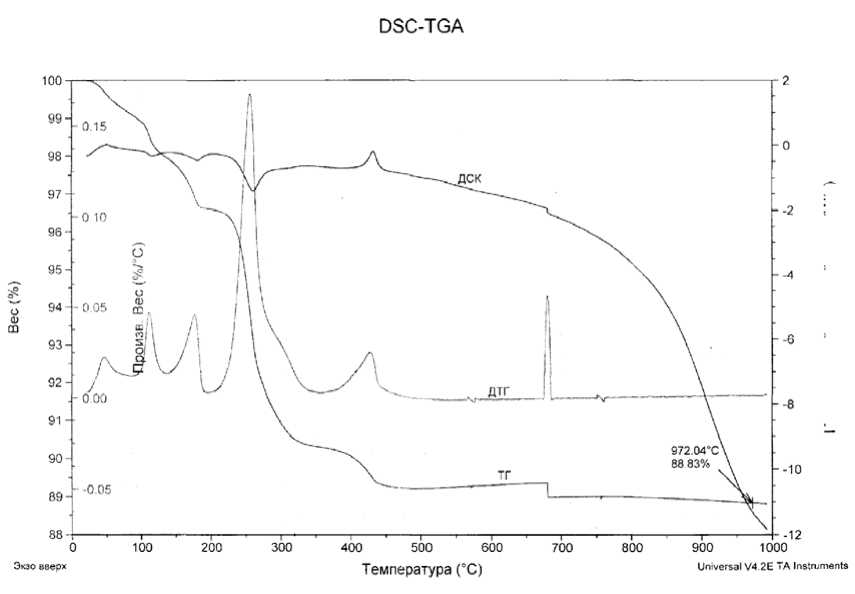
Термогравиметрическим анализом на синхронном термическом анализаторе типа SDT Q 600 образцов ПВА в разных атмосферах (рис. 2 и 3) показано, что высокотемпературная диссоциация ПВА в окислительной (воздух) и нейтральной (аргон) средах до t = 484 °С происходит практически одинаково. При нагревании до t = 110÷115 °С из состава ПВА переходят в газовую фазу две молекулы воды, а при t = 200 °С – шесть молекул воды (рис. 2 и 3), что соответствует потере массы образца на 1,1 и 3,45 %. В области температур от 230 до 320 °С происходит одновременное удаление практически всей воды и основной массы аммиака. Убыль массы образца в этом интервале составляет 6,05 %. Процесс сопровождается разрушением кристаллической решетки и образованием рентгеноаморфной фазы - исходной среды для последующего формирования новых кристаллических продуктов [2-11]. Рекристаллизация аморфной фазы начинается при температуре 320-350 °С и приводит к получению фаз на основе гексагонального триоксида вольфрама h-WO3. Для этого соединения характерна структура, в которой чередуются 3- и 6-угольные петли и имеются тригональные и гексагональные каналы [1]. В гексагональных каналах с большим сечением могут размещаться молекулы или катионы (например, NH3, H2O, NH4+, K+ и т.д.). В области температур от 390 до 430 °С происходит убыль массы образца, составляющая ~ 0,96 ^ 1,0 % и наблюдается экзотермический эффект, обусловленный кристаллизацией аморфной фазы и образованием кристаллов h-WO3. При этом в газовую фазу выделяются остатки воды и частично аммиак.
В экспериментах в атмосфере аргона кривые ТГ и ДТГ, ДСК (рис. 2) при t = 680 °С проявляют небольшой экзотермический эффект и потерю массы образца, составляющую 0,5 %, что соответствует переходу в газовую фазу одной молекулы NH3. Эндотермический пик при t=680 °С (кривая ДСК, рис. 2) обусловлен, по-видимому, развивающейся в небольшой степени рекристаллизацией и образованием мелких кристаллов фиолетового оксида вольфрама WO2 , 72.
При проведении анализа в воздушной атмосфере при t = 480 - 490 °С, которая по составу наиболее близка к «автогенной» (состав газовой фазы, формирующийся при прокаливании ПВА без доступа воздуха), наблюдается небольшая потеря массы образца (~0,15 ^ 0,2 %) и появление новой фазы - WO2-9, что может быть связано с частичным восстановлением h-WO3 аммиаком, который находится в гексагональных каналах кристаллической структуры этого соединения.
Таким образом, термогравиметрические исследования разложения ПВА показали, что при температуре до 200 – 220 °С в «автогенной» атмосфере присутствуют пары воды, а при температуре более 430 °С - только аммиак или продукты его разложения (N2 и Н2). Кристал- – 294 –

х500
х1000

х1500
х2500
Рис. 1. Морфологические характеристики ПВА, используемые для отработки промышленной технологии получения СОВ
Исправленный тепловой поток (W/g)
Рис. 2. Результаты термогравиметрического анализа ПВА в атмосфере аргона
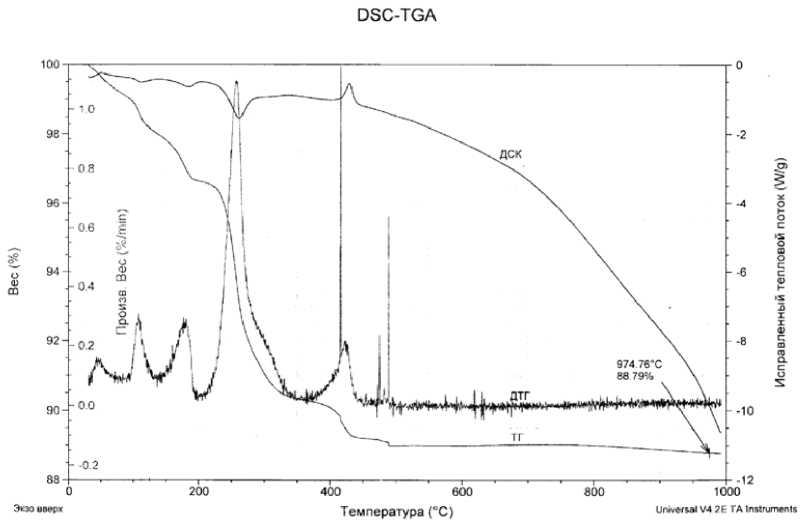
Рис. 3. Результаты термогравиметрического анализа ПВА в окислительной атмосфере
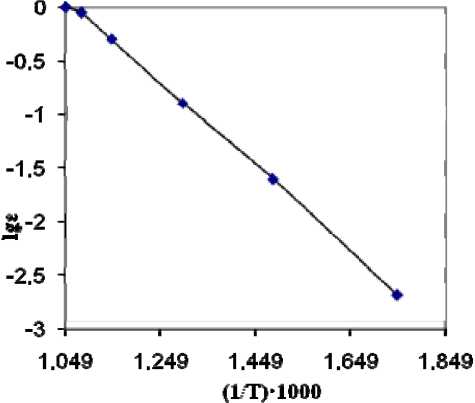
Рис. 4. Зависимость логарифма степени разложения выделяющегося аммиака ε от обратной температуры лическая параллелепипедная структура вольфрамового ангидрида, необходимая для получения «непровисающей» вольфрамовой проволоки и быстрорежущей стали, сохраняется до температуры 680 °С.
Исследования влияния различных параметров процесса прокалки ПВА на состав газовой фазы выявили, что образующийся при этом аммиак разлагается на N 2 и Н2 в слое твердого материала и при t ≥ 650 °С в газовой фазе его практически нет. В обычных условиях аммиак устойчив до t = 1200 °С [12], но в присутствии катализаторов начинает разлагаться на составные элементы уже при t = 300 ^ 400 °С [13]. Нами установлено, что при добавлении на поверхность ПВА оксидов вольфрама (WO3, WO2 , 9) диссоциация выделяющегося NH3 протекает при более низкой температуре и более полно.
Добавка ~25 % оксидов WO3 от массы ПВА при температуре прокалки 600 °С в течение 30 мин повышает степень диссоциации аммиака на N2 и Н2 на 20 - 30 %. Следовательно, оксиды вольфрама являются катализаторами процесса разложения аммиака на N2 и Н2.
Сильное влияние на образование водорода и азота из аммиака оказывает температура прокалки ПВА (рис. 4).
При t = 400 °С степень разложения NH3 не превышает 2,5 %, а при 680 °С в газовой фазе аммиак отсутствует полностью. Значение энергии активации процесса разложения аммиака, вычисленное на основании выполненных экспериментов и определения тангенса угла наклона кривой к оси абсцисс, составляет 75,7 кДж/моль.
Полученное экспериментальное значение энергии активации процесса разложения аммиака в 3,9 раза меньше, чем энергия активации процесса разложения аммиака на N2 и Н2 в газовой фазе [13]. Такое снижение энергии активации свидетельствует о каталитическом характере диссоциации NH3 на оксидах вольфрама (WO3 и WO2 , 9).
Разложение аммиака при повышении температуры процесса прокалки обусловливает наличие восстановителя – водорода – как в газовой фазе, так и в слое материала. Соответственно, и процесс восстановления WO3 водородом может происходить как в момент его образования в слое вольфрамового ангидрида, так и в результате диффузии молекулярного водорода из газовой фазы к поверхности WO 3 .
Таблица 1. Значение КР и ΔG реакций восстановления оксидов вольфрама водородом при Т = 882,4 К (609,4 °С) [14]
|
Продукты реакций восстановления WO3 |
lg K p |
K p |
ΔG, Дж/моль |
|
WO 2,9 |
0,364 |
2,312 |
-6147 |
|
WO 2,72 |
0 |
1 |
0 |
|
WO 2 |
-0,119 |
0,758 |
2009,6 |
|
W |
-0,985 |
0,104 |
16635 |
В системе вольфрам-кислород известно существование четырех оксидов: WO 3 , WO 2,9 , WO2,72 и WO2. Восстановление WO3 водородом протекает последовательно с образованием промежуточных оксидов [14]. Все реакции эндотермические, поэтому константы равновесия увеличиваются с ростом температуры (табл. 1).
Анализ этих термодинамических данных показывает, что при температуре менее 609,4 °С должно происходить селективное восстановление WO3 до W2,9.
На основании литературных и экспериментальных данных предложен следующий механизм восстановления WO3 в слое материала:
-
– термическое разложение ПВА с образованием Н 2 О, NH 3 и образованием кристалличе
ской фазы h-WO3·xNH3·yH2O [15];
-
– каталитическое разложение аммиака и удаление H 2 , N 2 и части NH 3 в газовую фазу [17];
-
– выделение аммиака из кристаллической фазы h-WO3·xNH3·yH2O [1];
-
– каталитическое разложение последней молекулы NH 3 на поверхности WO 3 , с образо
ванием адсорбированного водорода и N2 [17];
-
– химическое взаимодействие адсорбированного H 2 с WO 3 [17];
-
– десорбция воды с поверхности WO2,9 и диффузионный отвод паров воды из слоя твер
дого материала в газовую фазу [17].
Из теоретических и кинетических данных по восстановлению WO3 водородом до вольфрама известно [14, 15], что вода тормозит скорость процесса и для ее удаления используют 5 – 10-кратный избыток восстановителя. Поэтому при восстановлении WO3 в слое материала необходима максимальная эвакуация Н 2 О в газовую фазу.
Для полного восстановления WO3 до WO2,9 достаточно одной молекулы NH3 из состава ПВА [14].
Данное условие можно реализовать при температуре ≥ 430 °С (рис. 2, 3).
P
Используя равновесное отношение H 2 из диаграммы состояния системы вольфрам-
PH2O кислород-водород [1] и значения расчетного парциального давления паров воды в слое материала после восстановления WO до WO можно количественно оценить содержание WO в ,, слое материала (табл. 2).
Приведенные данные показывают существенное влияние температуры и равновесных парциальных давлений водорода и воды: повышение температуры прокаливания ПВА с 600 до 680 °С увеличивает содержание WO 2,9 в СОВ с 9,01 до 16,5 %. При высокой температуре воз- – 298 –
Таблица 2. Влияние температуры на содержание WO2 , 9 в СОВ при восстановлении WO 3 в слое материала, образующегося при разложении аммиака водородом ( тПВА =600 г; разложение NH3 на 100 %, расчетный состав исходной газовой фазы в порах материала, кПа: Рн = 77,3, PN = 25 8, слой материала 35 мм) H 2 N 2
|
t, °С |
Термодинамические равновесные условия существования WO2 , 9, PH 2/ /р / P H 2 O * |
Расчетное равновесное давление паров Н2О в слое материала, кПа |
Парциальное давление водорода в газовой фазе после восстановления WO 3 , кПа |
Расход водорода на восстановление WO 3 , дм3 |
C WO 2-9 , % |
|
600 |
от 15,89 до 12,59 |
5,5 |
71,8 |
0,464 |
9,01 |
|
620 |
от 13,98 до 10,8 |
6,34 |
70,96 |
0,534 |
10,37 |
|
640 |
от 11,65 до 9,27 |
7,49 |
69,81 |
0,628 |
12,21 |
|
650 |
от 10,66 до 8,57 |
8,14 |
69,16 |
0,682 |
13,25 |
|
680 |
от 8,57 до 6,81 |
10,13 |
67,16 |
0,849 |
16,5 |
* Расчет выполнен на основании данных диаграммы состояния системы W-O2-H2 [15]
можно наличие больших количеств воды в газовой фазе ( P H 2 O = 10,13кПа). Расход водорода на восстановительный процесс получения материала с содержанием 16,5 % WO2,9 составил 1,2 % от количества активного водорода в составе ПВА.
Расчет экспериментальной энергии активации процесса восстановления WO3 водородом до WO2 g по зависимости lg Cwo = f (—) (рис. 5) дает значение 455 кДж/моль. Такая большая , 2'9 Т величина энергии активации восстановления WO3 водородом в слое материала указывает на кинетическую область протекания процесса. Поэтому для увеличения скорости процесса и повышения содержания WO29 в СОВ необходимо поддерживать максимально высокую температуру прокалки ПВА.
Процесс гетерогенного восстановления WO3 до WO29 водородом из газовой фазы состоит из следующих стадий [14]:
-
– диффузионный подвод водорода из «автогенной» атмосферы к твердой поверхности WO3;
-
- хемосорбция водорода и химическая реакция на поверхности вольфрамового ангидрида;
-
- десорбция воды с поверхности реакции (WO2,9);
-
– диффузионный отвод паров воды от поверхности твердого материала.
-
2 . Кинетические закономерности процесса получения синего оксида вольфрама из паравольфрамата аммония в «автогенной» атмосфере
Для определения лимитирующей стадии процесса рассчитана экспериментальная энергия активации восстановления WO3 до WO2-9 водородом. На основании уравнения lg KP = 3266,9/+4,0667, найдены два значения константы равновесия при температурах 873 К -
1,1455 и 973 К - 1,0277. Тогда тангенс угла наклона прямой зависимости lg КP = f (T) имеет значение -3266.
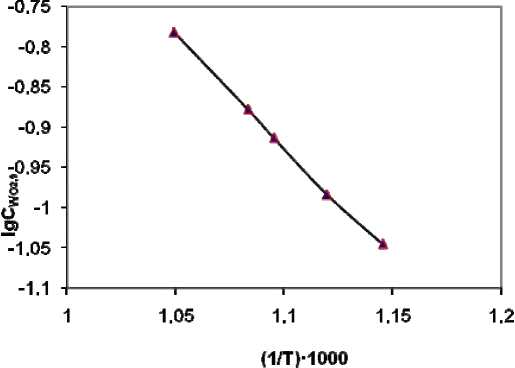
Рис. 5. Зависимость логарифма концентрации WO 2,9 в СОВ от обратной температуры
Экспериментальная энергия активации процесса восстановления WO 3 водородом составит 62,5 кДж/моль. Такая величина энергии активации характерна для высокотемпературных диффузионных процессов, и лимитирующей стадией будут транспортные процессы (подвод водорода или отвод воды).
Кинетика процесса получения СОВ при образовании восстановителя в слое твердого материала лимитируется стадией выделения NH3 из прочной кристаллической структуры h-WO3, характеризуется высокой экспериментальной энергией активации (Е = 455 кДж/моль) и определяется только температурой. В этом случае уравнение формальной кинетики можно записать следующим образом:
-
- Е/^
^ ) Кин = к ■ e/ RT , (1)
где k – константа скорости процесса; Е – экспериментальная энергия активации ( Е = 455 кДж/моль); R – газовая постоянная, R = 8,31; T – абсолютная температура процесса, К.
Кинетика восстановления WO3 до WO2 в интервале температур 625 - 675 и 800 - 875 °C газообразным водородом хорошо изучена [14, 16], однако для стадии WO3 - WO2 , 9 имеется только зависимость lgKp от температуры [14]. В соответствии с этой зависимостью процесс восстановления WO3 до WO29 характеризуется экспериментальной энергией активации 62,45 кДж/моль и протекает в диффузионной области.
Авторы работ [1, 14, 16] утверждают, что лимитирующей стадией процесса является отвод паров воды от поверхности вольфрамового ангидрида.
Наши исследования кинетики образования WO2 , 9 из WO3 в «автогенной» атмосфере также характеризуются небольшим значением экспериментальной энергии активации (E = 75,5 кДж/моль), что не противоречит диффузионному характеру процесса.
По нашему мнению, лимитирующей стадией второго механизма получения СОВ служит не отвод паров воды от поверхности WO2,9, а диффузия газообразного водорода к реакционной поверхности WO в слое твердого материала. Продукты разложения ПВА (NH , N , H , H O) движутся из слоя твердого материала навстречу диффузии водорода из газовой фазы и тормозят ее. Поэтому процессы восстановления водородом начинают идти тогда, когда из ПВА в газовую фазу перейдет весь аммиак и вода. Этот факт подтверждается также теоретическими исследованиями А.Н. Зеликмана [16], доказывающими математически, что отвод продуктов реакции не может лимитировать гетерогенный химический процесс. В экспериментах исследователей [18] показано, что активация исходного реагента – водорода – ускоряет процессы восстановления WO3 до WO2 в 1,3 – 1,5 раза, а продукт реакции – вода – не оказывает тормозящего действия на процесс.
В соответствии с этими представлениями о механизме восстановления WO 3 до WO 2,9 водородом уравнение диффузионной кинетики будет иметь вид
-
V 2 ) диф = D h .. s.^ P o - P n. ) , (2)
H 2
где DH – коэффициент диффузии водорода в газовой среде, м2/с; SWO – поверхность твердого WO 3 , где протекает реакция, м2; Р 0 – давление водорода в «автогенной» атмосфере, кПа; Р П – давление водорода на поверхности WO3, кПа; δ – толщина диффузионного слоя вблизи твердой поверхности WO 3 , м.
При проведении полупромышленных испытаний получения СОВ прокалкой ПВА в «автогенной» атмосфере на четырехтрубной печи толкательного типа скорость процесса определяли по уравнению
V = тПВА ■ C WO 3 ■ C WO 2,9 , (3)
E T^S где mПВА – масса навески ПВА в лодочке, г; CWO – содержание WO3 в ПВА, доли единиц (CWO =0,88825); CWO – содержание WO29 в готовом СОВ, доли единиц; τ – время продвижения 3 2,9 , лодочки, мин; S – поверхность материала в лодочке, м2.
С учетом условий полупромышленных испытаний: m ПВА = 600 г; τ = 20 мин; S = 0,015 м2 и CWO = 23,8 %, скорость процесса составляет 7,93 г/м2·с.
При восстановлении WO 3 до WO 2 активированным водородом в работе [18] скорость процесса составляла 0,175 г/м 2 · с , что в 45 раз меньше, чем в нашем случае, а при восстановлении WO 3 до WO 2,9 с учетом стехиометрии скорость получения СОВ в 4 – 4,5 раза выше.
Заключение
Изучение механизма и кинетики процесса позволяет выявить оптимальные параметры технологии получения СОВ прокалкой ПВА в «автогенной» атмосфере:
-
1. Необходима предварительная прокалка ПВА при температуре 200 ÷ 220 °C для более полного удаления воды.
-
2. Температура в трубной печи должна поддерживаться на уровне 640 ÷ 650 °C, а скорость продвижения лодочки 20 ÷ 30 мм/мин.
-
3. Длина трубной печи (рабочая зона) должна обеспечивать время нахождения лодочки в трубе в течение ~ 360 мин.
-
4. Толщина загружаемого слоя просушенного ПВА в лодочке должна находиться в пределах 35 – 50 мм.
-
5. Необходима организация противоточного движения «автогенной» газовой фазы в замкнутой системе трубная печь – холодильник – конденсатор для удаления паров воды и повторного использования водорода для восстановления WO 3 до WO2 , 9.
Выводы
-
1. Термогравиметрические исследования разложения паравольфрамата аммония в воздушной и инертной атмосфере позволили установить, что при температуре 200 °С из структуры ПВА удаляются шесть молекул воды, в области температур от 390 до 430 °С происходит образование гексагональных кристаллов h-WO3, удерживающих в своей решетке одну молекулу аммиака до температур 480 ÷ 680 °С. Этого количества аммиака достаточно для восстановления WO3 до WO2 9.
-
2. Изучен состав «автогенной» газовой фазы на ИК-Фурье – спектрометре Nicolet 380 FT-IR, совместимом с синхронным термическим анализатором SDT Q 600 при прокалке ПВА при различных температурах. Установлено, что при температурах до 400 – 450 °С в газовой фазе находятся пары воды и аммиака, а в области температур от 450 до 680 °С происходит каталитическая диссоциация аммиака на азот и водород. Катализаторами процесса разложения аммиака являются оксиды вольфрама WO3 и WO29. Экспериментально определенная энергия активации данного процесса составила 75,7 кДж/моль.
-
3. Термодинамические и кинетические исследования процесса получения СОВ прокалкой ПВА в «автогенной» атмосфере позволили установить механизм восстановления WO3 до WO2 , 9. Восстановление вольфрамового ангидрида происходит как при образовании водорода в слое исходного материала при температурах 610 ÷ 650 °С, так и при диффузии водорода из газовой фазы в слой WO3 на завершающей стадии получения СОВ.
-
4. Впервые изучен механизм и кинетика получения СОВ прокалкой ПВА в «автогенной» атмосфере. Показано, что лимитирующей стадией процесса при восстановлении вольфрамового ангидрида водородом, образующимся в слое твердого материала, служит наиболее медленная стадия выделения аммиака из прочной кристаллической структуры h-WO3^NH3 (экспериментальная энергия активации 455 кДж/моль). При восстановлении WO3 водородом из газовой фазы лимитирующей стадией является конвективная диффузия водорода к поверхности вольфрамового оксида (экспериментальная энергия активации процесса 62,5 кДж/моль).
-
5. Проведенные термогравиметрические, рентгенографические, термодинамические и кинетические исследования механизма получения СОВ прокалкой ПВА в «автогенной» атмосфере позволили рекомендовать основные параметры ведения процесса: предварительная отгонка воды из структуры ПВА при температурах 200 – 220 °С, температура прокалки 640 – 650 °С, продолжительность нахождения материала в трубной печи ~ 360 мин.
Статья опубликована при поддержке Программы развития Сибирского федерального университета.


