Изучение механизма электрокаталитического процесса образования молекулярного водорода в присутствии акридиниевых солей
Автор: Аль-обади Ф.Т.А., Долганов А.В., Моисеева Д.Н., Солдатова В.И., Танасейчук Б.С., Цебулаева Ю.В., Шмелькова Н.М., Юрова В.Ю.
Журнал: Огарёв-online @ogarev-online
Статья в выпуске: 19 т.4, 2016 года.
Бесплатный доступ
Изучен механизм электрокаталитической реакции образования водорода в присутствии солей акридиния. Выявлены основные интермедиаты процесса.
Механизм процесса, органические катализаторы, электрокатализ
Короткий адрес: https://sciup.org/147249194
IDR: 147249194 | УДК: 547.829
Текст научной статьи Изучение механизма электрокаталитического процесса образования молекулярного водорода в присутствии акридиниевых солей
В связи с наблюдаемым увеличением энергетических нужд растущего населения и сокращением запасов ископаемых источников энергии в последние десятилетия все больше внимания мирового сообщества уделяется поиску альтернативных видов топлива. На данный момент наиболее перспективным кандидатом для использования в качестве «топлива будущего» является водород, запасы которого в водах мирового океана практически неисчерпаемы. Однако глобальный переход к водородной энергетике и впоследствии к «водородной экономике» возможен только после решения ряда проблем, связанных с производством, хранением и транспортировкой водорода, а также экономической и экологической эффективностью его использования в сочетании с проблемами безопасности. В настоящее время молекулярный водород в основном получают из природного газа [1], что не позволяет ни снизить зависимость от ископаемых ресурсов, ни уменьшить сопутствующие выбросы диоксида углерода в атмосферу. Для решения проблемы интенсивно изучается возможность использования комплексов переходных металлов при помощи бионеорганического (биомиметического) подхода, основанного на имитации функциональной структуры каталитических фрагментов - железо- и/или никельсодержащих гидрогеназ [2]. Эти природные ферменты с высокой эффективностью катализируют как получение молекулярного водорода из воды, так и его окисление в стандартных условиях [3]. Несмотря на высокую каталитическую активность гидрогеназ практически при полном отсутствии перенапряжения, их использование в промышленных масштабах не представляется возможным в виду сложности их получения в больших количествах и их чрезвычайно высокой чувствительности к окружающим условиям (температуре, pH, наличию кислорода) [4]. Таким образом, существующие в настоящее время катализаторы генерации молекулярного водорода не обладают достаточной активностью, стабильностью и доступностью для их успешного применения в водородной энергетике. Недавно нами представлены данные о наличии каталитической активности в процессе получения водорода из кислых органических сред у «безметальных» органических соединений - 10-метил-9-фенилакридин иодида (PhAcrI, см. рис. 1) [5]. В представленной работе представлены данные об изучении механизма протекающего процесса.
Рис. 1. 10-метил-9-фенилакридин иодид (PhAcrI).
Циклические вольтамперограммы (цва) PhAcrI в ацетонитриле, зарегистрированные с использованием стеклоуглеродного электрода, демонстрируют обратимую одноэлектронную волну восстановления при -0,86 В относительно пары Fc/Fc+. Добавление хлорной кислоты привело к сдвигу указанной волны в область более отрицательных потенциалов с одновременным значительным увеличением тока (см. рис. 2). При отсутствии PhAcrI в указанном диапазоне потенциалов не наблюдалось восстановительных процессов; помещение «использованного» электрода в свежий раствор электролита без PhAcrI также не привело к какой-либо каталитической активности. Это свидетельствует о том, что электрокаталитический процесс имеет строго гомогенную природу, и влияние адсорбции катализатора или продуктов его разложения на поверхности электрода минимально.
I, µ A 20
-20
-40
-60
-80
-100 ------------------------1------------------------1------------------------1------------------------1------------------------1------------------------1-----------------------1------------------------1
-1.2 -1.0 -0.8 -0.6 -0.4 E, V
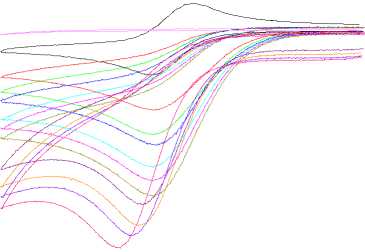
Рис 2. Циклические вольтамперограммы 1,0 мМ раствора PhAcrI в ацетонитриле при следующих концентрациях хлорной кислоты (мМ): 0 ( 1 ); 6,05 ( 2 ); 12,1 ( 3 ); 18,15 ( 4 ); 24,2 ( 5 ); 30,25 ( 6 ); 48,4 ( 7 );
60,5 ( 8 ); 84,7 ( 9 ); 96,8 ( 10 ); 108,9 ( 11 ), а также чистой хлорной кислоты (108,9 мМ) в отсутствии PhAcrI ( 12 ). Условия: скорость развертки 200 мВ с–1, 25 °C, 0,1 M [ n -Bu 4 N][BF 4 ] в ацетонитриле, стеклоуглеродный рабочий электрод. Потенциалы приведены относительно пары Fc/Fc+.
Стоит отметить, что на всех цва не наблюдается характеристичного плато даже при скоростях развертки в 10 В/с (Рис. 3), высоких концентрация как хлорной кислоты (вплоть до 1 M), так и PhAcrI (вплоть до 12,5 mM; см. рис. 3), что свидетельствует об очень быстром электрокаталитическом процессе, ограниченном диффузией субстрата к поверхности электрода.
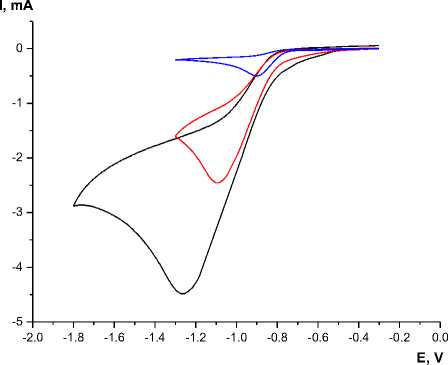
Рис. 3. Циклические вольтамперограммы 12,5 мМ раствора PhAcrI в ацетонитриле в присутствии HClO 4 (1,0 M) при высоких скоростях развертки (мВ с–1): 1000 ( – ), 5000 ( – ) и 10000 ( – ). Условия: скорость развертки 200 мВ с–1, 25 °C, 0,1 M [ n -Bu 4 N][BF 4 ] в ацетонитриле, стеклоуглеродный рабочий электрод. Потенциалы приведены относительно пары Fc/Fc+.
Модельный электролиз при потенциале -0,850 В vs. Fc/Fc+ в течение одного часа (см. рис. 4), проведенный с одновременным хроматографическим анализом газовой смеси из электролизера, подтвердил электрокаталитическое образование молекулярного водорода при значении перенапряжения 0,82 В. Указанное значение было получена как разница между термодинамическим потенциалом восстановления протонов в ацетонитрильном растворе хлорной кислоты и наблюдаемым экспериментально потенциалом на половине каталитического тока. Электролиз 10-5 моль PhAcrI в ацетонитриле в течение одного часа привело к образованию 0,076 ммоль молекулярного водорода (электрический заряд 14,7 Кл, фарадеевский выход 95±5%), что соответствует каталитической активности в 76 моль H2 на 1 моль катализатора в час.
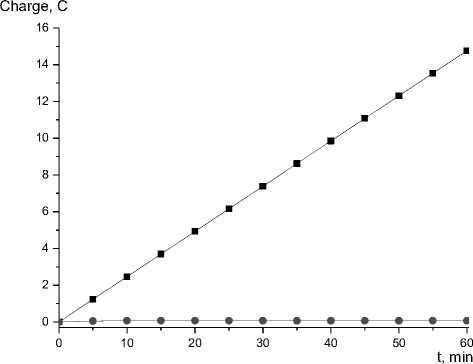
Рис. 4. Временная зависимость электрического заряда, пропущенного в процессе модельного электролиза 0,11 M раствора хлорной кислоты в ацетонитриле при –0,850 В в отсутствии (•) и в присутствии (■) of 10-6 моль PhAcrI. Условия: 25 °C, 0,1 M [ n -Bu 4 N][BF 4 ], стеклоуглеродный рабочий электрод (S = 0,125 см2).
С учетом того, что для PhAcrI известна возможность двух обратимых восстановлений [6], а для получения одной молекулы водорода необходимо два электрона, необходимо рассмотреть два основных возможных механизма электрокаталитической реакции (см. рис. 5). Указанные механизмы по своей сути аналогичных классическим гомолитическому и гетеролитическому механизмам восстановления протона на электрокатализаторах на основе переходных металлов [2]. При этом в случае гетеролитического механизма ожидались бы два последовательных электрохимических восстановления одной и той же молекулы акридина, с протонированием образующегося аниона (путь EEC), либо протонированием промежуточного продукта (путь ЕСЕС); в обоих случаях конечным продуктом являлся бы 9-фенил-10-метил-9,10-дигидроакридин (либо его протонированная форма), способный к фотохимическому отщеплению гидридного иона в присутствии кислорода. Гомолитический механизм подразумевает одноэлектронное восстановление PhAcr+ с последующим протонированием и бимолекулярной реакцией между двумя протонированными частицами, сопровождающейся элиминированием водорода.
Комплексное исследование, проведенное при помощи электрохимии, ЯМР, ЭПР и
UV-vis спектроскопии, позволило предложить следующий каталитический механизм
(см. рис. 5).
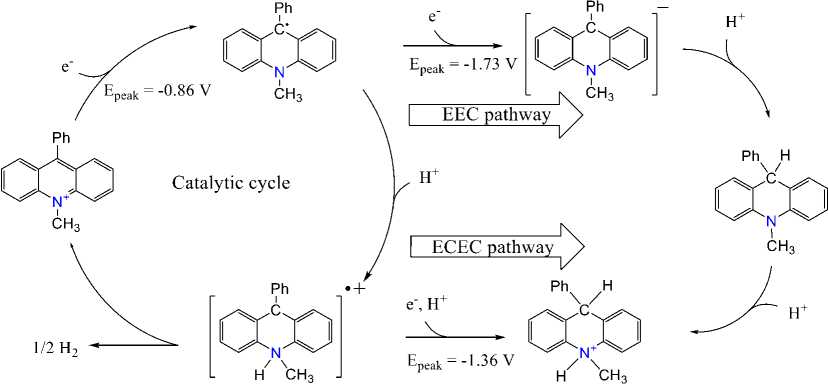
Рис. 5. Возможный электрокаталитический механизм получения молекулярного водорода в присутствии PhAcrI, а также конкурирующие EEC и ECEC механизмы. Приведенные потенциалы относятся к раствору в ацетонитриле и указаны относительно пары Fc/Fc+.
Первый шаг указанного механизма одинаков для обоих возможных вариантов (гомолитического или гетеролитического) и включает электрохимическое восстановление акридильного катиона с образованием радикальных частиц PhAcr', которые были однозначно определены с использованием характеристичного потенциала волны восстановления (–0,86 В vs. Fc/Fc+). При -0,850 В (потенциале, использованном для электрокаталитического получения водорода), второе восстановление образовавшихся радикалов PhAcr' до анионов PhAcr-, соответствующее механизму EEC, невозможно, поскольку оно происходит при значительно более отрицательных потенциалах (-1,73 В vs Fc/Fc+; см. рис. 6). Таким образом, единственно возможных вторым шагом каталитического механизма в этих условиях является протонирование радикалов PhAcr' по атому азота, обладающему максимальной основностью в PhAcr'. Предложенный каталитический механизм является полностью аналогичным распространенному гомолитическому ECC механизму получения молекулярного водорода на электрокатализаторах, содержащих переходные металлы. Важно отметить, что хотя последняя бимолекулярная стадия обычно считается невыгодной с точки зрения практического использования, поскольку ограничивает скорость каталитического процесса, это так только в тех случаях, когда достижение высокой концентрации катализатора невозможно из-за его низкой растворимости или невыгодно экономически из-за его высокой стоимости. В случае легкодоступной и стабильной акридиниевой соли PhAcrI общая скорость электрокаталитического процесса легко может быть увеличена путем простого увеличения концентрации катализатора.
Список литературы Изучение механизма электрокаталитического процесса образования молекулярного водорода в присутствии акридиниевых солей
- Turner J. A. Sustainable hydrogen production // Science. - 2004. - № 305. - P. 972 - 974.
- Artero V., Chavarot-Kerlidou M., Fontecave M. Splitting Water with Cobalt // Angew. Chem. Int. Ed. - 2011. - Vol. 50. - P. 7238 - 7266. EDN: YAXZYJ
- Frey M. Hydrogenases: Hydrogen-Activating Enzymes // ChemBioChem. - 2002. - Vol. 3, № 153. - P. 60- 64.
- Cracknell J. A., Vincent K. A, Armstrong F. A. Enzymes as Working or Inspirational Electrocatalysts for Fuel Cells and Electrolysis // Chem Rev. - 2008. - Vol. 108. - P. 2439- 2461. EDN: MLGZJL
- Dolganov A., Tanaseichuk B., Moiseeva D. V. and all. Acridinium salts as metal-free electrocatalyst for hydrogen evolution reaction // Electrochem Commun. - 2016. - Vol. 68. - P. 59- 63. EDN: WWEXDF
- Koper N. W, Jonker S. A, Verhoeve J. W. Electrochemistry of the 9-phenyl 10-methyl-acridan/acridinium redox system; a high-potential NADH/NAD analogue // Recl Trav Chim Pays-Bas. - 1985. - Vol. 104. - P. 296- 301.


