Изучение молекулярных взаимодействий органических растворителей с водой при производстве лакокрасочных материалов
Автор: Язов Анатолий Николаевич
Журнал: Технико-технологические проблемы сервиса @ttps
Рубрика: Методические основы совершенствования проектирования и производства технических систем
Статья в выпуске: 2 (8), 2009 года.
Бесплатный доступ
Исследованы концентрационные и температурные зависимости ЯМР спектров и времён релаксации бинарной системы бутилцелозольв (БЦ) - вода. Обнаружены как химические, так и физические взаимодействия между молекулами обоих веществ, которые приводят к образованию гомогенной системы комплексов переменного состава
Органические растворители, спектры и времена релаксации воды, расслоении смеси, синглет
Короткий адрес: https://sciup.org/148185776
IDR: 148185776 | УДК: 667.647.21
Текст научной статьи Изучение молекулярных взаимодействий органических растворителей с водой при производстве лакокрасочных материалов
Одним из органических растворителей (сорастворителей) применяемым в химической промышленности, например, при производстве водорастворимых лакокрасочных материалов (ЛКМ) является бутилцеллозольв (моно бутиловый эфир этиленгликоля) – БЦ: С 4 Н 9 –О–С 2 Н 4 –ОН. Обладая одновременно свойствами сложных эфиров и спиртов, БЦ в нормальных условиях неограниченно смешивается с водой. При этом происходит выделение тепла [1].
Изотерма вязкости образовавшейся смеси имеет максимум при 25 0С [1,2]. Смесь имеет нижнюю и верхнюю критические температуры смешения (НКТС – 49,1 0С и ВКТС – 128,0 0С) [1– 3]. Концентрационные исследования смеси позволили установить отклонения следующих эмпирических параметров от расчётных для аддитивной системы:
-
-коэффициентов вязкости смеси Δ h (максимальное при мольной концентрации воды 0,6– 0,8 [2]);
-
-мольных объёмов {имеют два максимума – при мольной концентрации воды 0,8 (главный) и 0,4 (побочный) [2]};
-теплот смешения (имеют максимум при мольной концентрации воды – 0,7 [1]).
Полученные данные позволяют предположить существование трёх типов соединений БЦ с водой – 2БЦ:Н 2 О, БЦ:2Н 2 О и БЦ:4Н 2 О [1,2]. Однако они не дают возможность однозначно судить о характере механизма взаимодействий БЦ с водой. Поэтому целью настоящей работы было изучение молекулярных взаимодействий при помощи спектроскопии и релаксометрии ЯМР.
Для проведения исследований были выбраны дистиллированная вода и БЦ МРТУ6– 01– 222– 68, который осушали перегонкой над плавленым хлористым кальцием СаСl 2 [4]. При этом добивались чистоты БЦ обеспечивающей ему относительное отклонение показателя преломления n D 20 менее 1,00 % от значения 1,4191 [4]. Затем оба вещества смешивали в различных пропорциях, использовав для этого стандартную методику [5].
ЯМР– спектры и времена релаксации воды, БЦ и приготовленных смесей определяли на спектрометре "Тес-ла– 467" и опытном релаксометре. Резонансная частота первого – 60 МГц, а второго – 15 МГц. Параметры последнего близки спектрометру– релаксомет-ру "Брукер Миниспек n– 20". Спектры снимали адиабатически медленно варь- ируя условия резонанса [6– 8]. В качестве внешнего эталона использовали тетраметилсилан (ТМС) и циклогексан (ЦГ). Для определения времени релаксации при помощи серии Карра– Парселла–Мейбумма–Джилла в исследуемом образце возбуждали релаксационный процесс [6– 8]. Его кривую затем анализировали с помощью ЭВМ по специальной программе выявления неэспо-нентциальности и расчёта параметров релаксирующих компонентов. В основу программы положен алгоритм для выделения отдельных экспонент из суммарной кривой подобной методике [9]. Относительная погрешность определения времён релаксации не превосходила 3 % [10].
Спектральные исследования, частично представленные на рис. 1 позволили установить, что резонансная линия ОН– группы БЦ в исходном веществе триплет, а смесях – синглет. Причём синглет общий для БЦ и воды. При расслоении смеси он распадается на два синглета. Их положение отражает перенос зарядов между компонентами, а форма (ширина) – особенности молекулярных движений [6– 8]. Теоретическая для быстрого протонного обмена без химического межкомпонентного взаимодействия (расчётная для аддитивной системы [8,11]) и эмпирическая концентрационные зависимости положения синглета от концентрации воды в смеси приведены на рис. 2 (кривые δ р и δ э ). Влияние температуры (температурное изменение спектра) сказывается лишь на положении синглета ОН– группы и отражено на рис. 3.
Исследования показали, что релаксация всех исследуемых систем строго экспоненциальна и характеризуется единственным временем. Оно отражает особенность движений молекул компонентов смеси значительно точнее, чем форма линии [6,7].
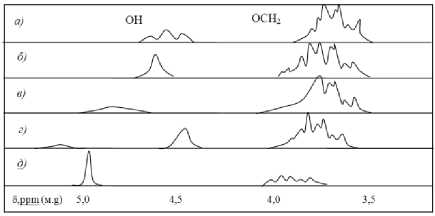
Рис. 1 - ЯМР спектры исследуемой смеси: а) - бутилцеллозольва (БЦ - t0 =30 °C); б) - БЦ- вода, мольное межкомпонентное соотношение - 0,7985:0,2015 (t ° = 3° ° C); в) – БЦ– вода, мольное межкомпонентное соотношение - 0,6017:0,3985 (t0 = 30 0C); г) -БЦ– вода, мольное межкомпонентное соотношение - 0,2430:0,7570 (t0 = 90 0C); д) -БЦ– вода, мольное межкомпонентное соотношение – 0,2430:0,7570 (t0 = 30 0C).
Теоретическая для быстрого протонного обмена без физического и химического взаимодействий (расчётная для аддитивной системы [8,12]) и эмпирическая концентрационные зависимости времён релаксации для смеси приведены на рис. 2 (кривые Т 2р и Т 2э ).
Единственные времена релаксации и одинаковая ширина линий в спектрах смесей позволяют предполагать как интенсивный межкомпонентный обмен между протонами, так и упорядоченное расположение молекул воды и БЦ, которое обуславливает синхронность их движений. Разность между теоретическим δр и эмпирическим δэ положением синглета Δδ в спектре смесей указывает на перенос заряда и образование химической связи – водородных мостиков между OH– группами молекул обоих компонентов. Температурная зависимость положения синглета δэ позволяет считать указанную связь водородной. Концентрационная зависимость δэ позволяет выявить близкую величину переноса заряда – энергии связи вода–БЦ для диапазона мольных концентраций воды 0,15– 0,30 и 0,5– 0,8 со слабовыраженным главным максимумом Δδ при 0,66 и побочным максимумом Δδ при 0,25, а также резко выраженным минимумом Δδ при 0,36. Это означает, что молекулы воды и БЦ образуют за счёт переноса заряда комплексы переменного состава, среди которых незначительно выделяются комплексы с мольными соотношениями БЦ:вода – 3:1 и 1:2, как обладающие наиболее сильной связью. Причём перенос заряда для второго в 2,5 раза больше, чем для первого. В комплексе же с мольным соотношением БЦ:вода – 2:1 перенос заряда химическое взаимодействие через ОН– группы практически отсутствует. По– видимому, влияние на молекулу воды одной молекулы БЦ компенсировано другой молекулой БЦ.
Наблюдаемые времена релаксации Т 2э значительно меньше расчётных Т 2р , что указывает на замедление, а не на усреднение интенсивности молекулярных движений в смеси. Слабо выраженный минимум Т 2э отмечен у смеси содержащей 0,66 молей воды. Разность между теоретическим Т 2р и эмпирическим Т 2э значениями времён релаксации ΔТ 2 указывает на более существенное замедление движений молекул у смеси содержащей 0,8 молей воды. Следовательно, в комплексах вода– БЦ наряду с химической связью через ОН– группы существует и другая, которая в наших исследованиях проявляется как физическая – без переноса заряда между радикалами. Возможно это взаимодействие воды с эфирным кислородом БЦ. Отмеченная связь наиболее существенна для комплекса с мольным отношением БЦ– вода – 1:4. При уменьшении содержания воды в комплексах эта связь ослабевает медленно, а при возрастании – быстро.
Совместное действие обоих видов взаимодействий обуславливают стабильность связывания одной молекулой БЦ четырёх молекул воды. При большем содержании воды оба компонента связи БЦ–вода ослабевают, что способствует расслоению смеси.
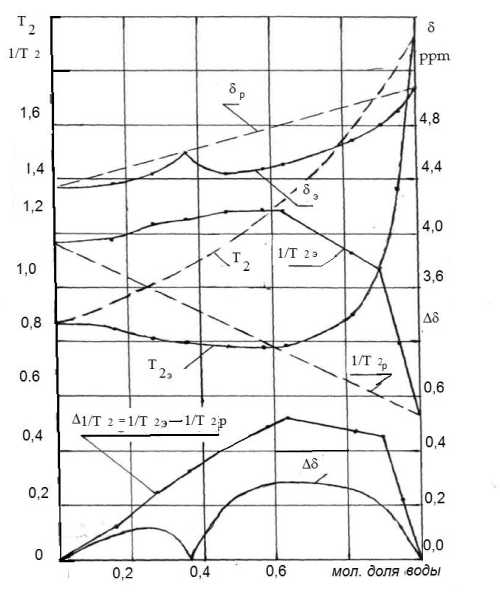
Рис. 2 - Концентрационные зависимости: δ Р – расчётная для химического сдвига ОН– групп в аддитивной (виртуальной) системе БЦ–вода при быстром протонном межкомпонентном обмене без химического взаимодействия; δ Э – эмпирическая для синглета ОН– групп воды и БЦ; Т 2Р и 1/Т 2Р – расчётные для времени и скорости спин– спиновой релаксации протонов в аддитивной (виртуальной) системе БЦ–вода при быстром протонном межкомпонентном обмене без химического и физического взаимодей-ствий;Т 2Э и 1/Т 2Э – эмпирическая для времени и скорости спин– спиновой релаксации реальной системы БЦ–вода; Δδ – разность между расчётным и эмпирическим значениями химического сдвига; ΔТ 2 . и Δ1/Т 2 = 1/Т 2Э – 1/Т 2Р – разности между расчётным и эмпирическим значениями времён и скоростей релаксации.
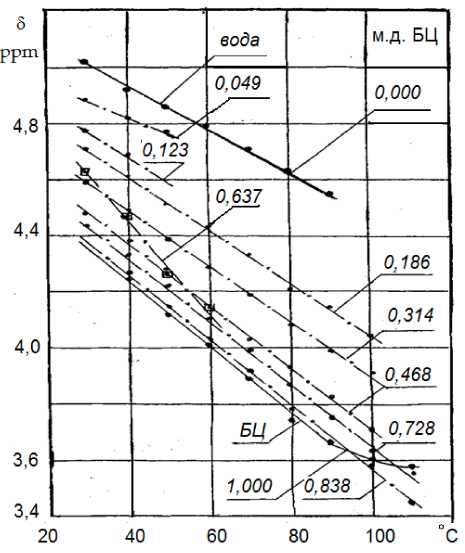
Рис. 3 Температурная зависимость химического сдвига ОН– групп в: – исходных веществах (вода и БЦ); – смесях с обобщёнными ОН– группами при различных мольных доля БЦ.
Повышение температуры приводит к смещению синглета воды, триплета ОН– групп в исходных веществах и общего синглета ОН– групп БЦ и воды в смесях в сторону сильных полей. Причём это смещение практически одинаково и линейно. Но для ОН– групп БЦ в исходном веществе оно линейно при температурах 30– 80 0С, а для ОН– групп смесей – 30–110 0С. Возможно это проявление изменения соотношения между внутри– и межмолекулярными водородными связями в БЦ при смене конформации структуры, а также стабилизации связей обусловленной внедрением воды. Подобные эффекты выявляли в растворах гликолей и их производных другие исследователи при помощи ИК– спектроскопии [13]. Они также отмечали, что увеличение в растворе содержания воды уменьшает температур- ную зависимость изучаемых смесей. Возможно это проявление уменьшения числа водородных связей в комплексах. Оно позволят предполагать циклическую структуру ассоциатов в БЦ, которая переходит в линейную структуру комплексов по мере растворения БЦ водой. Однако в исследуемом ансамбле есть исключение – ранее отмеченная смесь с мольным отношением БЦ:вода – 2:1. Характер её температурной зависимости δэ позволяет предполагать, во– первых, что существует оптимальное насыщение возникающих в смеси комплексов водородными связями. А, во– вторых, что оно реализуется при мольном отношении БЦ:вода – 2:1. Это возможно при включении дополнительного источника межкомпонентных связей – атома эфирного кислорода. Можно предполагать, что его акцепторные свойства и компенсируют влияние водородного мостика на сдвиг сигнала ОН– групп в спектре смеси.
Всё это позволяет заключить, что между молекулами БЦ и воды действуют дополняющие друг друга, разные по природе и проявлению химические и физические связи. Постоянным участником и источником первых являются ОН– группы, которые подобно ОН– группам молекул спирта образуют с водой водородные мостики. Но эти мостики затрудняют изучение выбранным методом механизм влияния эфирного кислорода на воду. Молекула БЦ благодаря способности к химическим и физическим взаимодействиям, во– первых, может связать четыре молекулы воды. При этом можно предполагать, что молекула БЦ взаимодействует с двумя молекулами как физически, так и химически (обмениваясь с ними зарядом). С двумя другими она, по– видимому, взаимодействует только физически – индуцируя ван– дер– ваальсовы связи или же взаимодействует через эфирный кислород как физически, так и химически. Однако при этом суммарная химическая связь между молекулой БЦ и молекулами воды ослабевает из– за перераспределения заряда между четырьмя одинаковыми молекулами. Во– вторых, БЦ и вода могут образовывать комплексы переменного состава, среди которых выделяются четыре: 3БЦ:Н2О, 2БЦ:Н2О, БЦ:2Н2О и БЦ:4Н2О. Первый и третий из них возникают через химические взаимодействия ОН– групп. Второй – через насыщение водородными связями взаимодействующих ОН– групп. Возможно, что при дополнительном подключении эфирного кислорода эти взаимодействия ослабляются. Четвёртый – через совместное влияние химических и физических связей. При этом можно предполагать, что первый является результатом внедрения молекулы воды в ассоциат БЦ. Второй и третий – замещения в ассоциате БЦ одной или двух молекул. Четвёртый – окончательного разрушения ассоциатов БЦ и образования собственных комплексов смеси БЦ– вода. Переход от ассоциатов к комплексам предположительно связан с изменением конформации молекул БЦ. По– видимому, она способствует образованию комплексов переменного состава – линейных n– меров, образованных чередованием молекул БЦ и воды.


