Изучение особенностей аккумуляции ионов тяжелых металлов водными растениями и роли липидов в адаптации к ним
Автор: Розенцвет O.A.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Водные экосистемы
Статья в выпуске: 1 т.8, 2006 года.
Бесплатный доступ
Изучены особенности аккумуляции ионов тяжелых металлов (ТМ) - (Al+3, Cu+2, Cd+2, Pb+2, Zn+2) - водным растением Potamogeton perfoliatus. Степень накопления ионов ТМ зависела от экзогенных факторов (концентрации, времени экспозиции, природы ТМ) и эндогенных фазных органов растения, возраста). Выявлено, что действие ионов ТМ приводит к изменениям в липидном метаболизме: изменении соотношения липидных классов, индивидуальных фосфо- и гликолипидов.
Короткий адрес: https://sciup.org/148197814
IDR: 148197814 | УДК: 628.581:13.577.7.15
Текст научной статьи Изучение особенностей аккумуляции ионов тяжелых металлов водными растениями и роли липидов в адаптации к ним
Институт экологии Волжского бассейна РАН,г.
Изучены особенности аккумуляции ионов тяжелых металлов (ТМ) - (Al+3, Cu+2, Cd+2, Pb+2, Zn+2) -водным растением Potamogeton perfoliatus. Степень накопления ионов ТМ зависела от экзогенных факторов (концентрации, времени экспозиции, природы ТМ) и эндогенных (разных органов растения, возраста). Выявлено, что действие ионов ТМ приводит к изменениям в липидном метаболизме : -нении соотношения липидных классов, индивидуальных фосфо- И гликолипидов .
Проблема повышенного содержания тяже-лых металлов (ТМ) в окружающей среде с каждым годом приобретает все большую ак-туальность. Металлы представляют серьез-ную угрозу для биоты вследствие их острой токсичности для организмов и постепенно-го накопления их в окружающей среде до опасного уровня. Уровень, при котором они становятся действительно опасными, зави-сит не только от степени загрязнения ими окружающей среды, но и от химических осо-бенностей металла и его биохимического цикла [1].
В отличие от других факторов среды, вли-яние которых на живые объекты, равно как и ответные реакции живого на эти факторы, хорошо изучены, эколого-биохимические ме-ханизмы адаптации к воздействию ТМ ис-следованы в меньшей степени . Особенно это касается водных экосистем и водных обита-телей, поскольку вопросы адаптации водных организмов к загрязнению окружающей сре-ды имеют в настоящее время первостепен-ное значение [2].
Учитывая опасность ТМ для здоровья че-ловека, исследование механизмов токсично-сти ТМ на объекты различного уровня орга-низации проводятся во многих лаборатори-ях мира [3-7]. При этом усилия исследовате-лей направлены как на решение фундамен-тальных задач , связанных с изучением меха-низмов адаптации растительные организмов к изменениям условий обитания, так и при-кладных задач , таких как фиторемидиация загрязненных территорий [8].
Целью данной работы было сравнитель-ное изучение особенностей аккумуляции ионов ТМ водным растением Potamogeton perfoliatus (рдест пронзеннолистный), а так-же роли одного из важнейших компонентов жизнедеятельности клетки - липидов в про-цессах адаптации данного вида растений к этому виду загрязнений окружающей среды .
Результаты и их обсуждение
При изучении влияния загрязнения вод-пых источников солями тяжелых металлов и их влияния на водные растения было исполь-зовано натурное моделирование с примене-нием мезокосмов, устанавливаемых непос-редственно в водоеме. Использование этого метода позволяло наиболее полно учесть всю совокупность абиотических и биотических факторов, определяющих поведение ТМ в це-лостной гидросистеме [9]. Согласно этой ме-тодике, в мезокосмы (в нашем случае, ЦИЛИН-дрические окрашенные емкости объемом 250 л, отграничивающие до дна несколько расте-ний вместе с корнями), изолирующие учас-ток материнской экосистемы с сохранением ее основных параметров, вводили заданные порции ТМ в виде нитратных солей. Конт-ролем служили растения, отобранные до на-чала эксперимента из каждой емкости, рас-
, ( ),
, -
,
( ).
В качестве исследуемых металлов были : Cu, Cd,
Pb, Zn Al.-
. -, -
-
Hg, Pb, Cd, As, Zn,-
,-
-
Из этого списка приоритетных загрязнителей Cd, Pb, Zn, наиболее распространенные и актуальные для акваторий Саратовского и Куйбышевского
.,
.-
, , ,-
Cd, Pb, Zn-
, ,-
--
,-
.,
,,
,-
,,
.
С химической точки зрения ТМ являются металлами, имеющими свободные d- орб ита-
. ,, -
, Zn Al,-
, Zn-
,
[11].,
-
.-
- трациях эти металлы способны оказывать
,
.-
-
.-
,-
,,
,
.
-копление ТМ в макрофитах отличается от
.-
-
[12,
13].- ренные элементы поглощаются из воды всей поверхностью и аккумуляция определяется
-
.-
-
-
-
, .
, ,- кумуляции ионов используемых металлов в различных органах исследуемого водного
.- тов по динамике поступления ТМ в листья . 1.
,-
, в присутствии ТМ в течение трех суток было
.
Через три дня содержание меди составило 74,4, 33,0 25,3 /
-
, 1000 / .
. 1, -
.
Исследуемый вид рдеста наиболее активно
.
-
[14-16].
-
, -
-
. . -
-
-
, , - ная способность листьев рдеста уменьшалась
.
Таблица 1.Динамика аккумуляции ионов ТМ в листьях Potamogeton perfoliatus по результа-там атомно-адсорбционного анализа
|
Концентрация металла в водной среде, мкмоль/л |
Концентрация металла в листьях, мг на г сухой массы |
||
|
Время экспозиции, сут. |
|||
|
1 |
2 |
3 |
|
|
Cd 1 |
0,3 |
0,5 |
0,7 |
|
Cd 10 |
1,0 |
1,1 |
3,7 |
|
Cd 100 |
12,4 |
22,3 |
24,7 |
|
Cd 1000 |
15,3 |
32,5 |
33,0 |
|
Cu 1 |
0,1 |
0,1 |
0,2 |
|
Cu 10 |
1,0 |
2,2 |
4 ,4 |
|
Cu 100 |
11,5 |
23,7 |
24,6 |
|
Cu 1000 |
44,3 |
68,0 |
74,4 |
|
Zn 10 |
0.3 |
0,4 |
0,6 |
|
Zn 100 |
4,2 |
13,3 |
15,7 |
|
Zn 1000 |
11,3 |
25,2 |
25,3 |
|
Pb 100 |
2,8 |
3,5 |
3,9 |
|
Al 100 |
3,2 |
3,6 |
4,4 |
Было проанализировано также накопле-ние металлов в разных органах Potamogeton perfoliatus (корнях, стеблях, листьях) и в лис-тьях разного возраста (табл. 2). При этом раз-деление листьев на разные возрастные кате-гории проводились следующим образом . Листья розетки, обычно 1-4 ярус , принима-лись за молодые листья, листья 5-9 ярусов -за листья среднего возраста и листья ниже 9 яруса - за старые листья.
Таблица 2. Содержание ионов металлов в разных частях растения Potamogeton perfoliatus через одни сутки воздействия при начальной концентрации солей металлов в воде 100 мкмоль/л
|
Часть растения |
Cu |
Cd |
Zn |
Pb |
Al |
|
Молодые листья |
3,7 |
11,1 |
2,3 |
3,9 |
3,6 |
|
Зрелые листья |
8,3 |
6,9 |
5,6 |
3,8 |
3,6 |
|
Старые листья |
17,8 |
6,9 |
6,2 |
2,9 |
2,5 |
|
Стебли |
0,6 |
6,6 |
0,5 |
0,5 |
8,0 |
|
Корни |
0,3 |
1,6 |
0,2 |
0,3 |
1,8 |
Данные табл . 2 показывают, листья, но и стебли и корни, аккумулировали металлы . Причем степень накопления в раз- ных органах растения зависела от природы металла. Так, медь максимально накаплива-лась в ранее сформированных старых листь-ях , кадмий и свинец - в молодых макушеч-НЫХ листьях, а алюминий - в стеблях. Корни растения менее всего аккумулировали ионы ТМ .
Таким образом, несмотря на то,что ввод-ных растениях воздействию металлов под-вергаются все органы одновременно , распре-деление ионов металлов в этих органах ока-залось весьма неравнозначным и зависело от природы металла.
Сравнительное исследование роли липи-дов в ответных реакциях на воздействие ионов ТМ проводили по следующим показа-телям : , COOT-ношению липидных классов, соотношению индивидуальных фосфо- и гликолипидов.В табл . 3 приведены данные по содержанию общих липидов ( ОЛ ) через трое суток воздей-ствия всех испытанных металлов при началь-ных концентрациях 10 и 100 мкмоль/л. Из этих данных видно, что действие ионов ТМ приводило к снижению количества ОЛ в той или иной степени . Но наиболее токсичными для липидов рдеста оказались ионы меди и кадмия, которые, по-видимому, -ли синтез новых липидов , в результате чего разрушение липидов не восполнялось вновь синтезированными липидами и количество ОЛ снижалось в 1,5-2 раза.
Таблица 3. Зависимость изменения коли-чества общих липидов в листьях Potamoge-ton perfoliatus от природы ТМ, время экспо-зиции - трое суток
|
Концентрация металла в водной среде, мкмоль/п |
Содержание общих липидов, мг/г сырого веса |
|
Фон |
22,4± 1,8 |
|
Контроль |
20,1±1,6 |
|
Cu 10 |
9,4 ± 1,3 |
|
Cu 100 |
7,7 ± 0,8 |
|
Cd 10 |
13,5 ± 1,1 |
|
Cd 100 |
9,3 ± 0,8 |
|
Zn 10 |
16,8± 0,8 |
|
Zn 100 |
14,9 ± 1 |
|
Pb 10 |
15,8 ± 3,4 |
|
Pb 100 |
12,1 ± 2,1 |
|
Al 100 |
18,5±0,9 |
Таким образом, первый «ответ» липидов растений на присутствие ионов металлов в среде был связан со снижением количества синтезируемых липидов .
Дальнейшее определение содержания ос-новных классов липидов в данных условиях показывал на перестройку метаболизма ли-ПИДОВ , проявляющейся в изменении соотно-шения гликолипидов ( гл), фосфолипидов ( ФЛ ) и нейтральных липидов (НЛ). При этом разные металлы и разные концентрации этих металлов имели различный эффект на состав липидов . Сравнительное исследование вли-яния всех исследованных металлов в равных условиях на соотношение липидных классов приведено в табл. 4. Данные этой таблицы показывают, имеет разную направленность. Если ионы меди при 100 мкмоль/л и кадмия при 10 и 100 мкмоль/л действовали таким образом, что снижалось содержание полярных липидов, как ФЛ, так ГЛ, то действие ионов свинца при двух испытанных концентрациях (10 и 100 мкмоль/л) было направлено на снижение сии-теза хлоропластных ГЛ . Ионы цинка вызы-вали меньшие изменения в соотношении ли-пидных классов, хотя при концентрации 100 мкмоль/л наблюдалось снижение содержания ФЛ по сравнению с контрольными образца- МИ . Но это снижение содержания ФЛ было заметно меньше в сравнении со снижением количества ФЛ, наблюдаемое при действии ионов кадмия и меди.
Таблица 4. Соотношение нейтральных (НЛ), глико- ( ГЛ ) и фосфолипидов ( ФЛ ) в листьях Potamogeton perfoliatus в зависимости от концентрации и природы ТМ. Время экспо-зиции - трое суток
|
Концентрация солей, мкМ |
Содержание липидов, %от суммы |
||
|
НЛ |
ГЛ |
ФЛ |
|
|
Фон |
28,5 ± 2,3 |
41,0 ± 3,9 |
30,5 ± 2,4 |
|
Контроль -1 |
30,0 ± 1,7 |
41,6 ± 4,9 |
28,4 ± 0,7 |
|
Cu - 10 |
29,9 ± 0,8 |
38,8 ± 0,5 |
31,3 ± 0,8 |
|
Cu - 100 |
53,0 ± 7,3 |
28,1 ± 3,3 |
18,8 ± 1,9 |
|
Cd - 10 |
48,6 ± 1,4 |
36,0 ± 2,8 |
15,2 ± 2,8 |
|
Cd -1 00 |
57,9 ± 4,1 |
26,4 ±0,2 |
15,8 ± 1,5 |
|
Zn - 10 |
27,2 ± 2,2 |
43,2 ± 3,8 |
29,5 ± 4,3 |
|
Zn - 100 |
35,4 ± 1,6 |
40,5 ± 3,1 |
23,8 ± 3,6 |
|
Pb - 10 |
32,7 ± 4,5 |
35,6 ± 4,2 |
31,6 ± 2,8 |
|
Pb - 100 |
35,0 ± 0,1 |
30,9 ± 2,1 |
34,0 ± 2,2 |
|
Al - 100 |
26,4 ± 2,5 |
34,1 ± 2,8 |
39,8 ± 4,2 |
Из полученных результатов можно пред- ПОЛОЖИТЬ , что , по-видимому, от специфичности металла затрагиваются разные линии синтеза полярных липидов.
Поскольку полярные липиды становились главной мишенью воздействия ионов ТМ, то более подробно был исследован состав ин-дивидуальных ФЛ под воздействием ионов ТМ . В наших предыдущих исследованиях было показано, что ФЛ данного вида расте-ния состоят из фосфатидилхолина ( ФХ), фос-фатидилэтаноламина (ФЭ), фосфатилглице-рола (ФГ), фосфатидилинозитола (ФИ) и фос-фатидной кислоты (ФК) [17]. Главными в количественном отношении являются ФХ, ФЭиФГ.
при одинаковой концентрации 100 мкмоль/л разных металлов приведены на рис. 1-3.
Все ионы исследуемых ТМ в данной кон-центрации мало влияли на количество ФХ, за исключением ионов кадмия, действие ко-торых приводило к снижению его уровня.в отличие от ФХ содержание ФЭ под действи-ем некоторых металлов менялось драмати-чески . Причем в изменении данного липида особенно четко проявилась специфика каж-дого из исследуемых ТМ . Если динамика из-менения этого липида под действием ионов цинка не отличалась от контроля, то под дей-ствием ионов алюминия количество ФЭ уве-личивалось . Но действие ионов меди, кадмия и свинца было направлено на снижение ко-личества ФЭ вплоть до полного исчезнове-ния из состава ФЛ. Специфичность воздей-ствия разных ТМ проявилась и в изменении содержания ФГ.
были индифферентны к ФГ, меди и кадмия приводило к увеличению вкла-да ФГ, .
Таким образом, на примере главных ФЛ выявлены устойчивые и чувствительные ли-нии синтеза индивидуальных ФЛ в зависи-мости от специфики металла и действующей концентрации этих металлов.
Одной из мишеней при атаке иона метал-ла становятся хлоропластные липиды, о чем свидетельствует увеличение доли ФГ - фос-фолипида, который стабилизирует светосо-бирающий комплекс ФС II. Это подтвержда-
ФХ
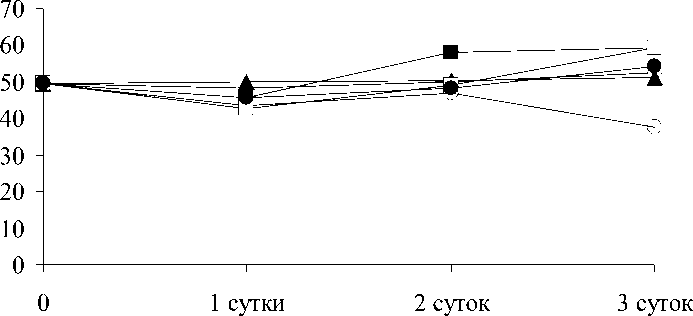
Время экспозиции
Zn Cu Cd Pb Al
. 1.
Potamogeton perfoliatus
100 / 3- ется и соотношением липидных классов
(. 4)
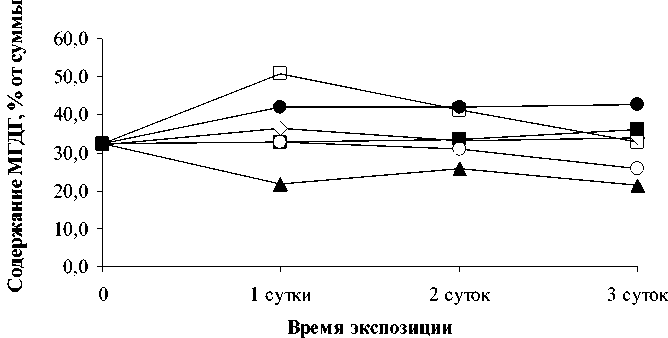
( ) ( . 4-6).- ния ионов всех изученных ТМ при равных
-
.
49,0-54,5% .- действии ионов цинка в течение трех суток
44,1
-59,7%, ионов кадмия - 41,7-35,5%, ионов
ФЭ
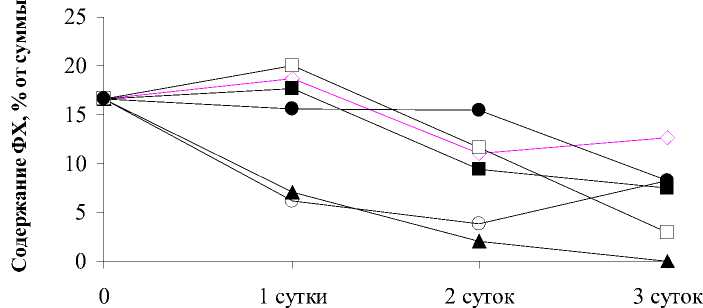
Время экспозиции
Zn Cu Cd Pb Al
. 2.
Potamogeton perfoliatus
100 / 3-
ФГ
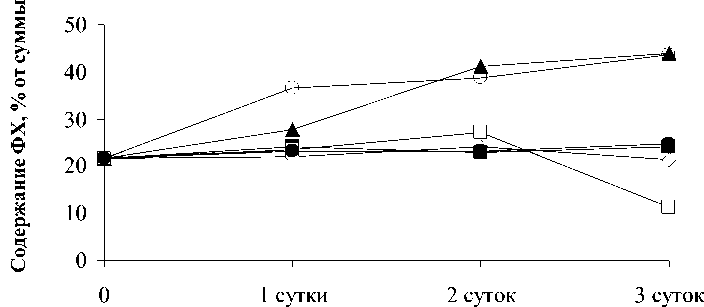
Время экспозиции
Zn Cu Cd Pb Al
. 3.
Potamogeton perfoliatus
100 / 3
48,2-60,8%,39,2
52,4%, - 48,6-49,1%-
. ,-
-
.-
,
( . 4).
В отношении второго галактолипида ДГДГ
,
33,6%
36,3% -
.
разных концентраций нитрата цинка за этот
-
32,9-36,0%,
.
мгдг
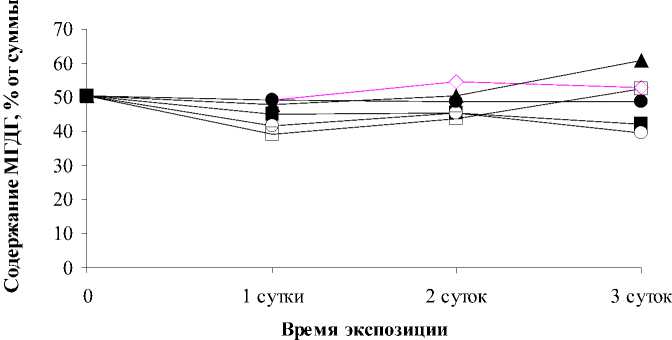
Zn 100 Cu 100 Cd 100
Pb 100 Al 100
. 4. Potamogeton perfoliatus при воздействии исследованных ионов ТМ в концентрации 100 мкмоль/л
ДГДГ
Zn 100 Cu 100 Cd 100
Pb 100 Al 100
. 5. Potamogeton perfoliatus
100 /
-
.-
-
24,6 -34,0%,
20,7-29,4%, 32,9-50,9%,
41,8-42,8%.
,- вали в направлении снижения количества
.,
-
,-
( . 5).
-
,, свинца и снижалось под действием ионов
( . 6).
,
,- схдг

Zn 100 Cu 100 Cd 100
Pb 100 Al 100
. 6. Potamogeton perfoliatus при воздействии исследованных ионов ТМ в концентрации 100 мкмоль/л
чае с фосфолипидами, выявлен специфичес-кий отклик на воздействие разных ТМ.
Таким образом, изучены особенности ак-кумуляции ионов тяжелых металлов (Al+3, Cu+2, Cd+2, Pb+2, Zn+2) водным растением Potamogeton perfoliatus. Степень накопления ионов ТМ зависела от экзогенных факторов (концентрации, времени экспозиции , приро-дыТМ) и эндогенных (разных органах расте-НИЯ , возраста). На примере одного вида вод-ных растений показана роль липидов в от-ветных реакциях на воздействие ионов ТМ как одного из неблагоприятных абиотичес-ких факторов антропогенного характера. Не-смотря на разную направленность действия ионов ТМ, общая роль липидов заключается в изменении соотношения липидных классов,
. Аналогичные изменения были характерны для растений при встрече с другими стрес-совыми воздействиями (низкая температура, соленость, гипоксия ит. .) [18]. Это говорит о том , что механизмы адаптации (реагирова-НИЯ) живой системы на внешние воздействия на биохимическом уровне являются достаточ-но однотипными и рациональными . В то же время из полученных результатов можно еде-лать вывод, что растительная клетка имеет в своем арсенале набор приспособительных механизмов, которые она реализует, тем неблагоприятным факторам, которых она ранее не встречала.
Объекты и методы исследования
На мелководном участке акватории Сара-товского водохранилища с обильными зарос-лями рдеста пронзенолистного (Potamogeton perfoliatus L.) были установлены емкости, от-граничивающие до дна 10-12 растений вме-сте с корнями. В емкостях поддерживали объем природной воды 135-140 л. В течение трех суток через каждые 24 ч в емкости до-бавляли Cd (NO3)2 для поддержания концен-траций - 1, 10, 100 и 1000 мкмоль/л. Для ана- лизов использовали листья , стебли и корни . Отобранные для анализа образцы раститель-ного метериала тщательно промывали в про-точной воде, подсушивали фильтровальной бумагой , взвешивали и использовали для ана-лиза содержания липидов . Полученные дан-ные, приведенные в таблицах и на рисунках, представляют средние значения трех биоло-гических повторностей.
Экстракцию липидов проводили по мето-ду Блайя и Дайера [19]. Липиды разделяли методом тонкослойной хроматографии (тех) на пластинках (10х10 см и 6X6 см) с закреп-ленным слоем силиказоля (эстонская фирма «Хаапсалу»). Для анализа гликолипидов ис-пользовали систему растворителей :
бензол - вода (91:30:8). Фосфолипиды ана-лизировали двумерной ТСХ с применением систем растворителей :
- бензол - аммиак (130:60:20:12)- первое на-правление и хлороформ - метанол - бензол -ацетон - уксусная кислота (140:60:20:10:8) второе направление . Общее количество ли-пидов определяли гравиметрическим спосо-бом . Количественное определение фосфоли-пидов проводили методом Васьковского [20], гликолипидов - по содержанию галактозы с антроновым реагентом [21].
Определение содержания ТМ в тканях ра-стений проводили по методу Голубкиной [22]. Навеску воздушно-сухого растительно-го материала (30-50 мг) заливали смесью кон-центрированной азотной (1,5 мл) и хлорной (0,8 мл) кислот и оставляли на сутки. Затем с помощью термостата пробы прогревали по 1 часу последовательно при 1200С, 1500С и 1800С и после охлаждения до 1500С вносили в них по 5-6 капель концентрированной 2О 2. Через 10 мин к пробам приливали 1 мл 6 М раствора НСl и выдерживали их 10 мин при температуре 1100С. После обесцвечива-ния растворов концентрацию ТМ измеряли на атомно-абсорбционном спектрофотомет-ре Hitachi-207 (Япония).
Список литературы Изучение особенностей аккумуляции ионов тяжелых металлов водными растениями и роли липидов в адаптации к ним
- Бингам Ф.Т., Коста М., Эйхенбергер Э. и др. Некоторые вопросы токсичности ионов металлов/Под ред. X. Зигель, А. Зигель. М.: Мир, 1993.
- Ипатова В.И. Адаптация водных растений к стрессовым абиотическим факторам среды. М.: "Графикон-принт" 2005.
- Maksymiec W., Russa R., Urbanik-Sypniewska T., Baszynski T. Changes in acyl lipid and fatty acid composition on thylakoids of copper nontolerant spinach exposed to excess copper//J. Plant Physiol. 1992. V. 140.
- Kupper H., Kupper F., Spiller M. In situ detection of heavy metal substituted chlorophylls in water plants//Photosynthesis Res., 1998. V.
- Rama Deli S., Prasad M.N.V. Membrane lipid alteration in exposed plants//Heavy metal stress in plants. From molecules to ecosystems. Berlin: Springer, 1999.
- Stefanov K., Kimenov G., Popova I., et al. Lipid and sterol changes in plants and invertebrates caused by environmental pollution//Bulgarian Chemical Comm. 1992. V. 25.
- Guilizzoni P. The role of heavy-metals and toxic materials in the physiological ecology of submersed macrophytes//Aquatic Botany. 1991. V 41, № 1-3.
- Демидчик В.В., Соколик A.И., Юрин B.M. Токсичность избытка меди и толерантность к нему растений//Успехи совр. биол. 2001. Т. 121, №5.
- Ильин В.Б. Тяжелые металлы в системе почва-растение. Новосибирск: Наука, 1991.
- Холодова В.П., Волков К.С., Кузнецов Вл.В. Адаптация к высоким концентрациям солей меди и цинка растений хрустальной травки и возможность их использования в целях фиторемедиации//Физиология растений. 2005. Т. 52, № 6.
- Селезнев В.А., Рубцов М.Г., Купер В.Я., Розенберг Г.С. Оценка пространственной неоднородности качества вод Саратовского водохранилища//Изв. СНЦ РАН. 1999, № 2.
- Maksymiec W. Effects of copper on cellular processes in higher plants//Photosynthetica. 1997. V 34, №3.
- Лукина Л.Ф., Смирнова Н.Н. Физиология высших водных растений. Киев: Наук. думка, 1988.
- Христофорова Н.К. Химико-экологическая характеристика Кандалашского залива Белого моря по содержанию тяжелых металлов в моллюсках и водорослях//Биология моря. 1994. Т. 20, №2.
- Прасад М.Н. Практическое использование растений для восстановления экосистем загрязненных металлами//Физиология растений. 2003. Т. 50, № 35.
- Розенцвет O.A., Мурзаева С.В., Гущина И.А. Роль мембранных липидов в устойчивости Potamogeton perfoliatus L. к избытку Кадмия в воде//Изв. РАН. Сер. биол., 2004. № 6.
- Смоляков Б.С., Жигула M.B., Рыжих A.П., и др. Поведение различных форм меди (II) в пресноводной экосистеме//Водные ресурсы. 2004. Т. 31, № 1.
- Bligh E.G., Dyer W.J. A rapid method for total lipid extraction and purification//Can. J. Biochem. Physiol. 1959. V. 37.
- Vaskovsky V.E., Latyshev L.A. Modified Jungnickel's reagent for detecting phospholipids and other phosphorus compounds on thin-layer chromatography//J. Chromatogr. 1975. V. 115.
- Северин C.E., Соловьева Г.А. Практические работы в биохимии. М.: Изд-во Моск. у-та. 1989.
- Голубкина Н.А. Флуорометрический метод определения селена//Журн. аналит. химии. 1995. Т. 50.


