Изучение особенностей распространенности вируса папилломы человека и его физического статуса при немелкоклеточном раке легкого
Автор: Ибрагимова Марина Константиновна, Цыганов Матвей Михайлович, Певзнер Алина Михайловна, Родионов Евгений Олегович, Черемисина Ольга Владимировна, Миллер Сергей Викторович, Тузиков Сергей Александрович, Литвяков Николай Васильевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.20, 2021 года.
Бесплатный доступ
На сегодняшний день вопрос о значении вируса папилломы человека (ВПЧ) в возникновении и развитии рака легкого остается открытым. Имеющиеся опубликованные данные в силу противоречивости полученных результатов не дают убедительных доказательств участия ВПЧ в патогенезе данной онкопатологии. А в России исследований, касающихся определения роли данного вируса в канцерогенезе рака легкого, не встречается вовсе. Целью исследования является определение наличия ВПЧ-инфекции высокого канцерогенного риска у больных немелкоклеточным раком легкого. Материал и методы. В исследование включено 30 больных с верифицированным диагнозом первично-операбельный немел-коклеточный рак легкого IIB-IIIA стадии. В качестве исследуемого материала использованы образцы нормальной и опухолевой ткани легкого и цельная кровь на каждого пациента. ДНК из полученных образцов выделяли при помощи набора QIAamp DNA mini Kit (Qiagen, Germany). Выявление и генотипирование ДНК ВПЧ проводили методом ПЦР с использованием комплектов реагентов фирмы «Amplisens®» (Москва, Россия). Результаты. ВПЧ был обнаружен у 3 (10,0 %) и не выявлен у 27 (90,0 %) больных. Для каждого из ВПЧ-позитивных больных наличие вируса идентифицировано в 2 из 3 исследуемых образцов на пациента. У двух ВПЧ-позитивных пациентов наблюдалось наличие 16 генотипа вируса, и у одного - 33 типа вируса. Установлено, что в ВПЧ-позитивных образцах практически во всех случаях определена клинически малозначимая вирусная нагрузка с точки зрения показателей, характерных для рака шейки матки. Оценка степени интеграции вируса у ВПЧ16-позитивных больных раком легкого показала, что в опухолевой ткани пациентов выявлена смешанная и интегрированная форма вируса. Анализ 5-летней безметастатической выживаемости показал, что у всех пациентов с наличием ВПЧ в опухолевой ткани этот показатель равен 100 %. Заключение. Получены данные о 10 % представленности вируса папилломы человека среди больных немелкоклеточным раком легкого. Наличие или отсутствие вирусной компонент при раке легкого является клинически значимым параметром.
Впч, рак легкого, прогноз, физический статус вируса, патогенез рака легкого
Короткий адрес: https://sciup.org/140254430
IDR: 140254430 | УДК: 616.24-006.6-092:616.9 | DOI: 10.21294/1814-4861-2021-20-2-53-60
Текст научной статьи Изучение особенностей распространенности вируса папилломы человека и его физического статуса при немелкоклеточном раке легкого
Известно, что в этиологии рака легкого (РЛ) определенную роль играет множество факторов, начиная от курения и неблагоприятных экологических условий, заканчивая различными индивидуальными молекулярно-генетическими параметрами организма. Установлено, что возможной причиной развития РЛ могут являться полиморфизмы генов, регулирующих метаболизм канцерогенных веществ, клеточный цикл и другие ключевые процессы канцерогенеза и т. д. [1, 2]. При РЛ наблюдается гиперметилирование промоторов различных генов, связанных с важными функциями, включая контроль пролиферации, апоптоз, клеточную адгезию, репарацию ДНК [3, 4]. Вирусная этиология РЛ практически не рассмотрена, также не установлено влияние вирусов на течение данного злокачественного новообразования. В немногочисленных работах особое внимание уделяется вирусу папилломы человека (ВПЧ), который является важным этиологическим и прогностическим фактором не только при различной гинекологической патологии [5], но и при опухолях других локализаций, в частности верхних дыхательных путей и пищеварительного тракта [6].
Некоторые авторы описывают случаи 100 % спонтанной трансформации папиллом в дифференцированную плоскоклеточную карциному легких (51,1 %) и гортани (42,9 %) [7]. Ранее у данных пациентов в папилломах был выявлен ВПЧ низкого канцерогенного риска (НКР) – 6 и 11 типы. Согласно данным метаанализа, частота встречаемости вируса при РЛ колеблется в широких пределах в зависимости от количества обследованных пациентов: от полного отсутствия вируса в опухолевой ткани до 75 % и более [8, 9]. В подавляющем большинстве случаев при РЛ встречаются ВПЧ высокого канцерогенного риска (ВКР) – 16 и 18 типы, которые, по данным мировой литературы, чаще всего выявляются у больных раком шейки матки [10].
Таким образом, несмотря на наличие работ, посвященных изучению связи ВПЧ и РЛ, опубликованные на сегодняшний день литературные данные в силу противоречивости результатов не
Таблица 1/Table 1
Клинико-патологические параметры больных
Clinical and pathological parameters of the studied patients
Клинико-патологический параметр/Clinical and pathological parameter Кол-во бол p ь a н ti ы en х ts (n (n = = 3 3 0 0 )/ ) Number of
Целью исследования является определение наличия ВПЧ-инфекции высокого канцерогенного риска у больных немелкоклеточным раком легкого.
Материал и методы
В настоящее исследование включено 30 больных первично-операбельным немелкоклеточным раком легкого (НМРЛ) IIBIIIA стадии (табл. 1), центральной и периферической локализации, проходивших обследование и лечение в НИИ онкологии Томского НИМЦ. Диагноз верифицирован гистологически, пациентам проводилась операция в объеме пневмонэктомии или лобэктомии. Адъювантная химиотерапия назначалась по показаниям в зависимости от результатов исследования операционного материала. Исследование проходило в соответствии с Хельсинкской декларацией 1964 г. (исправленной в 2013 г.) и с разрешения локального этического комитета института.
В качестве исследуемого материала были использованы операционные образцы нормальной и опухолевой ткани легкого (~60–70 мм3) и цельная кровь каждого пациента. Образцы ткани помещали в раствор RNAlater (Ambion, USA). После 24-часовой инкубации при +4 ºС образцы опухоли сохраняли при температуре –80 ºС для дальнейшего выделения ДНК.
ДНК из полученных образцов выделяли при помощи набора QIAamp DNA mini Kit (Qiagen,
Germany) в соответствии с инструкцией производителя. Концентрация ДНК измерялась при помощи флуориметра Qubit 4.0 (Thermo Fisher Scientific, USA) с использованием набора для количественной оценки ДНК. Концентрация составила от 10 до 100 нг/мкл. Выделенная ДНК хранилась при –80 ºС в низкотемпературном морозильнике (Sanyo, Japan) и использовалась для дальнейших микроматричных исследований.
Выявление и генотипирование ДНК ВПЧ проводили методом ПЦР в режиме реального времени на приборе RotorGene 6000 (Corbett Research, Australia) с использованием комплектов реагентов фирмы «Amplisens®» («АмплиСенс® ВПЧ ВКР скрин-титр-FL», кат# R-V31-T4x (RG,iQ,Mx); «АмплиСенс® ВПЧ ВКР генотипFL», кат# R-V25(RG,iQ,Mx) (Москва, Россия). Определяли наличие ВПЧ 16 и 18 генотипов. Значение вирусной нагрузки рассчитывалось в геномных эквивалентах ДНК ВПЧ/105 клеток, порог релевантного количества вируса принимался равным 3 lg ДНК ВПЧ/105 клеток в соскобе. Метод основан на одновременной амплификации (мультиплекс-ПЦР) и детекции в режиме «реального времени» участков ДНК Е1-Е2 генов ВПЧ и участка ДНК бета-глобинового гена, используемого в качестве эндогенного внутреннего контроля. Выявление области Е6 при отсутствии области E1/Е2 интерпретировалось как интеграция ВПЧ в ДНК человека, выявление области Е6 при наличии области E1/Е2 – как смешанная форма/ частичная интеграция вируса в ДНК человека, отсутствие области Е6 при наличии области E1/ Е2 – как эписомальная форма вируса.
Оценку отдаленной выживаемости проводили по методу Каплан – Майера.
Таблица 2/Table 2
Результат определения наличия ВПЧ ВКР и вирусной нагрузки
The result of determining the presence of HpV HVL and viral load
|
Пациент/ Patient |
Стадия/Stage |
Определение типа ВПЧ/Вирусная нагрузка/Determination of the type of HPV/viral load |
||
|
Нормальная ткань легкого/ Normal lung tissue |
Опухолевая ткань/ Tumor tissue |
Кровь/ Blood |
||
|
К1 |
IIB |
16/малозначимая/ 16/insignificant |
16/малозначимая/ 16/insignificant |
|
|
Л1 |
IIIA |
16/малозначимая/ 16/insignificant |
16/значимая/ 16/significant |
|
|
С1 |
IIIA |
33/малозначимая/ 33/insignificant |
33/малозначимая/ 33/insignificant |
|
Проведенная работа отвечает этическим стандартам, разработанным в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ от 19.06.2003 г. № 266. От лиц, участвовавших в исследовании, получено информированное согласие.
Результаты исследования
В результате исследования была оценена частота встречаемости ВПЧ в исследуемых образцах на каждого пациента. ВПЧ был обнаружен у 3 (10,0 %) и не выявлен у 27 больных (90,0 %). У ВПЧ-негативных пациентов были проведены повторная процедура выделения ДНК и идентификация ВПЧ в исследуемых образцах. В результате было подтверждено отсутствие ВПЧ у данных пациентов.
В зависимости от инфицированности ВПЧ пациенты были разделены на 2 группы наблюдения: ВПЧ-позитивные (n=3) и ВПЧ-негативные (n=27). В таблице 2 представлены полученные данные по определению ВПЧ ВКР для вирус-позитивных пациентов с РЛ. Показано, что для каждого из ВПЧ-позитивных больных наличие вируса идентифицировано в 2 из 3 исследуемых образцов на пациента. Для 100 % вирус-позитивных больных ВПЧ ВКР определен в опухолевой ткани легкого, для больных Л1 и С1 также ВПЧ определен в нормальной ткани легкого, для больного К1 – в крови. Наличие ВПЧ в нормальной ткани легкого или в крови может свидетельствовать о разных путях проникновения вируса в легкие – пероральном в первом случае и через кровь – во втором.
После генотипирования ВПЧ было определено, что у пациента К1 идентифицирован ВПЧ 16 типа в опухолевой ткани и крови, у пациента Л1 16 генотип вируса определен в нормальной и опухолевой ткани легкого, у 3-го пациента (С1) вирус также определен в нормальной и опухолевой ткани легкого, но выявлен 33 генотип. Далее в положительных образцах была определена вирусная нагрузка. Ви- русная нагрузка менее 105 геномных эквивалентов (ГЭ) ВПЧ ВКР в соскобе или 103 ГЭ, приходящихся на 105 клеток человека, считается клинически малозначимой, а количество вируса более 105 ГЭ, приходящихся на 105 клеток, обозначается как повышенная нагрузка. В нашем исследовании было показано, что в подавляющем большинстве случаев определена клинически малозначимая вирусная нагрузка в ВПЧ+ образцах, полученных от пациентов с РЛ. Необходимо отметить, что единственным образцом с клинически значимой вирусной нагрузкой оказалась опухолевая ткань пациента Л1 (табл. 2).
Далее была оценена степень интеграции вируса у ВПЧ16-позитивных больных РЛ. Так, было показано, что в опухолевой ткани пациента К1 выявлена смешанная форма вируса, тогда как в крови этого пациента вирус находился в эписомальной форме. При этом в опухолевой ткани пациента Л1 выявлена интегрированная форма вируса, тогда как в нормальной ткани вирус присутствовал в смешанной форме.
Последним этапом работы была оценка без-метастатической выживаемости больных РЛ в зависимости от инфицированности ВПЧ ВКР. Было обнаружено, что у ВПЧ-позитивных пациентов наблюдается 100 % 5-летняя безметастатическая выживаемость, тогда как у ВПЧ-отрицательных пациентов этот показатель составил 63 % (рис. 1). Различия статистически не значимы из-за малочисленности первой группы (log-rank test, p=0,28). Несмотря на малочисленность выборки, полученные данные о благоприятном исходе у больных раком легкого при наличии ВПЧ являются очень интересными и требуют дальнейшие исследования.
Обсуждение
В результате проведенного исследования установлено, что частота встречаемости ВПЧ ВКР в опухолевой ткани у больных немелкоклеточным раком легкого на примере выборки Томского региона составляет 10,0 %, а частота встречаемости ВПЧ ВКР в нормальной ткани легкого этих же пациентов составляет 6,7 %. При этом, согласно данным метаанализа 2015 г., наличие ВПЧ-инфекции в ткани легкого связано с риском развития рака
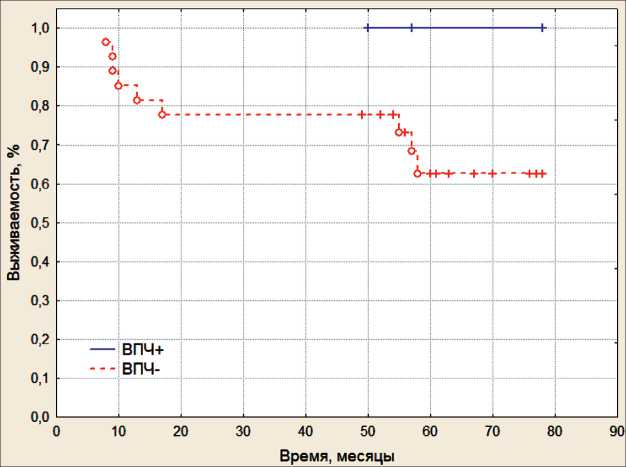
Рис. 1. Безметастатическая выживаемость ВПЧ-позитивных и ВПЧ-отрицательных больных раком легкого (log-rank test, p=0,28)
Fig. 1. Non-metastatic survival of HPV-positive and HPV-negative patients with lung cancer (log-rank test, p=0.28)
легкого (OR=5,67, 95 % CI: 3,09–10,40, p<0,001). В опухолевой и нормальной ткани распространенность ВПЧ 16 типа составила 19,8 % и 3,37 % соответственно. Аналогичный результат получен при анализе ВПЧ 18 типа – 18,59 % в опухолевой ткани и 5,24 % в нормальной [11]. Полученные данные согласуются с результатами проведенного ранее собственного метаанализа, согласно которому частота встречаемости ВПЧ в опухолевой ткани при РЛ составила 28,7 %, при частоте встречаемости ВПЧ в нормальной ткани легкого – 7,6 % [8].
Интересные данные были получены при определении типов ВПЧ ВКР в настоящей работе. Классическим лидером по частоте встречаемости признан ВПЧ 16 генотипа (66,7 % случаев), что также согласуется с данными литературы, в которых именно ВПЧ определен как агент высокого канцерогенного риска при опухолях различных локализаций [12, 13]. Важно отметить, что также был определен и ВПЧ 33 генотипа. Полученные в исследовании факты важны в эпидемиологическом плане, поскольку в литературе опубликованы данные по особенностям распространения ВПЧ ВКР при раке шейки матки в Томской области, согласно которым в регионе 2-е и 3-е место занимает ВПЧ типов 33 и 31 – 11,9 и 10,4 % соответственно. Однако для подтверждения особенностей циркулирования ВПЧ ВКР при немелкоклеточном раке легкого в Томской области требуется увеличение выборки больных и дальнейшие эпидемиологические исследования.
При анализе 100 образцов опухолевой ткани легкого установлено, что частота ВПЧ-позитивных больных РЛ составляет 19 %, причем распределение генотипов ВПЧ было следующим: ВПЧ 16 – 8 (42,1 %); ВПЧ 11 – 3 (15,8 %); ВПЧ 6 – 1 (5,2 %); ВПЧ 59 – 1 (5,2 %); ВПЧ 33 – 2 (10,5 %); ВПЧ 31 – 2 (10,5 %), ВПЧ 18 – 2 (10,5 %) случая [14].
Поскольку сам факт инфицирования ВПЧ даже высокого онкогенного риска не позволяет в полной мере судить о вероятности возникновения рака, необходимо учитывать и другие показатели ВПЧ-инфекции, которые коррелируют с тяжестью патологического процесса и позволяют оценивать риск злокачественной трансформации у каждого пациента. Одним из таких показателей онкоген-ности вируса является вирусная нагрузка. Согласно данным исследований значения вирусной нагрузки в качестве предиктора развития РЛ, как правило, выявляется очень низкая вирусная нагрузка: менее одной копии вируса на клетку в исследуемых образцах [15]. Это подтверждается другими исследованиями, в которых выявлена очень низкая вирусная нагрузка в опухолевой ткани легкого – 0,02 [16] и 0,003 [17]. Данное явление может быть обусловлено так называемым механизмом «Hit-and-run», когда происходит интеграция вируса в клетку с последующей элиминацией вирусного генома. Некоторые авторы считают, что даже низкая вирусная нагрузка (1–2 копии на клетку) достаточна для запуска канцерогенеза в ткани легкого [18]. В настоящее время не найдены публикации, освещающие вопрос исследования физического статуса ВПЧ в ткани опухоли легкого. Результат этой части исследования сложно интерпретировать в силу малочисленности выборки, однако впервые полученные данные о физическом статусе ВПЧ 16 типа при РЛ фактически указывают на возможность и необходимость определения данного вирусологического критерия даже при малой концентрации ДНК ВПЧ.
Вопрос о связи между ВПЧ-инфекцией при РЛ и выживаемостью до сих пор остается неопределенным, в первую очередь это связано с малым количеством исследований по данной тематике. Тем не менее имеющиеся в литературе данные согласуются с результатами настоящего исследования. Так, J.L. Wang et al. показали, что больные с ВПЧ 16 и 18 типов в аденокарциноме легких имеют более высокие показатели выживаемости по сравнению с пациентами без наличия вируса в опухоли [19]. C. Ragin et al. также показали, что наличие вируса в опухолевой ткани у пациентов с РЛ сопряжено с хорошим прогнозом заболевания [20]. Хороший исход при наличии ВПЧ-инфекции также отмечается и при других локализациях злокачественных новообразований: раке гортани и ротоглотки [21], раке шейки матки [10] и колоректальном раке [13].
Список литературы Изучение особенностей распространенности вируса папилломы человека и его физического статуса при немелкоклеточном раке легкого
- Mukeriya A.F., Zaridze D.G. Epidemiologiya i profilaktika raka legkogo. Vestnik RONTs im. N.N. Blokhina RAMN. 2010; 21(3): 3-12.
- Hung R.J., McKay J.D., Gaborieau V., Boffetta P., Hashibe M., Zaridze D., Mukeria A., Szeszenia-Dabrowska N., Lissowska J., Rudnai P., Fabianova E., Mates D., Bencko V., Foretova L., Janout V., Chen C., Goodman G., Field J.K., Liloglou T., Xinarianos G., Cassidy A., McLaughlin J., Liu G., Narod S., Krokan H.E., Skorpen F., Elvestad M.B., Hveem K., Vatten L., Linseisen J., Clavel-Chapelon F., Vineis P., Bueno-de-Mesquita H.B., Lund E., Martinez C., Bingham S., Rasmuson T., Hainaut P., Riboli E., Ahrens W., Benhamou S., Lagiou P., Trichopoulos D., Holcátová I., Merletti F., Kjaerheim K., Agudo A., Macfarlane G., Talamini R., Simonato L., Lowry R., Conway D.I., Znaor A., Healy C., Zelenika D., Boland A., Delepine M., Foglio M., Lechner D., Matsuda F., Blanche H., Gut I., Heath S., Lathrop M., Brennan P. A susceptibility locus for lung cancer maps to nicotinic acetylcholine receptor subunit genes on 15q25. Nature. 2008 Apr 3; 452(7187): 633-7. https://doi.org/10.1038/nature06885.
- Herceg Z., Vaissière T. Epigenetic mechanisms and cancer: an interface between the environment and the genome. Epigenetics. 2011 Jul; 6(7): 804-19. https://doi.org/10.4161/epi.6.7.16262.
- Langevin S.M., Kratzke R.A., Kelsey K.T. Epigenetics of lung cancer. Transl Res. 2015 Jan; 165(1): 74-90. https://doi.org/10.1016/j.trsl.2014.03.001.
- Ibragimova M.K., Tsyganov M.M., Karabut I.V., Churuksaeva O.N., Shpileva O.N., Bychkov V.A., Kolomiets L.A., Litvyakov N.V. Integrativnaya i episomal'naya formy genotipa 16 virusa papillomy cheloveka pri tservikal'nykh intraepitelial'nykh neoplaziyakh i rake sheiki matki. Voprosy virusologii. 2016; 61(6): 270-74. https://doi.org/10.18821/0507-4088-2016-61-6-270-274.
- Klein F., Kotb W.F.A., Petersen I. Incidence of human papilloma virus in lung cancer. Lung Cancer. 2009; 65(1): 13-8. https://doi.org/10.1016/j.lungcan.2008.10.003.
- Go C., Schwartz M.R., Donovan D.T. Molecular transformation of recurrent respiratory papillomatosis: viral typing and p53 overexpression. Ann Otol Rhinol Laryngol. 2003; 112(4): 298-302. https://doi.org/10.1177/000348940311200402.
- Tsyganov M.M., Pevzner A.M., Ibragimova M.K., Deryusheva I.V., Litviakov N.V. Human papillomavirus and lung cancer: an overview and a meta-analysis. J Cancer Res Clin Oncol. 2019 Aug; 145(8): 1919-37. https://doi.org/10.1007/s00432-019-02960-w.
- Galvan A., Noci S., Taverna F., Lombardo C., Franceschi S., Pastorino U., Dragani T.A. Testing of human papillomavirus in lung cancer and non-tumor lung tissue. BMC Cancer. 2012 Nov; 12: 512. https://doi.org/10.1186/1471-2407-12-512.
- Ibragimova M., Tsyganov M., Shpileva O., Churuksaeva O., Bychkov V., Kolomiets L., Litviakov N. HPV status and its genomic integration affect survival of patients with cervical cancer. Neoplasma. 2018; 65(3): 441-448. https://doi.org/10.4149/neo_2018_170414N277.
- Zhai K., Ding J., Shi H.Z. HPV and lung cancer risk: a meta-analysis. J Clin Virol. 2015 Feb; 63: 8490. https://doi.org/10.1016/j.jcv.2014.09.014.
- Pevzner A.M., Tsyganov M.M., Ibragimova M.K., Litvyakov N.V. Virus papillomy cheloveka i zlokachestvennye novoobrazovaniya golovy i shei (obzor literatury). Opukholi golovy i shei. 2019; 9(2): 43-51. https://doi.org/10.17650/2222-1468-2019-9-2-43-52.
- Ibragimova M.K., Tsyganov M.M., Litviakov N.V. Human papillomavirus and colorectal cancer. Medical Oncology. 2018; 35(11): 1-6. https://doi.org/10.1007/s12032-018-1201-9.
- Sarchianaki E., Derdas S.P., Ntaoukakis M., Vakonaki E., Lagoudaki E.D., Lasithiotaki I., Sarchianaki A., Koutsopoulos A., Symvoulakis E.K., Spandidos D.A., Antoniou K.M., Sourvinos G. Detection and genotype analysis of human papillomavirus in non-small cell lung cancer patients. Tumour Biol. 2014 Apr; 35(4): 3203-9. https://doi.org/10.1007/s13277-013-1419-2.
- Koshiol J., Rotunno M., Gillison M.L., Van Doorn L.J., Chaturvedi A.K., Tarantini L., Song H., Quint W.G., Struijk L., Goldstein A.M., Hildesheim A., Taylor P.R., Wacholder S., Bertazzi P.A., Landi M.T., Caporaso N.E. Assessment of human papillomavirus in lung tumor tissue. J Natl Cancer Inst. 2011 Mar 16; 103(6): 501-7. https://doi.org/10.1093/jnci/djr003.
- Baba M., Castillo A., Koriyama C., Yanagi M., Matsumoto H., Natsugoe S., Shuyama K.Y., Khan N., Higashi M., Itoh T., Eizuru Y., Aikou T., Akiba S. Human papillomavirus is frequently detected in gefitinibresponsive lung adenocarcinomas. Oncol Rep. 2010; 23(4): 1085-92. https://doi.org/10.3892/or_00000736.
- Kato T., Koriyama C., Khan N., Samukawa T., Yanagi M., Hamada T., Yokomakura N., Otsuka T., Inoue H., Sato M., Natsugoe S., Akiba S. EGFR mutations and human papillomavirus in lung cancer. Lung Cancer. 2012 Nov; 78(2): 144-7. https://doi.org/10.1016/j.lungcan.2012.08.011.
- Aguayo F., Castillo A., Koriyama C., Higashi M., Itoh T., Capetillo M., Shuyama K., Corvalan A., Eizuru Y., Akiba S. Human papillomavirus-16 is integrated in lung carcinomas: a study in Chile. Br J Cancer. 2007 Jul 2; 97(1): 85-91. https://doi.org/10.1038/sj.bjc.6603848.
- Wang J.L., Fang C.L., Wang M., Yu M.C., Bai K.J., Lu P.C., Liu H.E. Human papillomavirus infections as a marker to predict overall survival in lung adenocarcinoma. Int J Cancer. 2014; 134(1): 65-71. https://doi.org/10.1002/ijc.28349.
- Ragin C., Obikoya-Malomo M., Kim S., Chen Z., Flores-Obando R., Gibbs D., Koriyama C., Aguayo F., Koshiol J., Caporaso N.E., Carpagnano G.E., Ciotti M., Dosaka-Akita H., Fukayama M., Goto A., Spandidos D.A., Gorgoulis V., Heideman D.A., van Boerdonk R.A., Hiroshima K., Iwakawa R., Kastrinakis N.G., Kinoshita I., Akiba S., Landi M.T., Eugene Liu H., Wang J.L., Mehra R., Khuri F.R., Lim W.T., Owonikoko T.K., Ramalingam S., Sarchianaki E., Syrjanen K., Tsao M.S., Sykes J., Hee S.W., Yokota J., Zaravinos A., Taioli E. HPV-associated lung cancers: an international pooled analysis. Carcinogenesis. 2014 Jun; 35(6): 1267-75. https://doi.org/10.1093/carcin/bgu038.
- Bychkov V.A., Nikitina E.G., Ibragimova M.K., Kaigorodova E.V., Choinzonov E.L., Litviakov N.V. Comprehensive meta-analytical summary on human papillomavirus association with head and neck cancer. Exp Oncol. 2016 Jun; 38(2): 68-72.


