Изучение первых стадий сборки вириона у Х-вируса картофеля
Автор: Никитин Н.А., Трифонова Е.А., Петрова Е.К., Борисова О.В., Карпова О.В., Атабеков И.Г.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Молекулярная биология, вирусология
Статья в выпуске: 5 т.49, 2014 года.
Бесплатный доступ
Х-вирус картофеля (ХВК, Potexvirus ) относится к экономически значимым патогенам ряда важных сельскохозяйственных культур из семейства Solanaceae. Вирионы ХВК представляют собой гибкие нитевидные частицы длиной 515 нм и диаметром 13,5 нм со спиральной структурой. Геном вируса представлен одноцепочечной молекулой РНК (6435 нуклеотидов) положительной полярности, которая кэпирована и полиаденилирована. Изучение различных этапов инфекционного процесса при заражении растений вирусами, в том числе сборки вирусных частиц, представляет большой практический интерес, так как выявление ее механизмов может стать основой разработки новых подходов в безвирусном растениеводстве. Первые этапы сборки вирионов Х-вируса картофеля изучали на примере вирусоподобных частиц (ВПЧ), полученных при инкубации РНК ХВК с белком оболочки (БО) ХВК in vitro. Показано, что в различных условиях инкубации (ионная сила, рН) образуется один и тот же набор ВПЧ дискретного размера. Однако количество полученных ВПЧ того или иного размера меняется в зависимости от условий инкубации. Максимально эффективной сборки ВПЧ, которые по размерам приближались к нативному вириону, удалось достигнуть в буфере с низкой ионной силой при рН 8,5. Из сформировавшихся ВПЧ были выделены участки РНК ХВК длиной от 800 до 5700 нт, защищенные белковой спиралью. Их индивидуальный анализ подтвердил, что все они представляют собой 5´-концевые фрагменты геномной РНК разной длины. Таким образом, подтверждено, что сборка вирионов ХВК инициируется на 5´-конце РНК и кооперативно продолжается в направлении от 5´- к 3´-концу молекулы. При анализе нуклеотидной последовательности фрагментов РНК, выделенных из ВПЧ разного размера, в районах, соответствовавших 3´-концу молекулы, обнаружены участки, способные формировать шпильки, которые могут играть роль стоп-сигналов, препятствующих взаимодействию БО с РНК и непрерывной кооперативной сборке ВПЧ и вирионов ХВК. Вероятно, БО может с большей или меньшей эффективностью (в зависимости от условий инкубации с РНК in vitro) плавить РНК-шпильки и преодолевать стоп-сигналы при сборке вирусных частиц.
Вирусы растений, х-вирус картофеля, вирусоподобные частицы, рнк, белок оболочки, сборка вирусных частиц
Короткий адрес: https://sciup.org/142133538
IDR: 142133538 | УДК: 632:578.2''21
Текст научной статьи Изучение первых стадий сборки вириона у Х-вируса картофеля
Вирионы ХВК представляют собой гибкие нитевидные образования длиной 515 нм и диаметром 13,5 нм со спиральной структурой. Около 1300 идентичных субъединиц белка оболочки (БО) формируют полярную спираль с шагом 3,6 нм. Вирусная РНК заключена между витками этой спирали, на каждый виток приходится 8-9 субъединиц БО (1).
ХВК — первый нитевидный вирус растений, реконструированный in vitro из РНК и БО (2). Различия в структуре нативных вирионов и та- ких реконструированных частиц (вирусоподобные частицы или вирусные рибонуклеопротеиды, соответственно ВПЧ или вРНП), не обнаружены. Кроме того, выявлено, что БО ХВК не способен к полимеризации в отсутствие РНК (3), но может формировать in vitro вРНП не только с РНК ХВК, но и с гетерологичными нуклеиновыми кислотами (2). Позже при изучении структуры и свойств таких вРНП (ВПЧ) было показано, что они гомологичны нативным вирионам (4, 5).
K.H. Kim и C. Hemenway (6) предположили, что 5'-район РНК ХВК участвует в координации образования вирусной частицы. До сих пор участок инициации сборки ХВК полностью не охарактеризован, хотя в ряде работ подтверждено, что он находится на 5'-конце молекулы РНК (7-9). Недавно были опубликованы данные, продемонстрировавшие, что кэп-структура на 5'-конце молекулы РНК играет ключевую роль при образовании вРНП ХВК, влияя на конформацию 5'-концевого участка молекулы РНК и способствуя его узнаванию БО ХВК при инициации сборки частиц (10).
Цель представляемой работы заключалась в изучении первых стадий сборки вириона у Х-вируса картофеля (ХВК) на примере вирусоподобных частиц, полученных при инкубации РНК и белка оболочки ХВК в разных условиях.
Методика. Вирионы ХВК (штамм Русский) выделяли из листьев растения Datura stramonium , как описано ранее (11), белок оболочки ХВК — после обработки вирусной суспензии раствором LiCl (12), РНК — фенольным методом (13).
Для получения ВПЧ РНК и БО ХВК инкубировали при молярном соотношении 1:700 в течение 10 мин при комнатной температуре в буфере Трис-HCl (0,01-0,001 М) при рН 7,5; 8,0 и 8,5. При обработке ВПЧ микрококковой нуклеазой (МН) («Fermentas», Литва) фермент активировали в присутствии CaCl2 (100 мМ), добавляли к ВПЧ, оставляли на 10 мин при комнатной температуре, после чего реакцию останавливали этиленгликольтетрацетатом (EGTA, 250 мМ). После обработки МН фрагменты РНК выделяли с использованием тРНК в качестве соосадителя.
Обратную транскрипцию и полимеразную цепную реакцию (ОТ-ПЦР) проводили согласно протоколу производителя («Promega», США). Использовали прямой и обратный праймеры, комплементарные последовательностям фрагментов геномной РНК ХВК — соответственно 21-40-й нуклеотиды (нт) и 950-981-й нт.
Анализ нуклеиновых кислот, а также РНК в составе ВПЧ (метод торможения в геле) осуществляли с помощью электрофореза в 1 % агарозном геле, приготовленном на буфере ТАЕ (Трис-ацетат — 40 мМ, ЭПТА — 2 мМ, pH 8,0; 0,025 мкг бромистого этидия). В лунки наносилась смесь РНК и БО, проинкубированных в различных условиях, в электрофорезном буфере, содержащем 10 % глицерин и бромфеноловый синий в концентрации 0,2 %. Электрофорез проводили в горизонтальной электрофоретической системе QS-710 («IBI Scientific», США) при постоянном напряжении 70 В. После завершения электрофореза гель фотографировали под ультрафиолетовым светом ( X = 254 нм) с помощью системы хемилюминисцент-ной детекции ChemDOC XRS+ («Bio-Rad», США).
Для исследования ВПЧ методом просвечивающей электронной микроскопии образцы контрастировали 2 % раствором уранилацетата (микроскоп JEOL JEM-1011, «JEOL Ltd.», Япония; ускоряющее напряжение 80 кВ). Изображение получали с помощью цифровой камеры (ES500W, Erlangshen, «Gatan», США), применяя программное обеспечение DigitalMicrograph («Gatan», США). Статистические данные о длине и диаметре
ВПЧ получали на основе анализа микрофотографий с использованием программы для обработки изображений ImageJ (National Institutes of Health — Национальный институт здоровья, США).
Нуклеотидные последовательности анализировали с применением данных и инструментария The mfold Web Server (14).
Результаты. Для изучения первых стадий сборки вирионов ХВК РНК ХВК инкубировали с БО при молярном соотношении 1:700 в различных условиях. В вирусной частице молярное соотношение РНК:белок составляет 1:1300 (1). Использованное нами количество БО недостаточно для инкапсидации всей РНК, и в результате образуются частицы, у которых часть молекулы РНК в составе ВПЧ остается свободной. Такие ВПЧ (single tailed particles — STP, частицы с одним хвостом) с 3'-концом РНК, свободным от БО, и палочковидными головками, сформированными в результате спиральной упаковки БО на 5'-концевом фрагменте РНК, были описаны ранее (9). Вероятно, STP служат одной из транспортных форм вируса наряду с вирионами ХВК (9). Следует отметить, что даже при молярном соотношении РНК:БО, соответствующем таковому в вирионе, большая часть реконструированных препаратов вирусных частиц содержала неполные (не достроенные до нормальной длины) частицы (3).
1 2 3 4 5 6 7
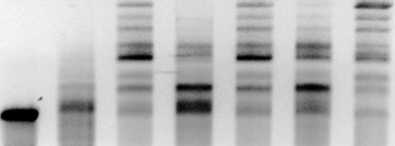
Рис. 1. Электрофореграммы вирусоподобных частиц, полученных in vitro в результате сборки из РНК и белка оболочки (БО) Х-вируса картофеля (ХВК) при разной величине ионной силы и рН буфера : 1 — контроль (свободная РНК ХВК), 2, 4, 6 — 0,01 М Трис-HCl (соответственно рН 7,5; 8,0 и 8,5), 3, 5, 7 — 0,001 М Трис-HCl (соответственно рН 7,5; 8,0 и 8,5). Молярное соотношение РНК и БО — 1:700; 1 % агарозный гель, окрашивание бромистым этидием.
Из представленных электрофореграмм (рис. 1) видно, что при сборке ВПЧ интенсивность окрашивания полосы, соответствующей геномной РНК ХВК (см. рис. 1, дорожка 1), уменьшалась и появлялись продукты, обладающие меньшей подвижностью в геле вследствие образования частиц, у которых РНК в разной степени упакована в БО (см. рис. 1, дорожки 2-7). Полосы с наибольшей молекулярной массой соответствовали ВПЧ, в которых основная часть РНК упакована в белок. При увеличении рН от 7,5 до 8,5 в 0,01 М Трис-HCl буфере эффективность сборки заметно повышалась, то есть увеличивался набор продуктов с большей молекулярной массой (см. рис. 1, дорожки 2, 4, 6). В инкубационном буфере 0,001 М Трис-HCl набор продуктов практически не менялся с изменением рН (см. рис. 1, дорожки 3, 5, 7), но при рН 8,5 интенсивность полосы с самой высокой молекулярной массой оказалась максимальной (см. рис. 1, дорожка 7). Таким образом, РНК ХВК в указанных условиях эффективно связывалась с БО, формируя ВПЧ, в которых большая часть геномной РНК была упакована в спиральную оболочку. Важно отметить следующий факт: хотя интенсивность полос, соответствующих образовавшимся ВПЧ разной длины, менялась в зависимости от условий инкубации, положение этих полос при электрофорезе в 1 % агарозном геле оставалось неизменным. Создавалось впечатление, что при сборке БО с РНК ХВК в направлении 5'^3' на определенных участках молекулы нуклеиновой кислоты возникают стоп-сигналы, преодоление которых становилось возможным при изменении ионной силы и pH инкубационного буфера.
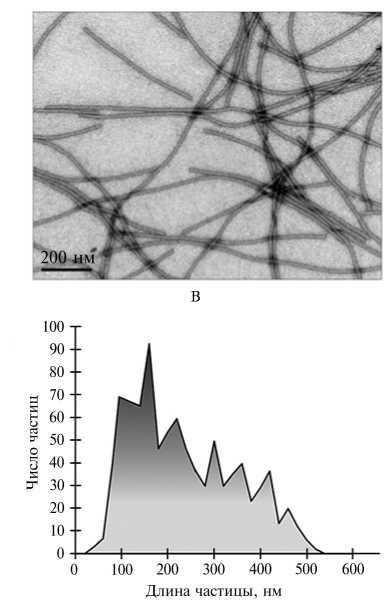
При изучении морфологии ВПЧ, полученных в условиях эффективной сборки (0,001 М буфер Трис-HCl, pH 8,5), с использованием просвечивающей электронной микроскопии (рис. 2, Б) было показано, что ВПЧ представляют собой частицы разной длины, идентичные по диаметру и структуре вирионам ХВК (см. рис. 2, А). ВПЧ оказались короче, чем вирионы ХВК, то есть часть молекулы геномной РНК в составе ВПЧ не связана с БО.
А
Б
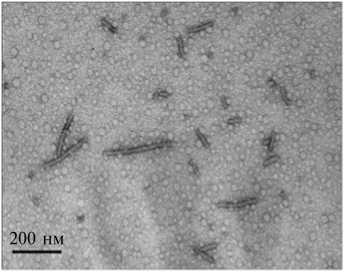
Рис. 2. Электронные микрофотографии нативных вирионов Х-вируса картофеля (ХВК) (А) , вирусоподобных частиц (ВПЧ) , полученных in vitro в результате сборки из РНК и белка оболочки ХВК (Б) , и гистограмма распределения ВПЧ по длине (В) (просвечивающая электронная микроскопия, микроскоп JEOL JEM-1011, «JEOL Ltd.», Япония; ускоряющее напряжение 80 кВ; контрастирование 2 % раствором уранилацетата).
На гистограмме можно выделить 8 дискретных пиков, которые соответствуют частицам с длиной 60, 90, 160, 220, 300, 360, 420 и
460 нм (см. рис. 2, В). Эти данные согласуются с результатом анализа методом торможения в геле (см. рис. 1, дорожка 7), который показал, что полу ченные ВПЧ представляли собой дискретный набор частиц, гетерогенных по размеру. С учетом того, что у ХВК в вирион длиной 515 нм упакована РНК размером 6435 нт, ВПЧ указанной длины могут содержать фрагменты РНК размером соответственно 800, 1100, 2000, 2700, 3700, 4500, 5200 и 5700 нт.
Для того чтобы охарактеризовать участки геномной РНК, находящиеся в составе ВПЧ, частицы обрабатывали МН в условиях, когда РНК, связанная с БО в составе ВПЧ, защищена от воздействия нуклеазы. При электрофоретическом разделении полученных после этого образцов РНК был выявлен набор фрагментов размером от 800 до 5700 нт (рис. 3, А, дорожка 1). С целью выяснения, являются ли полученные фрагменты 5'-концевыми, каждый из них выделили индивидуально (см. рис. 3, А, дорожки 2-9) и использовали в качестве матрицы в реакции обратной транскрипции (ОТ) с последующей полимеразной цепной реакцией (ПЦР). Для ОТ использовали олигодезоксирибонуклеотид, комплементарный области 950-981-го нт РНК ХВК. Для амплификации 5'-концевого района РНК ХВК методом ПЦР использовали прямой и обратный праймеры, соответствующие участкам 21-40-й и 950-981-й нт РНК ХВК. Ожидаемый продукт амплификации (см. рис. 3, Б)
был получен на основе большинства фрагментов (см. рис. 3, дорожки 2-8). Исключение составил фрагмент РНК, длина которого согласно маркерам меньше 876 нт (см. рис. 3, А, дорожка 9), то есть у него отсутствует область связывания с обратным праймером, соответствующим области 950-981-го нт РНК ХВК. Таким образом, в составе ВПЧ РНК представлена 5'-концевыми фрагментами генома ХВК. Это подтверждает, что инициация сборки вириона происходит на 5'-конце молекулы РНК и продолжается кооперативно в направлении от 5'- к 3' -концу молекулы.
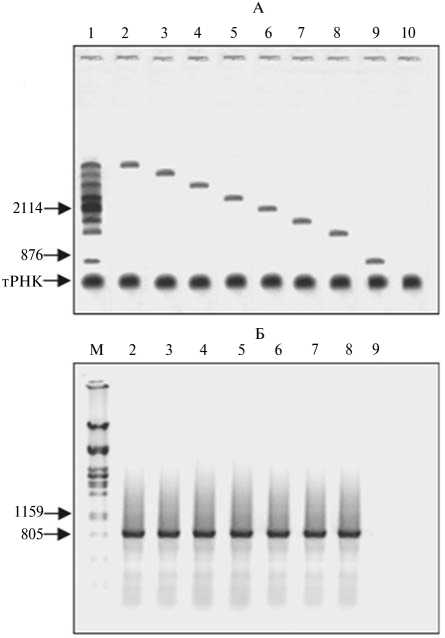
Рис. 3. Анализ фрагментов РНК X-вируса картофеля (ХВК) , выделенных из реконструированных in vitro вирусоподобных частиц (ВПЧ) разной длины после обработки последних микрококковой нуклеазой: А — электрофоретическое разделение, Б — ПЦР с обратной транскрипцией (ОТ-ПЦР) соответствующих индивидуальных фрагментов РНК; 1 — набор фрагментов РНК, выделенный из ВПЧ (А), 2-9 — индивидуальные фрагменты РНК, 10 — тРНК, использованная в качестве со-осадителя (А); М — маркеры молекулярной массы ДНК (Б). Стрелками отмечены маркеры длины РНК, нт (А) и ДНК, п.н. (Б). Электрофорез в 1 % агарозном геле, окрашивание бромистым этидием. При ОТ-ПЦР использовали прямой и обратный праймеры, комплементарные последовательностям нуклеотидов РНК ХВК в положении соответственно 21-40 и 950-981.
Ранее S.J. Kwon с со-авт. (7), используя метод SE-LEX, выделили ряд последовательностей РНК, имеющих наибольшее сродство с Б О ХВК. При компьютерном мо делировании было показано, что полученные последовательности способны образовывать идентичные по структуре шпильки. Мы предположили, что аналогичные шпильки могут располагаться вдоль всей последовательности геномной РНК ХВК и влиять на взаимодействие БО с РНК.
Компьютерный анализ вторичной структуры нуклеотидной последовательности РНК ХВК в районах, соответствующих 3'-концам индивидуальных фрагментов РНК, выделенных из ВПЧ разной длины, выявил возможность формирования подобных РНК-шпилек. На рисунке 4 представлены шпилечные структуры, которые могут присутствовать на 3'-конце индивидуальных фрагментов (см. рис. 3) 1100, 2700, 5200 и 5700 нт, рассчитанной на основании гистограммы распределения ВПЧ по длине (см. рис. 2, В). Вероятность образования таких РНК-шпилек была показана и для индивидуальных фрагментов другой длины (800, 2000, 3700 и 4500 нт, данные не представлены).
Можно предположить, что обнаруженные нами шпильки выполняют роль «стоп-сигналов», препятствующих кооперативной сборке ВПЧ. Ранее сообщалось, что БО потексвирусов обладает способностью плавить вторичную структуру РНК (15). Для преодоления стоп-сигналов БО должен задержаться на таком участке РНК, расплавить шпильку, и только после этого будет продолжен процесс сборки вириона.
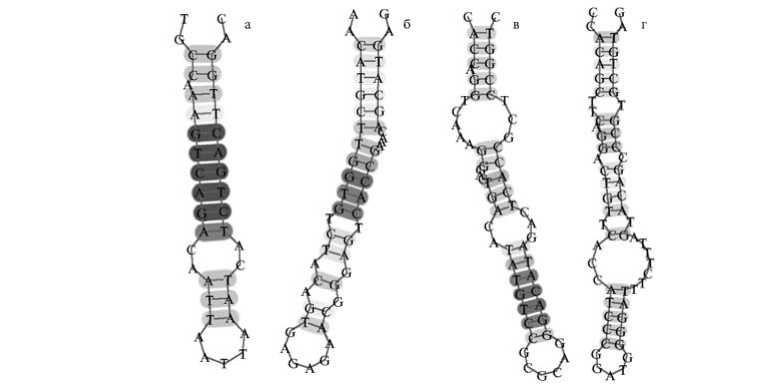
Рис. 4. Схематическое изображение предполагаемой вторичной структуры на 3'-концевых участках фрагментов РНК X-вируса картофеля, выделенных из вирусоподобных частиц разной длины: а — 1078-1117 нт, б — 2705-2757 нт, в — 5125-5183 нт, г — 5730-5792 нт. Градации серого цвета отражают силу взаимодействия между нуклеотидами. Изображения получены с помощью The mfold Web Server .
Итак, показано, что при инкубации РНК Х-вируса картофеля (ХВК) с белком оболочки (БО) ХВК в различных условиях (ионная сила, рН) образуется один и тот же набор вирусоподобных частиц (ВПЧ) дискретного размера. Однако количество таких ВПЧ меняется в зависимости от условий инкубации. Максимально эффективной сборки (ВПЧ приближались по размерам к нативному вириону) удалось достигнуть в буфере с низкой ионной силой при рН 8,5. Из ВПЧ выделены участки РНК, защищенные белковой спиралью. Показано, что все они — 5'-концевые фрагменты геномной РНК, имеющие разную длину. Получены дополнительные доказательства того, что сборка вирионов ХВК инициируется на 5'-конце РНК и кооперативно продолжается по направлению от 5'- к 3'-концу молекулы. При анализе нуклеотидной последовательности фрагментов РНК, выделенных из ВПЧ в районах, соответствующих 3'-концу молекулы, обнаружены участки, где возможно формирование РНК-шпилек, которые могут играть роль стоп-сигналов, препятствующих непрерывной кооперативной сборке ВПЧ. Вероятно, изменение условий инкубации влияет на способность БО плавить и преодолевать РНК-шпильки.


