Изучение полифенольных соединений рябины обыкновенной флоры Башкортостана
Автор: Галимова Дина Фирусовна, Латыпова Гузель Минулловна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Природопользование
Статья в выпуске: 5-3 т.13, 2011 года.
Бесплатный доступ
Изучен качественный состав фенольных соединений смеси цветков и листьев рябины обыкновенной флорыБашкортостана методами ТСХ и ВЭЖХ.
Рябина обыкновенная, качественный состав, полифенолные соединения
Короткий адрес: https://sciup.org/148200468
IDR: 148200468 | УДК: 615.322.074:[582.711.712:634.18]
Текст научной статьи Изучение полифенольных соединений рябины обыкновенной флоры Башкортостана
В настоящее время фитотерапия занимает особое место в лечении и профилактике многих хронических и длительно протекающих заболеваний. Применение лекарственных средств растительного происхождения, особенно в комплексном лечении хронических заболеваний, имеет ряд достоинств, к которым относятся: поливалентность действия, весьма незначительное число противопоказаний, малая токсичность, возможность длительного применения.
Рябина обыкновенная Sorbus aucuparia L. – небольшое листопадное дерево сем. розоцветных Rosaceae, высотой до 20 м, реже кустарник с неплотной кроной. Входит в состав 2-3-древесных ярусов, встречается в хвойных, мелколиственных и широколиственных лесах на равнине и в горах [4]. По 1-2 т плодов рябины заготавливают ежегодно в РБ. По подсчетам Министерства лесного хозяйства РБ, биологические запасы плодов и ягод в республике составляют около 12 тыс. т, 50% которых составляют промысловые запасы [5].
В научной медицине используются плоды, химический состав которых изучен достаточно подробно и представлен разнообразными группами биологически активных веществ. Они применяются в качестве поливитаминных, мочегонных, желчегонных средств для профилактики и лечения гипо-и авитаминозов, гипертонии и атеросклероза. Однако исследования по изучению новых видов сырья представляют интерес, т. к. позволяют расширить ассортимент и область применения рябины обыкновенной в медицине. В этом плане перспективными объектами изучения являются цветки и листья рябины обыкновенной.
Целью настоящего исследования является изучение качественного состава фенольных соединений рябины обыкновенной.
Объектом исследования служила смесь цветков и листьев рябины обыкновенной, собранных в различных районах РБ.
Для проведения качественного анализа был приготовлен водно-спиртовый экстракт смеси цвет-
ков и листьев рябины обыкновенной на 70% спирте этиловом. Наличие флавоноидных соединений определяли в этилацетатных фракциях и водных извлечениях из исследуемых объектов с помощью качественных реакций [3]: цианидиновая реакция (основана на восстановлении их в кислой среде с образованием окрашивания. К 2 мл извлечения добавляли 5-7 капель концентрированной хлористоводородной кислоты и 10-15 мг металлического цинка, нагревали на водяной бане в течение 2-3 мин до появления розовой окраски), цианидиновая реакция по Брианту (позволяет определить агликоновую или гликозидную природу исследуемого вещества. К окрашенному продуктy цианидиновой реакции добавляли 1/3 часть бутанола по объему, разбавляли водой, встряхивали. При этом пигменты гликозидов обнаруживались в воде, а агликоны - в слое органического растворителя. При добавлении к извлечению 1-2 капли 10 % спиртоводного раствора натрия гидроксида раствор желтел). В результате проведенных качественных реакций в исследуемых образцах были обнаружены флавоноидные соединения.
Следующим этапом работы было обнаружение полифенольных соединений в этилацетатной фракции водно-спиртового экстракта смеси листьев и цветков методом тонкослойной хроматографии (ТСХ) на пластинках «Sorbfil», «Silufol». Наилучшее разделение полифенольных соединений наблюдалось в системах «н-бутанол-уксусная кислота-вода (4:1:5)» и «этилацетат-уксусная кислота-вода (5:1:1)». Детектирование зон флавоноидов проводили как по собственной флюоресценции веществ в УФ-свете, так и с помощью проявителей: 5% спиртовый раствор алюминия хлорида, пары аммиака. Для сравнения использовали имеющиеся в наличии достоверные образцы свидетелей флавоноидов. Хроматографический анализ флавоноидов свидетельствовал, что зоны адсорбции соединений данной группы в видимом свете имели бледножелтую окраску, а в УФ-свете - коричневую, которая усиливалась после проявления хромогенными реактивами. В смеси листьев и цветков рябины были обнаружены зоны адсорбции, совпадающие по окраске и расположению пятен со свидетелями флавоноидов: рутина (R f - 0,45), кверцетина (R f -0,97) (рис. 1).
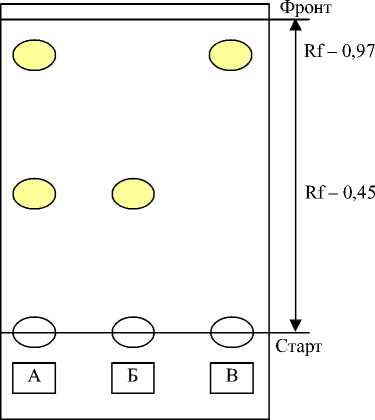
Рис. 1. Схема хроматограммы этилацетатной фракции из смеси цветков и листьев рябины обыкновенной. А – смесь цветков и листьев рябины обыкновенной, Б – рутин, В – кверцетин.
Хроматографический анализ этилацетатной фракции на присутствие фенолкарбоновых кислот проводили методом ТСХ на пластинках «Sorbfil», «Silufol». При этом хорошее разделение наблюдалось в системе «хлороформ-метанол-вода (62:32:7)». Кислоты обнаруживали по яркоголубой, зеленовато-голубой, фиолетовой флюоресценции, которая становилась интенсивнее после обработки проявляющими реактивами. В смеси листьев и цветков обнаружены зоны адсорбции, совпадающие по окраске и расположению пятен со свидетелями фенолкарбоновых кислот: кофейная кислота (R f - 0,95), галловая кислота (R f - 0,97).
В ходе дальнейших исследований качественного состава фенольных соединений был применен метод ВЭЖХ на высокоэффективном жидкостном хроматографе фирмы «Gilston», модель 305 (Франция); инжектор ручной, модель «Rheodyne 7125» (США), с последующей компьютерной обработкой результатов с помощью программы «Мультихром для «Windows». В качестве неподвижной фазы использована металлическая колонка размером 4,6х250 мм «Kromasil C 18», размер частиц 5 мк, в качестве подвижной фазы – метанол-вода-кислота фосфорная концентрированная, в соотношении 400:600:5. Анализ проводили при комнатной температуре. Скорость подачи элюента 0,8 мл\мин. Продолжительность анализа 120 мин. Детектирование с помощью УФ-детектора «Gilston UV/VIS» модель 151, при длине волны 254 нм. Для исследования сырьё измельчали до размера частиц, проходящих сквозь сито с диаметром отверстий 2 мм по ГОСТ 214-83.
Около 3,8 г сырья помещали в колбу вместимостью 200 мл, прибавляли 40 мл 70 % этилового спирта, присоединяли к обратному холодильнику и нагревали на кипящей водяной бане в течение 1 ч с момента закипания спиртоводной смеси в колбе.
После охлаждения смесь фильтровали через бумажный фильтр в мерную колбу объёмом 50 мл и доводили спиртом этиловым 70 % до метки (раствор А, исследуемый раствор).
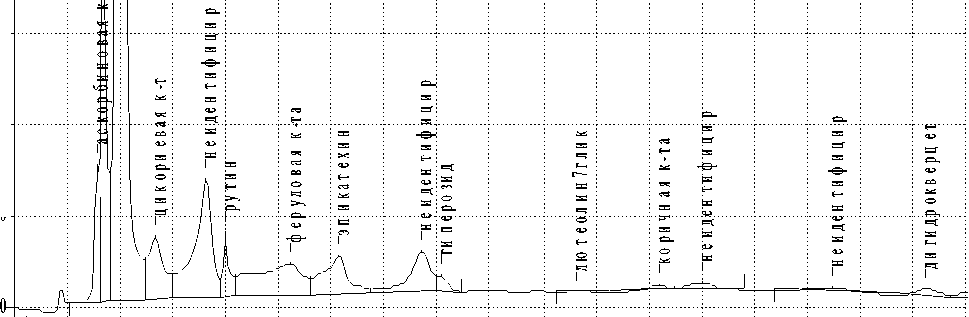
Параллельно готовили серию 0,02 % растворов стандартных образцов в 70% спирте этиловом: рутина, кверцетина, лютеолина, лютеолин-7-гликозида, кемпферола, кумарина, гиперозида, гес-передина, апигенина, галловой кислоты, кофейной кислоты, хлорогеновой кислоты, неохлорогеновой кислоты, коричной кислоты, феруловой кислоты, арбутина катехина, умбеллиферона, о-кумаровой кислоты, эпигаллокатехингаллата, эпикатехина, дикумарина. По 50 мкл исследуемых растворов и растворов сравнения вводили в хроматограф и хроматографировали в вышеприведенных условиях. Идентификацию разделенных веществ проводили путем сопоставления времен удерживания пиков, полученных на хроматограмме пробы, с временами удерживания стандартных растворов. Результаты проведенных исследований приведены в таблице и на рис. 2.
Таблица. Результаты исследования фенольных веществ смеси цветков и листьев рябины обыкновенной методом ВЭЖХ
|
Наименование РСО |
Время удерживания, мин |
Количественное соотношение, % |
|
Аскорбиновая кислота |
3,08 |
2,58 |
|
Никотиновая кислота |
3,29 |
11,65 |
|
Галловая кислота |
3,97 |
33,33 |
|
Цикориевая кислота |
5,31 |
4,93 |
|
Рутин |
7,93 |
1,73 |
|
Феруловая кислота |
10,40 |
7,57 |
|
Эпикатехин |
12,24 |
4,74 |
|
Гиперозид |
16,07 |
0,77 |
|
Лютеолин-7-гликозид |
21,27 |
0,09 |
|
Коричная кислота |
24,33 |
0,61 |
|
Дигидрокверцетин |
34,45 |
0,79 |
|
Кверцетин |
39,06 |
2,50 |
|
Кемпферол |
59,02 |
0,10 |
|
Лютеолин |
70,16 |
0,86 |
В результате проведенных исследований методом ВЭЖХ в смеси цветков и листьев идентифицировано 12 соединений фенольной природы, которые в основном представлены флавоноидами (рутин, гиперозид, лютеолин-7-гликозид, дигидрокверцетин, кверцетин, кемферол, лютеолин), производными фенолкарбоновых кислот (галловая, ци-коревая, феруловая, коричная) и эпикатехином. Установлено, что из флавоноидных соединений в наибольшем количестве содержится рутин и кверцетин, из производных фенолкарбоновых кислот – галловая кислота. Также в исследуемом сырье идентифицированы органические кислоты – аскорбиновая, никотиновая.
mV
ch1
0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 мин
Рис. 2. Хроматограмма ВЭЖХ смеси цветков и листьев рябины обыкновенной.
Изученный качественный состав полифеноль-ных соединений методами ТСХ и ВЭЖХ показал разнообразный состав и перспективность дальнейших исследований новых источников сырья рябины обыкновенной.
Наличие рутина в исследуемых объектах и его доступность позволило рекомендовать его в качестве рабочего стандартного образца для дальнейших исследований.
Список литературы Изучение полифенольных соединений рябины обыкновенной флоры Башкортостана
- Беликов В.В. Методы анализа флавоноидных соединений//Фармация. 1970. № 1. С. 68.
- Государственная фармакопея СССР. Вып. 1: Общие методы анализа. Лекарственное растительное сырье/МЗ СССР. 11-е изд., доп. М., 1989. С. 199.
- Практикум по фармакогнозии/под общ. ред. В.Н. Ковалева. Харьков: Изд. НФаУ, 2004. 512 с.
- Растительные ресурсы СССР: Цветковые растения, их химический состав, использование. Семейства: Rosaceae. Л.: Наука, 1985. 460 с.
- Кучеров Е.В., Галеева А.Х. Ресурсы основных видов дикорастущих лекарственных растений в Башкирии. Уфа: Башкирский НЦ УрО РАН, 1991. 114 с.


